冷冻干燥制备番茄红素微胶囊及其缓释性能研究
龙海涛,毕阳,张慧秀,孙艳,牛红艳,蒲陆梅,2*
1(甘肃农业大学 理学院,甘肃 兰州,730070)2(甘肃农业大学 农业资源化学与应用研究所,甘肃 兰州,730070) 3(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)
冷冻干燥制备番茄红素微胶囊及其缓释性能研究
龙海涛1,2,3,毕阳3,张慧秀1,孙艳3,牛红艳1,蒲陆梅1,2*
1(甘肃农业大学 理学院,甘肃 兰州,730070)2(甘肃农业大学 农业资源化学与应用研究所,甘肃 兰州,730070) 3(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)
为了提高番茄红素的稳定性,以酯化微孔淀粉、麦芽糊精、明胶、蔗糖及VC为复合壁材,番茄红素为芯材,通过冷冻干燥的方法制备了番茄红素微胶囊,并对制备的番茄红素微胶囊缓释性能进行了研究。研究表明:采用酯化微孔淀粉、麦芽糊精、明胶、蔗糖及VC为复合壁材,其质量比为1∶0.67∶0.56∶0.22∶0.44,包合温度为50 ℃,包合时间为0.5 h,芯材和壁材的质量比为10∶90时制得的微胶囊包封率高达91.78%,微胶囊经扫描电镜表征得表面光滑且呈球形,直径在10 μm左右;制备的番茄红素微胶囊具有良好的肠溶性,体外释放研究表明其释放数据符合Higuchi扩散模型,说明番茄红素微胶囊体外释放符合菲克扩散机理。
番茄红素;酯化微孔淀粉;微胶囊;缓释
微胶囊化技术是使用天然的或者合成的高分子材料将固体、液体甚至是气体的微小颗粒包裹在直径为1~500 μm的半透性或密封囊膜的技术。微胶囊化技术主要有喷雾干燥、冷冻干燥、凝聚法等,其中冷冻干燥在食品及医药领域应用广泛,主要用于热敏性物质的干燥。近年来部分学者采用不同的壁材通过冷冻干燥的方式制备了杨桃多酚[1]、α-亚麻酸油[2]、长双歧杆菌[3]、α-淀粉酶[4]等微胶囊。番茄红素微胶囊大多采用喷雾干燥[5-6]法,而采用冷冻干燥方法制备番茄红素微胶囊鲜有报道。其次,微胶囊采用的壁材目前主要以阿拉伯胶、明胶、麦芽糊精等为主,上述壁材价格较高。而采用辛烯基琥珀酸酯化微孔淀粉不仅价格便宜,黏度较低,而且其自身是优良的乳化剂,便于形成较高包埋率的微胶囊。因此拟采用酯化微孔淀粉、麦芽糊精等为壁材,番茄红素为芯材,冷冻干燥制备番茄红素微胶囊,进而研究微胶囊在模拟体液中的缓释性能。
1 材料与方法
1.1 材料与试剂
番茄红素(纯度90%),上海源叶生物科技有限公司;乙酸乙酯(分析纯),天津市福晨化学试剂厂;酯化微孔淀粉,实验室自制;体积分数95%乙醇(分析纯),天津市福晨化学试剂厂;丙酮(分析纯),北京化工厂;吐温80,麦克林试剂公司;石油醚,天津市福晨化学试剂厂,分析纯;胃蛋白酶,沃德赛斯生物公司;胰蛋白酶,沃德赛斯生物公司。
1.2 仪器与设备
722型分光光度计,上海新茂仪器有限公司;恒温水浴锅,北京科伟永兴仪器有限公司;RE-2000B旋转蒸发器,上海亚荣生化仪器厂;JJ-1悬挂式搅拌器,常州国华电器有限公司;DS-2510超声波振荡仪,上海奥谱勒仪器有限公司;FD-1A-50冷冻干燥机,上海争巧科学仪器有限公司;JSM-5600LV扫描电子显微镜,日本电子光学公司。
1.3 实验方法
1.3.1 番茄红素微胶囊制备工艺流程
取适量壁材于锥形瓶,加入蒸馏水,在70 ℃下糊化30 min。而后降温至一定温度,取适量芯材溶解于乙酸乙酯中,用恒压漏斗将番茄红素溶液缓慢加入到壁材中,并加入适量乳化剂吐温80,搅拌一定时间后均质乳化,将乳状液在-40 ℃下冷冻干燥48 h得到橙色的粉末状番茄红素微胶囊产品。
1.3.2 番茄红素微胶囊包封率测定
1.3.2.1 番茄红素标准曲线
参照刘玉梅等[7]的方法绘制番茄红素标准曲线。
1.3.2.2 番茄红素微胶囊中番茄红素含量色测定
将一定质量的番茄红素微胶囊置于锥形瓶中,而后加入适量水,再用萃取剂V(石油醚)∶V(丙酮)=1∶1的混合液萃取其中的番茄红素,并辅以超声振动,水相无色时,合并有机相,旋转蒸干并用乙酸乙酯溶解萃取出的番茄红素,测其吸光度,对照番茄红素标准曲线计算出番茄红素的含量。
1.3.2.3 微胶囊表面番茄红素含量的测定
将一定质量的番茄红素微胶囊置于锥形瓶中,而后加入适量石油醚,振荡1 min,抽滤,将不溶物加入石油醚反复提取至萃取液无色,合并石油醚,旋转蒸干并用乙酸乙酯溶解,测其吸光度,对照番茄红素标准曲线计算出番茄红素的含量。
1.3.2.4 番茄红素微胶囊包封率
微胶囊化包封率的高低决定了微胶囊产品质量的高低,是评价微胶囊质量的核心指标[8]。微胶囊包封率高表明芯材暴露于外表面的少,产品性质稳定,延长了产品的货架期。
(1)
1.3.3 番茄红素微胶囊制备的工艺优化
从壁材选择、芯材加入方式、包合时间、包合温度、芯材与壁材质量比、固形物含量等因素进行试验,在单因素的基础上,以包合时间、包合温度、芯材与壁材质量比为因素进行3因素3水平的正交优化实验,其因素水平表见表1。
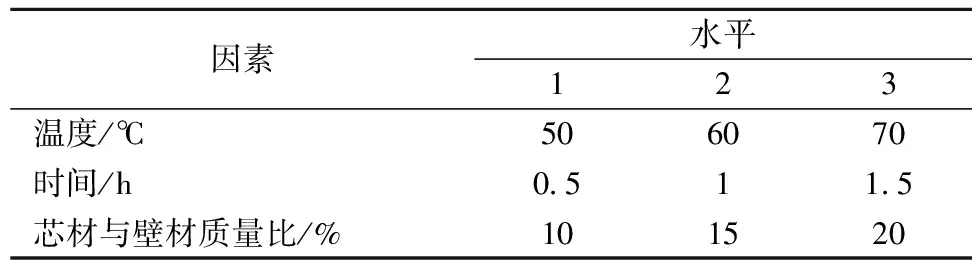
表1 番茄红素微胶囊优化正交因素水平表
1.3.4 番茄红素微胶囊的形貌分析
取少量番茄红素样品喷金后置于扫描电镜(SEM)下观察其形貌。
1.3.5 番茄红素微胶囊的缓释性能
模拟胃液配制:用量筒量取HCl 8.2 mL,转移至500 mL的容量瓶中,而后加水稀释至400 mL,再称取胃蛋白酶5 g,加少量水溶解后,转移至500 mL的容量瓶中,用蒸馏水定容,储存于4 ℃条件下备用,所得溶液即为模拟胃液[9]。
模拟肠液配制:分析天平称取磷酸二氢钾(KH2PO4)3.4 g,加少量水使其溶解,而后转移至500 mL容量瓶中,再称取胰蛋白酶5 g加适量水溶解,也转移至500 mL容量瓶中,最后用稀的NaOH调节容量瓶中溶液pH值至6.8,用蒸馏水定容,储存于4 ℃条件下备用,所得溶液即为模拟肠液[10]。
番茄红素在模拟肠液及胃液中的标准曲线:以模拟肠液及胃液为空白对照,在200~800 nm进行紫外扫描,以确定番茄红素在释放介质中的特征吸收波长。以相应的释放介质作为空白,在模拟胃液中分别选取番茄红素浓度在0.2~1.2 μg/mL的6个样品,在模拟肠液中分别选取番茄红素浓度在0.2~1.2 μg/mL的6个样品,分别在最大吸收波长处测定吸光度。以番茄红素浓度为横坐标,吸光度为纵坐标,线性回归得到番茄红素在肠液及胃液中的标准曲线用以测定释放率。
番茄红素微胶囊缓释性能测定:精密称取冷冻干燥方式制备的微胶囊10 mg各7份,分别置于100 mL具塞试管中,每个试管分别加入50 mL释放介质(即人工肠液和人工胃液),加塞密封。将各试管置于恒温振荡器,在37 ℃下振荡释放。每隔2 h从每个具塞试管中取出5 mL液体以测定从微胶囊中释放出来的番茄红素含量,并同时往具塞试管中补充释放介质以位置体积不变。所取样品离心分离,以排除部分微胶囊微粒的干扰,离心后取上清液测定其吸光度,利用番茄红素标准曲线换算出质量浓度,利用式(2)计算累积释放率[11]。
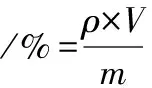
(2)
式中:ρ,测定时刻溶液中番茄红素的浓度,μg/mL;V,某时刻混合溶液体积,mL;m,初时加入番茄红素微胶囊中番茄红素总含量,μg。
番茄红素微胶囊缓释动力学以常见表2中的动力学模型对番茄红素微胶囊14h内释放性能进行模拟,探讨最佳的释放模型。

表2 数学拟合模型
注:Q为累计释放率,Q∞为完全释放量,t为累计释放时间,a,b分别为方程的截距及斜率。
1.3.6 数据统计方法
本实验所有数据均为重复3次平行实验,并将其所得的数据分析后求其平均值所得。
2 结果与分析
2.1 番茄红素标准曲线
以番茄红素标准溶液质量浓度为横坐标,相应溶液的吸光度为纵坐标,绘制标准曲线(图1),线性拟合方程为y=0.230 7x-0.015 5,R2=0.999 7。表明番茄红素质量浓度与吸光度存在良好的线性关系,该曲线适合于测定番茄红素的含量,曲线适用的番茄红素溶液含量在0.5~2.5 μg/mL。
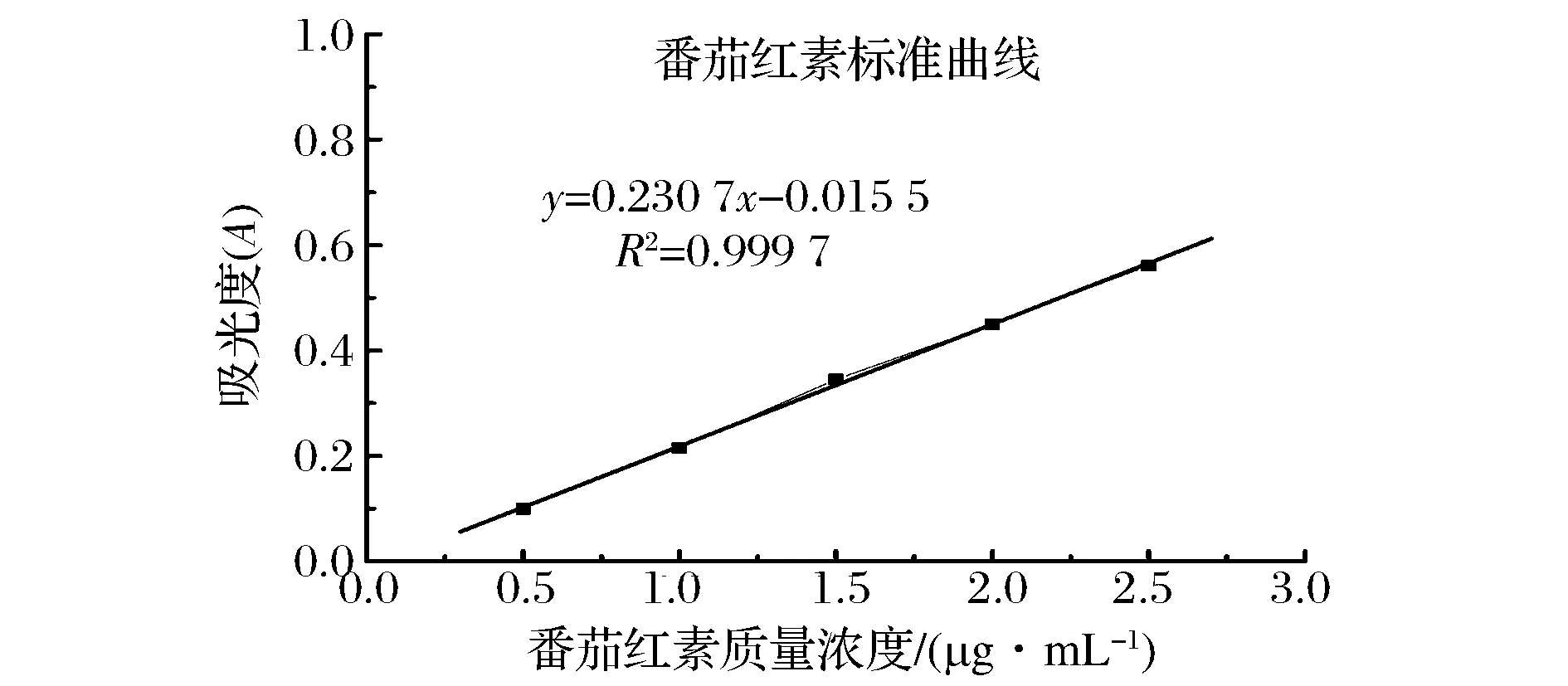
图1 番茄红素标准曲线Fig.1 Standard curve of lycopene
2.2 壁材对番茄红素微胶囊效率的影响
微胶囊化的壁材对于微胶囊产品的微胶囊效率及产品形态具有重要的作用,为此壁材的选择是首要考虑的问题。常用的壁材有明胶、麦芽糊精以及变性淀粉等[12],其中明胶有突出的成膜性及乳化性,但是其流动性较差以及黏度较大的问题,限制了其在微胶囊壁材中的应用,所以明胶常与其他壁材复配来进行微胶囊化;糊精无甜味,不易吸水,黏度低,水溶性好,但囊壁疏松、成膜性差,在微胶囊化过程中添加糊精可以有效地提高物料的固形物含量,且糊精来源广泛、价格便宜。微孔酯化淀粉即具有良好的乳化性能,同时还具备良好的与脂类芯材相容的特性,能够有效提高微胶囊效率[13]。此外蔗糖作为添加剂可以提高壁材成膜的强度,因此选择了4种壁材:(1)酯化微孔淀粉,(2)酯化微孔淀粉+麦芽糊精(质量比为1∶2),(3)酯化微孔淀粉+麦芽糊精+明胶(质量比为1∶0.67∶0.56),(4)酯化微孔淀粉+麦芽糊精+明胶+蔗糖+VC(质量比为1∶0.67∶0.56∶0.22∶0.44);其中配方(1)中壁材质量浓度为0.10 g/mL,芯材与壁材的质量比为1∶10,配方(2)中壁材质量浓度为0.20 g/mL,芯材与壁材的质量比为1∶10,配方(3)中壁材质量浓度为0.25 g/mL,芯材与壁材的质量比为1∶10,配方(4)中壁材质量浓度为0.25 g/mL,芯材与壁材的质量比为1∶10,通过冷冻干燥方式制备微胶囊。
由图2可知,以微胶囊化包封率为指标,在其他条件相同的情况下,最佳壁材选择是(4),即酯化微孔淀粉+麦芽糊精+明胶+蔗糖+VC。分析其原因在于明胶具有良好的成膜性,酯化微孔淀粉及麦芽糊精有效提高了固形物含量,蔗糖增加了微胶囊的成膜性,VC对于微胶囊的稳定性有着较大的提升作用,因此配方(4)制备的微胶囊包封率达到了最高。
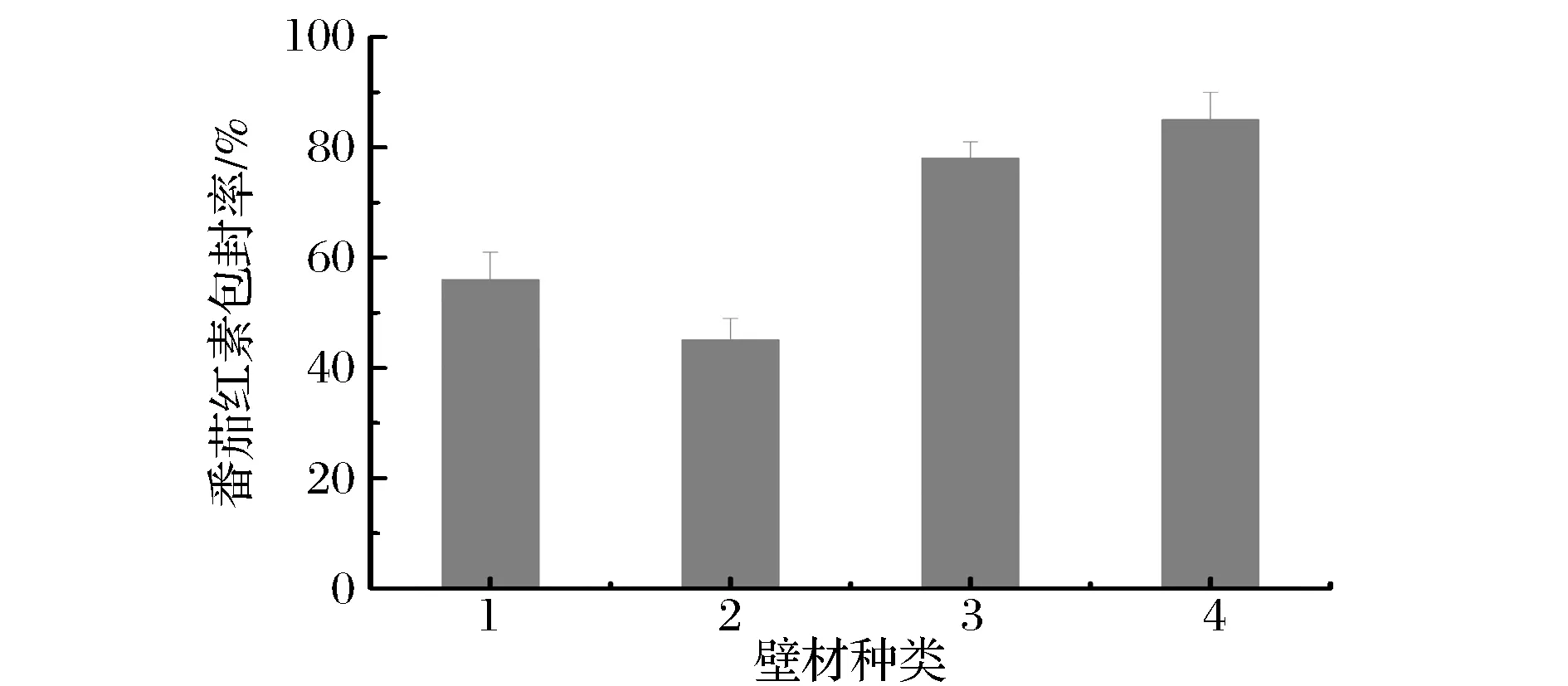
图2 壁材对番茄红素微胶囊包封率的影响Fig.2 Effect of wall material types on lycopene microencapsulation
2.3 芯材的加入方式对微胶囊制备的影响
由图3可知,第一种添加方式,番茄红素直接添加到壁材溶液中,番茄红素分散性较差,存在着番茄红素颗粒聚集的现象。第二种添加方式,番茄红素溶解于乙酸乙酯溶液中加入的方式,番茄红素在壁材溶液中均匀分散,得到了比较稳定的乳状液。因此采用第二种加入方式。

(a)番茄红素直接加入;(b)番茄红素溶解于乙酸乙酯中加入图3 番茄红素不同加入方式制得的乳液显微镜图片Fig.3 The microscope pictures with different adding lycopene method
2.4 单因素变量对于冷冻干燥微胶囊的影响
2.4.1 温度的影响
由图4可知,随着温度的增加,微胶囊包封率在60 ℃时最高,随后呈下降趋势。所以最适温度为60 ℃。这是由于温度低时,壁材的流动性变差,导致微胶囊化效率下降。温度过高,番茄红素异构化及降解,导致微胶囊化效率降低[14]。尤其是温度较高时,在包埋时间较长的情况下,分散芯材所用的乙酸乙酯由于沸点比较低,容易发生冲料事故,这在工业化应用当中非常危险,因此我们选择温度50、60、70 ℃这3个水平进行后续的工艺优化实验。
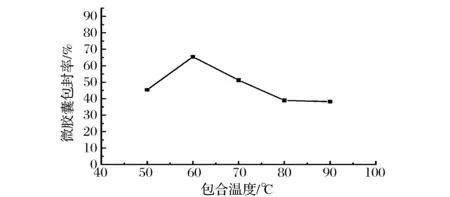
图4 温度对番茄红素微胶囊包封率的影响Fig.4 Effect of temperatureon lycopene microencapsulation
2.4.2 时间的影响
由图5可知,随着包合时间的增加,微胶囊包封率在1.0 h时最高,随后呈下降趋势,所以最适包合时间为1.0 h。分析其原因是由于包合时间短,首先使得芯材与壁材混合不够充分,部分番茄红素未被包埋,其次时间过短乙酸乙酯没有进行充分的挥发,使得芯材无法从溶剂中析出而形成微胶囊,故而包封率低。但是包合时间越长,从图5可以看出微胶囊包封率略微有所下降,分析其原因在于较长的时间,芯材的液滴直径变小,表面能变高,油滴有趋于聚合的趋势,导致包封率下降[15]。
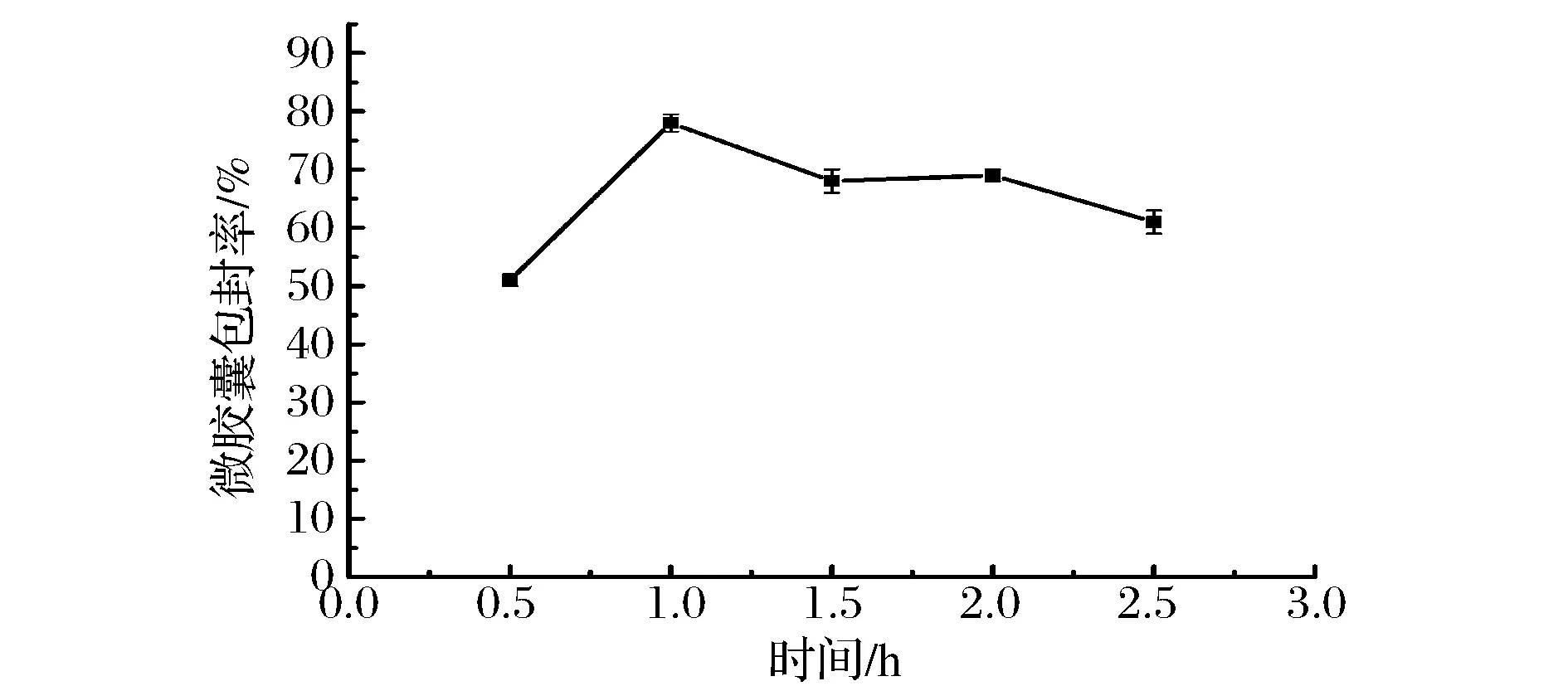
图5 时间对番茄红素微胶囊包封率的影响Fig.5 Effect of time on lycopene microencapsulation
2.4.3 芯材与壁材质量比的影响
由图6可知,随芯材与壁材质量比的增大,包封率先增大后减小,在15%时包封率最大。芯材与壁材质量比越低,说明芯材少而壁材多,多余的壁材聚集于微环境,对芯材的扩散运动和微胶囊网状结构的形成不利[16],故包封率随之降低。随着芯材与壁材质量比增大,包封率也随之提高,当芯材与壁材质量比增加到一定程度时,较少的壁材难以将番茄红素完全包埋,故影响了包封率使之反而降低。
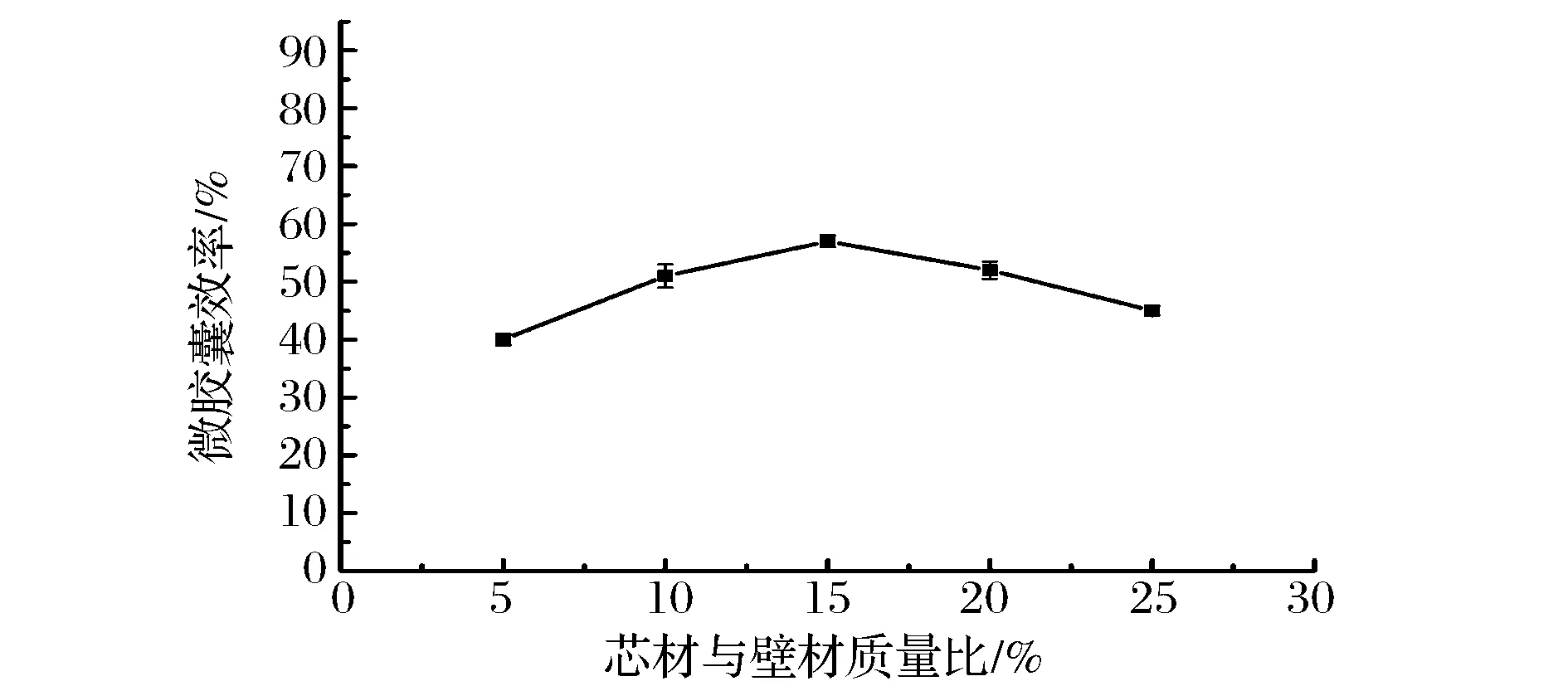
图6 芯材和壁材质量比对番茄红素微胶囊效率的影响Fig.6 Effect of core material to wall material on lycopene microencapsulation
2.5 番茄红素微胶囊最佳条件的确定
在单因素试验基础上,通过温度、包合时间、芯材与壁材质量比3个主要因素,进行3因素3水平的正交设计(表1),以确定制备番茄红素微胶囊的最佳条件。
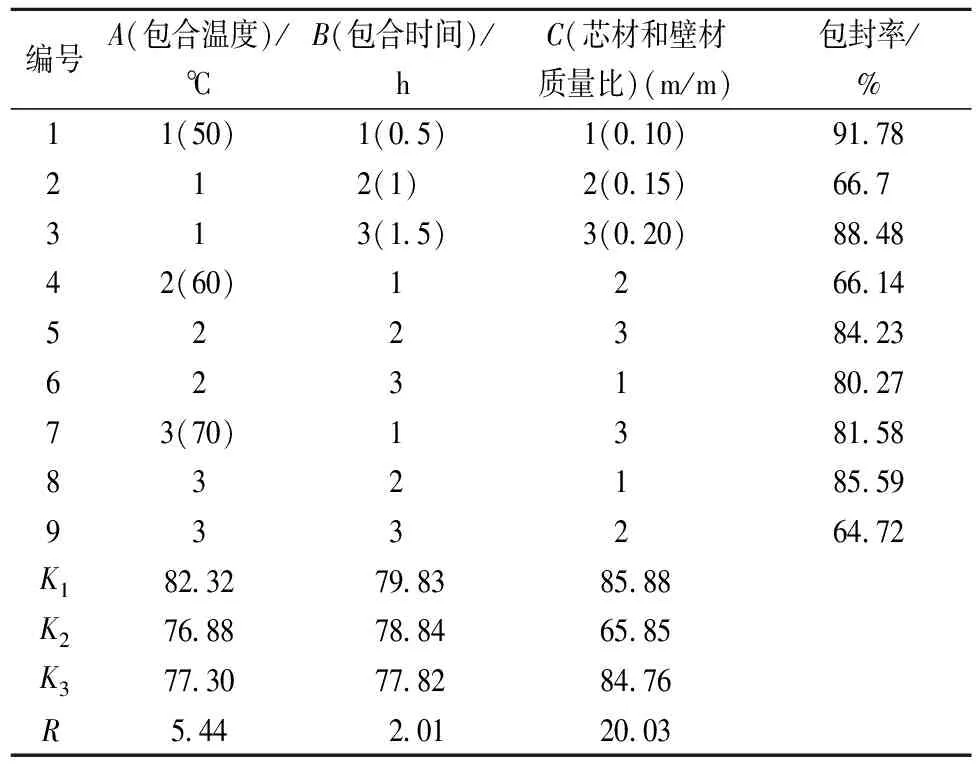
表3 番茄红素微胶囊化工艺优化正交设计和结果
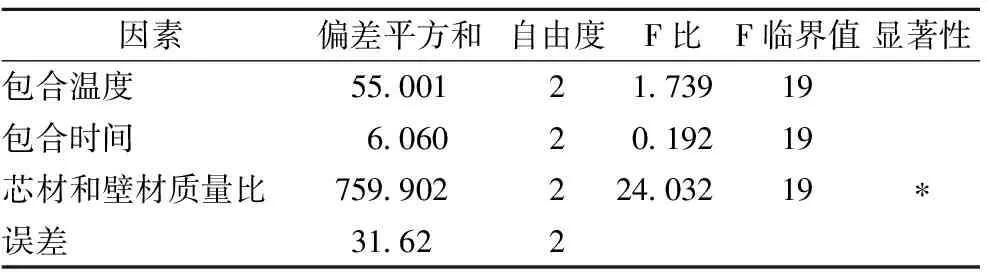
表4 正交试验结果方差分析
注: *表示影响显著。
由表3可知,因素A包合温度极差为5.44,因素B包合时间极差为2.01,因素C芯材与壁材质量比极差为20.03,因此对番茄红素微胶囊包封率的影响力度为C>A>B,最佳组合为A1B1C1,即每个因素的最佳水平为:包合温度为50 ℃,包合时间为0.5 h,芯材和壁材的质量比为10%。由表4可以看出,当置信水平α=0.05时,由于FC>F0.05,说明芯材与壁材质量比对微胶囊包封率影响显著,包合温度及包合时间对微胶囊包封率影响不显著。
在上述正交优化的最佳条件下,冷冻干燥制备的微胶囊其包封率高达91.78%,与舒铂[17]等人以明胶和蔗糖为复合壁材,喷雾干燥制备的番茄红素微胶囊包封率为83.89%具有更高的包封率。此外,采用酯化微孔淀粉与传统的壁材相比由于酯化微孔淀粉经过了水解,具有更小的粘度,允许制备工艺中固形物含量较高,如BORRMANN[18]等人使用酯化淀粉为壁材,喷雾干燥制备了百香果的微胶囊,其固形物含量只有10%。且与传统的喷雾干燥制备工艺相比较,由于喷雾干燥中存在物料在干燥塔中黏塔现象,造成微胶囊产率的损失,而冷冻干燥不存在这种现象。最后,由于在冷冻干燥过程中,没有高温的加热,会减少番茄红素在制备过程中的损失。综上所述,用冷冻干燥制备番茄红素微胶囊是较好的一种方法。
2.6 冷冻微胶囊SEM表征
为了对比复合壁材与酯化微孔淀粉在制备番茄红素微胶囊上形貌上的区别,按照正交优化的最佳试验条件制备了2组番茄红素微胶囊,其中一组壁材选用酯化微孔淀粉,另外一组选择了复合壁材,即酯化微孔淀粉+麦芽糊精+明胶+蔗糖+VC(质量比为1∶0.67∶0.56∶0.22∶0.44),由图7可以看出,大部分微胶囊直径在10 μm左右,采用酯化微孔淀粉为壁材的微胶囊表面凹陷较深,而用复合壁材的微胶囊呈圆球形,表面有细微的孔洞,没有明显的裂缝,因此具有较高的包封率。

图7 番茄红素微胶囊的SEM表征Fig.7 Scanning electron microscope micrograph of lycopene microcapsle
采用微孔酯化淀粉为壁材观察到较大的凹陷,分析其原因在于在冷冻干燥过程中酯化微孔淀粉的抗变形能力较复合壁材弱,且持水能力差,因此在冷冻干燥过程中,出现较大的收缩,导致表面凹陷。由于复合壁材中的蔗糖具有提高膜强度的能力,其加入明显能够改善微胶囊的形态,从图中可以看出复合基壁材的微胶囊呈圆球形,且表面较为光滑,微胶囊上面存在的细微孔洞是在冷冻干燥过程中细小的冰晶结构对其表面结构造成的破坏。微胶囊的缓释作用主要决定于囊壁的完整性、密封性, 因此推测所制备的微胶囊具有良好的缓释性能[19]。
2.7 番茄红素微胶囊缓释动力学研究
2.7.1 模拟肠液及胃液中番茄红素标准曲线
经过紫外扫描,番茄红素在肠液中最佳吸收波长为314 nm,对应的标准曲线方程为y=0.191 7x-0.031 2,R2=0.999 6,在胃液中的最佳吸收波长为251 nm,对应的标准曲线方程为y=0.976 9x-0.0974 7,R2=0.999 8。
2.7.2 番茄红素微胶囊体外释放
由图8可知,番茄红素微胶囊在肠液中的释放率明显高于在胃液中的释放率,分析其原因在于壁材采用了明胶等物质,肠液为中偏碱性的环境,在此环境中,胰蛋白酶作用于明胶,将明胶中的碱性氨基酸的羧基段肽键剪切,然后作用于糊精及酯化淀粉上,造成了壁材的破裂,使得芯材番茄红素能够释放出来。而胃液中的胃蛋白酶对于该复合壁材的剪切能力有限。所以同样缓释14 h,胃液中冷冻微胶囊的累计缓释率为38%,而在肠液中冷冻微胶囊的累计缓释率高达82%。说明番茄红素微胶囊在体外释放主要发生于肠道中。此外,番茄红素微胶囊缓释过程中没有观察到突释现象,主要是由于番茄红素在溶液中溶解度较低,其溶解速度是向外扩散的控制因素。
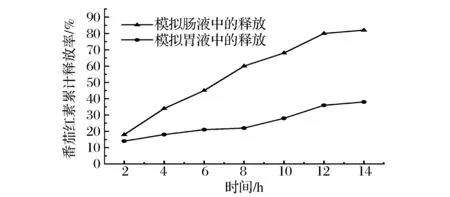
图8 番茄红素微胶囊体外释放Fig.8 In vitro release of lycopene microcapsule
2.7.3 番茄红素微胶囊体外释放动力学
由于番茄红素微胶囊在胃液中释放率较低,而在肠液中释放率较高,因此选择番茄红素在肠道中的释放为研究对象并探讨其缓释模型。采用线性回归法,分别对番茄红素微囊体外释放按照零级、一级动力学方程及Higuchi方程进行模型拟合,拟合结果见表5。由表5可见,对于冷冻干燥制备的微胶囊,Higuchi拟合其相关系数R2=0.996 06,拟合度最高,说明番茄红素微胶囊在模拟肠液中的释放符合Fick扩散,即以骨架溶蚀为主的释放机理。这与壁材中的使用明胶密切相关,胰蛋白酶不仅可以切断明胶主链上的肽键,而且对于明胶侧链氨基所形成的酰胺键也具有反应活性,导致明胶的溶蚀[20]。

表5 模拟肠液中体外释放行为的模型模拟结果及相关参数
3 结论
以酯化微孔淀粉、麦芽糊精、明胶、蔗糖及VC为复合壁材,番茄红素为芯材,通过冷冻干燥的方法制备了番茄红素微胶囊;通过正交实验优化了制备番茄红素微胶囊的工艺条件;在温度50 ℃、包合时间0.5 h、芯材与壁材质量比为10%,制得微胶囊包封率高达91.78%。微胶囊经扫描电镜表征为表面光滑且呈球形,直径在10 μm左右;微胶囊具有良好的肠溶性,体外释放符合Higuchi扩散模型,符合菲克扩散机理。
[1] SANGEETA S,NIKHIL KUMAR M,CHARULATA M. Optimisation of phenolic extraction from Averrhoacarambolapomace by response surface methodology and its microencapsulation by spray and freeze drying[J]. Food Chemistry,2015,171(6): 144-152.
[2] NAIK A,MEDA V,LELE S S. Freeze drying for microencapsulation of alpha-linolenic acid rich oil: A functional ingredient fromLepidiumsativumseeds[J]. European Journal of Lipid Science and Technology,2014,116(7): 837-846.
[3] AMINE K M,CHAMPAGNE C P,SALMIERI S,et al. Effect of palmitoylated alginate microencapsulation on viability of Bifidobacteriumlongum during freeze-drying[J]. Lwt-Food Science and Technology,2014,56(1): 111-117.
[4] AMID M,MANAP Y,ZOHDI N K. Microencapsulation of purified amylase enzyme from pitaya (Hylocereuspolyrhizus) peel in arabic gum-chitosan using freeze drying[J]. Molecules,2014,19(3): 371-3 743.
[5] 邱伟芬,李敏,汪海峰,等. 正交试验优化番茄红素微胶囊化工艺[J]. 食品科学,2012,33(10):45-50.
[6] 时慧,敬思群,纵伟,等. 均匀设计和正交设计法优化番茄红素微胶囊制备工艺[J]. 食品工业科技,2014,35(5):238-243.
[7] 刘玉梅,刘奎钫,刘罡. 番茄红素油树脂中番茄红素的分析方法的研究[J]. 食品工业科技,2004,25(12): 127-129.
[8] SPADA J C,NOREA C P Z ,MARCZAK L D F. Study on the stability of β-carotene microencapsulated with pinhão (Araucariaangustifoliaseeds) starch[J]. Carbohydrate Polmers,2012,89(4): 1 166-1 173.
[9] MCCLEMENTS D J,DECKER E A,PARK Y,et al. Designing food structure to control stability,digestion,release and absorption of lipophilic food components[J]. Food Biophysics,2008,3(2): 219-228.
[10] MARAMBE H R,SHAND P J,WANASUNDARA P D. Release of angiotensin I-converting enzyme inhibitory peptides from flaxseed (LinumusitatissimumL.) Protein under Simulated Gastrointestinal Digestion[J]. Agricultural and Food Chemistry,2011,59(17): 9 596-9 604.
[11] 王会娟,李馨儒,黄燕清,等. 番茄红素微囊的体内外药剂学行为[J]. 药学学报,2005,40(9): 787-791.
[12] 杨佳,侯占群,贺文浩,等. 微胶囊壁材的分类及其性质比较[J]. 食品与发酵工业,2009,35(5): 122-126.
[13] 李梦凡,陶宁萍,俞骏,等. 喷雾干燥法制备微胶囊化罗非鱼油研究[J]. 上海海洋大学学报,2015,24(4): 617-624.
[14] 王娣,许晖,汪张贵,等. 百里香精油的微胶囊制备及其缓释性能[J]. 食品科学,2013,34(6): 60-63.
[15] 周正,陈存社. 辛烯基琥珀酸淀粉酯包埋共轭亚油酸工艺的研究[J]. 食品科学技术学报,2014,32(4):35-40.
[16] 刘可,段旭. 天然红花黄色素的微胶囊化研究[J]. 食品工业科技,2015,36(1):226-234.
[17] 舒铂,赵亚平,于文利. 以明胶和蔗糖为复合壁材的番茄红素微胶囊化研究[J]. 食品工业科技,2004,35(9):52-58.
[18] BORRMANN D,PIERUCCI A P T R ,LEITE S G F,et al. Microencapsulation of passion fruit (Passiflora) juice with n-octenylsuccinate-derivatised starch using spray-drying[J]. Food and Bioproducts Processing,2013,91(1): 23-27.
[19] 胡洋,刘嘉怡 ,周华俊,等.广藿香油微胶囊的制备与性能[J]. 高分子材料科学与工程,2012,28(9):162-170.
[20] 关蕊,黄雅钦,葛佑勇,等. 胰蛋白酶降解琥珀明胶的研究[J]. 化学工业与工程,2005,22(3):206-210.
Microcapsulation of lycopene by freeze-drying method and its slow-release performance
LONG Hai-tao1,2,3, BI Yang3, ZHANG Hui-xiu1, SUN Yan3, NIU Hong-yan1, PU Lu-mei1,2*
1(College of Science,Gansu Agricultural University,Lanzhou 730070,China) 2(Institute of Agricultural Resources Chemistry and Application,Gansu Agricultural University,Lanzhou 730070,China) 3(College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China)
In order to improve the stability of lycopene,microporous starch esterification,maltodextrin、gelatin、sucrose and Vitamin C were used as wall material,lycopene was the core material. Lycopene microcapsule was prepared by the freeze-drying method. The slow-release properties of lycopene microcapsules were also tested. The results showed that the encapsulation efficiency was 91.78% when the mass ratio of the wall materials of microporous starch esterification/maltodextrin/gelatin/sucrose/VCwas 1∶0.67∶0.56∶0.22∶0.44),embedding temperature 50℃,embedding time of 0.5 h and the mass ratio of the core and wall material of 10%. Microcapsule was characterized by scanning electron microscope. The surface was smooth and spherical,the diameter was about 10 μm; the lycopene release profiles from microcapsule was exhibited enteric property. The release kinetics of which was conform to the Higuchi equation. The releasing mechanism was in line with Fick diffusion.
lycopene; microporous starch esterification; microencapsulation; sustained-release
10.13995/j.cnki.11-1802/ts.201612023
硕士研究生(蒲陆梅教授为通讯作者,E-mail:pulm@gsau.edu.cn)。
甘肃省科研基本业务项目,项目编号:044-01009
2016-03-28,改回日期:2016-06-12

