复合泡菜专用菌剂的制备与发酵性能评价
李玉斌,吴华昌,邓静*,刘阳,吉志伟,易宇文,彭毅秦
1(四川理工学院 生物工程学院,四川 自贡,643000) 2(四川旅游学院,烹饪科学四川省高等学校重点实验室,四川 成都,610000)
复合泡菜专用菌剂的制备与发酵性能评价
李玉斌1,吴华昌2,邓静2*,刘阳2,吉志伟2,易宇文2,彭毅秦2
1(四川理工学院 生物工程学院,四川 自贡,643000) 2(四川旅游学院,烹饪科学四川省高等学校重点实验室,四川 成都,610000)
以实验室保藏的1株乳酸菌与1株酵母菌为研究对象,采用真空冷冻干燥技术制作活菌制剂,并对菌剂发酵性能进行评估。结果表明:经4 ℃、6 500 r/min,13 min离心收集菌体,再以10%蛋白胨+3%维生素C为保护剂,真空冷冻干燥后,酵母菌与乳酸菌冻干存活率分别达86.3%、87.8%。将自制复合菌剂用于甘蓝发酵,并与市售菌剂、自然发酵比较:添加自制菌剂发酵的甘蓝pH、总酸度提前2 d趋于稳定,分别为5.4、11.05 g/100 g;亚硝酸盐含量更低,最大值仅为7.07 mg/kg;初步认定乙醇(42.46%)、苯乙醇(13.47%)、4-乙基苯酚(6.77%)、顺-3-己烯醇(4.48%)为自制菌剂发酵甘蓝的主要风味物质。此复合菌剂具有较好的产酸产香能力,其在泡菜行业具有良好的应用前景。
酵母菌;乳酸菌;菌剂;发酵性能
传统泡菜生产多采用陈泡菜水自然发酵法,此法成本低、操作简单、风味较好,但也存在生产周期长、质量不稳定、受环境影响大等弊端。直投式菌剂因其发酵周期短、亚硝酸盐含量低、产品质量稳定等优点受到人们的重视[1-4]。目前,泡菜菌剂的制作以乳酸菌为主,包括植物乳杆菌[5]、短乳杆菌[6]、胚牙乳杆菌、肠系膜明串珠菌[7]等,这些菌剂与传统自然发酵泡菜相比,虽产酸速率快、亚硝酸盐含量低,但由于菌种单一,而导致风味不足[7-8]。
目前国际上生产活菌制剂的技术主要有真空冷冻干燥、喷雾干燥等[9]。其中,真空冷冻干燥是多数微生物菌剂制作的方法[12-14],此法生产的菌剂与喷雾干燥技术相比具有更高的活菌存活率。在真空冷冻干燥中,菌体的收集、冻干保护剂选择及冻干条件等因素影响冻干菌剂的活菌存活率,而菌体的收集与保护剂的选择对菌剂活菌存活率影响十分显著。
研究以实验室保藏的1株益生乳酸菌与1株产香酵母菌为研究对象,采用真空冷冻干燥技术,探究冻干前预处理条件(菌体收集条件、保护剂的选择)对活菌存活率的影响,并将自制菌剂投放于结球甘蓝中发酵,与市售菌剂、自然发酵的甘蓝比较,对3种菌剂的发酵性能进行评价。
1 材料与方法
1.1 材料
二甲基亚砜(DMSO)、亚铁氰化钾、乙酸锌、硼酸钠、对氨基苯磺酸、盐酸萘已二胺、亚硝酸钠,以上试剂均为分析纯,成都市科龙化工试剂厂;MTT,美国Amresco公司。
菌种:戊糖乳杆菌、酵母菌(Kazachstaniabarnettii),实验室保藏(2株菌的益生、产香性能已被鉴定);川秀泡菜乳酸菌发酵粉,市售;结球甘蓝,购于自贡市某农贸市场。
酵母菌的活化与培养为YPD培养基;乳酸菌的活化与培养为MRS培养基。
1.2 仪器与设备
Thermo 1500全自动酶标仪,Thermo公司;SJIA-10N真空冷冻干燥机,宁波双嘉仪器有限公司;Universal 320R冷冻离心机,德国Hettich公司;50/30μm DVB/AR/PDMS萃取头,Agilent -5975气相色谱质谱联用仪,美国Agilent公司。
1.3 实验方法
1.3.1 泡菜菌剂制作工艺流程

1.3.2 菌种的活化与培养
酵母菌活化与培养:挑取4 ℃斜面保存的酵母菌单菌落,于50 mL灭菌的YPD种子液培养基中,于28 ℃培养24 h。配制300 mL YPD液体培养基,均分于3个三角瓶中,灭菌后加入2%(v/v)的YPD种子液,于28 ℃静置培养18 h。
乳酸菌活化与培养:乳酸菌活化与培养的步骤同酵母菌,但乳酸菌活化、培养于MRS培养基中,培养温度为37 ℃,培养时间为18 h。
1.3.3 MTT法测定菌体存活率
按文献[15]方法,略有修改。取100 μL酵母菌菌悬液于96孔细胞培养板中,每个样做3组平行,以不接菌的培养基做空白对照,加入MTT溶液20 μL,混匀后避光置于28 ℃(乳酸菌为37 ℃)培养箱中,2 h后取出,加入二甲基亚砜100 μL,充分溶解,测定OD500 nm。
1.3.4 离心收集条件对菌体离心存活率的影响
以乳酸菌、酵母菌离心存活率为指标,分别对离心转速、温度、时间进行考察,设计L9(34)正交实验,确定2菌体的最佳离心收集条件。

1.3.5 保护剂对菌体冻干存活率的影响
1.3.5.1 单一保护剂的选择
分别以5%海藻糖、10%葡萄糖、5%甘油、5%谷氨酸钠、5% Vc、10%蛋白胨作为保护剂,0.22 μm的微孔滤膜过滤备用。按1.3.2、1.3.4小节活化培养与收集菌体,加入1 mL PBS溶液混匀,形成菌悬液,以1∶2体积比添加上述7种保护剂,放置30 min后,-20 ℃预冻2 h。预冻完成后,转移至真空冷冻干燥机中进行冻干,冻干条件为:-80 ℃,真空度1 999.8,时间12 h。以冻干菌体存活率为检测指标,确定最佳单因素冻干保护剂。

1.3.5.2 复合保护剂配比的确定
根据单一保护剂筛选结果,选择冻干效果较好的低分子与高分子保护剂作为复合保护剂进行冻干实验,复合保护剂添加体积比为1∶2,以菌体冻干存活率为检测指标,确定最佳保护剂配比。
1.3.6 泡菜制作
将甘蓝去杆、去坏叶后洗净沥干,称约3 kg结球甘蓝至4 L泡菜坛中,加入4%的盐水至2/3坛,再添加菌剂(0.1%自制复合菌剂、0.1%市售菌剂发酵、自然发酵),补充盐水至坛满,加盖密封发酵。每种发酵方式做3组平行。自制菌剂混合比例为1∶2(乳酸菌∶酵母菌),活菌数达到106CFU以上。
1.3.7 泡菜理化指标测定
pH:酸度计测定;总酸度:按GB 5009.7—2008测定[16];亚硝酸盐含量:按GB 5009.33—2010测定[17]。
1.3.8 泡菜挥发性风味物质测定
1.3.8.1 样品处理
称取适量3种方式发酵7 d的泡菜,制作匀浆,准确称取匀浆5.0 g装入15 mL样品瓶中,备用。
1.3.8.2 顶空固相微萃取(Headspace SPME)条件
将老化后的50/30 μm DVB/CAR/PDMS萃取头插入样品瓶顶空部分,70 ℃平衡30 min、吸附10 min后,将萃取头取出并插入GC进样口,同时启动仪器采集数据,解吸3 min。
1.3.8.3 GC-MS分析条件
HP 5890/5975 GC/MS联用仪, 色谱柱:HP-5MS型(30 m×0.250 mm×0.25 μm);载气:氦气;进样温度:230 ℃;进样量: 1 μL;升温程序: 初温45 ℃保持2 min,5 ℃/min上升至180 ℃,保持1 min,25 ℃/min升到230 ℃,保持5.5 min。
1.3.8.4 数据处理
由计算机质谱系统NSIT与RTLPEST检索未知化合物,匹配度大于800(最大1 000)的结果将予以报告,面积归一法计算各成分的含量。
1.3.9 感官评价
10位品评人员对泡菜感官特征进行描述,包括香气、质地滋味及色泽体态等[19],对各项指标进行权重与尺度建立,评价标准见表1。

表1 感官评价标准
2 结果与分析
2.1 菌体最佳离心收集条件的确定
2.1.1 菌体离心收集单因素试验
由于酵母菌与乳酸菌细胞壁结构的差异,使两菌对离心剪切力承受能力不同,影响菌剂的活菌存活率,后序研究中将两菌分开进行离心与冻干。实验分别固定离心转速9 000 r/min、时间15 min、温度5 ℃,考察离心转速(3 000、5 000、7 000、9 000、11 000 r/min)、离心温度(0、5、10、15、20 ℃)、离心时间(5、10、15、20、25 min)对酵母菌与乳酸菌离心存活率的影响,结果如图1~3:酵母菌与乳酸菌最佳单因素离心条件为转速7 000 r/min、温度5 ℃、时间15 min。
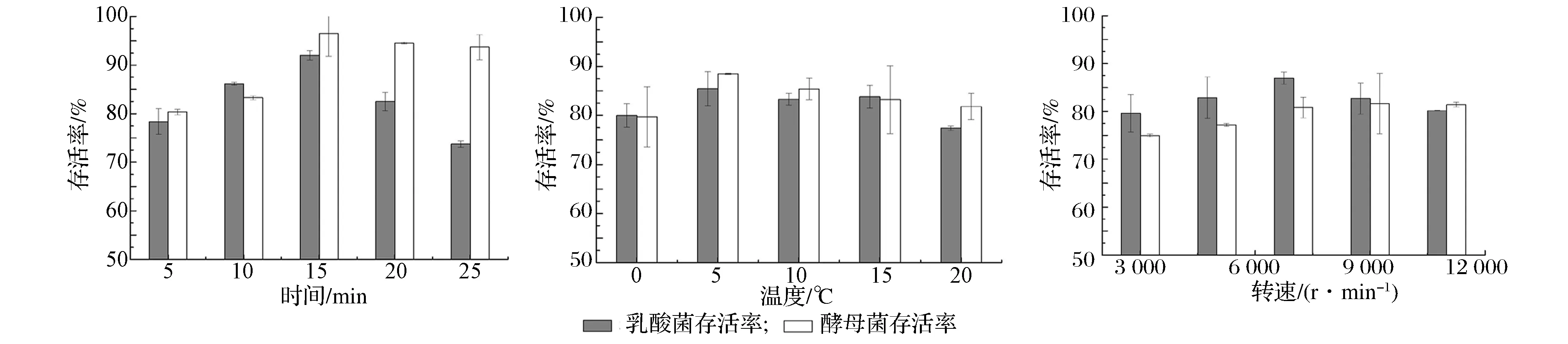
图1 不同离心条件下各菌体的存活率Fig.1 Survival rate of thallus under different conditions of centrifugation
2.1.2 乳酸菌与酵母菌最佳离心收集条件的确定
根据单因素试验结果,设计L9(34)正交试验,结果如表2和表3所示。对乳酸菌离心存活率影响大小为A(转速)>B(温度)>C(时间),最佳离心条件为转速7 500 r/min、离心时间13 min、离心温度4 ℃;对酵母菌离心存活率影响依次为C (温度)> B (时间)> A (转速),最佳离心条件为离心转速7 000 r/min、时间15 min、温度4 ℃。
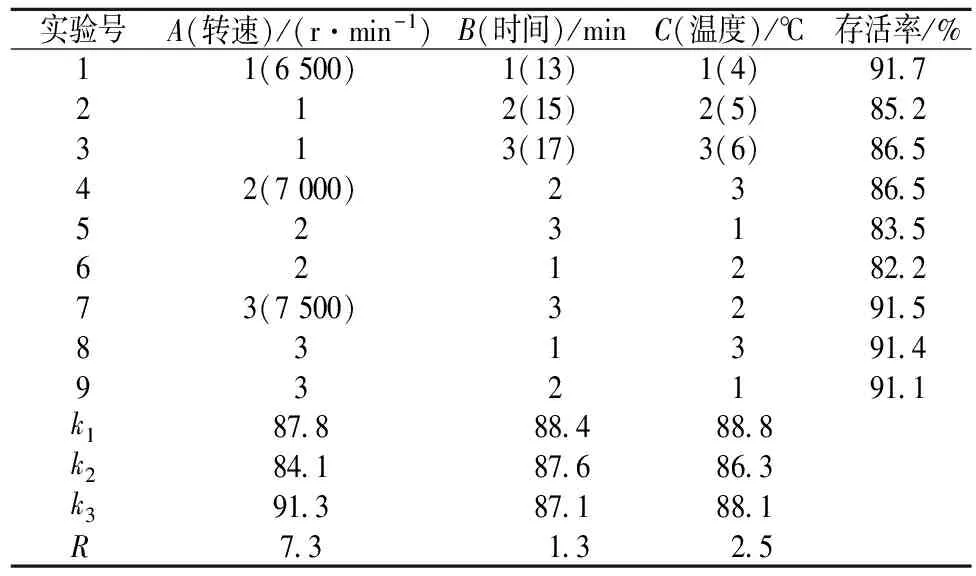
表2 乳酸菌离心收集的正交实验结果

表3 酵母菌离心收集的正交实验结果
2.2 保护剂对菌体冻干存活率的影响
2.2.1 单一保护剂对酵母菌与乳酸菌冻干存活率的影响
菌剂制备中,冷冻和干燥两个过程都会造成菌体的细胞膜破裂,从而使微生物活性降低甚至消失,通过添加一定量的保护剂,可使菌体的存活率大大提高。冻干保护剂可分为低分子保护剂与高分子保护剂[22]。低分子保护剂可与菌体细胞膜磷脂中的磷酸基团或菌体蛋白质极性基团形成氢键,保护细胞膜和蛋白质结构与功能的完整性[20]。而高分子保护剂则通过“包埋”形式保护菌体,同时促进低分子保护剂发挥作用[21-22]。实验选取一种高分子保护剂(蛋白胨)与六种低分子保护剂(海藻糖、葡萄糖、甘油、谷氨酸钠、Vc、PBS溶液)进行冻干(见图2)。

图2 七种保护剂下乳酸菌与酵母菌的冻干存活率Fig.2 The survival rate of freeze-dry of LAB and yeast protected by seven protective agents
图2可知,7种保护剂对乳酸菌冻干保护效果依次为:海藻糖> Vc >蛋白胨>甘油>谷氨酸钠>葡萄糖>PBS,其中,海藻糖、蛋白胨和Vc效果最佳,冻干存活率分别为54.58%、42.55%、44.65%,甘油和谷氨酸钠效果类似,PBS保护效果最差,冻干存活率仅为24.75%;7种保护剂对酵母菌冻干保护效果依次为:海藻糖>蛋白胨>Vc>谷氨酸钠>甘油>葡萄糖>PBS,以海藻糖、蛋白胨和Vc效果最好,冻干存活率分别为59.14%、56.28%、52.90%,PBS保护效果最差,冻干存活率为24.87%。由于海藻糖成本高、保护优势不明显,因此选择保护效果良好且成本较低的蛋白胨与Vc作为复合保护剂。
2.2.2 复合保护剂对酵母菌与乳酸菌冻干存活率的影响
与复合保护剂相比,单一保护剂对菌体的保护效果较差,不能满足菌体抵抗外界恶劣的条件,一般按一定配比制作复合保护剂,保护剂之间形成优势互补,提高菌体的冻干存活率。实验选用单一保护效果较佳的蛋白胨与Vc(8%蛋白胨+3%Vc、8%蛋白胨+5%Vc、8%蛋白胨+7%Vc、10%蛋白胨+3%Vc、10%蛋白胨+3%Vc、10%蛋白胨+3%Vc、12%蛋白胨+3%Vc、12%蛋白胨+3%Vc、12%蛋白胨+3%Vc)进行复合保护剂配比优化,研究其保护效果(图3)。
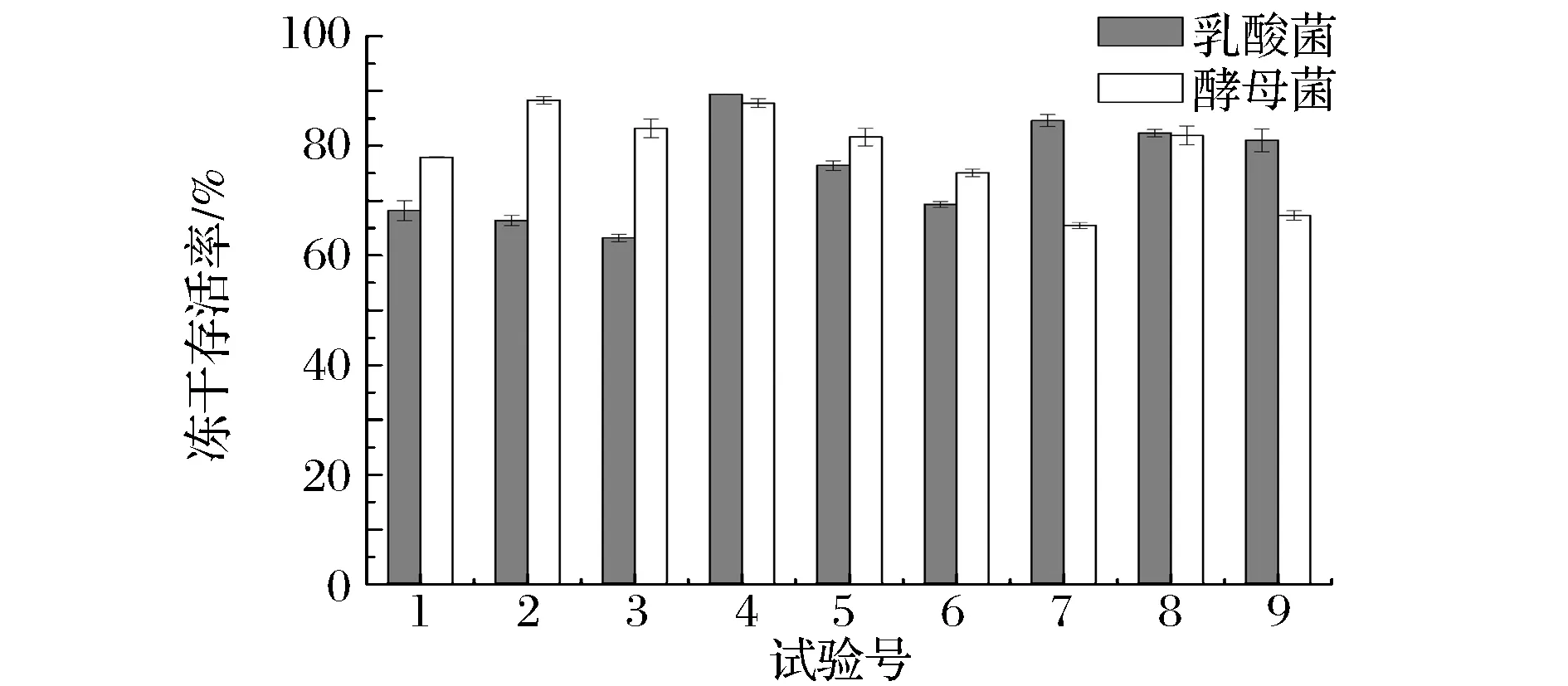
1-8%蛋白胨+3%Vc;2-8%蛋白胨+5%Vc;3-8%蛋白胨+7%Vc;4-10%蛋白胨+3%Vc;5-10%蛋白胨+3%Vc;6-10%蛋白胨+3%Vc;7-12%蛋白胨+3%Vc;8-12%蛋白胨+3%Vc;9-12%蛋白胨+3%Vc图3 复合保护剂保护效果Fig.3 Effect of protection by compound protective agents
由图3可知:对于乳酸菌,保护剂配比为10%蛋白胨+3%Vc时保护效果最佳,菌体冻干存活率达87.8%,8%蛋白胨+7%Vc效果最差,仅为63.1%。对于酵母菌,复合保护剂配比为8%蛋白胨+5%Vc保护效果最好,冻干存活率达86.8%,12%蛋白胨+3%Vc保护效果最差,其冻干存活率仅为65.5%。综合乳酸菌与酵母菌在9种不同配比复合保护剂下的冻干存活率,选择复合保护剂配比为10%蛋白胨+3%Vc,此时酵母菌与乳酸菌冻干存活率分别达到86.3、87.8%。
2.3 菌剂发酵性能评价
2.3.1 不同菌剂发酵甘蓝pH值与总酸度变化
pH值是泡菜发酵的一个重要指标,一般认为当pH≤4时即为发酵终点。实验比较自制菌剂、市售菌剂与自然发酵泡菜pH值与总酸度变化(见图4和图5):随着发酵进行,甘蓝的pH值逐渐降低,在3.5左右趋于稳定,总酸度先增大后趋于稳定。但同时自制菌剂、市售菌剂、自然发酵甘蓝的pH值与总酸度变化速率不同,pH值分别在第3、5、7 d后保持稳定,总酸度分别于第5、7、7天趋于稳定,为11.05、12.38、12.44 g/100 g。自制菌剂有显著的产酸能力,这一研究结果与余文华等人在研究直投式菌剂发酵泡菜时所得结论一致[4]。泡菜pH值与总酸度最后趋于稳定,是由于乳酸菌大量繁殖产酸,使乳酸积累过量,抑制了乳酸菌的生长[23]。

图4 不同菌剂发酵甘蓝的pH值变化Fig.4 The pH changes of cabbage fermented by different inocula

图5 不同菌剂发酵甘蓝的总酸变化Fig.5 The total acid changes of cabbage fermented by different inocula
2.3.2 不同菌剂发酵甘蓝亚硝酸盐含量的变化
腌制蔬菜制品中的亚硝酸盐主要是由部分革兰氏阴性菌的硝酸还原酶将细胞质中的硝酸盐还原而来,可造成人体急性或慢性中毒[24]。目前我国酱腌菜卫生标准(GB2714—2003)中规定亚硝酸盐含量不超过20 mg/kg。实验比较不同菌剂发酵甘蓝亚硝酸盐含量的变化情况(见图6)

图6 不同菌剂发酵甘蓝亚硝酸盐含量的变化Fig.6 The nitrite content changes of cabbage fermented by different inocula
由图6可知:自然发酵、市售菌剂、自制菌剂的泡菜亚硝酸盐含量均呈先增大后减小的趋势,分别在第5、2、2天达到最大值27.75、19.44和7.07 mg/kg,于第7天后基本趋于稳定,分别为4.36、3.56、2.66 mg/kg。自然发酵泡菜在第2~5天亚硝酸盐含量超过20 mg/kg,市售菌剂发酵泡菜亚硝酸盐含量于第2天时接近20 mg/kg,而自制菌剂发酵的泡菜亚硝酸盐含量远低于20 mg/kg。因此从安全性上来说自制菌剂比市售菌剂好,而自然发酵最差,这一研究结果与袁亚等人在研究人工接种乳酸菌对泡菜亚硝酸盐含量影响时得到的结论一致[25]。
2.4 不同菌剂发酵甘蓝挥发性风味成分比较
由不同菌剂发酵甘蓝的理化指标变化可知:发酵7 d后泡菜的酸度、pH值与亚硝酸含量趋于稳定,泡菜基本成熟。准确称取发酵7 d的泡菜匀浆各5.0 g,经顶空固相微萃取后进行GC-MS分析,挥发性风味物质的相对含量见表4。
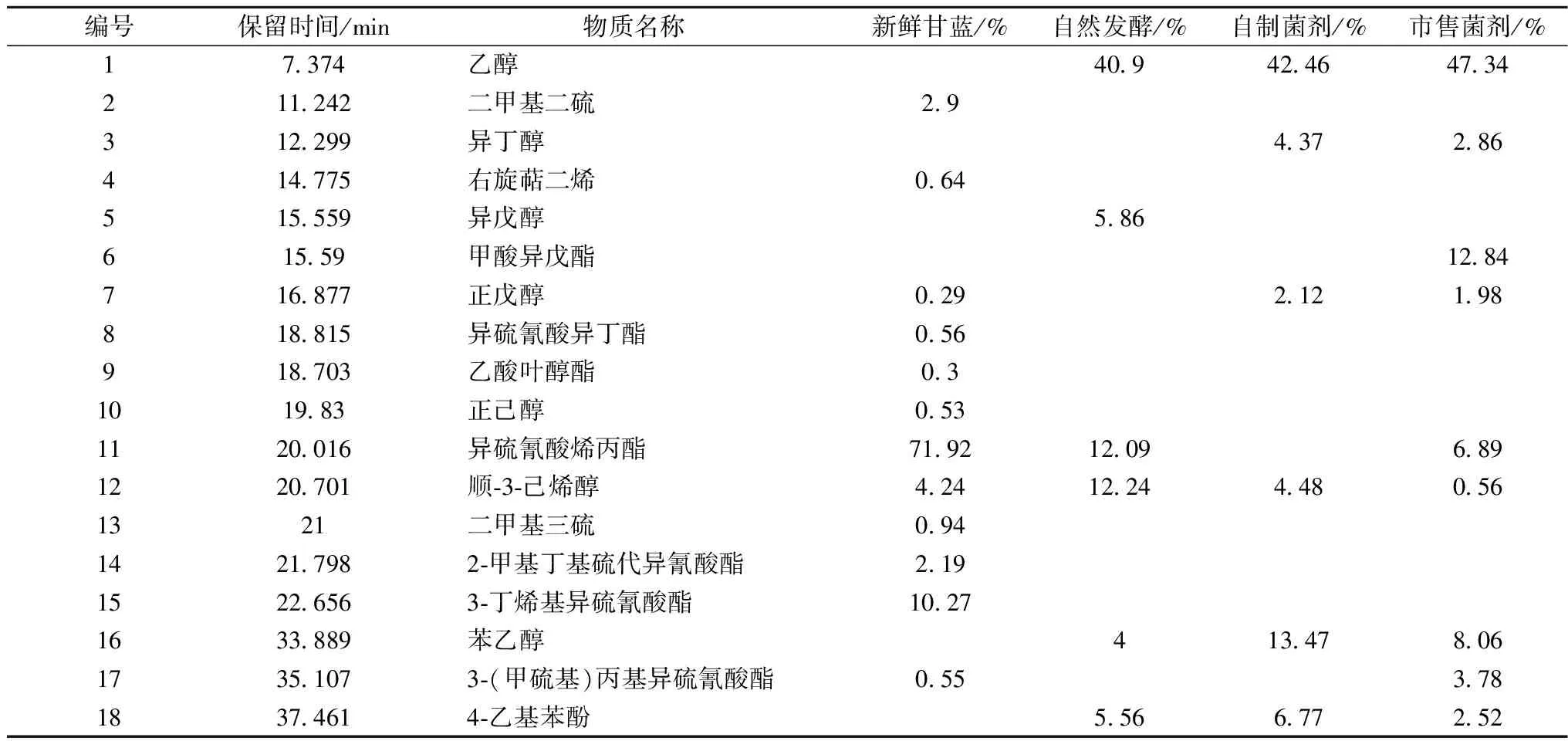
表4 不同菌剂发酵甘蓝的挥发性风味成分比较
异硫氰酸烯丙酯、3-丁烯基异硫氰酸酯、顺-3-己烯醇是新鲜青菜中的主要香味物质,相对含量分别为71.92、10.27、4.24%。异硫氰酸烯丙酯与3-丁烯基异硫氰酸酯具有辛辣味,广泛存在于芥菜、山葵、辣根等十字花科蔬菜及其制品中[29]。新鲜甘蓝发酵7 d后,自制菌剂发酵甘蓝中未检测出异硫氰酸烯丙酯,市售菌剂、自然发酵甘蓝中异硫氰酸烯丙酯相对含量分别减少到6.89%和12.09%,降低了90.42%和83.19%;3种菌剂发酵的甘蓝中均未检测出3-丁烯基异硫氰酸酯;这两种硫氰酯的减少或消失有效降低了青菜的辛辣感,是微生物代谢活动的结果。顺-3-己烯醇,又称叶醇,是一种重要的不饱和脂肪醇,具有清新的草香味。新鲜甘蓝经自制菌剂、自然发酵,叶醇的相对含量分别增加到4.48%和12.24%,上升了5.37%和188.68%,市售菌剂发酵泡菜相对含量减少到0.56%,下降了86.79%,这可能是菌种代谢特性不同造成的。
新鲜甘蓝经自制菌剂、市售菌剂、自然发酵,苯乙醇相对含量分别增加到13.47和8.06、4%,其中,自制菌剂发酵与其他2种发酵方式相比,苯乙醇含量分别上升了67.12%和236.75%。苯乙醇是酵母菌将L-苯丙氨酸经脱氨酶、脱羧酶、还原酶作用产生,具有甜香、玫瑰花香和蜂蜜香[30],有助于增加泡菜风味。4-乙基苯酚是新鲜青菜经自制菌剂、市售菌剂、自然发酵产生的香味物质,相对含量分别为6.77%、2.52%和5.56%,该物质具有特殊的香气[28],是由酵母菌将乙烯基分解产生,在葡萄酒和郫县豆瓣酱中均有检出[29]。
3种发酵方式相比,自制菌剂既可有效地降解新鲜甘蓝中辛辣物质(异硫氰酸烯丙酯、3-丁烯基异硫氰酸酯等),又可显著增加泡菜中特殊风味成分的含量(顺-3-己烯醇、苯乙醇、4-乙基苯酚等),是一种可提高泡菜风味的菌剂。
2.5 不同菌剂发酵甘蓝的感官评价
新鲜甘蓝经自制菌剂、市售菌剂、自然发酵7 d后,各取适量泡菜进行感官评价,结果如表5所示,自制菌剂发酵泡菜感官评价最优为91分,市售菌剂发酵泡菜次之,自然发酵泡菜最差。自制菌剂发酵泡菜色泽、香味、滋味、质地均高于其余二者,是由于自制菌剂产酸能力强,发酵初期大量产酸,钝化了使蔬菜组织软化的酶的活性,赋予产品清脆的质地[30]。香味上,自制菌剂发酵泡菜具有明显的玫瑰香味,香味得分最佳,为28分。
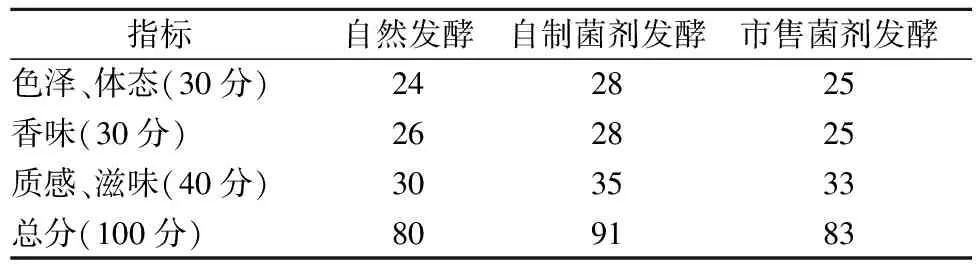
表5 不同菌剂发酵甘蓝的感官评价
3 结论
(1)研究采用正交设计确定了混合菌体最优离心收集条件为转速6 500 r/min、时间13 min、温度4 ℃,此条件下酵母菌与乳酸菌离心存活率分别达到88.1、92.4%。以10%蛋白胨+3%Vc为冻干保护剂,冻干12 h后,酵母菌与乳酸菌冻干存活率可达到86.3、87.8%。
(2) 3种菌剂发酵甘蓝相比:自制菌剂在产酸速率上具有明显的优势,其pH值在第3天达到3.5,总酸度于第5天达到11.05 g/100 g,与其他2种发酵方式相比缩短了2 d;自制活菌制剂发酵泡菜的亚硝酸盐含量最大值仅为7.07 mg/kg,远低于国标规定的最大值20 mg/kg,安全性更好;风味上,自制菌剂发酵泡菜的风味物质在第7天时达到6种,初步认定乙醇(42.46%)、苯乙醇(13.47%)、4-乙基苯酚(6.77%)、顺-3-己烯醇(4.48%)是其主要的风味物质;感官上,自制菌剂泡菜最优(91分)。研究结果可为优质泡菜菌剂的工业化生产提供一定的参考。
[1] 李书华,陈封政.泡菜的研究进展及生产中存在的问题[J].食品科技, 2007,32(3):8-11.
[2] 李书华,蒲彪,陈封政.泡菜的功能及防腐研究进展[J].中国酿造, 2005,17(4):6-8.
[3] 陈功,余文华,张其圣等.泡菜直投式菌剂制备及应用研究[J].四川食品与发酵,2008,44(4):19-23.
[4] 余文华,张其圣,陈功等.直投式菌剂发酵泡菜的动态研究[J].食品与发酵科技,2010,46(6):12-15,25.
[5] 赵爽,孙娟,刘书亮等.,泡菜直投式乳酸菌发酵剂的制备[J].食品工业科技, 2014,40(17):171-175;179.
[6] 朱孔亮,泡菜用乳酸菌的筛选、高密度培养及菌剂配方的研究[D]. 无锡:江南大学,2014:14-17..
[7] 张良,向文良,曾泽生等.四川泡菜乳酸发酵菌剂的研究[J]. 食品科学, 2013,34(19):200-206.
[8] 韩秋霞,邹玉红.传统泡菜的微生物学研究[J].中国酿造, 2008,27(7):47-50.
[9] GAO G. ZHANG G. Influence of freeze-drying conditions on survival ofOenococcusoenifor malolactic fermentation[J].International Journal of Food Microbiology, 2009,135 (1):64-67.
[10] JIN X, DAN C,Microencapsulating aerial conidia ofTrichodermaharzianumthrough spray drying at elevated temperatures[J]. Biological Control, 2011, 56(2): 202-208.
[11] LUNA-SOLANO G, SALGADO-CERWANTES M A,G C,et al. Optimization of brewer's yeast spray drying process[J]. Journal of Food Engineering, 2005,68(1):9-18.
[12] 余淑娴,郝晓霞,罗明,真空冷冻干燥技术及其应用[J].食品科技, 2007,32(10):22-25.
[13] 房星星,吕晓东.真空冷冻干燥技术的应用研究[J].食品与药品, 2007, 9(8):57-60.
[14] 付博,马齐,王卫卫.真空冷冻干燥与喷雾干燥长双歧杆菌的工艺比较研究[J].食品科学, 2012,33(7):188-192.
[15] 杨培洁,李腾,陈晓红等. MTT法测定瑞士乳杆菌MB2-1活菌数[J].食品科学, 2013,34(20):99-102.
[16] 中国食品发酵工业研究院.GB/T 12456-2008食品中总酸的测定[S]. 北京:中国标准出版社, 2008.
[17] 国家质检总局(CN-GB). GB/T 5009.33—2010食品中亚硝酸盐与硝酸盐的测定[S]. 北京:中国标准出版社, 2010.
[18] 魏永义,赵国品,张莉,定量描述法在食醋感官评定中的应用[J].中国调味品, 2012,37(6):20-21,26.
[19] 吕兵,张国农,林金资.酸奶发酵剂速效干燥制备中保护剂的研究[J].中国乳品工业, 1996. 15(2):3-5.
[20] 陈声明,吕琴.微生物冷冻干燥的抗性机理[J].微生物学通报, 1996, 20(4):236-238.
[21] TIMASHEFF SN. Control of protein stability and reactions by weakly interacting cosolvents: the simplicity of the complicated[J]. Advance in Protein Chemistry, 1998, 51(1) 355-432.
[22] MAZZOBRE M F, BUERA M D P, CHIRIFE J. Protective role of trehalose on thermal stability of Lactase in relation to its glass and crystal forming properties and effect of delaying crystallization[J]. LWT-Food Science and Technology, 1997,30( 3): 324-329.
[23] 闫征,王昌禄,顾晓波.pH值对乳酸菌生长和乳酸产量的影响[J].食品与发酵工业, 2003,29(6):35-38.
[24] 马延岩,发酵蔬菜中亚硝酸盐的生成及降解机理研究[D].天津:天津科技大学,2010: 8-10.
[25] 袁亚,池金颖,黄丹丹.人工接种乳酸菌对泡菜感官品质和亚硝酸盐含量的影响[J].食品工业科技, 2012,33(7):119-122;126.
[26] 肖华志,食用辛辣风味物质异硫氰酸烯丙酯(AITC)的研究[D].北京:中国农业大学,2004:21-24.
[27] 范文来,徐岩.酒类风味化学[M].北京:中国轻工业出版社, 2014:110-119.
[28] 崔云前,曹小红,王春玲等.发酵行业4-乙烯基愈创木酚和4-乙基愈创木酚研究进展[J].中国酿造, 2009,28(4):14-17.
[29] 冯军,陈海涛,黄明泉等.不同品牌郫县豆瓣酱挥发性成分的比较研究[J].北京工商大学学报(自然科学版),2010,28(3):17-22.
[30] RHEE S J,LEE J E,LEE C H., Importance of lactic acid bacteria in Asian fermented foods[J]. Microb Cell Fact, 2011,10(1): 5-9.
Preparation of a complex bacteria agent for pickles and evaluation of fermentation performance
LI Yu-bin1, WU Hua-chang2, DENG Jing2*, LIU Yang2, JI Zhi-wei2, YI Yu-wen2, PENG Yi-qin2
1(College of Bioengineering, Sichuan University of Science & Engineering, Zigong 643000, China) 2(Cooking Science Key Laboratory, Sichuan Tourism University, Chengdu 610000, China)
In this study, a lactic acid bacteria strain and a yeast strain preserved in laboratory were used to prepare live bacteria agent by vacuum freeze-drying technology, and fermentation performance of live bacteria agent was evaluated. Results showed that bacteria were collected by centrifugation (4 ℃, 6 500 r/min, 13 min) with 10%peptone and 3% vitamin C as protective agent, the survival rates of yeast and lactic acid bacteria after vacuum freeze-drying were 86.3% and 87.8%, respectively. Fermentation using self-made bacteria agent was compared with commercial bacteria agent and natural fermentation. The pH and total acid of cabbage fermented by self-made bacteria agent were 5.4 and 11.05 g, which showed stronger acid-producing capability than others. The maximum content of nitrate from fermentation using self-made bacteria agent was lower than that from other fermentation, which was only 7.07 mg/kg. Ethanol (42.46%), benzene ethanol (13.47%), 4-ethyl phenol (6.77%) and cis -3-hexenol (4.48%) were preliminarily identified as the main volatile flavor compounds of self-made bacteria agent. The self-made bacteria agent with stronger acid production and aroma-producing ability would have good application prospects in the pickle industry.
yeast; lactic acid bacteria; bacteria agent; fermentation performance
10.13995/j.cnki.11-1802/ts.201612018
硕士研究生(邓静教授为通讯作者,E-mail:79190096@qq.com)。
四川省教育厅自然科学基金(15ZA0315);四川省科技厅(2016NZ0018);四川省科技厅(2016FZ0027);成都市科技局(2015-NY02-00360-NC)
2016-03-25,改回日期:2016-07-15

