抗氧化型发酵剂对香肠发酵过程中脂肪氧化的影响
黄露,郇延军
(江南大学 食品学院,江苏 无锡,214122)
抗氧化型发酵剂对香肠发酵过程中脂肪氧化的影响
黄露,郇延军*
(江南大学 食品学院,江苏 无锡,214122)
在传统发酵香肠只接种戊糖片球菌(Pediococcus pentosaceus, P.p)的基础上,接种产过氧化氢酶的肉糖葡萄球菌(Staphylococcus carnosus, St.c)和产超氧化物歧化酶的酿酒酵母菌(Saccharomyces cerevisiae,Sa.c)作为混合发酵剂对香肠的发酵工艺进行优化。单因素实验表明St.c和Sa.c都具有一定的抗氧化效果,在单因素的基础上由响应面分析法模拟得到了二次多项式回归方程的预测模型,以过氧化值(Peroxide value, POV)和硫代巴比妥酸值(Thiobarbituric acid value, TBAV)为脂肪氧化指标,确定最佳发酵工艺:发酵温度为23 ℃,St.c与Sa.c的总添加量为8 lgCFU/g,St.c与Sa.c的复配比为1∶1。在该条件下,发酵香肠的POV为(0.299 7±0.003 1) meq/kg,TBAV为(0.151 0±0.000 8) mg/kg,感官评分为(82.7±1.2),与只添加乳酸菌的传统工艺相比,添加抗氧化型发酵剂显著降低了POV和TBAV,抑制了脂肪的氧化,同时保持了产品的色泽、外观、质地、风味。
发酵剂;发酵香肠;抗氧化性;感官评价
发酵香肠是指将绞碎的肉、动物脂肪、盐、发酵剂和香辛料等混合后灌进肠衣,在自然或人工控制条件下,经过微生物发酵产生酸或醇,使肉的pH值降低,并经或不成熟干燥使香肠的Aw下降而制成的具有较好保藏性能和典型发酵风味特性的肉制品[1-3]。脂质氧化是香肠发酵成熟过程中主要的生化反应过程,对风味物质的形成具有特殊的意义[4-5]。脂质氧化除了直接产生风味化合物外,其氧化产物还可以进一步参与美拉德反应,形成大量的风味物质[6]。适度的氧化可以产生肉的特征香味[7],而过度的氧化会导致肉品在加工贮存过程中出现品质劣化、产生不良风味,因此控制脂肪氧化对于肉制品工业至关重要[8]。目前,市场上发酵香肠的包装形式多样,有散装、一般包装和真空包装,其中,散装保存时间短且氧化程度较大,一般包装和真空包装主要是添加了抗氧化剂,如异VC、茶多酚、迷迭香等,黄丹等[9]发现将茶多酚按0.05%的量添加到香肠中,能延缓哈喇味的产生,提高香肠的氧化稳定性。NASSUA等[10]研究发现,0.05%的迷迭香可更有效地抑制羊肉香肠的脂肪氧化。微生物调控也是抑制脂肪氧化的途径之一[11]。研究表明某类微生物在生长代谢过程中会产生一些抗氧化酶,王永霞等[12]从中式传统肉制品中分离、纯化、筛选出能产生过氧化氢酶阳性的肉糖葡萄球菌,初步认定可作为肉用发酵剂。丛文蓉等[13]从不同来源的酿酒酵母中,筛选得到1株发酵特性优良,且抗氧化性能突出的酿酒酵母菌株。SONGISEPP等[14]证实,发酵乳杆菌ME-3具有抗氧化和抗微生物活性。LIN等[15]发现嗜酸乳杆菌与长双歧杆菌的无细胞提取物都具有清除膜脂质过氧化反应产物MDA的能力。
本实验以戊糖片球菌(Pediococcus pentosaceus, P.p)、肉糖葡萄球菌(Staphylococcus carnosus, St.c)和酿酒酵母菌(Saccharomyces cerevisiae,Sa.c)作为混合发酵剂,通过单因素和响应面优化实验对发酵香肠的发酵工艺进行优化,以过氧化值(Peroxide value, POV)和硫代巴比妥酸值(Thiobarbituric acid value, TBAV)为指标,并对发酵香肠进行感官评定,研究在最佳发酵条件下香肠的特性,以期开发具有抗氧化功能、风味独特的新型发酵香肠。
1 材料与方法
1.1 原料、试剂与仪器
新鲜猪后腿肉及猪背膘、食盐、白糖、味精、姜粉、胡椒粉、花椒粉、八角粉、五香粉等购于当地超市。其他试剂均为分析纯。P.p(编号GIM1.428),St.c(编号GIMT1.044),Sa.c(编号GIM2.110),三种菌都购于广东省微生物菌种保藏中心。MRS培养基,参照GB478912—2003;营养肉汤培养基,参照GB478912—2003;麦芽汁培养基购于广东环凯微生物科技有限公司。
SW-CJ-2D型双人单面垂直送风超净台,苏州净化设备有限公司;LDZX-50FBS立式压力蒸汽灭菌器,上海申安医疗器械厂;SPX型智能生化培养箱,南京金恒实验仪器厂;紫外-可见光分光光度计(UV-2600),上海天美科学仪器有限公司;KBF240型恒温恒湿生化培养箱,德国Binder公司;FE20K型pH计,瑞士梅特勒-托利多。
1.2 实验方法
1.2.1 发酵剂的制备
将菌种活化,作为种子液。分别将P.p、St.c和Sa.c静置培养到对数生长期,将各自的增殖培养液离心(4 000 r/min)10 min,倒掉上清液,菌体沉淀用10 mL无菌生理盐水(0.85%)悬浮,即得到需要的液体发酵剂,经活菌计数后稀释到所需浓度用于后续的接种。
1.2.2 猪肉发酵香肠发酵工艺流程及操作要点[16]
原料选择(肥瘦比为1∶4)→肥肉切丁、瘦肉绞碎→添加配料→腌制(4 ℃,1 d)→接种发酵剂→灌入肠衣→发酵→成熟干燥→成品。
原料肉的预处理:选用新鲜的猪后腿肉,将肥瘦肉分开,瘦肉绞碎,肥肉切丁,瘦肉与肥肉按4∶1进行混合。
腌制:2.5%盐、2%白糖、0.1%胡椒粉、0.1%花椒粉、0.1%姜粉、0.1%味精、0.1%五香粉、0.1%八角粉,在4 ℃条件下腌制1 d。
接种发酵剂:用灭菌的生理盐水提前将混合发酵剂活化。
灌入肠衣:用灌肠器将腌制好的猪肉糜灌入天然猪肠衣中。
发酵:于85%~90%RH及适宜温度的恒温恒湿箱中发酵。
成熟干燥:于15 ℃、75%RH的恒温恒湿箱中成熟。
1.3 单因素实验
按传统发酵香肠的一般工艺的将P.p接种量固定为8 lgCFU/g,分别考察发酵温度、St.c与Sa.c复配比、St.c与Sa.c总接种量对香肠发酵过程中脂肪氧化的影响。发酵48 h后,终止发酵,取样测定POV和TBAV。
发酵温度对脂肪氧化的影响:将菌种配比为1∶1、总接种量为8 lgCFU/g的St.c与Sa.c添加到腌制后的猪肉糜中,灌制成香肠后分别置于15、20、25、30、35 ℃下发酵。
St.c与Sa.c总接种量对脂肪氧化的影响:将菌种配比为1∶1、总接种量分别为6、7、8、9、10 lgCFU/g的St.c与Sa.c添加到腌制后的猪肉糜中,灌制成香肠后于25 ℃下发酵。
St.c与Sa.c复配比对脂肪氧化的影响:将总接种量为8 lgCFU/g的St.c与Sa.c添加到腌制后的猪肉糜中,且St.c与Sa.c复配比分别为1∶3、1∶2、1∶1、2∶1、3∶1,灌制成香肠后于25 ℃下发酵。
对照组:只接种与实验组等量的P.p,其他条件同上。
1.4 响应面优化实验
在单因素实验的基础上,根据Box-Behnken试验设计原理[17],选取发酵温度(A)、St.c与Sa.c总接种量(B)、St.c与Sa.c复配比(C)3个因素进行中心组合实验,以最终产品的POV和TBAV作为双响应值。利用Design-Expert 8.0.6软件进行响应面设计及数据处理,实验各因素及水平编码见表2。
1.5 相关指标的测定方法
POV的测定:参照GB/T5009.37—2003中的比色法测定。
TBAV的测定:参考郇延军[18]等的方法。

表1 发酵香肠感官评定指标及评分标准
感官评价:将经发酵成熟后的香肠切成1 cm×1 cm×2 cm大小在100 ℃水浴中下蒸煮15 min后,进行感官。参考文献[19],并改进如下:由经专门培训与考核的10人组成评定小组,评定标准见表1,评定方法采用100分制,按色泽、外观、质地、风味指标进行综合评价。最后按照色泽30%、外观20%、质地20%、风味30%的权重,评价产品的品质。
1.6 数据处理
每个样品重复3次实验,取平均值。实验数据用Excel 2010、Origin 9.1、SPSS 22及Design-Expert 8.0.6进行分析。
2 结果与分析
2.1 单因素实验
2.1.1 发酵温度对香肠脂肪氧化的影响
发酵温度是微生物生长及微生物产酶特性的一个重要影响因素。从图1和图2可看出,随发酵温度的增高,实验组和对照组发酵香肠的POV和TBAV逐渐上升,对照组POV和TBAV随温度的升高持续增加,且都高于实验组。这与王恺[20]在16~42 ℃接种3种乳酸菌发酵剂对香肠POV和TBAV的变化趋势是一致的。当发酵温度达到25~30 ℃时,温度对实验组POV和TBAV的影响不显著(P>0.05),但发酵温度高于30 ℃时,温度对实验组POV和TBAV的影响极其显著(P<0.05)且增长较快,这可能是因为25~30 ℃是3种微生物的最适生长温度,且是抗氧化酶产生的最佳温度,此时产生的抗氧化活性物质积累较多,在一定程度上抑制了脂肪的氧化,而温度高于30 ℃时,脂肪氧化速度加快,抗氧化活性物质生成较少,已不能起到抑制作用。故最终选取发酵温度20、25、30 ℃进行进一步分析。

图1 发酵温度对发酵猪肉香肠POV的影响Fig.1 Effects of different fermentation temperature on POV of fermented pork sausage
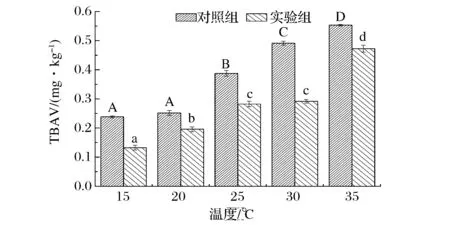
图2 发酵温度对发酵猪肉香肠TBAV的影响Fig.2 Effects of different fermentation temperature on TBAV of fermented pork sausage注:相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)
2.1.2St.c与Sa.c总接种量对香肠脂肪氧化的影响
如图3和图4所示,随着St.c与Sa.c总接种量的增大,对照组POV和TBAV变化不显著,而实验组两者都呈减小的趋势,随着接种量的逐渐增大脂质的氧化程度逐渐减小,可能是St.c与Sa.c生长繁殖代谢过程中产生的抗氧化活性物质对脂质的氧化起到了一定的抑制作用,两者的变化趋势与王燚等[21]的研究结果一致。接种量在6~8 lgCFU/g范围时,St.c与Sa.c总接种量对POV和TBAV的影响极其显著(P<0.05)。这可能是因为随着接种量的增大,St.c代谢产生的CAT积累较多,Sa.c生长代谢的SOD积累较多,即两者产生的总抗氧化物质较多,对脂肪氧化的抑制增强,即POV和TBAV减小。但当St.c与Sa.c总接种量大于8 lgCFU/g时,两菌总接种量对POV和TBAV的影响不显著(P>0.05)。故最终选取St.c与Sa.c总接种量为7、8、9 lgCFU/g进行响应面进一步分析。

图3 St.c与Sa.c总接种量对发酵猪肉香肠POV的影响Fig.3 Effects of different inoculum size of St.c and Sa.c on POV of fermented pork sausage

图4 St.c与Sa.c总接种量对发酵猪肉香肠TBAV的影响Fig.4 Effects of different inoculum size of St.c and Sa.c on TBAV of fermented pork sausage
2.1.3St.c与Sa.c复配比对香肠脂肪氧化的影响
如图5和图6所示,对照组的POV和TBAV在发酵过程中不变,而实验组POV和TBAV随St.c与Sa.c复配比的增大而减小,当其复配比从1∶3增加到1∶1时,POV和TBAV减小极其显著(P<0.05),其原因可能是酵母菌生长时耗尽了肠馅空间中残存的氧,不饱和碳链不能够吸收氧形成过氧化物,从而降低氧化值;另外随着酵母菌比例的增加,酵母菌产生的SOD酶增多,在一定程度上抑制了脂肪的氧化,使得POV和TBAV减小。这与LEE等[22]的研究结果类似,即酵母菌的添加提高了冷藏牛肉抗氧化酶活性,延缓了脂质的过氧化,延长了货架期。当两菌的复配比大于2∶1时,复配比对POV和TBAV的影响不显著(P>0.05),即随着复配菌株中酵母菌含量增加较多时,St.c总数较小,酵母菌的酒精发酵降低了乳酸菌活性,即St.c产CAT受到了抑制,总抗氧化活性物质变化不大。故最终选取St.c与Sa.c复配比为1∶2、
1∶1、2∶1进行响应面进一步分析。

图5 St.c与Sa.c复配比对发酵猪肉香肠POV的影响Fig.5 Effects of different compositeratio of St.c and Sa.c on POV of fermented pork sausage

图6 St.c与Sa.c复配比对发酵猪肉香肠TBAV的影响Fig.6 Effects of different compositeratio of St.c and Sa.c on TBAV of fermented pork sausage
2.2 响应面分析
2.2.1 响应面实验结果
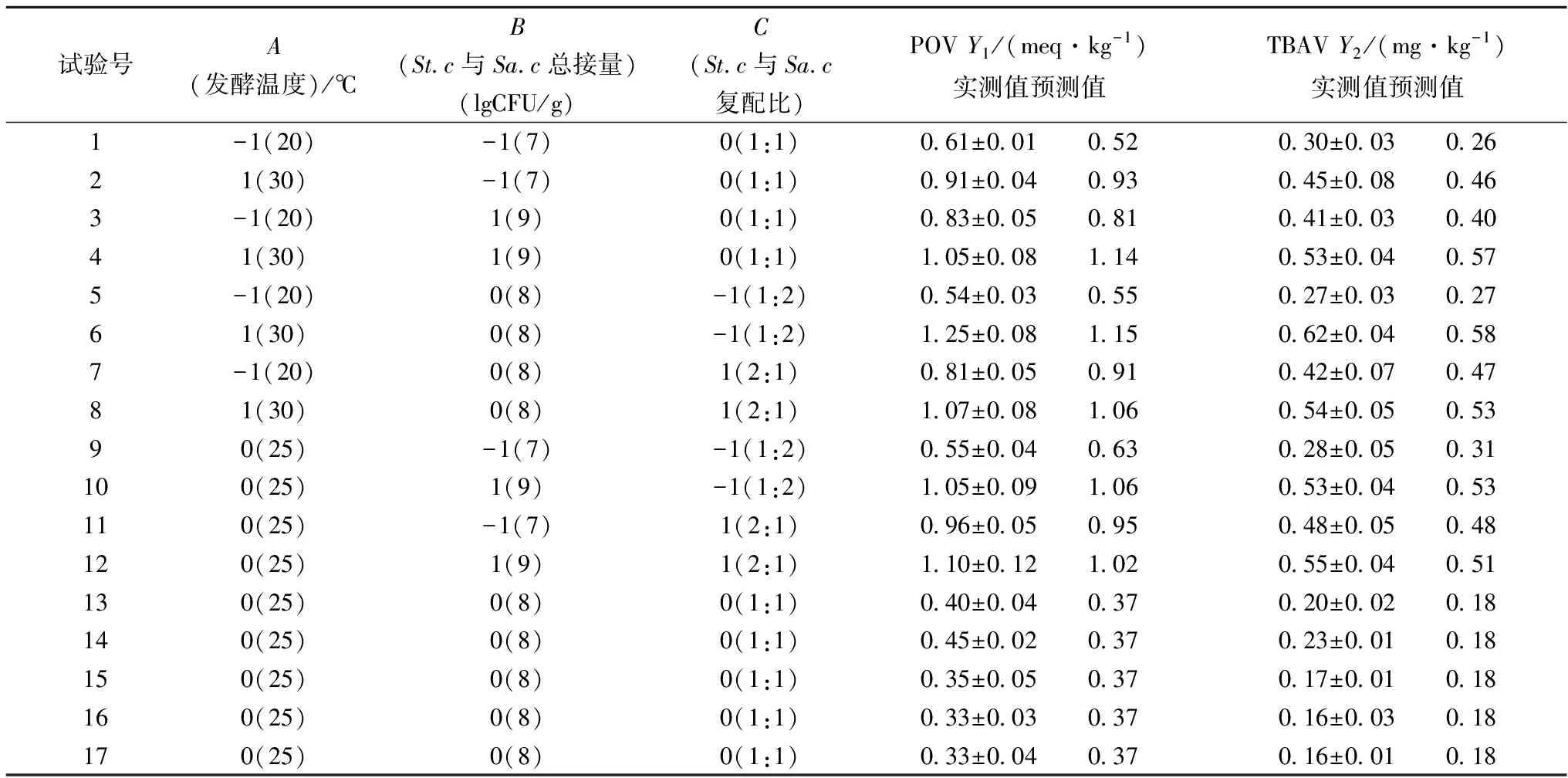
表2 响应面实验设计方案及结果
2.2.2 回归模型的建立及方差分析
以发酵温度(X1)、St.c与Sa.c总接种量(X2)、St.c与Sa.c复配比(X3)为自变量,分别以POV、TBAV为应变量Y1、Y2,利用Design-Expert8.0.6统计软件对响应面实验数据进行二次多项回归拟合,分别获得Y1、Y2的多元回归方程:Y1=17.622-0.376A-3.465B+0.448C-0.004AB-0.030AC-0.121BC+0.010A2+0.240B2+0.545C2;Y2=8.640-0.192A-1.679B+0.235C-0.002AB-0.016AC-0.060BC+0.005A2+0.116B2+0.278C2。
建立猪肉发酵香肠发酵工艺参数回归模型,对该模型进行方差分析,对模型系数进行显著性检验,分析结果分别见表2和表3。

表3 响应面方差分析结果(POV和TBAV为响应值)
注:**表示差异极显著(P<0.01),*表示差异显著(P<0.05),—表示差异不显著(P>0.05)。


2.2.3 各因素对POV与TBAV的影响
响应面分析根据回归的各单项指标方程,绘制各交互作用图,对交互作用影响不显著的未绘出。
图7和图8分别给出了发酵温度、St.c与Sa.c复配比之间交互作用对香肠发酵结束后POV和TBAV的响应面曲线图。图7反映出香肠发酵结束后POV随发酵温度的升高而增加,随St.c与Sa.c复配比的增大而增大。图8反映出香肠发酵结束后TBAV随发酵温度的升高而增加,随St.c与Sa.c复配比的增大而增大。

图7 A与C之间的交互作用对POV的影响Fig.7 Interactions between A and C on POV
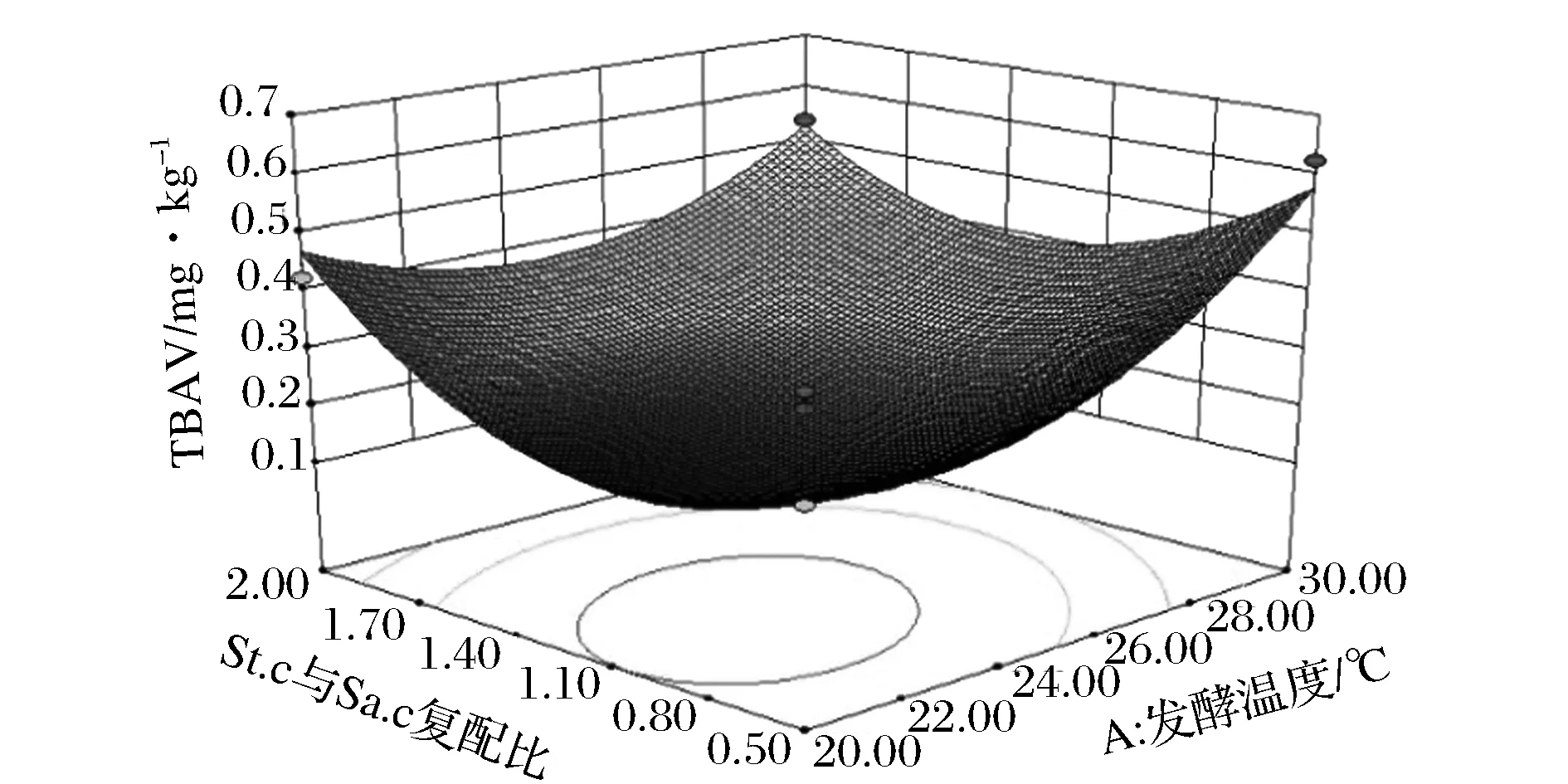
图8 A与C之间的交互作用对TBAV的影响Fig.8 Interactions between A and C on TBAV
2.3 模型的验证及感官评定
由Design-Expert8.0.6软件分析得到发酵香肠的最佳发酵条件为:发酵温度22.73 ℃,St.c与Sa.c总接种量为7.67 lgCFU/g,St.c与Sa.c复配比为1.06∶1。
考虑到实际操作,将参数调整为发酵温度23 ℃,St.c与Sa.c总接种量为8 lgCFU/g,St.c与Sa.c复配比为1∶1。为验证响应面法所得结果的可靠性,采用上述参数做3次验证试验,与传统工艺只添加乳酸菌的对照组进行比较并进行感官分析。实验结果显示,对照组POV和TBAV分别为(0.337 4±0.002 5) meq/kg和(0.182 3±0.000 6) mg/kg,优化后产品的POV和TBAV分别为(0.299 7±0.003 9) meq/kg和(0.151 0±0.000 5) mg/kg,显著降低了POV和TBAV,与预测值0.301 8 meq/kg和0.158 3 mg/kg相差较小。感官评分结果(表4)表明优化后的发酵香肠具有较高的评分(82.7±1.2),说明优化后的产品具有良好的外观、色泽、质地及香肠特有的风味。

表4 发酵香肠感官评定结果
注:用SPSS软件对感官评定中各项目进行两组独立样品t检验的显著性分析。其中, *表示差异显著(P<0.05),**表示差异显著(P<0.01),***表示差异极显著(P<0.001)。
3 小结
抗氧化型发酵剂对香肠发酵过程中的脂肪氧化起到了一定的抑制作用。通过响应面实验建立了POV和TBAV与3个因素之间的数学模型,模型分析确定发酵温度为23 ℃,St.c与Sa.c总接种量为8 lgCFU/g,St.c与Sa.c复配比为1∶1。在该条件下表现出较好的抗氧化效果,感官评分为(82.7±1.2),保持较好的感官品质;香肠的POV和TBAV分别为(0.299 7±0.003 9) meq/kg和(0.151 0±0.000 5) mg/kg,与传统工艺相分别降低了12.5%和20.7%,说明微生物发酵剂在一定程度上可以抑制脂肪的氧化。
[1] 王敏,李梦璐,葛庆丰,等.微生物外源酶对发酵肉制品品质的影响[J].食品与发酵工业,2012,38(10):134-139.
[2] COLORETTI F,TABANELLI G,CHIAVARI C, et al.Effect of wine addition on microbiologicalcharacteristics,volatile molecule profiles and biogenic amine contents in fermented sausages[J].Meat Science,2014,96(3):1 395-1 402.
[4] IACUMIN L,VENDRAME M,COMI G. Microbial spoilage of traditional dry sausages produced in small-scale facilities in Friuli,a north-eastern region of Italy[J].ACTA ALIMENTARIA,2013,42(3):390-399.
[5] 杨华,张亚杰,马俪珍.发酵剂及抗氧化剂对鲶鱼发酵香肠品质的影响[J].食品与发酵工业,2010,36(9):166-171.
[6] 魏艳丽.乳化型香肠中脂肪氧化及控制的研究[D].天津:天津商业大学,2010.
[7] 秦春君.发酵肉制品抗氧化研究进展[J].食品与发酵工业,2010,36(7):122-126.
[8] 霍晓娜,李兴民,谢辉,等.天然抗氧化剂对控制猪肉脂肪氧化及保鲜效果研究[J].食品与发酵工业,2005,31(10):145-148.
[9] 黄丹,冯治平,陈弘.茶多酚对香肠抗氧化作用的研究[J].食品科技,2003(12):53-54.
[10] RENATA T N,LIRENY A G G,MARIA A A P D S,et al.Oxidative stability of fermented goat meat sausage with different levels of natural antioxidant[J].Meat Science,2003,63:43-49.
[11] WOJCIAK K M,KARWOWSKA M,DOLATOWSKI Z J.Fatty acid profile,color and lipid oxidation of organic fermented sausage during chilling storage as influenced by acid whey and probiotic strains addition[J].Scientia Agricola,2015,72(2):124-131.
[12] 王永霞,牛天贵,郝华昆.肉品发酵剂葡萄球菌和微球菌的筛选[J].食品与发酵工业,2004,30(9):5-10.
[13] 丛文蓉,陈晶瑜,韩北忠.不同酿酒酵母发酵特性及抗氧化特性的比较[J].中国酿造,2012,31(5):21-24.
[14] SONGISEPP E,KULLLISAAR T,HUTT P,et al.A new probiotic Cheese with antioxidative and antimicrobial activity[J].J Dairy Sci,2004,87(7):2 017-2 023.
[15] LIN M Y,YEN C L.Inhibition of lipid peroxidation byLactobacillusacidophilusandBifidobacteriumlongum[J].J Agric Food Microbiol,2002,72:215-224.
[16] SPARO M,NUNEZ G G,CASTRO M,et al.Characteristics of an environmental strain,EnterococcusfaecalisCECT7121,and its effects as additive on craft dry-fermented sausages[J].Food Microbiology,2008,25(4):607-615.
[17] BELWAL T,DHYANI P,BHATT I D,et al.Optimizationextraction conditions for improving phenolic content and antioxidant activity inBerberisasiaticafruits using response surface methodology (RSM)[J].Food Chemistry,2016,10(207):115-124.
[18] 郇延军,陈妹,钟玉虎,等.高温风干对风鸭品质及脂质氧化的影响[J].食品工业科技,2013,34(15):91-96.
[19] 王萍萍,潘道东,孙杨赢,等.发酵鸭肉香肠的发酵工艺优化及抗氧化性[J].食品工业科技,2015,36(8):178-182.
[20] 王恺.三种乳酸菌发酵剂在发酵香肠中的应用研究[D].南京:南京农业大学,2013.
[21] 王燚.抗氧化肉品发酵剂的筛选及其在羊肉香肠中的应用[D].雅安:四川农业大学,2008.
[22] LEE S J,KIM H J,CHEONG S H,et al.Antioxidative effect of recombinant ice-binding protein (rLeIBP) from Arctic yeastGlaciozymasp. on lipid peroxidation of Korean beef[J].Process Biochemistry,2015,50(12):2 099-2 104.
Effect of antioxidant starter cultures on lipid oxidation of sausage during fermentation
HUANG Lu, HUAN Yan-jun*
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
In this study, based addition of lactic acid bacteria in traditional fermented sausage,Staphylococcuscarnosus(St.c) producing catelase andSaccharomycescerevisiae(Sa.c) metabolizing superoxide dismutase were used as mixed starter cultures to optimize fermentation process conditions of fermented sausage. The single factor experiments showed thatSt.candSa.chad certain antioxidant effect. Then based on response surface optimization design of experiment, orthogonal tests combining peroxide value (POV) and thiobarbituric acid value (TBAV) of sausage were used as indices to determine the optimum fermentation process. The results showed that the best fermentation temperature was 23 ℃, the inoculum size ofP.pwas 8 lgCFU/g, the inoculum size ofSt.candSa.cwere 8 lgCFU/g, and the composite ratio ofSt.atoSa.cwas 1∶1. Under these conditions, POV was (0.297 5±0.003 1), TBAV was (0.151 0±0.000 8) mg/kg, and the sensory score was (82.7±1.2). Compared with the blank control group, adding starter culture not only resulted in significant decrease of POV and TBAV, but also inhibited lipid oxidation and retained color, appearance, texture and flavor of the product.
starter culture; fermented sausage; antioxidant activity; sensory evaluation
10.13995/j.cnki.11-1802/ts.201612007
硕士研究生(郇延军教授为通讯作者,E-mail:huanyanjun@jiangnan.edu.cn)。
江苏省食品安全与质量控制协同创新中心资助项目
2016-06-01,改回日期:2016-07-13

