草莓品种红颜组培快繁体系的优化
陈英,张西英
(新疆生产建设兵团第六师农业科学研究所,新疆五家渠 831300)
草莓品种红颜组培快繁体系的优化
陈英,张西英
(新疆生产建设兵团第六师农业科学研究所,新疆五家渠 831300)
【目的】建立稳定的草莓组织培养快繁体系提供技术参数。【方法】以草莓品种红颜为材料,研究外植体消毒、诱导分化、增殖培养等各环节的影响因子和外源激素浓度配比。【结果】⑴外植体消毒的最佳方法为:匍匐茎用75%酒精浸泡30s,0.1%升汞消毒5 min,再用无菌水漂洗5遍迅速用滤纸吸干。⑵诱导方式:瓶内匍匐茎茎尖剥取0.3~0.5 mm最优最好。⑶诱导分化最佳培养基MS+6-BA 0.1 mg/L+IBA 1 mg/L。⑷采用培养基MS+6-BA 0.2 mg/L+IBA 0.05 mg/L+中苗期+每块3个芽的切割方式达到最理想的增殖系数。【结论】外源激素中细胞分裂素和生长素之间的适宜的配比浓度是,红颜草莓建立稳定的再生体系的关键因素。匍匐茎尖诱导分化适宜的细胞分裂素和生长素配比浓度为1∶10;快繁适宜的细胞分裂素和生长素配比浓度为4∶1。
草莓;组织培养;快繁;优化
0 引 言
【研究意义】草莓营养丰富,果肉中含有大量的糖类、有机酸、果胶、鞣花酸和花色苷等物质[1-3]。它既可鲜食也可加工成果浆、果汁、果酒、罐头[4]。随着新疆设施农业的快速发展,近年陆续引入红颜、章姬、甜查理等草莓新优品种,设施草莓进入了快速发展期。生产上草莓主要繁殖方法[5]:匍匐茎繁殖、母株分株繁殖,连续种植存在着严重病毒累积。草莓植株本身没有对病毒的免疫能力,目前又没有特效的药剂或方法治愈,一旦感染病毒,植株长势减弱、个体矮化、含糖量变低、畸形果多、产量降低[6-8]。我国研究者对草莓皱缩病毒、草莓斑驳病毒、草莓轻型黄边病毒、草莓镶脉病毒进行了鉴定[9],运用生物技术对草毒进行脱毒[10-11]和组培快繁是解决问题的有效途径。【前人研究进展】用茎尖培养法进行无病毒苗的培育,是目前世界上获得草莓无毒苗最普通且最有效的方法[12]。同一植物不同品种的外植体诱导所需最适生长调节剂种类和浓度不同[13]。【本研究切入点】对草莓品种红颜快繁过程中生长调节剂的适宜配比浓度研究较少,缺乏对组培快繁生产提供技术参数和指导。针对新疆主要推广品种之一的草莓红颜,研究其离体再生体系建立、组培种苗规模化快繁。【拟解决的关键问题】研究草莓红颜诱导分化、增殖快繁的影响因子,建立稳定的快繁体系,为其它草莓品种推广使用快繁苗并进行规模化生产提供参考。
1 材料与方法
1.1 材 料
1.1.1 草莓品种
供试材料为新疆生产建设兵团第六师国家科技园区设施基地引进栽培的草莓品种红颜。
1.1.2 试剂及器皿
0.1%升汞,蒸馏水,75%酒精,1%洗洁精,量筒100 mL、容量瓶1 000 mL、灭菌烧杯1 000 mL、玻璃棒、剪刀、镊子、接种针、滤纸。
1.1.3 仪器设备
超净工作台、40倍变倍体显微镜、灭菌器
1.2 方 法
1.2.1 外植体的灭菌时间
从田间选取生长健壮、无病虫害、具典型性状的优良植株为母株,剪取刚抽出的匍匐茎顶端约3 cm和幼嫩的叶片,分别用1%洗洁精水溶液浸泡5 min并用玻璃棒轻微搅动后,再用自来水冲洗30~40 min,无菌水冲洗1~2遍移入超净工作台,倒入75%酒精分别浸泡20、30、40 s三个处理,无菌水冲洗2~3次,转入0.1%升汞溶液轻微搅动4、5、8 min三个处理,最后用无菌水冲洗4~5遍。每个处理接种50个外植体,重复三次。7 d后统计外植体损伤程度、污染率、褐化率。
1.2.2 不同来源匍匐茎尖
按照1.2.1消毒过的外植体匍匐茎与组培瓶内生长的匍匐茎分别置于解剖镜下,剥取0.2~0.3 mm、0.3~0.5 mm、0.5~0.8 mm的生长点(三个处理),接种到培养基(每个培养瓶盛培养基25 mL左右)上,每瓶接入1个茎尖,每个处理接种50瓶。
1.2.3 不同生长调节剂配比对匍匐茎茎尖诱导分化的影响
茎尖剥离后接入培养基中诱导,在MS培养基中添加激素6-BA和IBA:设定6-BA的浓度为0.1和0.2 mg/L,IBA的浓度为0.05、0.1和1 mg/L,得到6组不同的培养基组合,编号为B1-B6。每种培养基接种50个外植体,25 d后对其增殖系数及其生长状态进行观察,通过方差分析统计,筛选最佳培养基。
1.2.4 不同生长调节剂配比继代培养基对增殖系数的影响
对红颜草莓继代培养基的优化试验在MS中添加激素6-BA和IBA:设定6-BA的浓度为0.1、0.2和0.3 mg/L,IBA的浓度为0.05、0.1和1 mg/L,得到9组不同的培养基组合,编号为C1-C9。每种培养基接种50个外植体,25 d后对其增殖系数及其生长状态进行观察,通过方差分析统计,筛选最佳培养基。
1.2.5 不同生长时期切割方式对增殖系数及状态的影响
按照人为划分的草莓组培苗生长时期对丛生芽的增殖进行培养基的优化,所用的组培苗时期分别为:丛生芽生成期、幼苗期、中苗期三个时期。操作时的切割方式分别为:每个外植体1个芽或3个芽。对以上三个时期及两种切割方式进行组合,得到6种处理组合方式, 将三个不同时期共六种处理组合接种至继代培养基,即MS+6-BA 0.2 mg/L+IBA 0.05 mg/L+蔗糖3%+卡拉胶 6.0 g/L,pH 值为5.8的培养基中。每种处理组合接种50个,重复三次,25 d后对每种组合的增殖系数及状态进行观察,通过方差分析统计。
2 结果与分析
2.1 不同外植体消毒时间对外植体污染率的影响
研究表明,随着酒精与升汞消毒时间的延长,幼嫩叶片与匍匐茎尖褐化率明显上升,控制消毒时间可以有效降低褐化率。草莓的幼嫩叶片和匍匐茎都能诱导分化,叶片采用A2处理时灭菌效果好损伤程度低,即叶片采用75%酒精浸泡20s,用无菌水漂洗三遍,0.1%升汞消毒5 min后用无菌水漂洗5遍。匍匐茎采用A5灭菌效果好,损伤程度低,即采用75%酒精浸泡30s,用无菌水漂洗三遍,0.1%升汞消毒5 min后用无菌水漂洗5遍。在外植体消毒过程中控制污染率是组培成败的关键环节,采用75%酒精+0.1%升汞处理方式,有效地控制叶片污染率在0.3%以下,匍匐茎污染率在3.2%以下。表1
表1 不同外植体消毒时间下外植体污染率变化
Table 1 Effects of sterilization time
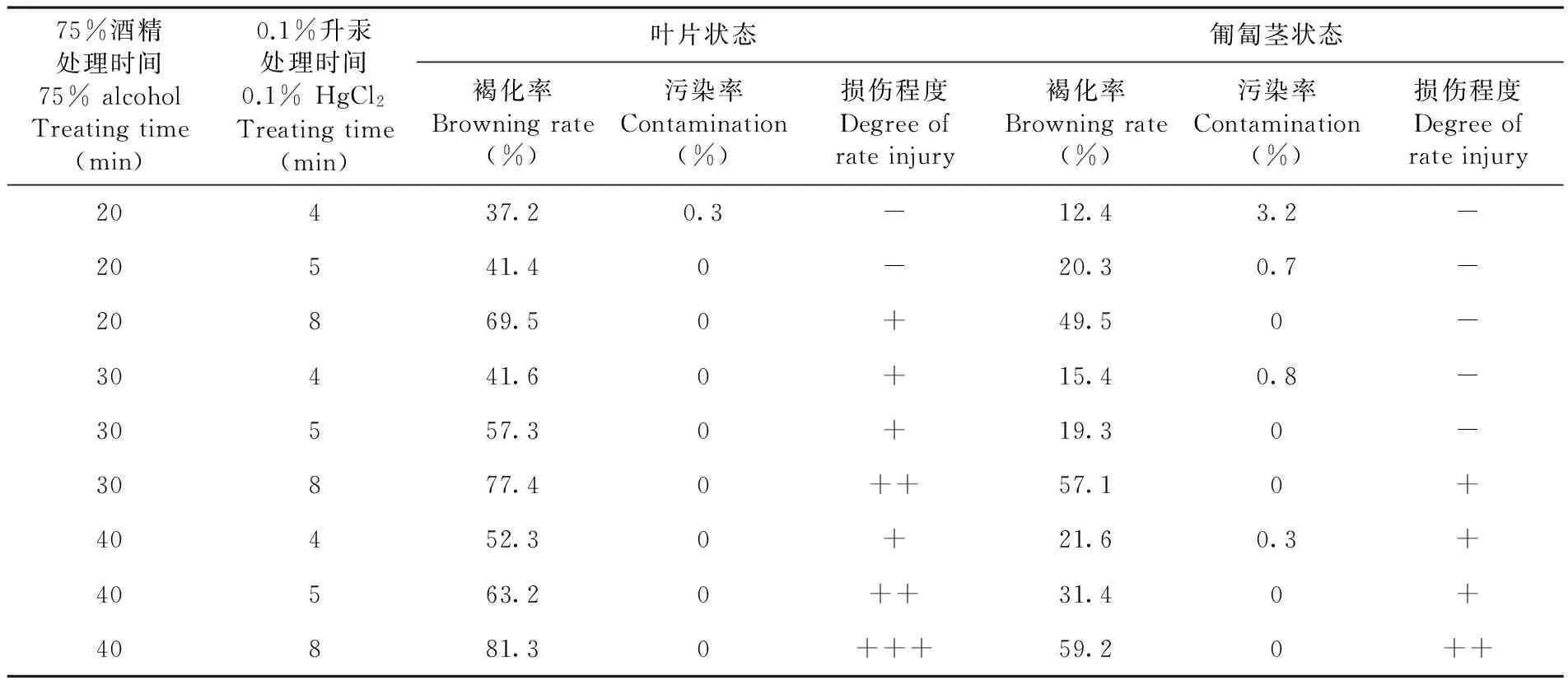
注:+表示受损外植体增加20%Note: + Expression damaged explants increased by 20%
2.2 不同来源匍匐茎的茎尖培养成活率
田间匍匐茎和瓶内匍匐茎都能诱导分化形成芽,大田采集的匍匐茎消毒,出现明显褐化现象,剥取的茎尖从小到大褐化率分别高出19%、32%、41%;污染率明显高于瓶内匍匐茎4.4%、5.7%、6.8%。瓶内的匍匐茎直接剥取茎尖,不用消毒灭菌,无褐化现象。因此,田间采集的匍匐茎茎尖接种后的成活率和诱导率低于瓶内匍匐茎尖。表2,图1
表2 不同来源匍匐茎成活率
Table 2 Effects of Different sources of stolons impacts
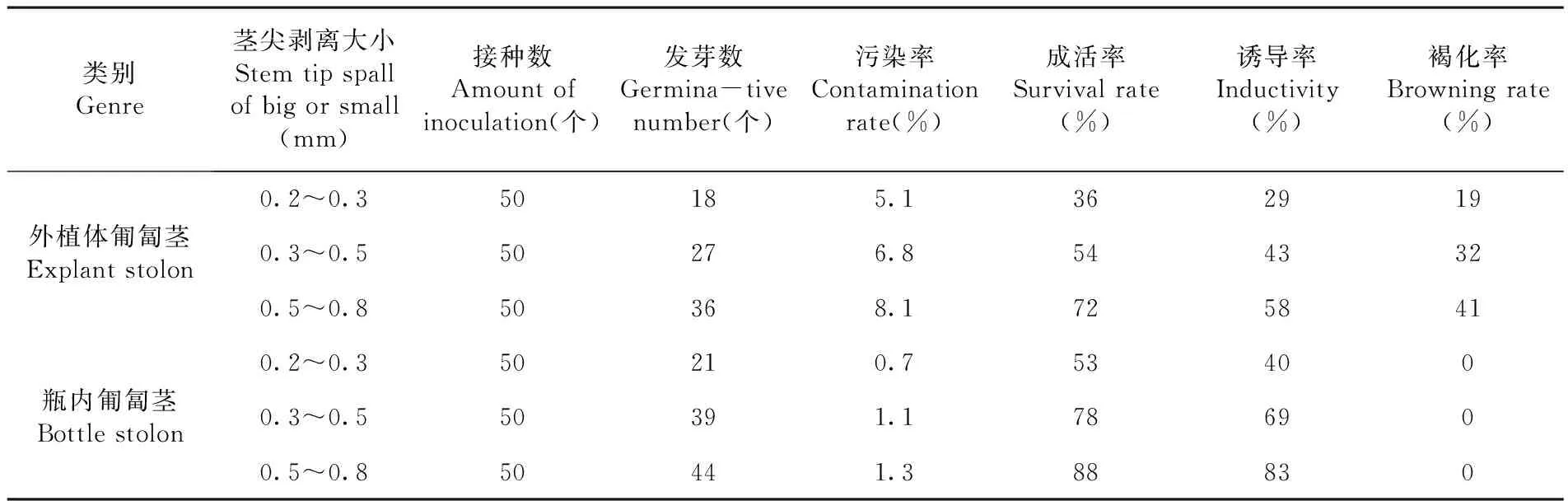
类别Genre茎尖剥离大小Stemtipspallofbigorsmall(mm)接种数Amountofinoculation(个)发芽数Germina-tivenumber(个)污染率Contaminationrate(%)成活率Survivalrate(%)诱导率Inductivity(%)褐化率Browningrate(%)外植体匍匐茎Explantstolon0.2~0.350185.13629190.3~0.550276.85443320.5~0.850368.1725841瓶内匍匐茎Bottlestolon0.2~0.350210.7534000.3~0.550391.1786900.5~0.850441.388830

图1 田间植株的匍匐茎与瓶内匍匐茎
Fig.1 Stolons in the field and within bottle of plants
2.3 培养基中添加外源激素对匍匐茎茎尖诱导分化的影响
研究表明,诱导愈伤组织再生器官时,生长素和细胞分裂素要同时用到。茎尖剥离后在添加外源激素的培养基中均可以诱导分化,不同配比浓度,分化的丛生苗的生长状态不同。B3丛生芽状态明显的良好,芽点多。茎尖脱毒诱导分化的激素配比为MS+6-BA 0.1 mg/L+IBA 1 mg/L +蔗糖3%+卡拉胶0.6%。表3,图2
表3 不同激素配比下匍匐茎茎尖诱导分化情况
Table 3 Stolons stem tip induced differentiation
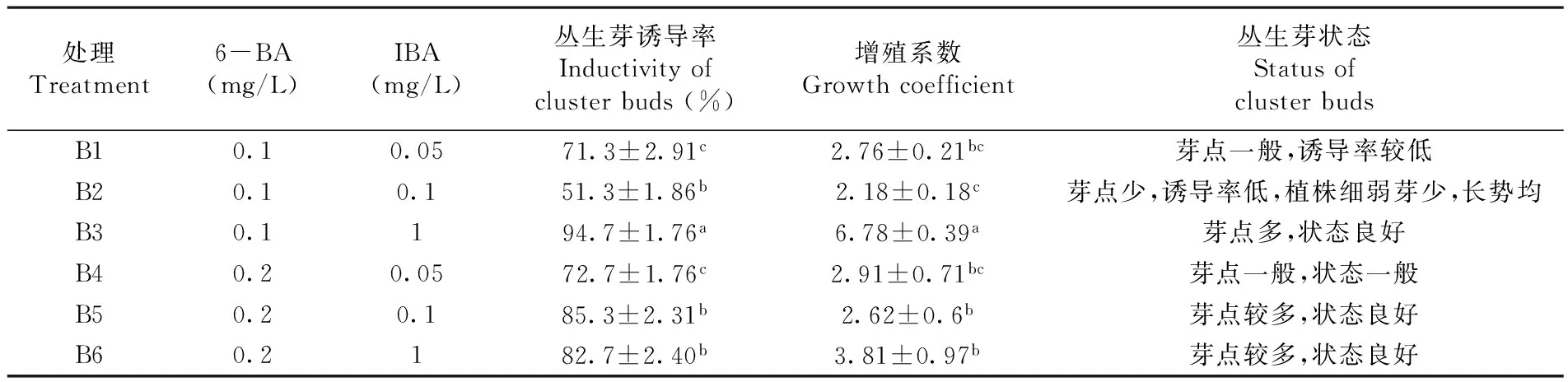
注:Note:

图2 匍匐茎茎尖诱导分化对比
Fig.2 The photos of contrast among stolons stem tip induced differentiation
2.4 继代培养基中添加外源激素对增殖系数的影响
在继代增殖培养中, 适当的外源激素浓度是获得高增殖倍数及良好生长情况的一个关键因素。过高或过低的激素浓度都会影响芽的增殖及生长效果。研究表明,C7丛生芽诱导率和增殖系数均高,但丛生芽有畸形和玻璃化发生,C5丛生芽诱导率和增殖系数较高,丛生芽多,长势均匀,状态良好,继代培养基选择C5即MS+6-BA 0.2 mg/L+IBA 0.05 mg/L+3%糖+0.6%卡拉胶为最佳。表4,图3
表4 不同激素配比下继代培养基对增殖系数
Table 4 Subculture medium impacts on multiplication factor
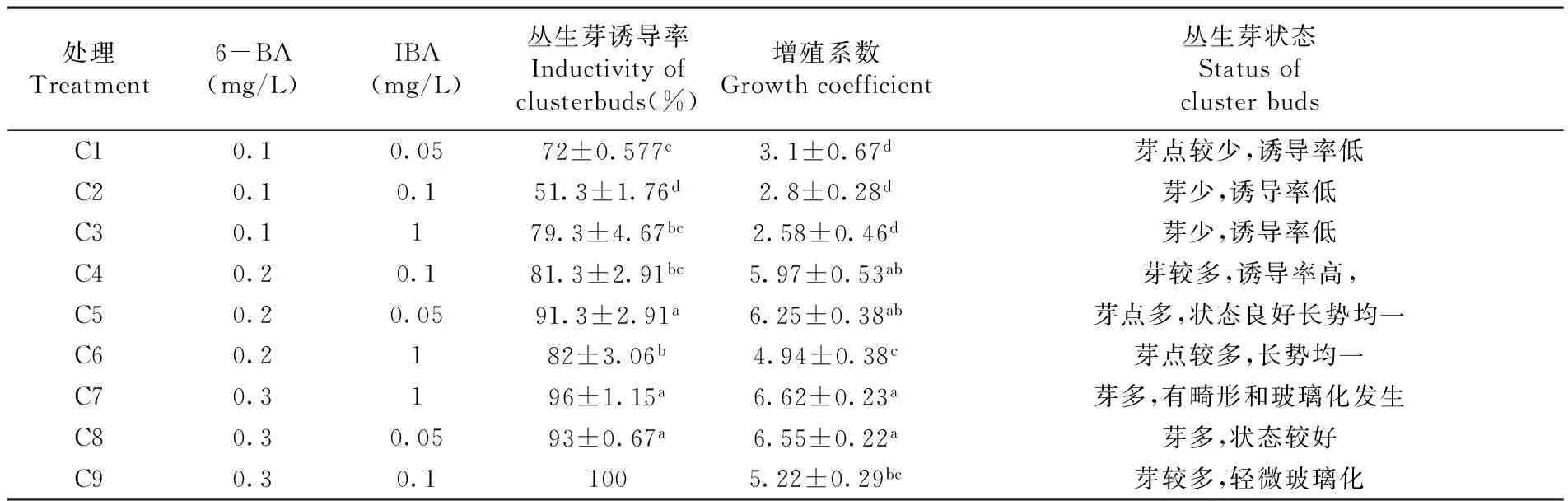
处理Treatment6-BA(mg/L)IBA(mg/L)丛生芽诱导率Inductivityofclusterbuds(%)增殖系数Growthcoefficient丛生芽状态StatusofclusterbudsC10.10.0572±0.577c3.1±0.67d芽点较少,诱导率低C20.10.151.3±1.76d2.8±0.28d芽少,诱导率低C30.1179.3±4.67bc2.58±0.46d芽少,诱导率低C40.20.181.3±2.91bc5.97±0.53ab芽较多,诱导率高,C50.20.0591.3±2.91a6.25±0.38ab芽点多,状态良好长势均一C60.2182±3.06b4.94±0.38c芽点较多,长势均一C70.3196±1.15a6.62±0.23a芽多,有畸形和玻璃化发生C80.30.0593±0.67a6.55±0.22a芽多,状态较好C90.30.11005.22±0.29bc芽较多,轻微玻璃化

图3 组培苗在继代培养基上的状态对比照片
Fig.3 The contrast photos of somaclones on successive transfer culture medium
2.5 不同生长时期切割方式对增殖系数的影响
处理组合D2“不定根生成期+每块3个芽”诱导得到的增殖系数较高为6.62,但是该处理组合诱导得到的丛生芽细密弱小,长势不均,在一定程度上延长了组培生产周期。而D4处理组合诱导得到的丛生芽生长旺盛,状态均一,多数处于中苗期,增殖系数为6.58,仅次于D2组,所以有利于工业化生产的快速扩繁。表5
表5 不同生长时期不同切割方式下增殖系数变化
Table 5 Influence of different growth periods and cutting methods on growth coefficient of strawberry
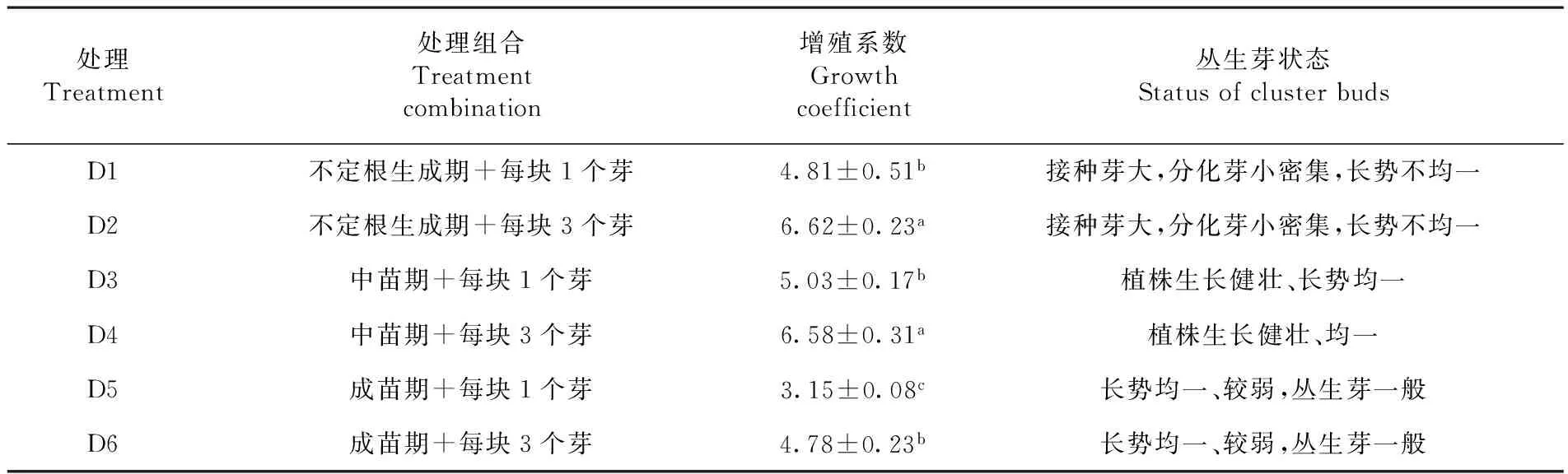
处理Treatment处理组合Treatmentcombination增殖系数Growthcoefficient丛生芽状态StatusofclusterbudsD1不定根生成期+每块1个芽4.81±0.51b接种芽大,分化芽小密集,长势不均一D2不定根生成期+每块3个芽6.62±0.23a接种芽大,分化芽小密集,长势不均一D3中苗期+每块1个芽5.03±0.17b植株生长健壮、长势均一D4中苗期+每块3个芽6.58±0.31a植株生长健壮、均一D5成苗期+每块1个芽3.15±0.08c长势均一、较弱,丛生芽一般D6成苗期+每块3个芽4.78±0.23b长势均一、较弱,丛生芽一般
3 讨 论
生产上培育草莓脱毒苗主要是通过高温与茎尖结合脱毒病毒检测快速繁殖,从而获得大批量的优质种苗,可进行周年生产,不受季节限制,从而实现草莓组培苗的规模化育苗和草莓新品种的迅速推广。
植物组织培养过程的关键是提高繁殖系数,基本培养基种类、激素种类配比及浓度、碳源和有机物的种类及浓度等都是影响繁殖系数的重要因素[16]。在诱导愈伤组织或器官分化及增殖过程中,生长素和细胞分裂素要同时使用,由于不同植物种基因型的差异和分离外植体的器官本身发育时期的差异,所需的激素浓度不可能固定不变,必须在一定的激素浓度范围内进行研究,在研究中,随着外源激素配比浓度的增加,6-BA与IBA的配比能明显提高红颜草莓的诱导分化和增殖系数,但到达一定浓度配比,草莓诱导分化和增殖培养的组培苗细密柔弱,甚至有些出现玻璃化苗,可能是由于内源激素水平直接受外源激素浓度水平的影响[17]。这与邓馨等[18]的研究相一致。表明培养条件和外源激素等是调节内源激素水平的重要途径。同一植物不同品种的外植体所需最适生长调节剂种类和浓度不同[19]。因此,寻找适宜的生长调节物质种类及配比对草莓离体再生非常重要。
大多数对草莓脱毒苗获取是采集大田匍匐茎,进行茎尖剥离,再病毒检测。而茎尖需采用0.2~0.3 mm,茎尖越小脱毒效果越好,但成活率低,且剥离茎尖难度大,操作易被污染,诱导分化成苗所需时间较长,工作效率低。采用在试管内先诱导匍匐茎再剥离茎尖的优化方法,可大幅度降低污染率和提高茎尖接种后的成活率,采用瓶内诱导匍匐茎,剥取茎尖再病毒检测可以作为目前草莓无毒苗加快推广的技术运用到生产中。
4 结 论
4.1 采集大田草莓匍匐茎优化为在试管内对草莓苗进行匍匐茎诱导是可行的。该优化技术的研究为大幅度降低污染率40%~61%,提高茎尖成活率30%,提高了茎尖成活率和脱毒率,为降低成本提高效率奠定了基础。
4.2 外源激素中细胞分裂素和生长素的适宜配比浓度是建立稳定的再生体系的关键因素。通过对红颜草莓的研究,匍匐茎尖诱导分化适宜配比浓度为1∶10;快繁适宜配比浓度为4∶1。
References)
[1] Josuttis, M., Dietrich, H., Treutter, D., Will, F., Linnemannstns, L., & Krüger, E. (2010). Solar uvb response of bioactives in strawberry (fragaria × ananassa duch. l.): a comparison of protected and open-field cultivation.JournalofAgricultural&FoodChemistry, 58(58):12,692-12,702.
[2] Wang, S. Y., & Millner, P. (2009). Effect of different cultural systems on antioxidant capacity, phenolic content, and fruit quality of strawberries (fragaria × aranassa duch.).JournalofAgricultural&FoodChemistry, 57(20):9,651-9,657.
[3] Wang, S. Y., Zheng, W., & Galletta, G. J. (2002). Cultural system affects fruit quality and antioxidant capacity in strawberries.JournalofAgricultural&FoodChemistry, 50(22):6,534-6,542.
[4]梁贵求,唐燕梅.草莓组织培养和快速繁殖[J].广西热带农业,2004,(6):8-9.
LIANG Gui-qiu, TANG Yan-mei. (2004). Strawberry tissue culture and rapid propagation [J].GuangxiTropicalAgriculture,(6):8-9. (in Chinese)
[5]李平.草莓三种繁殖方法[J].西北园艺,2012,(7):32-33.
LI Ping.(2012).Three breeding methods of strawberry [J].NorthwestHorticulture,(7):32-33. (in Chinese)
[6]朱文勇,赵玉军,郭黄萍,等.无毒草莓组织培养工厂化快速育苗技术研究[J].山西果树,1995,(1):21-22.
ZHU Wen-yong, ZHAO Yu-jun, Guo Huang-ping, et al. (1995). Study on non-toxic strawberry tissue culture factory rapid seedling technology [J].ShanxiFruits,(1):21-22. (in Chinese)
[7]席家军,聂凯华.草莓愈伤组织诱导的几个影响因素研究[J].甘肃农业科技,2008,(12):5-7.
XI Jia-jun, NIE Kai-hua. (2008). Study on Factors of Affecting Callus Induction of Strawberry [J].GansuAgriculturalScienceandTechnology,(12):5-7. (in Chinese)
[8]王玉英,高新.经济植物无性繁殖讲座(七)-组织培养快速繁殖的理论与应用 [J].植物杂志,1995,(6):35-37.
WANG Yu-ying, GAO Xin. (1995). Economic plant cloning lectures (7) - tissue culture theory and application of rapid propagation [J].Plants,(6):35-37. (in Chinese)
[9] Martin, R. R., & Tzanetakis, I. E. (2006). Characterization and recent advances in detection of strawberry viruses.PlantDisease, 90(90):384-396.
[10]郭春沅.草莓花药组织培养快速繁殖技术[J].农业科技通讯,2000,(11):13.
GUO Chun-yuan. (2000). Rapid reproduction technology of strawberry anther tissue culture [J].BulletinofAgriculturalScienceandTechnology, (11):13. (in Chinese)
[11] White, P. R. (1934). Potentially unlimited growth of excised tomato root tips in a liquid medium.PlantPhysiology, 9(3):585-600.
[12]刘健,刘向蕾,胡繁荣,等.草莓热处理结合茎尖培养脱毒效果研究[J].浙江农业科学,2009,(6):1 088-1 090.
LIU Jian, LIU Xiang-lei, HU Fan-rong, et al. (2009). Study on strawberry heat treatment combined with stem tip seedling cultivation effect [J].JournalofZhejiangAgriculturalSciences, (6):1,088-1,090.(in Chinese)
[13]王翡,高志红,章镇,等.草莓高效离体叶片再生体系的建立[J].西北植物学报,2010,30(5):1 045-1 049.
WANG Fei, GAO Zhi-hong, ZHANG Zhen, et al. (2010). stablishment of Regeneration System of Strawberry [J].ActaBotanicaBoreali-OccidentaliaSinica,30 (5):1,045-1,049.(in Chinese)
[14]吕树立,孙喜云,周玉玲,等.草莓组织培养与快速繁殖技术[J].山东农业科学,2010,(3):109-110.
LÜ Shu-li, SUN Xi-yun, ZHOU Yu-lin, et al. (2010). Technique of tissue culture and rapid propagation for strawberry [J].ShandongAgriculturalSciences,(3):109-110.(in Chinese)
[15]裘文达,孙宏宇.草莓组织培养试验[J].浙江农业大学学报,1998,3(1):58-60.
QIU Wen-da, SUN Hong-yu. (1998). Experiments on strawberry tissue culture [J].JournaiofZhejiangAgriculturalUniversity,3(1):58-60. (in Chinese)
[16]曹善东,李桂新.Ms培养基中不同浓度有机物对草莓脱毒苗繁殖系数的影响[J].山东农业大学学报,2004,35(1):32-35.
CAO Shan-dong, LI Gui-xin. (2004). Effects of Different Concentrations of Organic Compound in Ms Substrate on Propagation Coefficients of Strawberry Virus-Free Plantlet [J].JournalofShandongAgriculturalUniversity,35(1):32-35.(in Chinese)
[17]黄文江,潘超,阚显照,等."红丰"草莓无菌系及叶盘再生系统的建立[J].西南农业学报,2010,23(5):1 640-1 643.
HUANG Wen-jiang, PAN Chao, KAN Xian-zhao, et al. (2010). Tissue Culture and Establishment of Regeneration System from Leaves of Fragaria ananassa Duehesene [J].SouthwestChinaJournalofAgriculturalSciences, 23(5):1,640-1,643.(in Chinese)
[18]邓馨,胡文玉.草莓离体叶片脱分化与再分化过程中的生理生化变化[J].植物生理学通讯,2000,36(3):209-211.
DENG Xin, HU Wen-yu. (2000). Physiological and Biochemical changes in the process of Dedifferentiationand Redifferentiation of Strawberry Leaves in vitro [J].PlantPhysiologyCommunications,36(3):209-211. (in Chinese)
[19]冷春玲.草莓脱毒及组培快繁研究[J].北方园艺,2007,(5):20-21.
LENG Chun-ling. (2007). Research on Virus-free and Tissue-culture Techniques in Strawberry [J].NorthernHorticulture, (5):20-21. (in Chinese)
Fund project:Supported by the National "12th Five-Year Plan" Science & Technology Program " Integration and Demonstration of Key Technologies in Characteristic Agricultural Modernization in North Tianshan Mountain"(2012BAD41B00)
Optimization of a Rapid Reproductive System of Strawberry Variety 'Hongysn' by Using Tissue Culture Method
CHEN Ying, ZHANG Xi-ying
(ResearchInstituteofAgriculturalSciences,the6thAgriculturalProductionDivisionofXinjiangProductionandConstructionCorps,WujiaquXinjiang831300,China)
【Objective】 To Provide the key technical parameters for establishing a stable reproduction system of strawberry tissue cultures,and realize the virus free production of strawberry.【Method】Those impact factors and the ratios of exogenous hormones were determined during the process of tissue cultures and rapid reproduction, including explants disinfection, seedling stem tip detoxification, induced differentiation, and reproductive culturewith the "Hongyan" strawberry.【Result】(1) The optimal procedure of explants disinfection includes was as follows: the sterilization of stolons was dipping 30s in 75% alcohol, then disinfecting 5 minutes with 0.1% corrosive sublimate and rinsing 5 times with sterile water, absorbed rapidly with filter paper.(2) The optimal way of virus-freeing of stolons stem tip was stripping 0.3 to 0.5 millimeter in bottle.(3) The best culture medium of shoot tip of creeping stem for induced differentiation was MS+6-BA 0.1 mg/L+IBA 1 mg/L.(4) By using medium MS+6-BA 0.2 mg/L+IBA 0.05 mg/L+middle-stageseeding three buds per piece, the most ideal growth coefficient was achieved.【Conclusion】The key factors for establishing stable mass reproduction system included the suitable ratio between cytokinin and exogenous hormones during the strawberry stolons tip virus-removing, induced differentiation, and rapid propagation.
strawberry; tissue culture; rapid reproduction; optimizing
2016-07-17
国家“十二五”科技支撑计划项目“天山北坡特色农业现代化关键技术集成与示范”(2012BAD41B00)
陈英(1967-),女,湖北黄陂人,高级农艺师,研究方向为特色作物脱毒快繁技术和育苗技术,(E-mail)1131382130@qq.com
10.6048/j.issn.1001-4330.2016.12.007
S668.4;S603.8
:A
:1001-4330(2016)12-2210-07

