孕激素和脂联素分子受体11对A549肺癌细胞侵袭转移的影响研究*
李维娜 何 飞 薛慧君 张 敏 张晓军 曾召利
孕激素和脂联素分子受体11对A549肺癌细胞侵袭转移的影响研究*
李维娜①*何 飞②③*薛慧君①张 敏①张晓军①曾召利①

目的:观察孕激素和脂联素分子受体11(PAQR11)对A549肺癌细胞侵袭转移的作用,探索其可能的分子机制。方法:设计2条干扰PAQR11的核酸序列,以分子克隆的方法插入pLKO.1慢病毒载体,转染HEK-293T细胞包装病毒,以病毒上清感染A549细胞,嘌呤霉素筛选A549细胞;细胞划痕实验检测敲低PAQR11对A549细胞迁移的影响;Transwell小室实验检测敲低PAQR11对A549细胞侵袭能力的影响;实时定量PCR检测上皮间质转化相关分子的表达。结果:成功构建了干扰PAQR11表达慢病毒载体,获得稳定干扰PAQR11的A549细胞,实时定量PCR、Western blot验证干扰效果。敲低PAQR11能够促进A549细胞的迁移和侵袭能力;敲低PAQR11后E-Cadherin的表达水平降低,Snail1、Twist1和N-Cadherin表达升高。结论:敲低PAQR11能够促进A549细胞的迁移和侵袭能力,其机制可能与EMT增强有关。
肺癌;孕激素和脂联素分子受体家族11;侵袭;转移;上皮间质转化
[First-author’s address]Department of Biomedical Engineering, Fourth Military Medical University, Xi’an 710032, China.
肺癌是我国最常见的恶性肿瘤,其5年生存率不到15%,是目前肿瘤死亡的首要原因[1-4]。肺癌的传统治疗手段主要有手术疗法、化学疗法和放射疗法,但居高不下的病死率对传统疗法提出严峻挑战。近年来的分子靶向、基因治疗以及精准治疗的提法方兴未艾,但是其基础是深入了解与肿瘤相关的基因和分子在肿瘤发生、发展、侵袭和转移中的作用。
孕激素和脂联素分子受体11(PAQR11)又称单核细胞向巨噬细胞分化相关分子(monocyte to macrophage differentiation-associated,MMD)[5-6]。研究发现,PAQR11在肺癌组织中高表达,并且与肿瘤发展和患者预后密切相关[7]。然而,PAQR11其具体功能目前仍然不清楚。本研究通过在A549肺癌细胞中干扰PAQR11的表达,观察其对肺癌细胞迁移侵袭的影响,并初步探索其可能的分子机制。
1 材料与方法
1.1 实验细胞
人肺癌A549细胞株由第四军医大学第二附属医院胸外科惠赠;HEK-293T细胞株由第四军医大学基础医学院生化教研室惠赠。常规复苏,传代接种后取其生长良好的第三代细胞完成本次实验。
1.2 试剂与仪器
(1)pLKO.1、psPAX2和pMD2.G慢病毒ShRNA体系由第四军医大学基础医学院生化教研室惠赠;AgeI,NcoI和EcoRI购于美国NEB公司;转染试剂Fugene 6购于瑞士Roche公司;抗PAQR11抗体购于美国Santa Cruz公司;抗β-actin抗体购于美国Sigma公司;抗山羊-HRP抗体和抗小鼠-HRP抗体购于武汉博士德公司;Transwell小室为美国Corning产品。
(2)质粒提取、回收试剂盒购于北京天根公司;PrimeScript RT Reagent kit反转录试剂盒和SYBR Premix Ex TaqTM II(Perfect Real Time)实时定量试剂盒购于大连宝生公司;化学发光试剂盒supersignal WESTPICO,购于美国PIERCE公司。引物序列由北京奥科公司合成。ECL发光利用PIERCE supersignal WESTPICO试剂盒,A液和B液各取500 μL,混匀,把PVDF膜在滤纸上吸去液体,放入仪器暗室,混好的显影液均匀地滴于膜上,软件显影。
(3)QYC-200恒温摇床(上海),ChemiScope 3400 Mini化学发光仪(上海);实时定量PCR仪(Mastercycler ep realplex,德国Eppendorf公司),倒置显微镜、正置显微镜(日本Olymbus公司)。
1.3 PAQR11干扰慢病毒载体的构建和鉴定
1.3.1 干扰序列的设计
针对PAQR11设计2个靶点,每个靶点2条核苷酸序列,见表1。
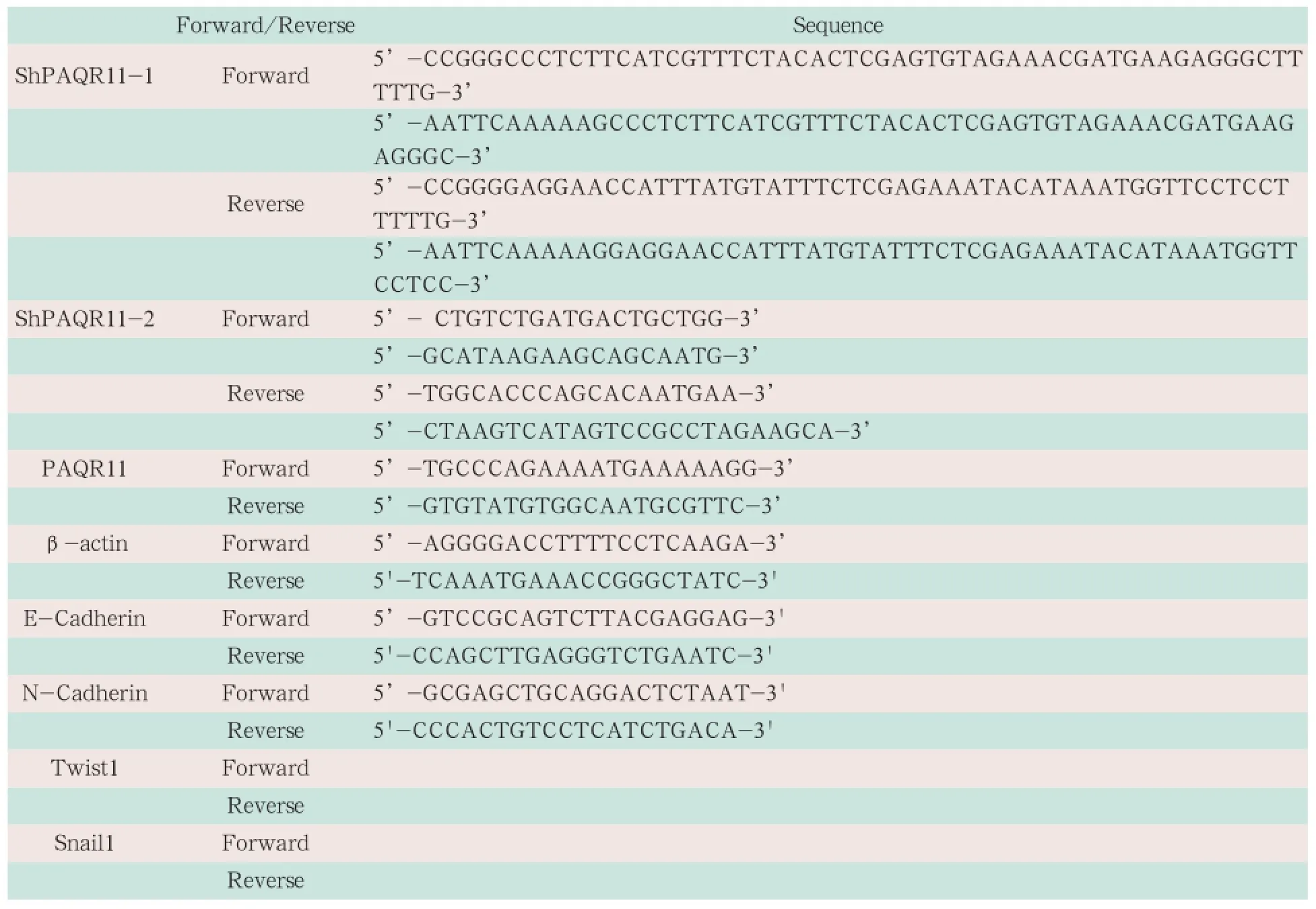
表1 引物序列表
1.3.2 干扰慢病毒载体的构建和鉴定
将2条引物混合加热煮沸,自然降温退火,反复3次;以AgeI和EcoRI分步酶切pLKO.1载体;退火引物混合物与回收的线性化pLKO.1载体连接,转化XL10感受态,挑克隆,接种于LB培养基(含50 μg/ml氨苄青霉素),37 ℃恒温摇床220 r/min,孵育12 h,提取质粒,以NcoI和EcoRI双酶切鉴定,构建pLKO.1-shPAQR11-1和pLKO.1-shPAQR11-2质粒。
1.4 病毒包装、感染和筛选稳定
pLKO.1-shPAQR11、psPAX2和pMD2.G以FuGENE6共转入HEK-293T细胞,12~15 h后更换培养基,加入新鲜DMEM,然后每24 h收集含病毒的培养上清,于-70 ℃保存。肺癌细胞A549接种于6 cm培养皿,加入0.05~1 ml含病毒的培养上清,24 h后加入含有嘌呤霉素(2 μg/ml)的DMEM培养基,进行抗生素筛选获得稳定干扰PAQR11的肺癌细胞株。
1.5 检测稳筛A549细胞的mRNA水平变化
实时荧光定量PCR(Real-time PCR)检测稳筛A549细胞的mRNA水平变化。常规利用Trizol提取稳定筛选获得A549肺癌细胞RNA,以PrimeScript RT Reagent kit进行反转录,以SYBR Premix Ex TaqTM II(Perfect Real Time)进行Real-time PCR,以β-actin作为内参照。引物序列见表1
1.6 Western blot检测A549细胞PAQR11的表达
RIPA常规提取A549肺癌细胞蛋白,SDS-PAGE电泳蛋白,稳流转膜到PVDF膜上,含5%脱脂奶粉PBST溶液封闭2 h,抗PAQR11抗体1∶500稀释,抗β-actin抗体1∶1000稀释,4 ℃孵育过夜,PBST洗膜3次,分别以HRP标记抗山羊IgG二抗和HRP标记抗小鼠IgG二抗(1∶2000)室温孵育2 h,PBST洗膜3次后ECL显色发光。
1.7 细胞划痕实验
接种7×105A549细胞于6 cm培养皿,第2 d达到80%汇合度,用枪头垂直的在6 cm皿底划线,用PBS清洗细胞3次,去除划下的细胞,加入无血清培养基,放入37 ℃、5%CO2孵箱中培养。在0 h、12 h及24 h时拍照。
1.8 Transwell小室侵袭实验
1.8.1 Transwell小室的准备
用8 μm微孔的Transwell细胞培养室进行侵袭实验。用50 mg/L的Matrigel 1∶3稀释包被Transwell小室底膜的上室面,并放入24孔中,37 ℃胶化30 min。
1.8.2 A549细胞的准备
无血清培养基稀释不同组的A549细胞(5×105/ ml),接种至Transwell小室的上室,每孔200 μl,给Transwell小室下室加入600 μl完全培养基,将24孔板放入37 ℃、5%CO2孵箱中培养24 h。
1.8.3 Transwell小室的染色和拍照
将培养24 h后不同的Transwell小室取出,用PBS清洗3遍,每次5 min;用95%的乙醇固定2~3 min,用水清洗30~60 s;用棉签轻轻擦去上室未迁移的细胞;给每孔加入400 μl结晶紫,将Transwell小室放入其中染色10 min;用PBS清洗3遍,每次5 min;在正置显微镜下用10×镜观察,并任选4个区域拍照。
1.9 数据分析
采用GraphPad Prism 5软件对数据进行处理和分析。
2 实验结果
2.1 干扰PAQR11的慢病毒载体酶切鉴定
通过NcoI和EcoRI双酶切能否获得大小约5 kbp和2 kbp的片段来鉴定干扰序列是否正确连入pLKO.1载体。对照shscramble的1~2号克隆,shPAQR11-1的5~6号克隆,shPAQR11-2的7~9号克隆都能够酶切获得大小约5 kbp和2 kbp的片段,连入正确,构建载体成功(如图1所示)。

图1 干扰慢病毒质粒NcoI和EcoRI双酶切琼脂糖凝胶电泳图
2.2 Real-time PCR和Western blot检测A549细胞PAQR11的干扰效率
通过慢病毒感染、嘌呤霉素筛选获得A549感染对照shscramble,shPAQR11-1和shPAQR11-2的3个细胞株,为了确认敲低的效率,操作步骤为:①Realtime PCR检测不同组A549中mRNA的表达水平;shPAQR11-1和shPAQR11-2分别是对照组的1/2和1/6,shPAQR11-2的干扰效果好;②Western blot在蛋白质水平检测不同组A549中的PAQR11的表达水平,通过灰度扫描,shPAQR11-2显著降低A549细胞中PAQR11的表达水平,约为对照组的1/5。通过以上2个实验证实shPAQR11-2敲低效果好(如图2所示)。
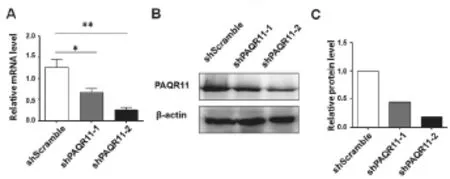
图2 A549细胞PAQR11干扰效率检测结果图
2.3 PAQR11敲低对A549细胞迁移和侵袭的影响
通过细胞划痕实验检测PAQR11敲低对A549细胞迁移能力的影响,shPAQR11-2组在24 h划痕显著缩小,提示细胞迁移能力增强(如图3所示)。

图3 A549细胞划痕后不同时间点明场图(×40)
Transwell小室侵袭实验检测PAQR11敲低对A549细胞侵袭能力的影响,shPAQR11-2组穿过小室的细胞(紫色着色)明显增加,提示敲低PAQR11促进A549细胞侵袭转移(如图4所示)。
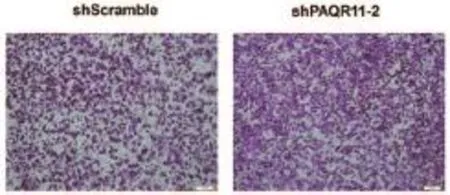
图4 Transwell小室侵袭实验结晶紫染色结果图(×100)
2.4 PAQR11敲低对上皮-间质转化(epithelial-mesenchymaltransition,EMT)的影响
为了探索PAQR11敲低对A549细胞迁移和侵袭影响的机制,本研究实验通过real-time PCR检测了EMT相关分子的表达,包括E-Cadherin、N-Cadherin、Twist1和Snail1,如图5所示。

图5 Real-time PCR检测EMT相关分子表达结果图
干扰PAQR11后E-Cadherin为对照组0.57倍,而与EMT成正相关的N-Cadherin、Twist1和Snail1表达升高,分别是对照组的1.5、1.9和2.1倍。这些结果提示在A549肺癌细胞中敲低PAQR11而增强的细胞侵袭转移可能与EMT密切相关。
3 讨论
人MMD于1995年被发现,由于最初发现其高表达于成熟巨噬细胞,而单核细胞不表达,故命名为单核细胞向巨噬细胞分化相关基因[5]。其后根据分子结构特点,将其归为孕激素和脂联素分子受体家族(PAQR)成员,故MMD又称为PAQR11。PAQR家族是一类不同于G蛋白耦联受体家族的7次跨膜蛋白家族,与原核生物的溶血素Ⅲ型蛋白在结构上相似[6]。研究发现,PAQR11除在单核细胞低表达外,几乎在所有组织中都可以检测到PAQR11表达[7]。这一结果提示PAQR11的功能很可能不局限于单核-巨噬细胞的分化。Chen等[8]和Nieto等[9]研究发现,PAQR11高表达于肺癌组织中,但PAQR11高表达的生物学意义仍不清楚。
本研究前期在蛋白质水平和组织水平验证了PAQR11高表达于NSCLC,发现敲低PARQ11的表达能显著抑制A549肺癌细胞的增殖[10]。在本研究中发现干扰PAQR11的表达后,A549细胞的迁移和侵袭能力反而增强。
EMT是上皮细胞来源的肿瘤细胞获得迁移和侵袭能力的重要生物学过程[11]。本研究发现,敲低PARQ11的表达能促进A549肺癌细胞EMT相关分子N-Cadherin、Twist1和Snail1的表达上调,而E-Cadherin的表达下调,促进A549细胞发生EMT。因而,本研究考虑:PAQR11是否为调节肺癌细胞功能的“开关”,“开”则肺癌细胞增殖,“关”则肺癌细胞转移?那么,在肺癌患者中是否由于PAQR11高表达,肺癌细胞原位扩增长大,但当达到“特定条件”时少量细胞PAQR11表达下降而发生转移?这些疑问需要在后续的研究中进一步通过动物体内实验证明。
有研究小组[12-13]发现,PAQR11定位于高尔基体细胞器膜,其能够结合胞浆内的Ras和RasGPR1信号分子,促进ERK信号持续激活,而敲低PAQR11的表达则导致Ras/ERK信号的削弱。本研究前期研究也发现在A549肺癌细胞中敲低PAQR11抑制ERK1/2的活化,进而影响增殖相关信号途径[10]。PAQR11是通过何种方式影响EMT途径,仍然有待于进一步研究。
综上所述,本研究成功构建了干扰PAQR11表达慢病毒载体,获得稳定干扰PAQR11的A549细胞,发现敲低PAQR11能够促进A549细胞的迁移和侵袭,其机制可能与EMT增强有关。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Ma GS,Kong LZ.The Nationwide Nutrition and Health Survey in China,2002:Behavior and Lifestyle[M].Beijing China:Peoples Medical Publishing House,2006.
[3]Chen Z,Yang G,Offer A,et al.Body mass index and mortality in China:a 15-year prospective study of 220 000 men[J].Int J Epidemiol,2012,41(2):472-481.
[4]She J,Yang P,Hong Q,et al.Lung cancer in China:challenges and interventions[J].Chest,2013,143(4):1117-1126.
[5]Rehli M,Krause SW,Schwarzfischer L,et al. Molecular cloning of a novel macrophage maturation-associated transcript encoding a protein with several potential transmembrane domains[J].Biochem Biophys Res Commun,1995,217(2):661-667.
[6]Tang YT,Hu T,Arterburn M,et al.PAQR proteins:a novel membrane receptor family defined by an ancient 7-transmembrane pass motif[J].J Mol Evol,2005,61(3):372-380.
[7]Liu Q,Zheng J,Yin DD,et al.Monocyte to macrophage differentiation-associated(MMD) positively regulates ERK and Akt activation and TNF-α and NO production in macrophages[J]. Mol Biol Rep,2012,39(5):5643-5650.
[8]Chen HY,Yu SL,Chen CH,et al.A five-gene signature and clinical outcome in non-small-cell lung cancer[J].N Engl J Med,2007,356(1):11-20.
[9]Nieto MA,Huang RY,Jackson RA,et al. EMT:2016.Cell,2016,166(1):21-45.
[10]Li W,He F.Monocyte to macrophage differentiation-associated(MMD)targeted by miR-140-5p regulates tumor growth in non-small cell lung cancer[J].Biochem Biophys Res Commun,2014,450(1):844-850.
[11]De Craene B,Berx G.Regulatory networks defining EMT during cancer initiation and progression[J]. Nature Reviews Cancer,2013,13(2):97-110.
[12]Jin T,Ding Q,Huang H,et al.PAQR10 and PAQR11 mediate Ras signaling in the Golgi apparatus[J].Cell Res,2012,22(4):661-676.
[13]Huang H,Jin T,He J,et al.Progesterone and adipoQ receptor 11 links ras signaling to cardiac development in zebrafish[J].Arterioscler Thromb Vasc Biol,2012,32(9):2158-2170.
Study of the effect of PAQR11 on invasion and metastasis in A549 lung cancer cells/
LI Wei-na, HE Fei, XUE Hui-jun, et al// China Medical Equipment,2016,13(12):150-154.
Objective: To investigate the effect of PAQR11 on invasion and metastasis in A549 lung cancer cells, and explore the possible molecular mechanism. Methods: Two oligonucleotides for interfering PAQR11 were designed, and were cloned into pLKO.1 lentiviral plasmid. entiviral particles were produced with HEK-293T cells. A549 cells were infected with lentiviral particle solution supernatant and screened with puromycin. Then the migration of PAQR11 knockdown A549 cell was detected with erasion trace test and the invasion was observed with transwell chamber. The expression of EMT associated molecular was detected by real-time PCR. Results: Lentiviral vector for interfering PAQR11 was built. Stable PAQR11 knockdown A549 lung cancer cells were established. The knockdown of PAQR11 was tested by real-time PCR and Western blot. Cell migration and invasion was promoted in PAQR11 knockdown A549 lung cancer cells. PAQR11 knockdown could reduce the expression of E-Cadherin, but up-regulate the level of Snail1, Twist1 and N-Cadherin. Conclusion: Knockdown of PAQR11 could promote the invasion and metastasis of A549 lung cancer cells, and this effect may be relevant with reinforcing EMT.
Lung cancer; PAQR11; Invasion; Metastasis; EMT
10.3969/J.ISSN.1672-8270.2016.12.044
1672-8270(2016)12-0150-05
R734.2
A
2016-09-17
陕西省自然科学基金面上资助项目(2015JM8470)“MiR-140-5p/PAQR11通路对肺癌的作用及机制”
①第四军医大学生物医学工程系物理教研室 陕西 西安 710032
②第四军医大学第一附属医院肝胆胰脾外科 陕西 西安 710032
③解放军95982部队卫生队 河南 开封 475003
*通讯作者:liweina228@163.com; hefei_hefei@163.com
李维娜,女,(1982- ),硕士,实验师。第四军医大学生物医学工程系物理教研室,从事生物物理研究工作。

