医院可疑医疗设备不良事件的分析与对策
蒋贻芳 高小坤
医院可疑医疗设备不良事件的分析与对策
蒋贻芳①高小坤②
目的:对医院可疑医疗设备不良事件(MDR)报告进行数据挖掘,分析不良事件产生的原因,提出相应的解决对策,以确保医疗设备临床使用安全。方法:从国家药品不良反应监测中心数据库中筛选出经过省、市评价的可疑MDR报告300例,利用SPSS统计软件对不良事件所涉及的医疗设备类别数量、不良事件主要表现、风险类别以及产生的主要原因进行统计分析。结果:MDR产生的原因依次为产品质量相关问题、患者体质与医疗设备之间存在生物不相容性和操作或使用不当。结论:医疗设备生产企业应严格按照生产质量管理规范(GMP)生产,确保产品质量。医疗机构应严格执行标准操作规程(SOP),主动询问患者过敏史,完善监测上报工作。
医疗器械;不良事件;过敏;对策;监测上报
[First-author’s address]Department of Pharmacy, Nanjing Gaochun People’s Hospital, Gaochun 211300, China.
医疗设备不良事件(medical device reporting,MDR)是指获得上市的、合格的医疗器械在正常使用情况下发生的导致或可能导致人体伤害的任何与医疗器械预期使用效果无关的有害事件[1]。MDR与药品不良反应(adverse drug reactions,ADR)存在许多的共同点:①均指与使用目的无关的使患者产生伤害或不适的反应;②均需及时上报;③上报工作均涉及到生产、经营、使用和监管部门。ADR监测是用来监管药品安全的一种重要手段,可为临床合理用药和维护公众安全提供有力保障[2]。随着药学队伍的不断壮大和药学工作者的不断努力,ADR上报工作已较为规范,其上报组织健全,网络架构完善,上报流程合理,报告数量较多、质量较高,对安全用药起到了很好的警戒作用。然而,MDR监测和上报工作与ADR相比远远落后,主要原因是我国医疗器械不良事件监测工作起步晚,并与医疗设备从业人员的多样性、医用耗材种类的复杂性和专业性强相关。本研究对医院可疑MDR进行具体分析,旨在更好地开展MDR监测和上报工作,降低医疗设备的固有风险和潜在风险,提高医疗设备临床应用的安全性和有效性。
1 资料与方法
1.1 资料来源
从国家药品不良反应监测中心数据库中,导出苏北人民医院近年来上报的《可疑医疗器械不良事件报告》,筛选出经过省市评价过的可疑MDR报告300例,对其进行阶段性的回顾分析。
1.2 分析方法
在导出可疑MDR报告资料后,依据国家食品药品监督管理局制定的《医疗器械分类目录》,对所涉及的医疗设备进行系统的分类;采用SPSS 13.0统计软件对不良事件所涉及的医疗器械类别、数量、主要表现以及产生的主要原因进行分析汇总和评价,并提出对策,其步骤为:①导出数据;②按品种分类;③按名称汇总MDR报告例数;④从MDR表现和产生原因等方面进行分析。
1.3 MDR分类
我国对医疗设备产品按照风险程序将其分为3类,即Ⅰ类、Ⅱ类和Ⅲ类医疗器械。①Ⅰ类医疗器械:风险程度低,实行常规管理可以保证其安全、有效的医疗器械;②Ⅱ类医疗器械:具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械;③Ⅲ类医疗器械:具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械[3]。
2 MDR报告结果与分析
2.1 MDR涉及的医疗设备风险类别
在300例可疑MDR报告中,涉及Ⅰ类医疗设备的最少,为34例(占11%);涉及Ⅱ类医疗设备的居中,为96例(占32%);涉及Ⅲ类医疗设备的最多,为170例(占57%),如图1所示。
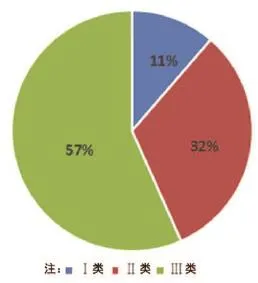
图1 涉及医疗设备的管理类别示意图
2.2 MDR涉及的产品分类情况
在300例可疑MDR报告中,涉及的医疗设备类别共有32类76种,报告数量在前5位的医疗设备类别见表1。

表1 可疑医疗设备不良事件涉及的产品分类情况
2.3 MDR涉及的医疗器械名称和临床表现
在300例可疑MDR报告中,引起不良事件数量居前6位的医疗器械分别是一次性使用输液器(带针)、一次性使用无菌注射器(带针)、一次性使用静脉留置针、一次性使用负压引流器、一次性使用导尿包和一次性使用心电电极,所占比例分别为27.7%、11%、7.3%、3.3%、2.3%和2.3%,其主要临床表现见表2。
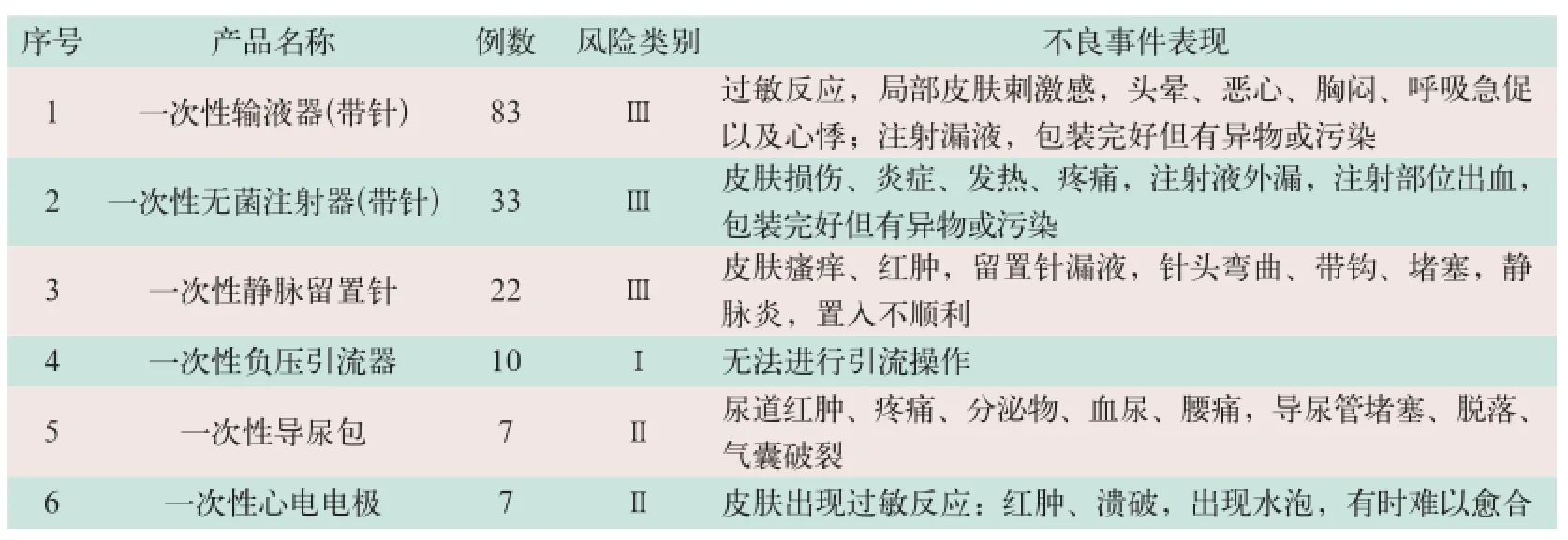
表2 排列前6位MDR的主要临床表现
2.4 MDR产生的主要原因
(1)对300例MDR报告进行分析,发生MDR的主要因素为:①产品质量相关问题,原包装产品组件缺失,出厂漏检,储运过程中的被损坏等;②患者特殊体质;③未完全按照产品说明书SOP操作,存在使用或操作不当;④其他因素,如仪器老化、心电监护仪自身干扰及管路堵塞等(如图2所示)。
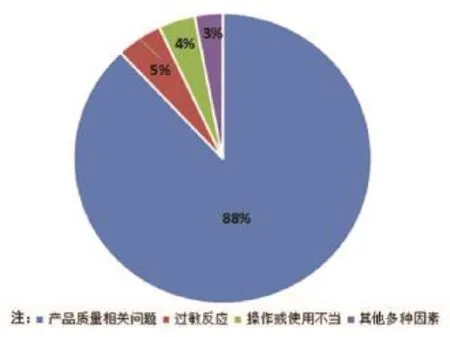
图2 不良事件产生的主要原因构成示意图
(2)在MDR报告中产生过敏反应的医疗器械主要是“械”字号的“类药品”,如一次性使用心电电极、纳米银系列制剂及小儿退热贴等。不良反应的症状主要是皮肤红肿、溃破等,与药品产生的过敏反应相似,过敏反应的产生是因为患者的体质与器械制成材料存在较大的生物不相容性[4]。发生过敏反应后应及时处理皮肤损伤症状,寻找过敏源,若由电极片引起,则应立即暂停电极片使用或更换其他品牌产品。
(3)在临床中进行静脉滴注大量液体时,患者有时会发生寒颤、高热及呕吐等症状,此现象称为热原反应[5]。热原反应严重时可能会导致休克甚至死亡,因此必须了解热原反应发生的原因,并提前预防。输液本身含有过量的热原和过敏物质是引起热原反应最主要的原因,但输液器械制造、灭菌不合格或者运输保存过程中不按规定进行,使输液器械被热原污染从而导致热原反应也是不可忽视的一个重要原因。临床在处理输液过程中引起的热原反应时,要综合考虑多方面的因素,包括药液本身和输液器械。
3 MDR的预防对策
3.1 严格按照使用说明书操作
医疗设备使用说明书是反映医疗设备是否安全有效的重要技术性文件,包含了医疗设备的使用方法、注意事项及存储条件等诸多信息,能够正确的指导医疗设备的安装、调试和使用[6]。医疗设备使用说明书对生产企业和使用者(包括医务人员和患者自身)非常重要,许多MDR的发生可能与未仔细阅读说明书,错误地使用医疗设备而引起。
以角膜塑形(orthokeratology,OK)镜为例。OK镜能够改变角膜形态来矫正屈光不正,但OK镜的作用是暂时、有限的,疗效可逆,患者必须科学佩戴,需要不定期的根据当前矫正效果验配、更换镜片,不能够一副镜片戴到底。由于产品说明书标注不够明确,使用者未仔细阅读说明书的内容,患者长期佩戴后产生视力模糊,角膜发炎等症状[7]。因此,医疗机构应充分认识医疗设备使用说明书的重要性,阅读其注意事项、警示及提示性说明,必要时提醒临床使用人员或者患者,保证医疗设备使用的安全有效,降低不良事件发生率。
3.2 注意禁忌证及过敏史
针对MDR中过敏反应的产生,完备的预防机制极其重要。临床使用一次性心电电极、纳米银等“类药品”的医疗器械前,医务人员应尽到询问和告知义务,主动询问患者过敏史,告知患者有可能会发生过敏反应等不良事件。凡是有过敏史者应尽量避免使用此类医疗设备,必要时可进行相关皮试。有研究表明,使用一次性心电电极前应清洁黏贴部位的皮肤,与常规清洁方法相比,在使用前涂抹一定量的芦荟胶能够有效降低心电电极引起过敏等不良事件的发生率[8]。此外,为了更加清楚的分析不良事件发生的原因,应在MDR报告中增加患者使用医疗设备过敏史的内容,这一举措同时也能够避免MDR的发生。
3.3 实施严格的人员培训
医疗设备的临床使用和药物的临床使用有所不同,不仅涉及到产品本身,还涉及到设备内部电子元器件运行的稳定度,机械部件的安全性和操作软件的人性化等工程类技术指标,其指标均需由具备相关知识的专业人员按照标准操作规程(standard operating procedures,SOP)操作[9]。因此,医务人员的相关培训必不可少,应该定期对医疗设备的操作人员和维修人员进行职能培训,组织其参加相关专业的学习研讨并制定一定的考核标准,确保在临床使用中负责操作医疗设备的人员能够对所使用的设备有足够的认知和了解,严格按照SOP操作,降低MDR发生率,减少对患者的伤害。
3.4 禁止使用召回产品
(1)查询国家食品药品监督管理总局网站,关注医疗设备召回信息、医疗设备质量公告、医疗设备不良事件监测信息通报以及医疗设备警戒等相关方面的信息。
(2)专人负责每日浏览上述网页,发现问题及时记录、调查及汇报。
(3)及时将网站信息转发内网,告知相关人员[10]。
3.5 生产企业须保证医疗器械生产质量
产生不良事件的原因显示,医疗设备质量不过关是最主要的因素。我国近半数的医疗设备生产企业规模较小,基础设施、工作环境、资源配置以及生产能力都较薄弱,医疗设备质量不稳定,企业经营者质量意识淡薄、生产行为不规范、自律性差。
医疗设备生产企业应严格执行生产质量管理规范(good manufacturing practice,GMP),各省级食品药品监督管理部门负责实施GMP的检查工作,严格医疗设备的生产过程控制,从而全面提升我国医疗器械生产企业的整体素质和医疗设备质量监督管理的水平。医疗器械的生产过程需要硬件和软件的资源。
(1)硬件要求。生产企业应具有与生产产品及生产规模相适应的厂房、生产设备、卫生设施及环境等方面的技术要求。
(2)软件要求。企业的生产、质量和技术负责人应具有与生产器械相适应的专业能力,并掌握国家有关医疗设备监督管理的法律、法规以及相关产品质量和技术的规定;应当设立质量检验机构,具备相适应的质量检验能力[11]。
生产企业应高度重视不良事件的发生,提高技术水平、加强安全检测及严格把关质检环节。同时要做到合理的运输和储存,避免野蛮装卸而造成人为损坏设备,避免高温和强光,杜绝和减少瑕疵产品到使用一线。对于MDR的处理,必要时可请生产或供应企业的专业人员协助分析和调查,及时解决问题,充分发挥生产企业在MDR发生后的补救作用。
3.6 做好MDR的监测上报工作
建立健全组织领导体系和组织架构,主动报告的制度和流程,不断修订、持续改进,通过必要的信息系统支持,方便上报。实行专人负责、多部门配合,共同做好MDR上报工作,并纳入年度目标任务,进行不定期监管。
4 完善MDR监报措施
4.1 MDR监测上报现状
近年来,国际上对医疗设备的监管已经逐渐从上市前审批向上市后监管转移,而我国MDR的监测上报工作起步比较晚,开展不完善[12]。主要表现在:①报告数量远远低于实际发生的数量,报告质量不高;②生产企业参与度不高,大部分的上报工作由医疗机构完成;③公众和医务工作者对MDR监测上报工作的认识不足,重视不够;④医疗设备相关的法规体系不完善,监管力度较薄弱[13]。
4.2 做好培训指导工作
(1)医院自身组织MDR知识培训,普及MDR知识,掌握“可疑即报”原则,全员消除不良事件上报疑虑,使网络成员人人知晓。
(2)请上级主管部门来院指导,主管部门专家进行专题培训,形成重视MDR上报氛围。科主任、护士长、主班以及总责任护士等一线工作人员统一思想、提高认识,并将“三基”考试加入MDR知识相关内容[14]。
(3)采取全方位、多层次及多形式培训,药监部门来院专题培训、专业指导,采用下发宣传手册、网络培训、医学工程部与使用部门之间的交流、提醒以及点对点培训的方式。培训内容为:①法律法规、相关标准要求以及MDR上报业务知识培训;②内网系统操作、上报步骤培训;③可疑不良事件报告表内容解读培训;④上报流程、报告填写专题培训以及上报实例演示。
4.3 认真组织严格奖惩
(1)根据市药监局MDR上报任务分配表进行院内任务分解,任务下达到科主任、护士长年度目标任务中。
(2)按照奖惩制度、落实奖惩措施。
(3)利用院查房机会,对MDR上报工作点评:报告的数量、质量,上报数量的分布。指导临床科室规范填写,现场展示高质量报告范例,旨在不断提高报告数量和质量,有力促进此项工作的开展。
(4)加强生产企业对MDR上报的积极性,对隐瞒上报的行为要严重处罚[15]。
5 结论
对于医院MDR的预防,可采用戴明循环(plan do check action,PDCA)法进行管理。即Plan(计划)、Do(执行)、Check(检查)及Action(行动)。①计划,拟定整改计划,对已经发生的不良事件正确规范处理,对潜在的不良事件有一定的预见性;②执行,具体实施,完善机构设置、制定上报制度、制定应急预案、培训相关人员、收集分析上报的不良事件[16];③检查,加强监督巡查,检查机制缺陷和执行情况;④行动,具体处理MDR,相关人员对本部门发生的可疑MDR进行收集分析,通过网络即时上报当地的食品药品监督管理局[17]。
医疗设备已广泛应用到临床中,但同时各种不良事件也层出不穷,因此完善监测上报工作迫在眉睫。应将监测上报工作落实到医疗器械的生产、经营、使用和监管的各个环节,不断完善法规体系,突出重点,加强人员素养,强化监管,使MDR监测上报工作稳步推进,从而保证患者用械的安全有效。
[1]丁桂萍,高小坤,于静.对优化医用耗材不良事件监测与报告体系的探讨[J].检验医学与临床,2013,10(24):3409-3410.
[2]周勇,田月杰,黄传海,等.1388例严重药品不良反应报告分析[J].药物警戒,2008,5(4):225-230.
[3]廖晓曼,李悦菱.从6841-I分类目录修订谈我国医疗器械分类界定工作[J].首都医药,2014(18):12-13.
[4]张景海.广饶县256例可疑医疗器械不良事件报告分析[J].齐鲁药事,2011,30(9):553-555.
[5]Lipschultz A.Adverse patient events involving medical devices[J].Biomed Instrum Technol,2013,47(2):154-155.
[6]Lennard N,Coutinho M,Campbell B.The surgeon and medical devices:adverse incident reporting and off-label use[J].Ann R Coll Surg Engl,2013,95(5):309-310.
[7]黄明,刘瑾生,刘婷.医疗设备及医用耗材不良事件浅析[J].中国医疗设备,2010,25(4):8-9.
[8]陆逸雁,崔文波.一次性心电电极致皮肤过敏的分析与思考[J].中国药物警戒,2014,11(11):687-692.
[9]张屹俊,施裕新.国内医疗器械临床试验现状分析及对策探讨[J].医疗卫生装备,2013,34(9):93-95.
[10]Alemzadeh H,Raman J,Iyer RK,et al.Analysis of safety-Critical computer failures in medical devices[J].IEEE Security and Privacy,2013,11(4):18-20.
[11]赵颖,顾汉卿.简述医疗设备生产质量管理规范[J].透析与人工器官,2008,19(4):25-26.
[12]高小燕,李素敏,崔泽实,等.医学装备风险管理文献的计量研究[J].中国医学装备,2013,10(4):12-15.
[13]Parvizi N,Woods K.Regulation of medicines and medical devices:Contrasts and similarities[J].Clin Med(Lond),2014,14(1):6-12.
[14]Beydon L,Ledenmat PY,Soltner C,et al.Adverse events with medical devices in anesthesia and intensive care unit patients recorded in the French safety database in 2005-2006[J].Anesthe siology,2012,112(2):367-372.
[15]Ouriel K,Fowl RJ,Davies MG,et al.Reporting standards for adverse events after medical device use in the peripheral vascular system[J].J Vasc Surg,2013,58(3):776-786.
[16]张鹏,陈文霞,荆斌,等.基于医疗设备事件管理的分析系统研究[J].中国医学装备,2014,11(5):19-22.
[17]吴君,刘丽萍,胡伟,等.应用PDCA循环提高医疗机构药品不良反应报告和监测管理质量[J].安徽医药,2013,17(10):1808-1809.
Analysis and countermeasures of suspected medical devices adverse events of hospital/
JIANG Yi-fang, GAO Xiao-kun// China Medical Equipment,2016,13(12):20-24.
Objective: To sort out cases of suspected medical device adverse events in Subei hospital, analysis for the reasons of adverse events, and propose measures to ensure the safe clinical use of medical devices. Methods: From the National Adverse Drug Reaction Monitoring Centre database, 300 cases of suspicious medical device adverse events were selected from cities and provinces. The number of categories of adverse events involving medical devices and the main reasons resulting adverse events were analyzed by SPSS. Results: The main reasons resulting the medical device adverse events were quality-related issues of the product, biological incompatibility existing between the patient and the physical device, and improper operation or use. Conclusion: The enterprises of medical devices should product on the basis of GMP strictly to ensure the quality of product. The medical institutions should ask hypersensitivity of patients actively and operate on the basis of SOP strictly to improve the work of monitoring and reporting.
Medical device; Adverse events; Hypersensitivity; Countermeasures; Monitoring and reporting of adverse events
10.3969/J.ISSN.1672-8270.2016.12.007
1672-8270(2016)12-0020-05
R197.39
A
2016-09-27
①南京市高淳人民医院药剂科 江苏 南京 211300
②苏北人民医院化学试剂耗材采购中心 江苏 扬州 225001
蒋贻芳,女,(1993- ),本科学历,药师。南京市高淳人民医院药剂科,从事临床药剂工作。

