CD44、CD47和c-met在卵巢透明细胞癌中的表达及意义
王慧敏,谭明子,张 嵩,2,李 潇,高 健,张丹晔,郝莹莹,高 嵩,刘娟娟,林 蓓
1中国医科大学 附属盛京医院妇产科,沈阳 1100042大连市妇产医院妇产科,辽宁大连 116033
·论 著·
CD44、CD47和c-met在卵巢透明细胞癌中的表达及意义
王慧敏1,谭明子1,张 嵩1,2,李 潇1,高 健1,张丹晔1,郝莹莹1,高 嵩1,刘娟娟1,林 蓓1
1中国医科大学 附属盛京医院妇产科,沈阳 1100042大连市妇产医院妇产科,辽宁大连 116033
目的 探讨CD44、CD47和c-met在卵巢透明细胞癌组织中的表达及其与患者的临床病理参数及预后的关系。方法 采用免疫组织化学检测86例卵巢透明细胞癌组织中CD44、CD47和c-met的表达,进一步分析其与卵巢透明细胞癌临床病理参数及预后的关系,分析三者表达的相关性。结果 卵巢透明细胞癌组织中CD44、CD47和c-met呈过表达,阳性表达率分别为90.7%、91.9%、94.2%,CD44、CD47的强阳性表达均与卵巢透明细胞癌的分期晚、化疗耐药及预后不良相关(P均<0.05),c-met的强阳性表达均与化疗耐药及预后不良相关(P<0.05),CD44、CD47的强阳性表达均与淋巴结转移无关。COX分析表明临床分期晚及CD44、CD47和c-met高表达是卵巢透明细胞癌预后独立风险因素(P均<0.05)。相关性分析显示,CD44与CD47、c-met及CD47与c-met间的表达均呈显著正相关(Spearman相关系数rs分别为0.783、0.776、0.835,P均<0.01)。结论 CD44、CD47和c-met在卵巢透明细胞癌中高表达且两两相关,是其不良预后独立危险因素。
卵巢透明细胞癌;CD44;CD47;c-met;预后
ActaAcadMedSin,2016,38(6):720-725
卵巢透明细胞癌(ovarian clear cell carcinoma,OCCC)是上皮性卵巢癌中较少见的一种病理类型,占全部卵巢癌的5%~25%,其发病机制尚不明确,部分由子宫内膜异位症恶变而来。卵巢透明细胞癌恶性程度高,且对卵巢癌基础化疗药物紫杉醇及铂类不敏感,易出现化疗耐药,预后差[1- 2]。肿瘤干细胞能够自我更新及无限增殖,是肿瘤形成、进展及转移的根源。不同组织肿瘤干细胞表面分子标记不同,目前已有针对肿瘤干细胞表面分子标记的靶向治疗,取得较好的疗效[3- 4]。因此,探讨OCCC的发生机制,寻找OCCC干细胞表面标记分子,为OCCC的生物学靶向治疗提供新思路具有十分重要的意义。CD44是一种由单基因编码的跨膜糖蛋白,主要作为一种细胞黏附分子参与多种恶性肿瘤的生长和转移。CD47又称整合素相关蛋白,属于免疫球蛋白(Ig)超家族成员,在许多恶性肿瘤中过表达,参与细胞免疫逃逸、增殖、凋亡、黏附等。c-met是酪氨酸激酶类受体的一种,是肝细胞生长因子(hepatocyte growth factor,HGF)唯一受体蛋白,二者结合形成HGF/c-met系统,参与肿瘤细胞的增殖、黏附、侵袭及抗凋亡等。CD44、CD47和c-met均为多种肿瘤干细胞表面分子标记。2013年Baccelli等[5]首次报道乳腺癌转移起始细胞为EPCAM+CD44+CD47+c-met+表型,CD44、CD47和c-met高表达增加肿瘤转移风险,且与预后呈负相关,认为CD44、CD47和c-met是乳腺癌转移起始细胞的标记分子。目前仅有研究表明CD44、c-met分别在OCCC中高表达,CD47在卵巢癌组织中高表达,且分别与肿瘤的发生、发展密切相关[6- 9]。但对三者在OCCC中的表达,及其与OCCC发生、发展中的相互作用关系及机制等报道较少。本研究采用免疫组织化学的方法,检测CD44、CD47和c-met在OCCC中的表达情况,探讨其表达与OCCC临床病理参数及预后的关系并分析三者表达的相关性,以期为OCCC的靶向治疗及改善预后提供帮助。
对象和方法
对象 选取中国医科大学附属盛京医院妇产科2003年1月至2012年12月手术切除的86例卵巢透明细胞癌石蜡标本。所有患者术前未经化疗,患者临床资料及随访资料完整,病理切片均经HE染色后由病理专家确诊。患者年龄29~73岁,平均年龄(50.3±17.5)岁。
手术方式 严格按美国国立综合癌症网络指南进行,24例患者行卵巢癌肿瘤细胞减灭术(全子宫双附件切除+大网膜切除+阑尾切除+盆腔淋巴结清扫+/-骶前淋巴结清扫+/-腹主动脉淋巴结切除+盆腹腔病灶切除),60例患者行卵巢癌全面分期手术(全子宫双附件切除+大网膜切除+阑尾切除+盆腔淋巴结清扫+/-腹主动脉淋巴结切除,或患侧附件切除+对侧附件剖检+大网膜切除+阑尾切除+盆腔淋巴结清扫),2例因病变广泛未行淋巴结清扫(全子宫切双附件切除+大网膜切除+阑尾切除+盆腹腔病灶切除)。术中残余病灶>1 cm共8例,余78例残余灶均<1 cm。
临床分期 采用国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO) 2009年的标准,Ⅰ期51例、Ⅱ期8例、Ⅲ期23例、Ⅳ期4例。84例行淋巴结切除的患者中有淋巴结转移10例、无淋巴结转移74例。
术后治疗及随访 4例Ⅰ期患者术后拒绝化疗,随访至今(50~84个月),未见复发及转移证据,失访11例,余71例患者术后根据美国国立综合癌症网络指南给予紫杉醇类+铂类系统化疗(6~8疗程),定期随访至2015年12月,中位随访时间56.5个月(36~108个月),死亡25例(35.2%),3年总体生存率为66.2%,中位生存期为42.1个月。
复发与耐药 卵巢癌复发的主要临床特征包括:(1)CA125持续升高;(2)妇科检查发现包块;(3)影像学检查发现肿块;(4)出现腹水等。71例患者中死亡患者25例、复发存活1例、无瘤生存45例。化疗耐药组:患者初次化疗后获得完全临床缓解,但是在化疗后期及完成化疗后6个月内出现复发;部分敏感组:患者在完成化疗后6~12个月内复发;敏感组:患者临床完全缓解达到12个月以上出现复发。71例经系统治疗的患者中化疗敏感52例(包括部分敏感组)、化疗耐药19例。
免疫组织化学链霉菌抗生物素蛋白-过氧化物酶连结法(SP法) 所选标本经10%福尔马林固定,进行常规石蜡包埋,4 μm厚连续切片,分别进行3组免疫组织化学染色。石蜡切片脱蜡至水,3% H2O237℃孵育30 min,封闭内源性过氧化酶活性。微波炉抗原热修复处理,自然冷却,滴加山羊封闭血清37℃孵育30 min,阻断非特异性结合。分别滴加兔抗人CD44(Santa Cruz,1∶400稀释)、CD47(Santa Cruz,1∶600稀释)、MET(Abcam,1∶800稀释)抗体4℃孵育过夜,滴加辣根酶标记的羊抗兔二抗37℃孵育30 min,滴加辣根过氧化物酶37℃孵育30 min。DAB显色,苏木素核复染、返蓝、脱水、二甲苯透明、中性树胶封片。每批实验均用相同病例切片分别进行CD44、CD47、c-met 3组染色,每批均设阳性和阴性对照片,CD44、CD47阳性对照使用浆液性卵巢癌组织,c-met阳性对照使用子宫内膜癌组织,阴性对照使用磷酸盐缓冲液代替一抗。实验操作过程严格按照试剂盒(迈新鼠兔通用试剂盒,福州)说明书进行。
结果判定 细胞膜或细胞浆出现棕黄色或黄色着色判定为阳性。按染色强度为不着色、浅黄色、棕黄色及棕褐色分别计分为0、1、2及3分;观察着色细胞所占整张切片癌组织的百分比进行评分,阳性细胞率<5%为0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分。二项乘积0~2为-,3~4为+,5~8为++,9~12分为+++。按染色结果分为CD44低表达组(-~+)及高表达组(++~+++,强阳性表达),CD47及c-met亦按表达情况分为低表达组及高表达组。误差控制:由2人分别阅片,当结果出现不一致时,由第3人判断。
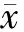
结 果
CD44、CD47、c-met在卵巢透明细胞癌组织中的表达 CD47蛋白阳性表达位于胞膜及胞浆,以胞膜为主,细胞核中亦可见染色,阳性表达率为91.9%(79/86),强阳性表达率为50.0%(43/86)。CD44蛋白阳性表达位于胞膜及胞浆,以胞膜为主,阳性表达率为90.7%(78/86),强阳性表达率为60.5%(52/86)。c-met蛋白阳性表达主要位于胞膜,阳性表达率为94.2%(81/86),强阳性表达率为69.8%(60/86)(图1)。

OCCC:卵巢透明细胞癌
OCCC:ovarian clear cell carcinoma
图 1 CD44(A)、CD47(B)、c-met(C)在卵巢透明细胞癌组织中的表达(×400)
Fig 1 Expressions of CD44(A),CD47(B),and c-met(C) in OCCC tissue (×400)
CD44、CD47、c-met的表达与卵巢透明细胞癌临床病理参数的关系 CD44及CD47在OCCC的表达相似。晚期(FIGO Ⅲ/Ⅳ)的患者CD44及CD47强阳性表达率分别为70.4%(19/27)及85.2%(23/27),显著高于早期(FIGO Ⅰ/Ⅱ)的40.7%(24/59)及49.2%(29/59)(P=0.011,P=0.002)。化疗耐药组 CD44及CD47强阳性表达率分别为84.2%(16/19)及89.5%(17/19),显著高于化疗敏感组的42.3%(23/52)及51.9%(27/52)(P=0.002,P=0.004)。c-met在临床分期晚(FIGO Ⅲ/Ⅳ)的患者中强阳性表达率为81.5%(22/27),与分期早(FIGO Ⅰ/Ⅱ)的64.4%(38/59)相比,差异无统计学意义(P=0.110)。化疗耐药组c-met强阳性表达率为94.7%(18/19),显著高于化疗敏感组的63.5%(33/52)(P=0.010)。CD44、CD47、c-met阳性表达率在FIGO早、晚期,淋巴结转移、非转移,化疗耐药和敏感各组间差异均无统计学意义(P均>0.05)(表1)。
卵巢透明细胞癌预后危险因素 应用COX分析模型分析临床分期、淋巴结转移、残余灶大小、就诊年龄、CD44、CD47、c-met表达水平与卵巢透明细胞癌患者存活时间的关系显示,临床分期晚(P=0.002)及CD44(P=0.044)、CD47(P=0.046)、c-met(P=0.047)高表达是卵巢透明细胞癌独立预后风险因素。
CD44、CD47、c-met表达水平与卵巢透明细胞癌3年生存率的关系 分别对CD44、CD47、c-met不同表达强度的患者总生存期进行Kapla-Meier分析显示,CD44、CD47、c-met高表达组的总生存期均显著延长 (P=0.009,P=0.002,P=0.039) (图2)。CD44高表达组3年生存率为81.8%,显著高于低表达组的52.2%(P=0.008)。与CD44相似,CD47、c-met高表达组3年生存率(88.7%、85.0%)均显著高于低表达组(52.3%、58.5%)(P=0.002,P=0.038)。
CD44、CD47、c-met在OCCC中表达的相关性 相关性分析显示,在86例卵巢透明细胞癌组织中,CD44与CD47共同阳性表达77例、共同阴性表达6例,二者表达呈线性相关(P=0.004,Spearman 相关系数rs=0.783)。CD44与c-met共同阳性表达78例、共同阴性表达5例,二者表达呈线性相关(P=0.0001,Spearman 相关系数rs=0.776)。CD47与c-met共同阳性表达79例、共同阴性表达5例,二者表达呈线性相关(P=0.006,Spearman相关系数rs=0.835)。
讨 论
CD44作为一种细胞黏附分子,通过抑制Fas表达[10]、激活有丝分裂原激活的蛋白激酶途径[11]、与基质透明质酸结合、影响基质金属蛋白酶的活性[12]等调控肿瘤细胞恶性生物学行为,促进恶性肿瘤的生长和转移。本研究显示CD44在OCCC组织过表达,其阳性表达率为90.7%(78/86),且晚期及化疗耐药者中高表达,提示CD44高表达促进OCCC的恶性生物学行为进展。HGF与c-met受体特异性结合后诱导c-met蛋白发生构象改变,激活受体胞内蛋白激酶结构域中的酪氨酸蛋白激酶,激活的酪氨酸蛋白激酶使c-met自身的酪氨酸磷酸化,进一步导致多种底物蛋白的酪氨酸磷酸化,经瀑布式的磷酸化反应,将信号逐级放大,转入细胞核内的转录机构,从而促进肿瘤细胞的增殖、分化,调节肿瘤细胞的运动、迁移,增强肿瘤细胞的侵袭能力并诱发肿瘤新生血管的生成,促进肿瘤进展。本研究免疫组织化学结果显示,同CD44表达类似,OCCC组织中c-met过表达,其阳性表达率为(94.2%,81/86),且其高表达与化疗耐药相关,提示c-met表达可能通过上述途径促进OCCC的发生及进展,导致其预后不良。CD44与c-met在肿瘤中具有一定的相互作用,CD44V6刺激能诱导肿瘤细胞c-met表达[13],且其胞外区存在c-met自动磷酸化结合位点[14],通过形成CD44V6-c-met-HGF复合体,使c-met受体酪氨酸激酶磷酸化,激活相关通路促进细胞增殖和抑制细胞凋亡,促进肿瘤组织血管的生成[15]。OCCC组织中CD44与c-met阳性率及组织定位类似,且二者高表达均与化疗耐药及预后差相关,本研究表明二者在OCCC中的表达呈显著正相关,推测CD44与c-met协同促进OCCC的发生及进展,导致其预后不良。
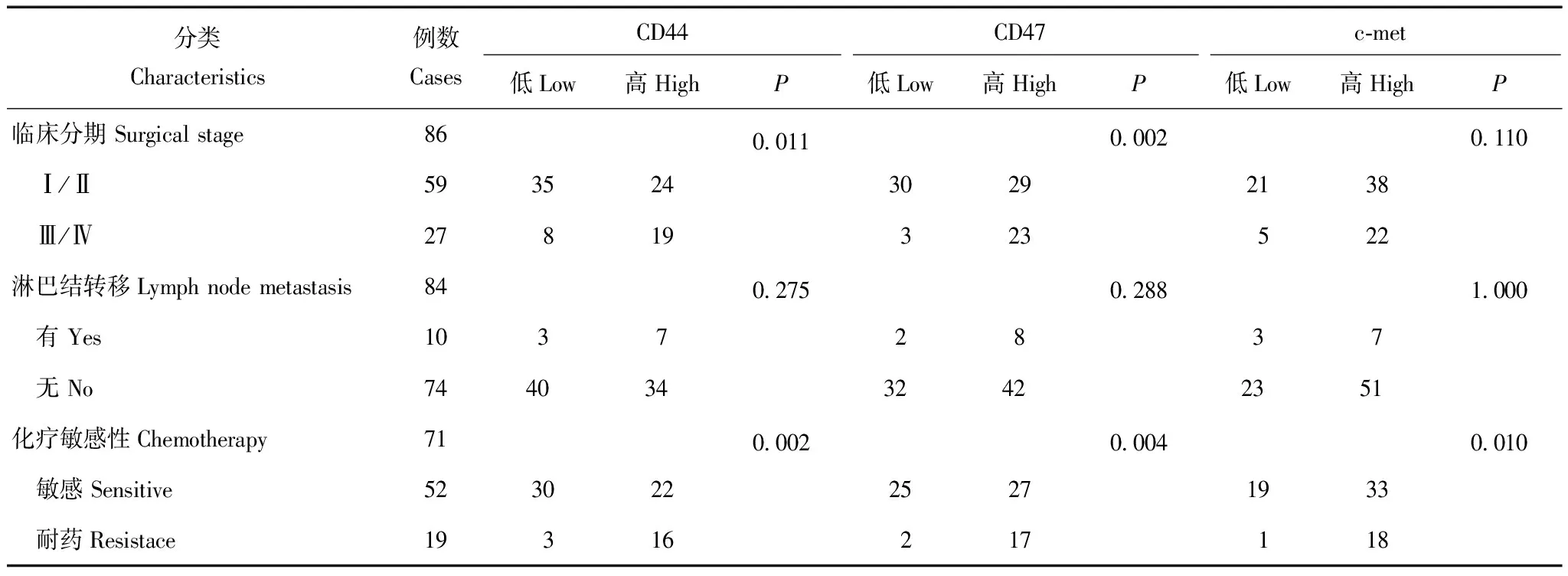
表 1 CD44、CD47、c-met的表达与OCCC临床病理参数的关系
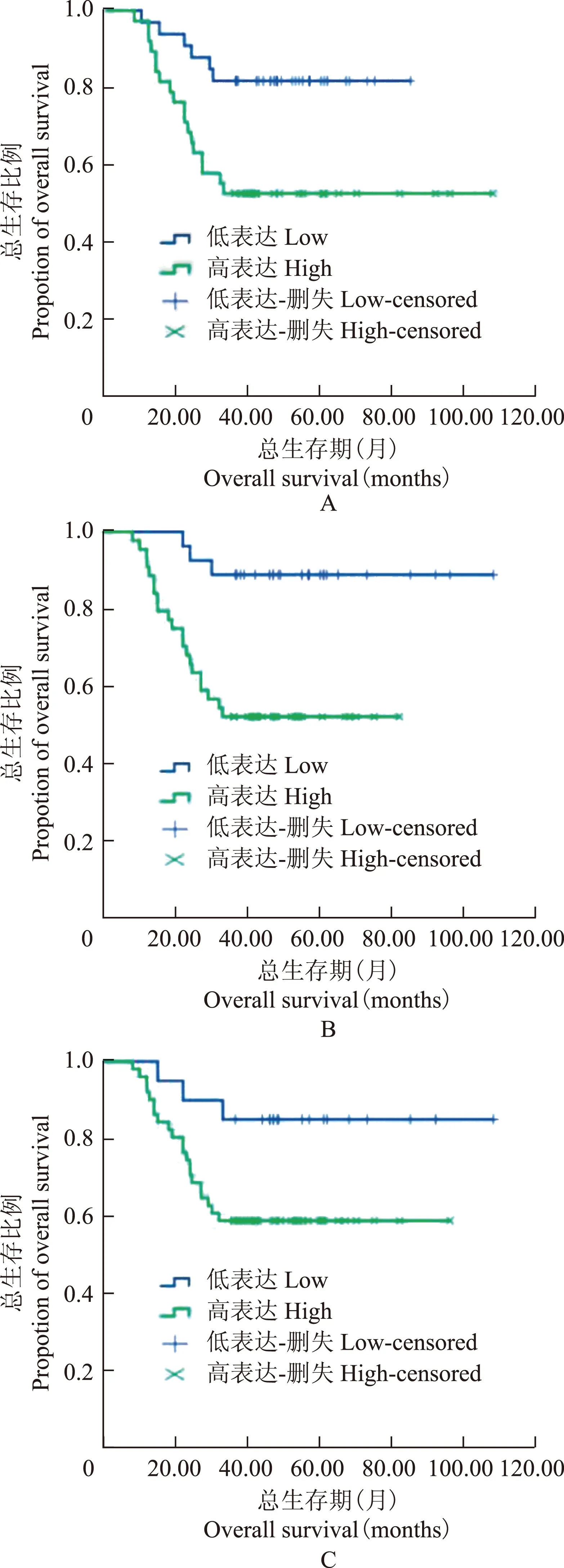
图 2 CD44(A)、CD47(B)、c-met(C)表达与OCCC患者生存的关系
Fig 2 Correlations of CD44(A),CD47(B),and c-met(C) expression with overall survival in OCCC
CD47分子通过与其配体相互作用对机体发挥调控作用:与整合素结合参与调节中性粒细胞的趋化、黏附、吞噬和迁移;与血小板反应素1结合调控细胞增殖、凋亡、黏附、迁移,参与血管生成及炎症反应;与信号调节蛋白α、r结合,传导抑制性信号,降低巨噬细胞的吞噬活性,促进肿瘤细胞的免疫逃逸,促进肿瘤发生[16];与E-钙黏素共表达,介导细胞间黏附,过表达CD47能破坏细胞间黏附,促进上皮细胞的转移[17]。本研究表明,CD47在OCCC中亦呈过表达,其阳性率为91.9%(79/86),且其高表达的患者临床分期更晚、更易化疗耐药、预后差,提示CD47与OCCC恶性生物学行为和不良预后密切相关。对CD47与c-met关系的研究表明,甲状腺乳头状癌中CD47的配体血小板反应素1的表达受c-met/HGF调控[18];CD47诱导HGF刺激培养的梅丁肾上皮细胞细胞间黏附断裂,二者共同作用通过重组细胞骨架促使细胞转移[19]。本研究CD47与c-met在OCCC组织中的表达基本一致,二者表达呈线性相关,推测在OCCC中二者可能通过上述相互作用导致肿瘤不良预后。
肿瘤干细胞是肿瘤形成、进展及转移的根源。有研究表明,CD44、CD47和c-met分别或同时为多种肿瘤干细胞的表面标记分子,且与肿瘤发生、发展及转移相关[5]。本研究显示OCCC组织中CD44、CD47及c-met的阳性表达率及阳性组织定位类似,三者均呈过表达且主要定位于细胞膜及胞浆,相关性分析表明CD44、CD47与c-met、CD44与CD47间的表达均呈正相关,同时CD44、CD47高表达均与OCCC的临床分期、化疗耐药及预后相关,c-met高表达与OCCC化疗耐药及预后相关,三者表达越强,越容易出现化疗耐药,患者的预后越差。CD44、CD47及c-met阴性表达患者预后较好,其中1例ⅢA期患者三者均为阴性表达,系统治疗后随访至今86个月未见复发迹象。推测CD44、CD47及c-met可能同为OCCC肿瘤干细胞的标记分子,协同促进OCCC的发生、发展。但对CD44、CD47和c-met相互作用对OCCC细胞的增殖、凋亡、黏附、侵袭转移等恶性生物学行为的影响及通过何种途径调控肿瘤细胞的生物学行为进展等作用机制仍需进一步研究,从而对OCCC的诊断、治疗及改善预后提供理论基础及探索方向。
本研究显示CD44、CD47及c-met在OCCC中均呈过表达且两两呈显著正相关,三者可能同时作为OCCC干细胞标记分子,协同促进这一特殊病理亚型卵巢癌的恶性生物学行为进展,最终导致其预后不良。因此可在现有的经典化疗方案的基础上联合应用针对CD47、CD44和c-met的靶向药物进行OCCC靶向治疗,对治疗的个体化和进一步提高疗效具有重要意义。
[1]Gounaris I,Brenton JD.Molecular pathogenesis of ovarian clear cell carcinoma[J].Future Oncol, 2015,11(9):1389- 1405.
[2]del Carmen MG,Birrer M,Schorge JO. Clear cell carcinoma of the ovary:a review of the literature [J]. Gynecol Oncol,2012,126(3):481- 490.
[3]Li L,Hao X,Qin J,et al. Antibody against CD44s inhibits pancreatic tumor initiation and postradiation recurrence in mice [J]. Gastroenterology,2014,146(4):1108- 1118.
[4]Burges A,Wimberger P,Kumper C,et al. Effective relief of malignant ascites in patients with advanced ovarian cancer by a trifunctional anti-EpCAM x anti-CD3 antibody:a phase Ⅰ/Ⅱ study [J]. Clin Cancer Res,2007,13(13):3899- 3905.
[5]Baccelli I,Schneeweiss A,Riethdorf S,et al. Identification of a population of blood circulating tumor cells from breast cancer patients that initiates metastasis in a xenograft assay [J]. Nat Biotechnol,2013,31(6):539- 545.
[6]Abelson S,Shamai Y,Berger L,et al. Niche-dependent gene expression profile of intratumoral heterogeneous ovarian cancer stem cell populations [J]. PLoS One,2013,8(12):e83651.
[7]Zhang S,Balch C,Chan MW,et al. Identification and characterization of ovarian cancer-initiating cells from primary human tumors [J]. Cancer Res,2008,68(11):4311- 4320.
[8]Yamashita Y. Ovarian cancer:new developments in clear cell carcinoma and hopes for targeted therapy [J]. Jpn J Clin Oncol,2015,45(5):405- 407.
[9]Baohui J,Yuting H,Jing T,et al.Invitroapplication of anti-CD47 monoclonal antibody for targeted therapy of ovarian cancer [J]. Chin J Clin Oncol,2013,40(8):440- 443.
[10]Manabu Y,Yoshiya T,Koichi F,et al. CD44 stimulation down-regulates Fas expression and Fas-mediated apoptosis of lung cancer cells [J]. IntImmunol,2001,13(10):1309- 1319.
[11]Nam K,Oh S,Lee KM,et al.CD44 regulates cell proliferation,migration,and invasion via modulation of c-Src transcription in human breast cancer cells [J]. Cell Signal,2015,27(9):1882- 1894.
[12]Jiang W,Zhang Y,Kane KT,et al. CD44 regulates pancreatic cancer invasion through MT1-MMP [J]. Mol Cancer Res,2015,13(1):9- 15.
[13]Sawada K,Radjabi AR,Shinomiya N,et al. c-Met overexpression is a prognostic factor in ovarian cancer and an effective target for inhibition of peritoneal dissemination and invasion [J]. Cancer Res,2007,67(4):1670- 1679.
[14]Rousseau V,Morrison H,Matzke A. Orian-hepatocyte growth factor induced Ras activation requires ERM proteins linked to both CD44V6 and F-actin [J]. Mol Biol Cell,2007,18(1):76- 83.
[15]Matsumura A,Kubota T,Taiyoh H,et al. HGF regulates VEGF expression via the c-Met receptor downstream pathways,PI3K/Akt,MAPK and STAT3,in CT26 murine cells [J]. Int J Oncol,2013,42(2):535- 542.
[16]Zhang H,Li F,Yang Y,et al. SIRP/CD47 signaling in neurological disorders [J]. Brain Res,2015,14(1623):74- 80.
[17]Shinohara M,Ohyama N,Murata Y,et al. CD47 regulation of epithelial cell spreading and migration,and its signal transduction [J]. Cancer Sci,2006,97(9):889- 895.
[18]Scarpino S,Di Napoli A,Taraboletti G,et al. Hepatocyte growth factor (HGF) downregulates thrombospondin 1 (TSP- 1) expression in thyroid papillary carcinoma cells [J]. J Pathol,2005,205(1):50- 56.
[19]Shinohara M,Ohyama N,Murata Y,et al. CD47 regulation of epithelial cell spreading and migration,and its signal transduction [J]. Cancer Sci,2006,97(9):889- 895.
Expressions of CD44,CD47,and c-met in Ovarian Clear Cell Carcinoma and Their Clinical Significance
WANG Hui-min1,TAN Ming-zi1,ZHANG Song1,2,LI Xiao1,GAO Jian1,ZHANG Dan-ye1,HAO Ying-ying1,GAO Song1,LIU Juan-juan1,LIN Bei1
1Department of Obstetrics and Gynecology,Shengjing Hospital Affiliated to China Medical University,Shenyang 110004,China2Department of Obstetrics and Gynecology,Dalian Maternity Hospital,Dalian,Liaoning 116033,China
LIN Bei Tel:024- 96615- 1- 40131,E-mail:linbei88@hotmail.com
Objective To investigate the expressions of CD44,CD47,and c-met in ovarian clear cell carcinoma (OCCC) tissue and their correlations with clinical variables and prognosis. Methods Immunohistochemical method was used to investigate the expressions of CD44,CD47,and c-met in tissues from 86 OCCC patients and the relationships of their expressions with the clinicopathological factors of OCCC were analyzed. Results The expressions of CD44,CD47,and c-met were significantly high in OCCC tissues (90.7%,91.9%,and 94.2%,respectively). The strong positive expressions of CD44 and CD47 were significantly correlated with advanced International Federation of Gynecology and Obstetrics stages,chemotherapeutic resistance,and poor prognosis (allP<0.05),the strong positive expression of c-met was significantly correlated with chemotherapeutic resistance and poor prognosis (allP<0.05),whereas there was no correlation between the strong positive expressions of CD44,CD47,and c-met and the lymphatic node metastasis. COX survival analysis revealed that advanced International Federation of Gynecology and Obstetrics stages and high expressions of CD44,CD47 and c-met were independent risk factors for poor prognosis (P<0.05). There was a positive correlation between CD44 (or CD47) and c-met and between CD44 and CD47 (the Spearman correlation coefficientrswas 0.783,0.776,and 0.835,respectively,allP<0.01). Conclusions The expressions of CD44,CD47,and c-met increase in OCCC tissues and are correlated with each other. High expressions of CD44,CD47,and c-met are independent factors for poor prognosis.
ovarian clear cell carcinoma;CD44;CD47;c-met;prognosis
国家自然科学基金(81172491、81101527、81472437),高等学校博士科学点专项科研基金(20112104110016、20112104120019)和盛京自由研究者计划(201303) Supported by the National Natural Sciences Foundation of China (81172491,81101527,81472437),the Education Department Doctor Project Fund (20112104110016,20112104120019),and Outstanding Scientific Fund of Shengjing Hospital(201303)
林 蓓 电话:024- 96615- 1- 40131,电子邮件:linbei88@hotmail.com
R711.75
A
1000- 503X(2016)06- 0720- 06
10.3881/j.issn.1000- 503X.2016.06.016
2015- 12- 25)

