荧光素二乙酸酯荧光微孔板法在细胞活力测定中的应用
陈 熙,杨秀颖,方莲花,杜冠华
中国医学科学院 北京协和医学院 药物研究所药物靶点研究与新药筛选北京市重点实验室,北京 100050
·论 著·
荧光素二乙酸酯荧光微孔板法在细胞活力测定中的应用
陈 熙,杨秀颖,方莲花,杜冠华
中国医学科学院 北京协和医学院 药物研究所药物靶点研究与新药筛选北京市重点实验室,北京 100050
目的 评估荧光素二乙酸酯(FDA)微孔板检测法在细胞活力测定中的应用。方法 培养板接种细胞,加入FDA孵育一定时间,多功能微板分析仪测定荧光值。评价FDA孵育时间、浓度及其他影响因素对检测精确度的影响,并与四甲基偶氮唑盐(MTT)方法在H2O2损伤及细胞数量的检测方面进行比较。结果 随着孵育时间的延长,荧光值与细胞数的相关系数随之增加,27~30 min时可达到0.99。FDA终浓度在10~30 μg/ml时,荧光值与细胞数的相关系数较高。在H2O2损伤模型检测中,与四甲基偶氮唑盐相比,FDA在H2O2高浓度时相关性更强。结论 FDA法检测细胞活力稳定可靠,适用于多种条件下的细胞活力检测及药理学研究。
荧光素二乙酸酯;荧光;微孔板检测;细胞活力;四甲基偶氮唑盐;细胞毒
ActaAcadMedSin,2016,38(6):710-714
基于对细胞内酯酶功能的评价是常用的检测细胞活力方法之一。酯酶是一大类存在于细胞内的、可裂解细胞中酯类的水解酶。活细胞中的非特异性酯酶可将荧光探针的非荧光部分裂解掉,产生滞留在细胞内的荧光物质。而死细胞或活性较差的细胞中非特异性酯酶活性较差,则无荧光或较暗的荧光。该类荧光探针中最常用的是荧光素二乙酸酯(fluorescein diacetate,FDA)及其衍生物。因价格低廉、操作简单、荧光信号较强而广为应用[1]。FDA及其衍生物普遍用于检测细菌[2]、植物细胞及哺乳动物细胞活性[3]。FDA检测通常用于基于荧光显微镜的图像分析检测[2- 3],在显微镜下发绿色荧光的是有活力的细胞,目前有关FDA荧光微板检测细胞活力应用的报道较少。本研究对FDA微板检测法检测细胞活力的方法进行探讨,并与常用的四甲基偶氮唑盐(methyl thiazolyl,MTT)检测进行对比。
材料和方法
材料 荧光素二乙酸酯[生工生物工程(上海)有限公司];四甲基偶氮唑盐(Sigma公司);内皮细胞株ECV304(北京协和医学院基础医学研究所细胞资源中心提供);DMEM培养基(Gibco公司)。多功能微板分析仪(SpectralMax M5,美国Molecular Devices 公司);CO2细胞培养箱(日本Sanyo公司);96孔透明底黑色细胞培养板(Costar,USA)。
试剂的配制 FDA贮存液:15 mg FDA溶于1 ml丙酮中,避光4℃保存。细胞裂解液:1% NP40,1% Triton,10 mmol/L磷酸盐缓冲液(phosphate buffer saline,PBS)配制。
细胞培养条件 内皮细胞株ECV304,采用含10% 胎牛血清的DMEM培养基培养。在37℃,5% CO2培养箱中常规培养,隔天换液,根据细胞生长情况每2~3 天传代1次。
FDA测定细胞活力最佳染色浓度及染色时间筛选 细胞接种在96孔黑色透明底细胞培养板中。需要测定细胞活力时吸弃培养板中培养液,用PBS液洗涤细胞。加入不同浓度的PBS液稀释的FDA 100 μl,室温或37℃培养箱中孵育相应的时间后。采用多功能微板分析仪,经培养板底部测定荧光值(激发光:485 nm,发射光:538 nm);或加入细胞裂解液100 μl振荡10 min后,经培养板顶部测定荧光值。
细胞完整或裂解对检测结果的影响 细胞消化后计数,接种到96孔黑色底部透明板中,于37℃,5%CO2培养箱中培养12 h。吸弃培养液,PBS洗涤后,加入终浓度为10 μg/ml的FDA,30 min后用多功能微板分析仪读取荧光值。然后再加入100 μl裂解液震荡10 min,读取荧光值。
MTT比色法 取出培养板,弃去培养基。轻轻加入无血清培养基溶解的MTT(0.04%)100 μl。37℃,5% CO2培养箱中静置4 h。吸弃MTT液,加入150 μl 二甲基亚砜溶解MTT。震荡溶解10 min后,多功能微板分析仪测定吸光度值(550 nm)。
H2O2对细胞的损伤作用 ECV304细胞首先由胰酶消化后计数,均匀接种到96孔板中,每孔4000个细胞。24 h后弃去含血清培养液,加入无血清DMEM(高糖)培养基90 μl。加入含不同浓度H2O2的培养基90 μl 至相应终浓度。4 h后进行FDA和MTT测定。
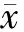
结 果
FDA浓度及孵育时间结果 随着FDA与细胞孵育时间的延长,荧光值与细胞数的相关系数也随之增加。孵育6 min后细胞数与荧光值的相关系数即可达到0.95以上,孵育27~30 min可达到0.99 (图1A)。采用不同浓度的FDA与不同量的细胞孵育30 min,FDA终浓度在10~30 μg/ml时,检测的荧光值与细胞数的相关系数可达0.99以上(图1B)。FDA终浓度10 μg/ml孵育30 min,荧光产物与细胞数量成正相关(图1C)。FDA终浓度10 μg/ml孵育24 h 未见其对细胞形态造成影响(图1D)。
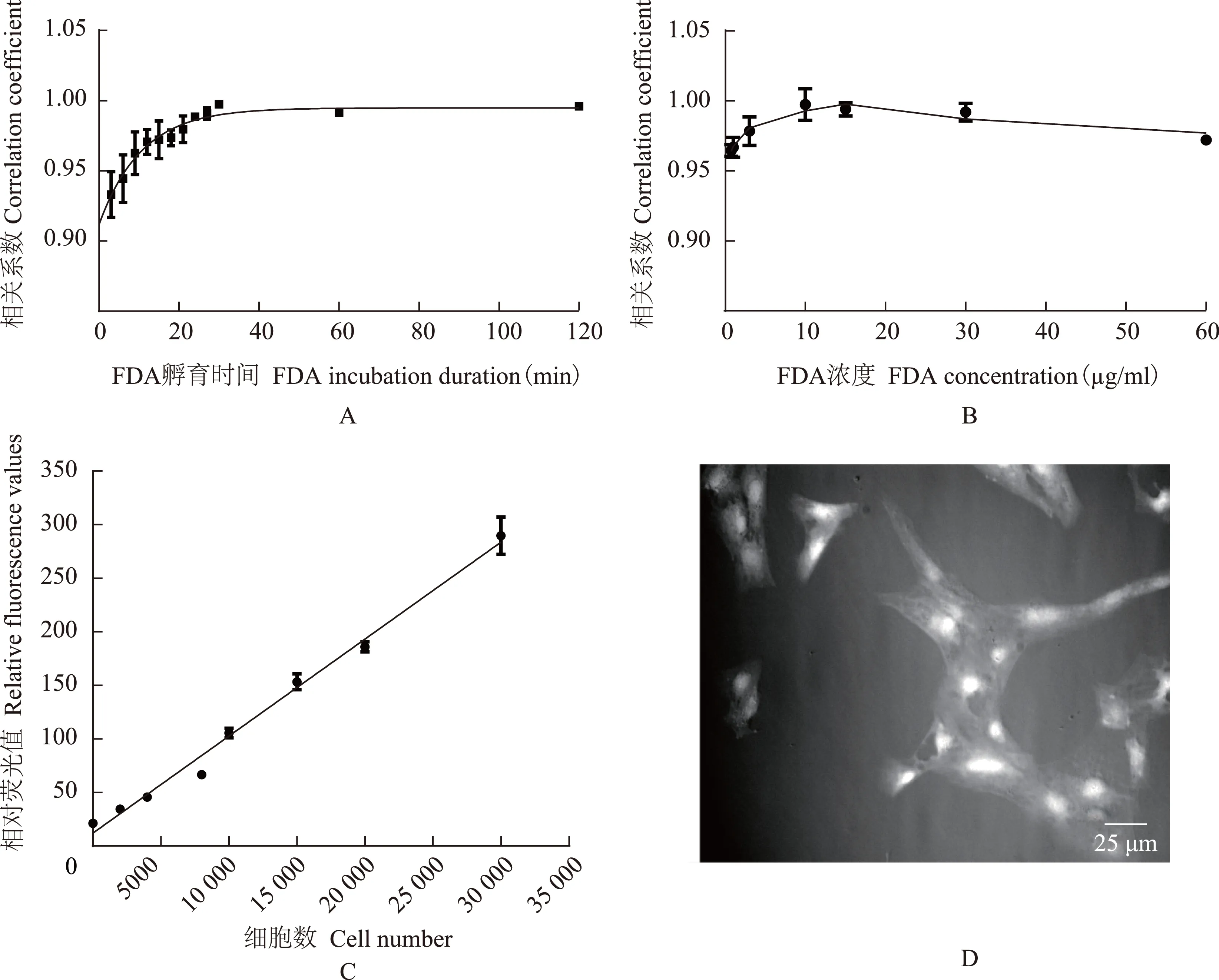
细胞完整或裂解对检测结果的影响 在96孔板培养系统中,细胞处于完整状态或裂解后的荧光值,与所对应的细胞数均呈良好的线性关系。但相比于完整细胞,细胞裂解后的荧光值与细胞数的线性关系更好。尤其是小于1000个/孔时,细胞裂解后荧光值本底更低,能更好地反应细胞数的线性关系(图2)。
FDA检测法与传统细胞活力测定MTT方法比较 ECV304细胞胰酶消化后,接种到96孔板中,于37℃,5%CO2培养箱中培养24 h。吸弃培养液,分别进行FDA、MTT测定。结果显示两种方法测得的值均与细胞数量呈良好的相关性,相关系数均大于0.99,两种方法比较差异无统计学意义(图3A)。FDA的检测信号在H2O2高浓度时与细胞活力的相关性较MTT法更强(图3B)。
FDA:二乙酸酯
FDA:fluorescein diacetate
A. FDA孵育不同时间与所对应不同细胞数荧光值的相关系数;B. 不同浓度FDA孵育与所对应不同细胞数荧光值的相关系数;C. 10 μg/ml FDA孵育30 min时,细胞数与所对应荧光值;D. 10 μg/ml FDA孵育24 h后,荧光显微镜下的细胞形态
A.correlation coefficient of different incubation duration of FDA with the different cell number;B. correlation coefficient of FDA concentration with the different cell number;C. scatter plot of fluorescence with cell number after cells were incubated with FDA (10 μg/ml) for 30 minutes;D.cell morphology under fluorescent microscope after the cells were incubated with FDA (10 μg/ml) for 24 hours
图 1 FDA不同浓度和孵育时间的影响
Fig 1 Effects of different concentration and incubation time of FDA
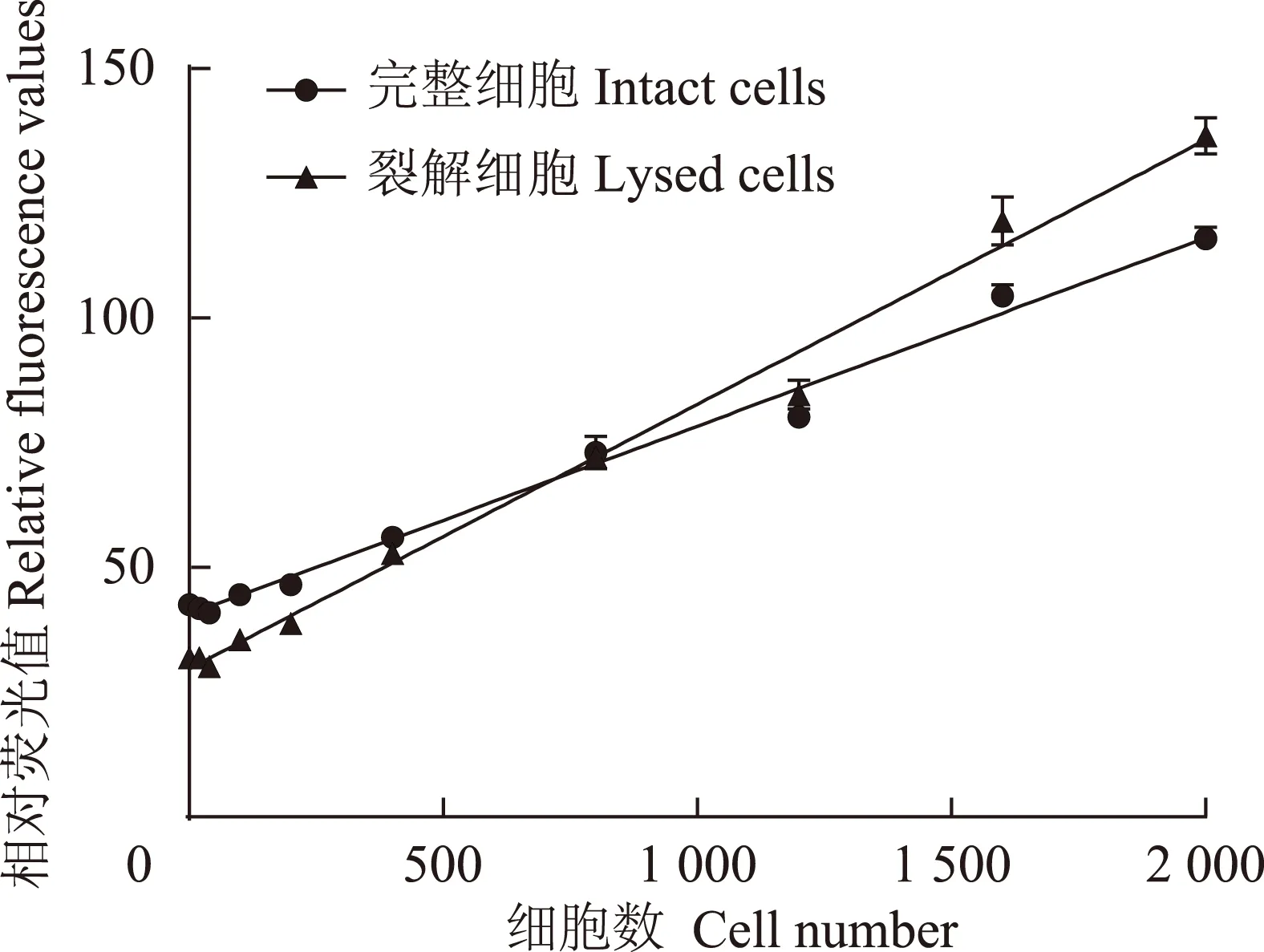
图 2 细胞完整或裂解后的荧光值相对细胞数量的散点图
Fig 2 Scatter plot of fluorescence from intact or lysed cells with cell number
讨 论
细胞活力一般指细胞的生存力,即细胞可执行一定的生理功能,如代谢、生长、增殖和一些反应与适应的能力。细胞活力的评价一般基于对一种或两种细胞特性的评价,如膜的完整性、细胞的生理状态及细胞的增殖能力等。细胞非特异性酯酶发现和用于微生物及细胞活力检测较早,酯酶底物应用最早且性价比较高的是FDA[4- 5],但目前在细胞活性评价中应用并不普遍。截止到2015年底,在PubMed中以“Fluorescein Diacetate”为检索词得到的文献仅1000余篇,而MTT法则是其300余倍。其中可能的原因是对该方法的认识不足,以及以往检测非特异性酯酶活力多采用荧光显微镜技术[6- 7],而荧光微孔板技术尚未普及。
MTT:四甲基偶氮唑盐; OD:光密度
MTT:methyl thiazolyl;OD:optical density
A. FDA和MTT在细胞数检测中的比较(n=8);B. 在H2O2引起的ECV304细胞损伤模型中,FDA和MTT检测细胞活力的比较(n=8)
A. FDA and MTT on cell number detection (n=8);B. FDA and MTT in ECV304 viability detection of H2O2injury (n=8)
图 3 FDA和MTT细胞活力检测的比较
Fig 3 Comparison of FDA and MTT in cell viability detection
FDA本身无荧光、无极性,可透过完整的细胞膜,由于受到酯酶的分解产生具有荧光的极性物质,它不能自由出入细胞膜,因此有活力的细胞能产生荧光。FDA荧光微板测定最早见于细胞毒性分析[8],对该方法的应用也时有报道[9- 12]。本研究采用MTT检测方法作为对照,其主要针对琥珀酸脱氢酶进行检测。细胞线粒体中的琥珀酸脱氢酶检测是常见的细胞活性评价手段,采用的底物包括MTT、3,3’-[1-(苯氨酰基)- 3,4-四氮唑]-二(4-甲氧基- 6-硝基)苯磺酸钠、水溶性四唑盐等。其中因MTT成本低,灵敏度也较高,因而最为常用。其原理是线粒体能量代谢过程中产生的琥珀酸脱氢酶可将淡黄色的MTT还原成蓝紫色的甲臜沉积在细胞内和细胞周围,形成的结晶与活细胞数成正比。
MTT类检测方法在药理学研究中存在缺陷,因为许多还原性药物可以模拟琥珀酸脱氢酶的还原性作用,尤其中药提取物大多存在还原性,会造成假阳性或假阴性[13]。同时,加入MTT后孵育的时间较长,在损伤性实验中会延长药物的作用时间,不能准确反应损伤当时时间点的变化。另外,MTT检测方法不能用于形态学观察。而FDA检测方法能较好地克服上述问题。
本研究显示FDA在检测细胞增殖方面线性范围较宽,测得值与细胞量的相关系数较高,稳定性较好。FDA微孔板检测法简单,灵敏度与MTT检测法相当,但孵育时间短于MTT检测,更有利于观察细胞活力水平变化,尤其适用于损伤的快速检测。FDA还可同时观察细胞形态学的变化。FDA转化生成的荧光物质很稳定,可以数天不变。与离心技术相结合,FDA还可用于悬浮细胞的检测。
FDA也存在着一定的缺点和局限。FDA在细胞活力测定方面受pH影响较大。如果药物影响细胞内pH的变化,就可能影响FDA的测定结果。另外,FDA还受细胞外血清中酯酶的影响,需要洗去细胞外的酯酶以保证实验结果的准确性。FDA在水中可有自发性水解,分解出荧光素。如果以FDA在水中的分解速度为1,那么其在PBS、无血清DMEM培养基、含10%胎牛血清的DMEM培养基中的分解速度分别为1、300、3000。一些药物也可对FDA的分解及荧光淬灭产生影响。因此在实验中要设定合适的对照,以降低误差。
综上,FDA法检测细胞活力准确、快速,可适用于多种条件下的细胞活力检测,适用于大量样品的评价。采用该检测方法亦可将荧光检测的灵敏性与微孔板相结合,实现快速、精确定量的细胞活性分析。
[1]Johnson S,Nguyen V,Coder D. Assessment of cell viability[J]. Curr Protoc Cytom,2013,Chapter 9:Unit 9.2.
[2]Guilini C,Baehr C,Schaeffer E,et al. New fluorescein precursors for live bacteria detection[J]. Anal Chem,2015,87(17):8858- 8866.
[3]Fishman JM,Lowdell MW,Urbani L,et al. Immunomodulatory effect of a decellularized skeletal muscle scaffold in a discordant xenotransplantation model[J]. Proc Natl Acad Sci U S A,2013,110(35):14360- 14365.
[4]Rotman B,Papermaster BW. Membrane properties of living mammalian cells as studied by enzymatic hydrolysis of fluorogenic esters[J]. Proc Natl Acad Sci U S A,1966,55(1):134- 141.
[5]Medzon EL,Brady ML. Direct measurement of acetylesterase in living protist cells[J]. J Bacteriol,1969,97(1):402- 415.
[6]Bozyczko-Coyne D,McKenna BW,Connors TJ,et al.A rapid fluorometric assay to measure neuronal survivalinvitro[J]. J Neurosci Methods,1993,50(2):205- 216.
[7]Amano T,Ki H,O’Donohue MJ,et al. A versatile assay for the accurate,time-resolved determination of cellular viability[J]. Anal Biochem,2003,314(1):1- 7.
[8]Larsson R,Nygren P. Pharmacological modification of multi-drug resistance (MDR)invitrodetected by a novel fluorometric microculture cytotoxicity assay. Reversal of resistance and selective cytotoxic actions of cyclosporin A and verapamil on MDR leukemia T-cells[J]. Int J Cancer,1990,46(1):67- 72.
[9]Ishaque AB,Timmons C,Ballard FV,et al.Cytotoxicity of dinitrotoluenes (2,4-dNT,2,6-DNT) to MCF- 7 and MRC- 5 cells[J]. Int J Environ Res Public Health,2005,2(2):304- 307.
[10]Keshelava N,Frgala T,Krejsa J,et al.DIMSCAN:a microcomputer fluorescence-based cytotoxicity assay for preclinical testing of combination chemotherapy[J]. Methods Mol Med,2005,110:139- 153.
[11]Villman K,Blomqvist C,Larsson R,et al.Predictive value ofinvitroassessment of cytotoxic drug activity in advanced breast cancer[J]. Anticancer Drugs,2005,16(6):609- 615.
[12]Zhang Y,Hwang HM,Ekunwe S. Comparing cytotoxicity and genotoxicity in HaCaT cells caused by 6-aminochrysene and 5,6-chrysenequinone under ultraviolet A irradiation[J]. Environ Toxicol Chem,2006,25(7):1920- 1925.
[13]Han M,Li JF,Tan Q,et al. Limitations of the use of MTT assay for screening in drug discovery[J]. J Chin Pharma Sci,2010,19(3):195- 200.
Fluorescein Diacetate Microplate Assay in Cell Viability Detection
CHEN Xi,YANG Xiu-ying,FANG Lian-hua,DU Guan-hua
Beijing Key Laboratory of Drug Target Identification and Drug Screening,Institute of Materia Medica,CAMS and PUMC,Beijing 100050,China
YANG Xiu-ying Tel:010- 63165313,E-mail:lucia@imm.ac.cn
Objective To investigate the application of the fluorescein diacetate (FDA) microplate assay in cell viability detection. Methods Cells were seeded in a 96-well culture plate until detection. After incubated with FDA,the plate was detected by fluorescence microplate analyzer. The effects of FDA incubation duration,concentration,and other factors on the assay’s accuracy and stability were assessed. We also compared the results of FDA with methyl thiazolyl(MTT) in terms of cell numbers and H2O2injury. Results Within 0- 30 minutes,the fluorescence-cell number coefficient of FDA assay increased with duration and reached 0.99 in 27- 30 minutes. The optimum concentration of final FDA in this study was 10- 30 μg/ml. On cell viability detection,the result of FDA method was equivalent to MTT method. As to H2O2injury assay,the sensitivity of FDA method was superior to MTT on the higher concentration H2O2treatment due to a relative shorter duration for detection. Conclusion As a stable and reliable method,FDA is feasible for cell variability detection under varied conditions.
fluorescein diacetate;fluorescence;microplate assay;cell viability;methyl thiazolyl;cytotoxicity
国家自然科学基金(81470159)和 中国医学科学院医学与健康科技创新工程(2016-I2M- 3- 007)Supported by National Natural Sciences Foundation of China (81470159),and CAMS Initiative for Innovative Medicine (CAMS-I2M) (2016-I2M- 3- 007)
杨秀颖 电话:010- 63165313,电子邮件:lucia@imm.ac.cn
Q33;R331
A
1000- 503X(2016)06- 0710- 05
10.3881/j.issn.1000- 503X.2016.06.014
2015- 12- 25)

