DNA结合分化抑制蛋白1和基质金属蛋白酶9在结直肠癌中的表达及与微血管密度的相关性
武雪亮,薛 军,王立坤,杨东东,屈 明,郭 飞,孙光源,韩 磊,杨瑞敏
河北北方学院 附属第一医院 1血管腺体外科 2超声医学科,河北张家口 075000
·论 著·
DNA结合分化抑制蛋白1和基质金属蛋白酶9在结直肠癌中的表达及与微血管密度的相关性
武雪亮1,薛 军1,王立坤2,杨东东1,屈 明1,郭 飞1,孙光源1,韩 磊1,杨瑞敏2
河北北方学院 附属第一医院1血管腺体外科2超声医学科,河北张家口 075000
目的 探讨结直肠癌组织中DNA结合分化抑制蛋白1(Id- 1)和基质金属蛋白酶9(MMP- 9)的表达及其与肿瘤微血管生成、临床病理指标的相关性。方法 应用免疫组织化学染色法检测50例结直肠癌组织和50例癌旁正常组织中Id- 1和MMP- 9的表达,以及CD34标记的微血管密度(MVD)情况。结果 Id- 1和MMP- 9在结直肠癌组织中阳性表达为72.00%(36/50)、78.00%(39/50),显著高于癌旁正常组织的24.00%(12/50)、28.00%(14/50)(P=0.000);结直肠癌组织中MVD值为17.22±2.08,明显高于癌旁正常组织5.36±2.17(P=0.000);Id- 1、MMP- 9和MVD均与肿瘤浆膜浸润、TNM分期、癌胚抗原(+)、脉管浸润、淋巴结转移及肝转移相关(P均<0.05),而与年龄、性别、肿瘤大小、分化程度无关(P均>0.05);癌组织中Id- 1和MMP- 9阳性表达组MVD值显著高于阴性组(P均=0.000);结直肠癌组织中Id- 1与MMP- 9呈明显正相关性(r=0.429,P=0.000);生存分析显示:Id- 1与MMP- 9表达与结直肠癌患者预后关系密切,二者高表达提示预后不良。结论 Id- 1、MMP- 9高表达与结直肠癌的发生演进高度相关,并与MVD呈正相关,二者可能共同参与了肿瘤微血管的生成、肿瘤的浸润及血行转移。
结直肠癌;DNA结合分化抑制蛋白1;基质金属蛋白酶9;微血管密度;相关性
ActaAcadMedSin,2016,38(6):696-701
最新流行病学研究显示:未来5年我国结直肠癌新发病率呈逐年上升趋势,且发病年龄有提前趋势,严重危害国民健康,手术联合放化疗、免疫治疗等针对性的治疗并不理想,结直肠癌患者术后5年生存率仍在50%~60%[1- 2]。肿瘤的治疗强调早期发现,根治手术、术后积极复查监测预防复发转移[3- 4],因而寻找特异性高的生物学指标对结直肠癌的早期诊断、术后防治及应用相应的分子靶向治疗有重要的价值。Benezra[5]于1990年首次从小鼠红白血病细胞中克隆出DNA结合分化抑制蛋白1(inhibitors of DNA binding- 1,Id- 1)基因,并通过小鼠实验发现其可阻断未成熟细胞的定向分化,促进胚胎和器官形成,加速细胞增殖,诱导肿瘤血管生成,促进肿瘤的生长及侵袭。近年研究表明,Id- 1的异常表达与乳腺癌、食管癌、胃癌、肝细胞癌、宫颈癌、脑膜瘤等多种恶性肿瘤的发生、进展及预后密切相关,但在结直肠癌中研究较少,且与结直肠癌血行转移等恶性生物学的关系尚不明确[6- 9]。基质金属蛋白酶(matrix metalloproteinase,MMP)家族在肿瘤细胞的侵袭和浸润中的作用已被广大学者认同,MMP- 9是MMP家族中与恶性肿瘤联系最为密切的因子之一,能够降解Ⅰ、Ⅲ、Ⅳ、Ⅴ、Ⅶ、Ⅹ、Ⅺ型胶原及层黏连蛋白、蛋白聚糖等,诱导肿瘤细胞突破基底膜致其浸润,而且能促进肿瘤微血管的形成,加速血行转移[10]。CD34特异性表达于肿瘤新生血管内皮细胞,在淋巴管细胞中无表达,因而CD34能准确监测癌组织内的微血管密度(microvessel density,MVD),反映血管新生状况。本研究通过对Id- 1、MMP- 9和MVD行免疫组织化学染色分析,探讨三者之间及其与结直肠癌临床相关病理的联系,为探索结直肠癌发生、血行转移的机制及抗血管浸润治疗提供科学依据。
对象和方法
对象 选取2014年5至12月河北北方学院附属第一医院血管腺体外科手术切除的原发性结直肠癌组织50例、癌旁正常组织50例,癌组织取自癌灶中心处,另取标本残端切缘经病理证实为正常肠组织,术前未行新辅助放化疗等针对性治疗。男∶女:32∶18,年龄33~71岁,平均(51±2.9)岁。
免疫组织化学染色方法 10%福尔马林固定组织标本,并用石蜡包埋,切片厚度为4 μm。使用苏木精-伊红染色方法,病理诊断。切片经过80℃烤箱烤片30 min,乙醇脱水,灭活内源性过氧化物酶,枸橼酸缓冲液高温高压水化修复;PBS洗3次,加一抗(兔抗人单克隆浓缩型Id- 1抗体、鼠抗人浓缩型MMP- 9单克隆抗体),4℃过夜;PBS洗3次,加二抗。室温下使用DAB显色试剂显色,根据显微镜下观察的显色情况控制显示时间,苏木精轻度复染,并用1%的盐酸乙醇分化5 min、流水冲5 min、梯度乙醇脱水(80%、85%、90%、95%、100%、100%)及松节油透明5 min,最后树胶封片。阴性对照为PBS代替一抗。
Id- 1、MMP- 9阳性判定标准 Id- 1和MMP- 9均以细胞浆中出现棕黄色颗粒为阳性表达,根据着色细胞占视野细胞总数的百分比及着色细胞染色强弱评分≤5%为0分,6%~25%为1分,26%~50%时为2分,51%~75%时为3分,>75%时为4分;阴性:0分;弱(+):1分;中(++):2分;强(+++):3分。两者相乘,0分为(-),1~4分为(+),5~8分为(++),9~12分为(+++),(+)~(+++)均视为阳性。
微血管密度检测 应用CD34抗体(美国Abnova公司)标记染色于肿瘤微血管内皮细胞的胞质和细胞核,以孤立的棕黄色内皮细胞或内皮细胞簇团作为一个微血管并计数;先在40倍光镜下选出4个脉管最密集的区域(即密集热点区),后换400倍光镜下将着色的单个及集簇的内皮细胞记为观察区,计数取其平均值即为MVD值[11]。
统计学处理 采用SPSS 17.0统计软件分析数据,用百分率表示计数资料,运用χ2检验表示Id- 1和MMP- 9的表达与临床病理参数关系,用均数±标准差表示计量资料,两组独立样本运用t检验表示MVD值与临床病理参数的关系,两组以上独立样本运用方差分析表示MVD值与临床病理参数的关系,相关性分析采用Spearmen检验,生存分析采用Kaplan-Meier法绘制曲线,对影响生存预后的联合效应采用Cox回归模型行多因素分析,设α=0.05为检验水准。
结 果
Id- 1和MMP- 9在结直肠癌中的表达 Id- 1在结直肠癌组织中的阳性表达为72.00%(36/50),明显高于癌旁正常组织中的阳性表达24.00%(12/50)(χ2=23.431,P=0.000);MMP- 9在结直肠癌组织中的阳性表达为78.00%(39/50),明显高于癌旁正常组织中的阳性表达28.00%(14/50)(χ2=18.944,P=0.000);结直肠癌组织中MVD值为17.22±2.08,明显高于癌旁正常组织中MVD值5.36±2.17(t=21.640,P=0.000)(图1)。
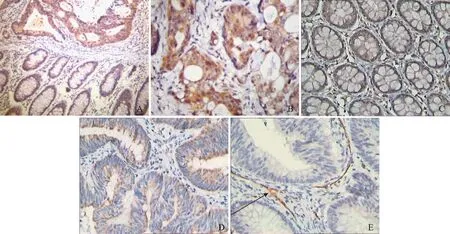
Id- 1:DNA结合分化抑制蛋白1;MMP- 9:基质金属蛋白酶9;MVD:微血管密度
Id- 1:inhibitors of DNA binding- 1;MMP- 9:matrix metalloproteinase- 9;MVD:microvessel density
图 1 免疫组织化学法检测结直肠正常组织(A)及结直肠癌组织(B)中Id- 1的表达,结直肠正常组织(C)及结直肠癌组织(D)中MMP- 9的表达,结直肠癌组织中CD34标记的MVD(箭头)表达情况(E)(×400)
Fig 1 Expression of Id- 1 in normal tissue(A) and colorectal carcinoma tissues (B),expression of MMP- 9 in normal tissue(C) and colorectal carcinoma tissues (D),and the MVD(arrow) marked by CD34 in colorectal carcinoma tissues (E) by immunohistochemistry (×400)
Id- 1和MMP- 9蛋白的表达及MVD值临床病理参数间的关系 Id- 1、MMP- 9和MVD的表达水平均与肿瘤浆膜浸润、TNM分期、癌胚抗原(+)、脉管浸润、淋巴结转移及肝转移相关(P均<0.05)(表1)。
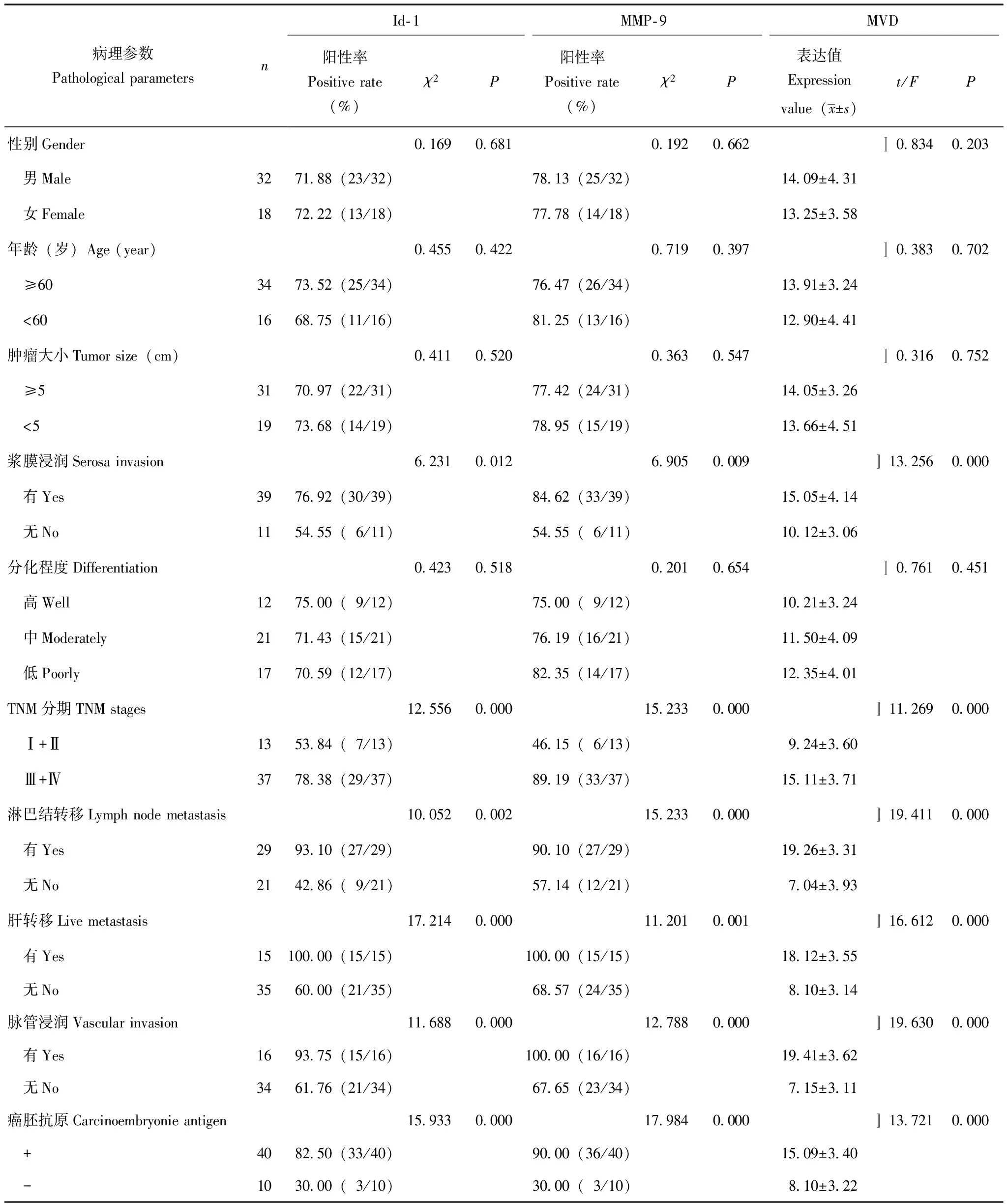
表 1 Id- 1和MMP- 9表达及MVD值与临床病理参数的关系
Id- 1和MMP- 9在结直肠腺癌中的表达与MVD的关联 结直肠癌中Id- 1阳性者MVD值18.09±4.25,Id- 1阴性者MVD值9.21±3.42(t=18.51,P=0.000);结直肠癌中MMP- 9阳性者MVD值19.98±3.27,MMP- 9阴性者MVD值9.11±2.09(t=22.16,P=0.000)。
Id- 1和MMP- 9在结直肠癌中表达的相关性 Id- 1和MMP- 9在结直肠癌中的表达呈明显正相关(r=0.429,P=0.000)(表2)。
预后生存分析及结直肠癌的独立预后因素分析 Cox回归模型分析显示,Id- 1表达水平(RR=1.193,P=0.002)、MMP- 9表达水平(RR=2.215,P=0.001)均是影响结直肠癌患者预后的独立因素,Kaplan-Meier法绘制曲线提示Id- 1和MMP- 9表达阳性的结直肠癌患者生存时间均明显降低(图2、3)。
讨 论
Id- 1系螺旋-环-螺旋(helix-loop-helix,HLH)转录因子家族重要成员,其广泛表达于哺乳动物的胚胎、生殖腺体及一些分化不成熟的组织细胞中,在正常组织中呈微量表达或不表达状态,而在诸多恶性肿瘤及体外培养的肿瘤细胞系中高表达,且与肿瘤的恶性潜能及预后相关[12]。HLH结构存在一个碱性HLH(bHLH)结构域与其相邻,二者相互结合形成异质二聚体,其碱性区与靶DNA结合,诱导启动子中的E-盒样结构的靶基因转录并整合成所谓的“E-box”DNA序列,从而调控细胞增殖分化。而Id- 1无碱性结构域,与bHLH因子结合生成的二聚体无转录功能,因而无法与相应DNA序列结合,从而抑制细胞分化增殖[13]。视网膜细胞瘤蛋白(Rb)是细胞分裂周期中重要的调控因子,磷酸化的Rb蛋白能与E2F解离,而游离的E2F能诱导肿瘤细胞进入不断增殖状态。Id- 1表达上调可与Ets结合阻断p16(INK4a)表达,从而激活CDK4/6,促进Rb蛋白的磷酸化;Id- 1还能直接与E2F结合形成异质二聚体,激活CDK2诱导Rb蛋白磷酸化,从而促进G1/S期细胞增殖,使细胞周期分裂顺利持续进行[14]。此外,Id- 1表达上调能激活Raf- 1及丝裂原活化蛋白激酶激酶信号传导途径,抑制细胞凋亡,参与肿瘤发生发展[15]。
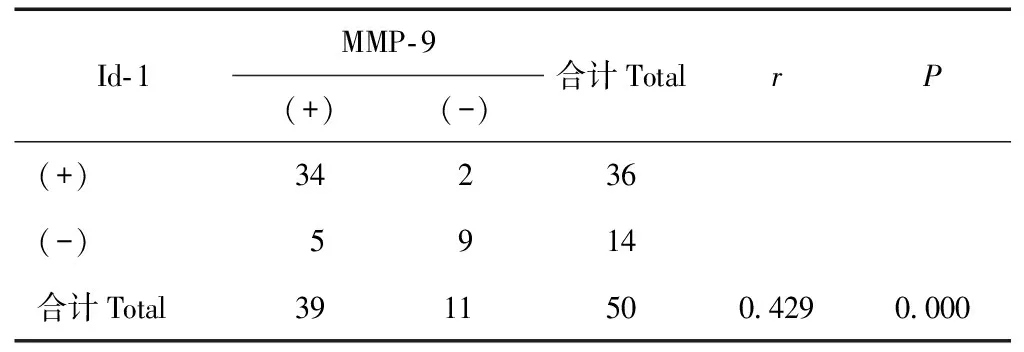
表 2 结直肠癌组织Id- 1和MMP- 9表达的相关性(n)
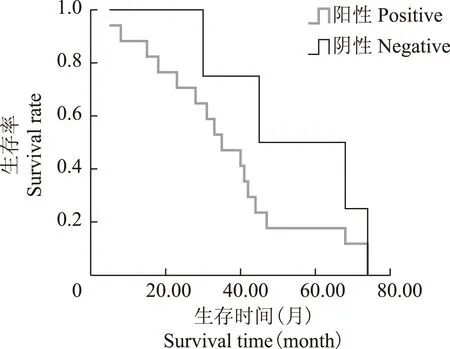
图 2 结直肠癌患者Id- 1表达与生存期的相关性
Fig 2 Relationship between the expression of Id- 1 and the survival time
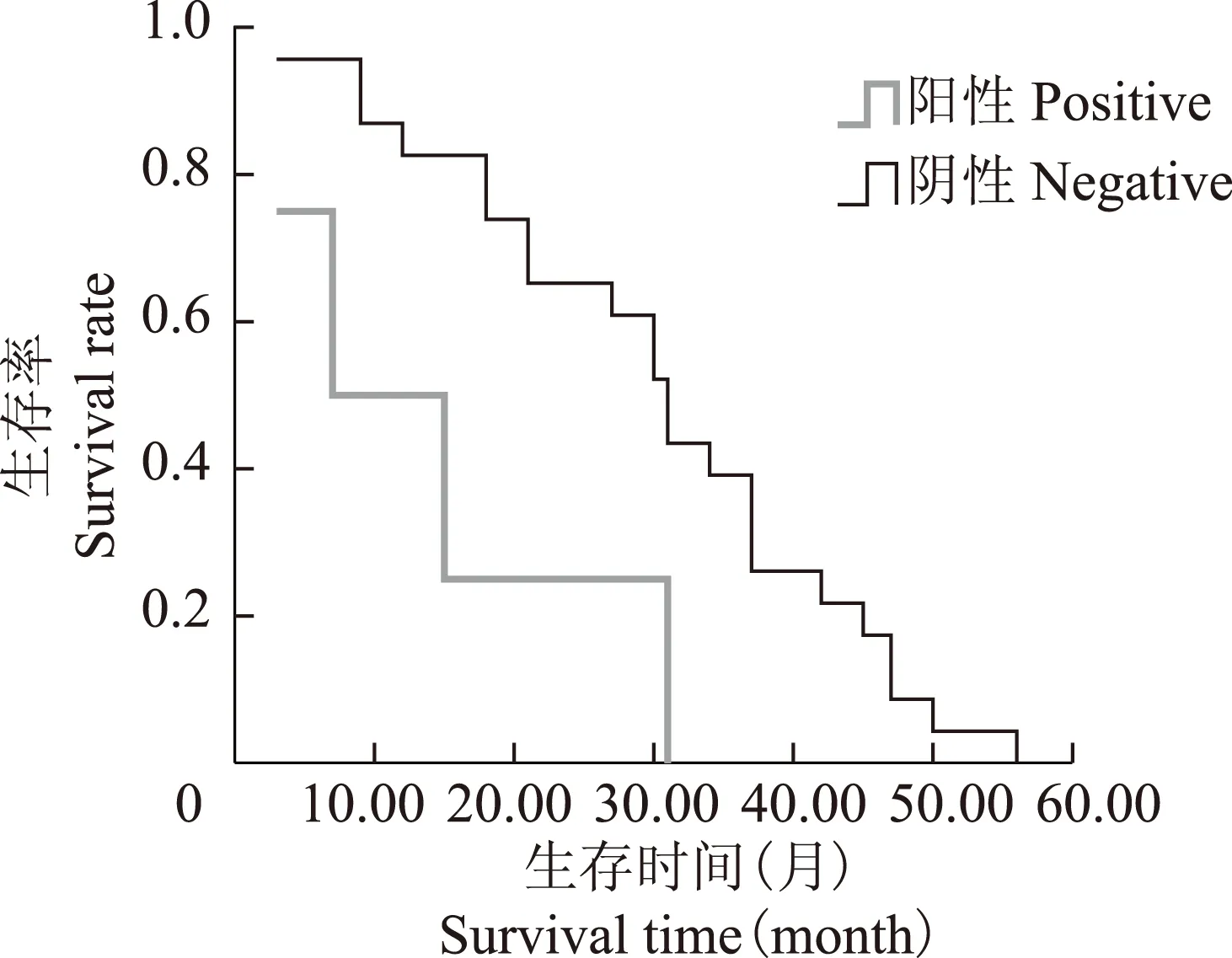
图 3 结直肠癌患者MMP- 9表达与生存期的相关性
Fig 3 Relationship between the expression of MMP- 9 and the survival time
MMP- 9能够降解各型胶原、层黏连蛋白、蛋白聚糖等,在乳腺癌、胃癌、肝癌、卵巢癌、子宫内膜癌、甲状腺癌等多种恶性肿瘤的发生、进展、转移过程中发挥重要作用。MMP- 9能打破基质的降解平衡、诱导癌细胞穿透细胞外基质与基底膜构成的屏障,同时降低细胞间的黏附力,从而使癌细胞向周围组织浸润、侵袭并转移到远处器官;此外,在降解过程中MMP- 9与血管内皮生长因子具有协同作用,共同促使细胞外基质中储存的血管内皮生长因子大量释放,诱导肿瘤新生血管形成,为肿瘤细胞的增殖与浸润提供必要的营养基础与途径[16]。
本研究显示Id- 1和MMP- 9在结直肠癌组织中表达明显高于癌旁正常组织,且与肿瘤的浆膜浸润、TNM分期、淋巴结转移、肝转移及脉管浸润密切相关,支持Id- 1和MMP- 9促进肿瘤恶性生物学进程的理论。MVD是评价肿瘤血管生成重要指标,能够准确反映肿瘤血管生成状况,本研究表明结直肠癌组织中MVD值明显高于癌旁正常组织,同时在Id- 1和MMP- 9的不同表达中MVD值差异具有统计学意义,与胡斌等[17]研究结果基本一致。研究证实将PD98059导入转移的乳腺癌细胞中抑制Id- 1的表达,发现MMP- 9、MT1-MMP及血管内皮生长因子表达水平均随之下降,肿瘤细胞的侵袭能力亦明显降低[18];Kim等[19]通过对乳腺癌转移细胞的研究显示,抑制Id- 1的表达,MMP- 9、MMP- 14等表达水平明显下降,且显微镜下显示癌灶及周围间质内的血管呈大量坏死状态,进一步基底膜侵袭模型实验表明其侵袭能力随之显著抑制,表明Id- 1通过抑制MMP- 9、血管内皮生长因子等表达,抑制肿瘤微血管生成、癌细胞浸润和侵袭,这一点在前列腺癌细胞中也得到了体现[20]。此外,通过生存分析显示Id- 1和MMP- 9与结直肠癌患者预后关系密切,二者高表达均提示预后较差。
综上,Id- 1的异常表达参与结直肠癌的发生、演进,并参与基底膜的降解破坏及血行浸润等恶性生物学行为,且与结直肠癌患者预后相关,因而研制抑制Id- 1的靶向药物将有望成为治疗结直肠癌的重要基因手段。
[1]汪建平. 结直肠癌治疗临床研究新热点[J]. 中华外科杂志,2014,52(11):801- 802.
[2]孙德聪,茅慧,王治宽,等. 影响Ⅲ期结直肠癌预后的相关因素分析[J]. 中国医学科学院学报,2015,37(5):549- 556.
[3]中国抗癌协会大肠癌专业委员会专家组. 结直肠癌肝转移转化治疗中靶向药物合理应用的专家指导意见[J]. 中华胃肠外科杂志,2013,16(10):1000- 1004.
[4]李志红,皮亚平. 不同术式治疗结直肠癌患者临床疗效[J]. 中华实验外科杂志,2013,30(7):1522- 1524.
[5]Benezra R,Davis RL,Lochshon D,et al.The protein Id:anegative regulator of helix-loop-helix DNA binding protein[J].Cell,1990,61(1):49- 59.
[6]Kubelac MP,Fetica B,Vlad IC,et al. The role of inhibitor of DNA-binding 1 (ID- 1) protein and angiogenesis in serous ovarian cancer[J]. Anticancer Res,2014,34(1):413- 416.
[7]Yang S,Guo LJ,Tang XF,et al. The alteration of Id- 1 and TSP- 1 expression in mucoepidermoid carcinoma associated with its clinical features and prognosis[J]. Int J Oral Maxillofac Surg,2010,39(1):29- 35.
[8]Ma H,Wei Y,Leng Y,et al. TGF-b1-induced expression of Id- 1 is associated with tumor progression in gastric cancer[J]. Med Oncol,2014,31(7):10- 19.
[9]Sharma P,Patel D,Chaudhary J. Id- l and Id- 3 expression is associated with increasing grade of prostate cancer:Id- 3 preferentially regulates CDKNlB[J]. Cancer Med,2012,l(2):187- 197.
[10]Georgiadou D,Sergentanis TN,Sakellariou S,et al. MMP- 9 and Id- 1 in pancreatic adenocarcinoma:prognostic significance and impact on angiogenesis[J].Eur J Surg Onc,2014,40(10):1331- 1337.
[11]史刚刚,郝敬鹏,王力,等. 结直肠癌组织中血管抑制蛋白1表达的临床意义及其与血管内皮生长因子A和微血管密度的相关性[J]. 中华胃肠外科杂志,2015,18(3):272- 276.
[12]马莉娟,何金彩,柴泽英,等. 细胞分化抑制因子- 1与细胞增殖核抗原Ki- 67在宫颈癌中的表达及相关性研究[J]. 中国临床药理学杂志,2015,31(8):627- 630.
[13]Liu P,Liu S,Qi H,et al. Effects of silencing Id- 1 in cell culture of human adenoid cystic carcinoma[J]. Oral Oncol,2009,45(9):783- 788.
[14]Lee JY,Kang MB,Jang SH,et al. Id- 1 activates Akt-mediated Wnt signaling and p27(Kip1) phosphorylation through PTEN inhibition[J]. Oncogene,2009,28(6):824- 831.
[15]Ciarroechi A,Piana S,Valcavi R,et a1.Inhibitor of DNA binding- 1 induces mesenchymal features and promotes invasiveness in thyroid tumour cells[J]. Eur J Cancer,2011,47(6):934- 945.
[16]Kim HC,Kim YS,Oh HW,et a1. Collagen triple helix repeat containing 1(CTHRCl) acts via ERK-dependent induction of MMP9 to promote invasion of colorectal cancer cells[J]. Oncotarget,2014,5(2):519- 529.
[17]胡斌,陈子华,陈志康,等. Id- 1和MMP- 9在人大肠癌组织中的表达及相关性研究[J]. 中国现代医学杂志,2010,20(17):2630- 2633.
[18]郭斌,张成梅,刘少华. Id- 1在恶性肿瘤发生中的作用及其机制[J]. 生命科学,2010,22(5):401- 404.
[19]Kim H,Chung H,Kim HJ,et al. Id- 1 regulates Bcl- 2 and Bax expression through p53 and NF-kB in MCF- 7 breast cancer cells[J]. Breast Cancer Res Treat,2008,112(2):287- 296.
[20]Asirvatham AJ,Carey JP,Chaudhary J. ID1-,ID2-,and ID3-regulated gene expression in E2A positive or negative prostate cancer cells[J]. Prostate,2007,67(13):1411- 1420.
Expressions of Inhibitors of DNA Binding- 1 and Matrix Metalloproteinase- 9 in Colorectal Adenocarcinoma Tissues and Their Correlations with Microvessel Density
WU Xue-liang1,XUE Jun1,WANG Li-kun2,YANG Dong-dong1,QU Ming1,GUO Fei1,SUN Guang-yuan1,HAN Lei1,YANG Rui-min2
1Department of Vascular Gland,2Department of Ultrasound,the First Affiliated Hospital of Hebei North University,Zhangjiakou,Hebei 075000,China
XUE Jun Tel:0313- 8046911,E-mail:yfyxuejun@163.com
Objective To explore the expressions of inhibitors of DNA binding- 1 (Id- 1) and matrix metalloproteinase- 9 (MMP- 9) in colorectal carcinoma tissues and its correlation with microvessel density (MVD). Methods The expressions of Id- 1 and MMP- 9 as well as CD34-labelled MVD in colorectal adenocarcinoma tissues (n=50) and normal adjacent tissues (n=50) were examined by immunohistochemistry. Results The positive expressions of Id- 1 and MMP- 9 were seen in 72.00% (36/50) and 78.00%(39/50) of colorectal adenocarcinoma tissues,which were significantly higher than those [24.00%(12/50) and 28.00% (14/50)] in normal adjacent tissues (P=0.000). The MVD value (17.22±2.08) in colorectal adenocarcinoma tissues was significantly higher than that (5.36±2.17) in normal adjacent tissues (P=0.000). The expressions of Id- 1 and MMP- 9 and MVD were significantly correlated with serosa invasion,TNM stage,carcinoembryonic antigen(+),lymph node metastasis,vascular invasion,and liver metastasis (allP<0.05) but not with the patient’s age,gender,tumor size,and differentiation degree (allP>0.05). The MVD value with Id- 1 and MMP- 9 positive expression were significantly higher than those with Id- 1 and MMP- 9 negative expression (allP=0.000). The expression of Id- 1 in colorectal adenocarcinoma tissues showed significantly positive correlation with that of MMP- 9 (r=0.429,P=0.000). Cox multivariate analysis showed that Id- 1 and MMP- 9 expressions were independent prognostic factors for colorectal carcinoma. Conclusions The high expressions of Id- 1 and MMP- 9 have high correlations with the development and progression of colorectal adenocarcinoma and have positive correlation with MVD. Both of them may be involved in the microvascular generation and the invasion and hematogenous metastasis of colorectal carcinoma.
colorectal cancer;inhibitors of DNA binding- 1;matrix metalloproteinase- 9;microvessel density;correlation
河北省卫生计生委医学科学研究重点课题(20150058)、河北省科技支撑计划项目(152777237)和河北省张家口市科技局指令性计划(1311055D) Supported by Medical Science Research Project From Hebei Province Health Department (20150058),Scientific Research Project From Scientific and Technology Agency (152777237),and Mandatory Planing Project from Scientific and Technology Bureau of Zhangjiakou (1311055D)
薛 军 电话:0313- 8046911,电子邮件:yfyxuejun@163.com
R735.37;R735.35
A
1000- 503X(2016)06- 0696- 06
10.3881/j.issn.1000- 503X.2016.06.011
2016- 03- 21)

