铁代谢异常在骨髓增生异常综合征中的临床价值
周开慧
(重庆市巴南区第二人民医院检验科 400054)
·论 著·
铁代谢异常在骨髓增生异常综合征中的临床价值
周开慧
(重庆市巴南区第二人民医院检验科 400054)
目的 探讨铁代谢异常改变对骨髓增生异常综合征(MDS)诊断和鉴别诊断的意义,以期为临床干预和预后提供重要参考。方法 回顾性分析该院115例MDS、80例再生障碍性贫血(AA)及100例健康体检者的临床基线资料,收集其外周血常规指标,血清铁蛋白和血清铁等铁代谢相关指标,并观察细胞化学铁染色、骨髓组织铁染色观察病理学形态,以及荧光原位杂交技术分析染色体核型。结果 MDS、AA和健康者间,在铁代谢指标如血清铁蛋白(SF)、血清铁(SI)、血清未饱和铁结合力(UIBC)、总铁结合力(TIBC)、可溶性转铁蛋白受体(sTfR)、转铁蛋白饱和度(TS)、铁粒幼红细胞等参数方面差异有统计学意义(P<0.05)。未接受红细胞输注组和应急性接受少量红细胞输注组的MDS患者,在SI、UIBC、TIBC、sTfR、TS、铁粒幼红细胞等参数方面差异有统计学意义(P<0.05)。结论 铁代谢指标具有简单易行且可重复检测的特点,是诊断铁过载和监测去铁治疗疗效的首选方法,可为MDS的临床辅助诊断、病情监测、预后评估等提供可靠的理论依据。
骨髓增生异常综合征; 铁代谢; 再生障碍性贫血
骨髓增生异常综合征(MDS)是起源于造血干细胞的一组异质性髓系克隆性疾病,特点是髓系细胞发育异常,表现为无效造血、难治性血细胞减少,高风险向急性髓系白血病(AML)转化[1-2]。近年来大量的研究表明,MDS患者常常伴随以不同程度的铁负荷过高的相关铁代谢障碍,红细胞输注依赖及铁超负荷不仅导致器官损害,也可直接损害造血系统功能,从而可能影响MDS患者的自然病程[3]。目前认为铁代谢障碍主要原因可能是由于MDS患者的无效造血和输血依赖,但迄今国内外对MDS铁代谢紊乱的研究主要集中在输血依赖性MDS患者,而对于单纯的无效造血即未接受红细胞输血或未形成输血依赖的MDS患者铁代谢状况鲜有研究[4-5]。为此,本研究从红细胞铁代谢的角度研究MDS患者骨髓内无效造血中铁代谢指标的改变和紊乱,并选取再生障碍性贫血(AA)患者和健康体检者为对照组,进一步明确MDS患者的铁代谢异常及其对临床的意义。
1 资料与方法
1.1 一般资料 2005~2015年本院门诊或住院部新确诊的115例MDS患者(MDS组)。按2008年世界卫生组织(WHO)标准对患者进行回顾性诊断和分型,其中难治性贫血伴单系发育异常(RCUD)18例,RA伴有环状铁粒幼红细胞(RARS)11例,难治性血细胞减少伴有多系发育异常(RCMD)43例,RA伴原始细胞增多(RAEB-1)22例,RA伴原始细胞增多(RAEB-2)18例,MDS伴单纯5q-1例,未分类MDS(MDS-U)2例。在本院随机选取80例再生障碍性贫血(AA)患者作为AA组,其诊断标准参考中华医学会血液学分会红细胞疾病(贫血)学组《再生障碍性贫血诊断治疗专家共识》[1]。随机抽取100例在本院健康体检者作为健康对照组。排除标准:先天性骨髓衰竭综合征患者;既往接受环孢素和抗人胸腺细胞球蛋白等免疫抑制剂治疗患者;既往使用抗肿瘤药物及放疗造成的继发性骨髓增生低下患者;感染、代谢异常、营养异常、自身免疫性疾病等造成骨髓增生低下的非血液系统疾病患者;肝、脾、淋巴结肿大患者;骨髓活检组织长度小于1 cm,镜下骨小梁间隙<4个的患者[6]。
1.2 仪器与试剂 各指标的测定均由本院检验科和骨髓室完成,正常值参照检验科及骨髓室的正常值参考范围。所有标本均由至少2位检验医师独立阅片,当诊断意见不一致的病例,共同商讨确定诊断。
1.3 方法 采用亚铁嗪比色法和放射免疫法测定患者血清铁(SI)、血清铁蛋白(SF)水平;采用固相夹心酶联免疫分析技术测定血清转铁蛋白(Tf)、可溶性转铁蛋白受体(sTfR);总铁结合力(TIBC)=转铁蛋白(Tf)/0.70;血清未饱和铁结合力(UIBC)=总铁结合力(TIBC)-血清铁(SI);铁饱和度(TS)=血清铁(SI)/总铁结合力(TIBC)×100%。采用普鲁士蓝染色法对骨髓组织铁染色并分级;利用荧光原位杂交技术对骨髓标本进行染色体核型分析,经过固定、脱水、杂交、洗脱和Rnase处理,最后在荧光显微镜下观察并分析结果。
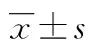
2 结 果
2.1 基线资料 115例MDS患者包括未接受红细胞输注者81例和应急性接受少量红细胞输注者34例,其中男76例,女39例,男女比为1.9∶1,中位年龄58.4岁。115例MDS患者中,出现脾脏肿大者62例(53.9%),肝脏肿大者7例(6.1%);在临床诊疗期间转急性白血病者21例(18.3%),其转白血病中位时间为2.8个月。80例AA患者中,均未出现脾脏肿大,但有出血倾向35例(43.8%)。100例健康体检者均无肝大、脾大,也无出血倾向。
2.2 外周血常规和铁代谢指标在MDS、AA和健康者间的比较MDS组、AA组及健康对照组在血红蛋白、红细胞、血小板等方面的差异有统计学意义(P<0.05);在SF、SI、UIBC、TIBC、sTfR、TS、铁粒幼红细胞等参数方面差异有统计学意义(P<0.05)。见表1。
2.3 红细胞输注对铁代谢指标的影响 未接受红细胞输注组和应急性接受少量红细胞输注组的MDS患者,在SF、SI、UIBC、TIBC、sTfR、TS、铁粒幼红细胞等参数方面差异有统计学意义(P<0.05)。为了排除红细胞输注对各组间铁代谢指标的影响,本研究采用方差分析,结果显示是否进行红细胞输注对SF差异有统计学意义(F=45.86,P<0.01),但对SI、UIBC、TIBC、sTfR、TS等指标影响不大。见表2。
2.4 荧光原位杂交(FISH)检测MDS组中有53例患者行FISH检测,结果42例(79.24%)出现染色体异常。对MDS通过国际预后积分系统(IPSS-R)分组,53例MDS患者中,极低危组2例,低危组13例,中危组26例,高危组10例,极高危组2例,各组之间的在铁代谢指标如SF、SI、UIBC、TIBC、sTfR、TS、铁粒幼红细胞、细胞内外铁水平均差异无统计学意义(P>0.05),但中高危组的各个指标均值要高于低危组,呈增高趋势。

表1 外周血常规和铁代谢指标在MDS、
注:与对照组相比较,*P<0.05;与AA组相比较,#P<0.05。
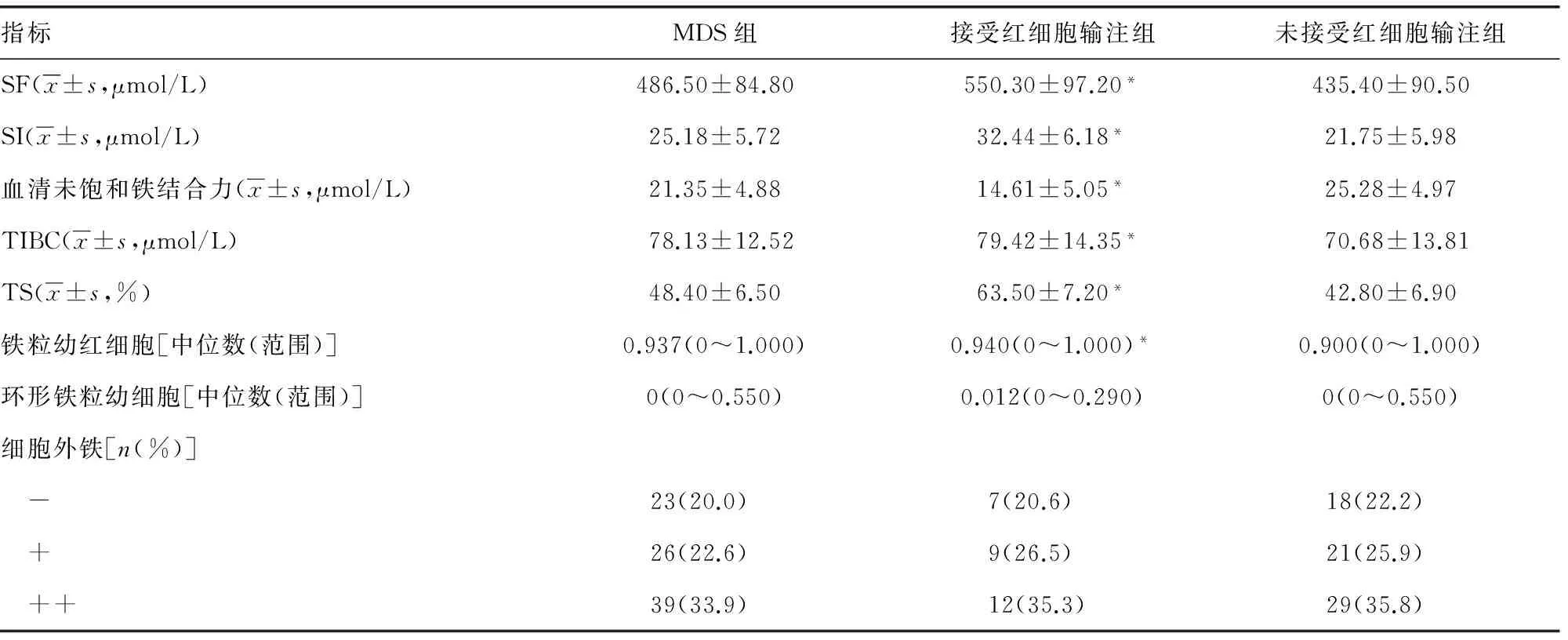
表2 MDS亚组间患者的铁代谢相关指标和铁染色检测结果
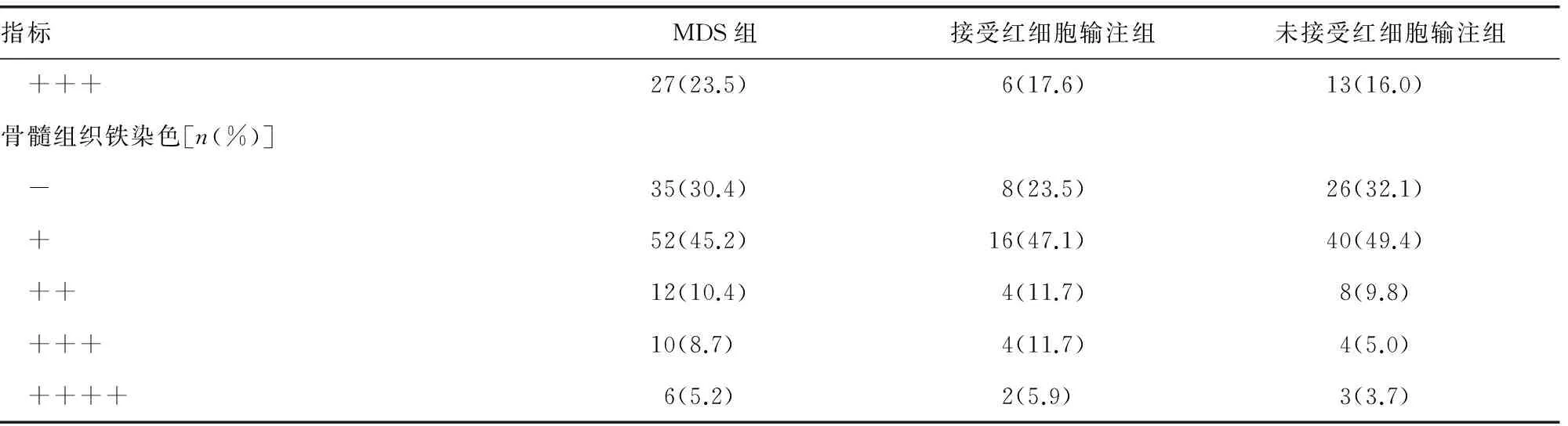
续表2 MDS亚组间患者的铁代谢相关指标和铁染色检测结果
注:与未接受红细胞输注组相比较,*P<0.05。
3 讨 论
MDS是一组以无效造血为主要病理特征的疾病,大约80%的MDS患者会表现出不同程度的贫血,其代偿机制主要是通过肠道代偿性吸收过多的铁以满足造血需要[7]。超过40%MDS患者逐渐进展为红细胞输注依赖,但随着大量外源性红细胞输注的增加,同时伴随肠道铁吸收的代偿性增加,导致机体继发性铁负荷过载的发生,将严重影响患者的生存质量和生活质量[8]。在对非输血依赖的MDS患者,无效造血可能既是引起贫血的原因,也是引起机体铁代谢紊乱的主要原因。因此,研究贫血患者铁代谢的病理学和临床血液学表现,是当前血液造血系统疾病亟待解决的重要科学问题,将有助于制订更为优化的诊疗策略和作出精准的临床决策[9]。
SF、TF、TIBC和SI等血清铁代谢指标能够定量评价机体铁的状态,而准确估计机体铁状态是临床上鉴别其他类型缺铁性贫血与慢性病贫血伴缺铁的关键[10]。其中以缺铁性贫血和慢性病贫血伴缺铁是临床上最常见的两类贫血,形态上均表现为小细胞低色素性,骨髓形态学上极易误诊[11]。本文研究发现,在MDS组、AA组及健康对照组中,铁代谢指标与骨髓检查的临床诊断一致性较高。结果显示,MDS患者总体和未接受红细胞输注的患者SF值明显高于健康体检者,提示MDS的无效造血可导致铁负荷过载,红细胞输注则进一步加速和恶化铁在体内的蓄积,加重铁代谢紊乱[12]。这可能与SF也是急相反应蛋白有关,慢性病贫血伴缺铁的炎症状况可使其升高,因此,不能有效判断出慢性病贫血伴缺铁的情况。由此可见,SF、TIBC、TF及SI等铁代谢指标对单纯性缺铁性贫血的实用价值更大,骨髓铁染色仍然是鉴别铁缺乏最可靠的方法[13]。因此,当面对MDS等贫血患者时要综合多学科团队充分评估骨髓造血功能状态,不仅要在诊疗前制订全面综合的评估计划,在临床干预阶段,要实时动态多次监测机体铁代谢、脏器功能状态等相关的重要指标,有助于控制铁过载、保护器官功能,延长患者生存时间[14]。
本研究发现,就诊前未接受红细胞输注的MDS患者SF值与患病时间无关,这表明患者通过肠道吸收的铁并未随患病时间的延长而相应增加[15]。同时,也发现这组患者中原始粒细胞比例<0.05者SF值增高,由此,推测在低危MDS患者中可能存在造成铁过载的其他机制。本研究在光镜下观察发现,MDS组中细胞内外铁增多的患者骨髓小粒可染铁主要呈球菌状分布,是无效造血在形态上的一种表现,可能与线粒体酶的缺陷有关也可能与原位溶血有关,其出现机制有待进一步研究证实[16]。
幼红细胞膜上的TfR是摄铁的主要通道,sTfR作为TfR的酶切形式,与转铁蛋白受体呈正相关。研究认为,在缺铁状况下,sTfR直接反映机体的铁储存量,而在不缺铁的情况下,该指标可用来评价骨髓红系造血功能及某些情况下整体骨髓造血,可以间接反映骨髓幼红细胞比例[17]。本研究结果显示,MDS患者的sTfR的变化与健康患者相比较,差异无统计学意义(P>0.05);而AA患者的sTfR的变化与健康者相比较,差异有统计学意义(P<0.05)。三组间sTfR的差异表明,sTfR水平在评价MDS患者骨髓造血功能方面存在缺陷,其原因可能是由于MDS存在不同程度的无效造血,致骨髓幼稚红细胞发育异常,其表面转铁蛋白受体表达数目差异较大,或增加或减少或正常,由此推测与MDS异质性疾病本身有关,不能真实地反映骨髓增生程度及幼红细胞比例[6]。为此,Matsuda等[17]提出了sTfR-E新指标,公式为sTfR-E=血清可溶性转铁蛋白受体水平/[骨髓造血组织有核细胞量(%)×骨髓幼红细胞数(%)],在其研究中表明MDS患者的sTfR-E值小于AA患者,并通过流式细胞术证实MDS患者单个幼红细胞膜上的TfR受体数目表达减少,而AA患者单个幼红细胞上的膜受体数明显增加,且高于健康者,该指标在一定程度上间接反映了单个幼红细胞膜表面的TfR数量。因此,应该将sTfR、骨髓造血组织增生程度、幼红细胞比例三者综合起来考虑,更全面真实地评价MDS患者骨髓增生程度及评价骨髓造血,特别是在鉴别诊断AA和MDS上有重要价值[18]。
SF和TS等无创性检测手段已逐渐成为临床诊断铁过载和监测去铁治疗疗效的方法,其具有简单易行、相对便宜且可重复检测的特点,是诊断铁过载和监测去铁治疗疗效的首选方法,通过研究MDS未输血患者和输血患者的铁代谢指标变化,为更进一步明确骨髓无效造血特点及为临床的辅助诊断、病情监测、预后评估等提供可靠的理论依据。
[1]中华医学会血液学分会.骨髓增生异常综合征诊断与治疗中国专家共识(2014年版)[J].中华血液学杂志,2014,35(11):1042-1048.
[2]Garcia-ManeroG.Myelodysplasticsyndromes:2015Updateondiagnosis,risk-stratificationandmanagement[J].AmJHematol,2015,90(9):831-841.
[3]中华医学会血液学分会,中国医师协会血液科医师分会.铁过载诊断与治疗的中国专家共识[J].中华血液学杂志,2011,32(8):572-574.
[4]GangatN,PatnaikMM,TefferiA.Myelodysplasticsyndromes:contemporaryreviewandhowwetreat[J].AmJHematol,2016,91(1):76-89.
[5]中华医学会儿科学分会血液学组,《中华儿科杂志》编辑委员会.儿童骨髓增生异常综合征诊断与治疗中国专家共识(2015年版)[J].中华儿科杂志,2015,53(11):804-809.
[6]覃霞,BaumannI,陈静,等.130例骨髓增生异常综合征(难治性血细胞减少)和获得性再生障碍性贫血患儿的临床及病理特征分析[J].中华血液学杂志,2014,35(8):713-718.
[7]TaranSJ,TaranR.Roleofironchelationinimprovingsurvival:Anintegralpartofcurrenttherapyformyelodysplasticsyndromes[J].SouthAsianJCancer,2015,4(4):186-188.
[8]彭碧,曾白华,陈小红.铁代谢相关血清学指标在贫血诊断中的应用价值[J].国际检验医学杂志,2014,35(5):552-554.
[9]ChamseddineAN,JabbourE,KantarjianHM,etal.UnravelingMyelodysplasticSyndromes:CurrentKnowledgeandFutureDirections[J].CurrOncolRep,2016,18(1):4.
[10]KawaiN,MatsudaA,JinnaiI,etal.Proposalofcriteriafordyserythropoiesisinthediagnosisofmyelodysplasticsyndromes[J].IntJHematol,2016,103(2):227-233.
[11]BurgstallerS,WiesingerP,StauderR.Myelodysplasticsyndromesintheelderly:treatmentoptionsandpersonalizedmanagement[J].DrugsAging,2015,32(11):891-905.
[12]董海波,谢品浩,袁翠英,等.病态造血在骨髓增生异常综合征诊断中的意义[J].检验医学与临床,2016,13(5):685-688.
[13]RemachaF,ArrizabalagaB,VillegasA,etal.Evolutionofironoverloadinpatientswithlow-riskmyelodysplasticsyndrome:ironchelationtherapyandorgancomplications[J].AnnHematol,2015,94(5):779-787.
[14]陈梅,顾俊,陆弘逾,等.骨髓增生异常综合征输血依赖患者铁代谢状况分析[J].实用临床医学,2016,17(1):1-4.
[15]WoodJC.Estimatingtissueironburden:currentstatusandfutureprospects[J].BrJHaematol,2015,170(1):15-28.
[16]邢丽丽,秦卫玲,窦敬芳,等.细胞形态学异常在骨髓增生异常综合征的诊断价值[J].河南科技大学学报(医学版),2016,34(1):12-15.
[17]MatsudaA,JinnaiI,IwanagaM,etal.CorrelationbetweendysplasticlineageandtypeofcytopeniainmyelodysplasticsyndromespatientswithrefractoryanemiaaccordingtotheFABclassification[J].AmJClinPathol,2013,140(2):253-257.
[18]TaranSJ,TaranR.Roleofironchelationinimprovingsurvival:Anintegralpartofcurrenttherapyformyelodysplasticsyndromes[J].SouthAsianJCancer,2015,4(4):186-168.
Clinical value of iron metabolism disorder in myelodysplastic syndrome
ZHOUKaihui
(DepartmentofClinicalLaboratory,Ba′nanDistrictSecondPeople′sHospital,Chongqing400054,China)
Objective To explore the significance of abnormal changes of iron metabolism on the diagnosis and differential diagnosis in myelodysplastic syndrome (MDS) so as to provide an important reference for clinical intervention and prognosis.Methods The clinical baseline data from 115 cases of MDS,80 cases of aplastic anemia (AA) and 100 subjects undergoing physical examination in our hospital were retrospectively analyzed.The data of peripheral blood routine indicators and iron metabolism related indicators of serum ferritin(SF) and serum iron(SI) were collected.The pathological morphology was observed by bone marrow tissue ion staining,cellular chemical iron staining and bone marrow tissue iron staining.And the chromosome karyotypes were also observed.Results There was statistically significant difference (P<0.05) among MDS,AA and healthy subjects in the respects of iron metabolism indexes including SF,SI,unsaturated iron binding force (UIBC),total iron binding force (TIBC),soluble transferrin receptor (sTfR),transferrin saturation (TS) and sideroblasts.Similarity,the MDS patients without accepting red blood cell (RBC) transfusion had statistically different from those with accepting a small amount of RBC transfusion in the aspects of SI,SF,UIBC,sTfR,TS and sideroblasts (P<0.05).Conclusion The iron metabolism indexes have the advantages of simple and easy operating,and repeatable testing,which can be regarded as the first choice method for diagnosing iron overload and monitoring the deferrization therapy and contributes to provide the reliable theory basis for clinical auxiliary diagnosis,condition monitoring and prognosis evaluation of MDS.
myelodysplastic syndromes; iron metabolism; aplastic anemia
周开慧,女,主管技师,主要从事造血及淋巴系统的临床检验学诊断研究。
10.3969/j.issn.1673-4130.2016.24.023
A
1673-4130(2016)24-3445-04
2016-09-12
2016-10-30)

