影像引导血管内精准介入诊疗
陈芳,马龙飞,廖洪恩
清华大学 医学院 生物医学工程系,北京 100084
影像引导血管内精准介入诊疗
陈芳,马龙飞,廖洪恩
清华大学 医学院 生物医学工程系,北京 100084
血管类疾病作为全球头号死因,其诊断与治疗已受到越来越多的关注。由于创伤小、恢复时间短及术后并发症少等原因,微创介入诊疗成为血管内疾病治疗的新趋势。而血管内介入诊疗需要借助于术中影像的引导,如术中2D X线透视图。但是X线透视图引导的方式存在以下问题:术前影像的定量分析不足;缺少对介入装置及组织的三维实时影像且影像显示方式不直观;术中依赖重复的X线照射会带来安全隐患。针对这些问题,本文从基于影像分析的术前先验、术前术中影像结合及引导、直观的影像显示3方面展开,提出了术中无辐射的影像引导血管内介入诊疗方法,为医生提供3D定量、显示直观的影像引导信息,辅助血管内诊疗。
图像引导;血管内诊疗;三维直观;无辐射
1 研究背景
2015年美国最新研究报告显示血管类疾病已成为全球头号死因[1],每年死于血管类疾病的人数多于任何其他死因。随着人口的老龄化,预计在很长的一段时间内,血管类疾病将继续成为单个首要死因[2]。血管内微创介入手术具有创伤小、术后恢复快、并发症少等优点,是血管类疾病治疗的重要手段,并得到了不断推广与应用。而影响血管内微创介入手术效率与手术成功率的关键因素之一是术中影像导航的直观性和准确度[3]。
血管内微创介入临床手术中,医生通过屏幕上2D血管造影和X线透视图,凭经验在脑中想象三维组织结构,判断导管插入的路径与到达的位置和植入支架的位姿。该影像引导血管内介入诊疗方式存在以下问题:
(1)对术前影像定量分析不足,未能给医生提供病情严重等级的先验信息和组织变形信息等,且术前影像未在术前高效使用。
(2)为了实时追踪导管位置,医生需要术中重复注射造影剂进行X-线照射,使医生和患者被暴露在大量的射线辐射下,造成安全隐患。
(3)医生基于2D血管造影图像定性判断血管分支位置和支架距离血管目标的距离,会导致支架放置位置不准确。特别是对血管狭窄严重的病人,通过2D影像难以准确确定血管狭窄的位置,会引起支架放置位置误差。血管内介入微创手术中放置支架是通过人体自然血管通道到达血管病变区,导管植入过程中血管分支会带来路径干扰,影响导管快速到达病变目标区,导致手术时间延长。所以2D的X线透视图或血管造影无法提供给医生三维的解剖信息,影响手术成功率和导管插入时间。
(4)手术过程中,医生从2D屏幕获取引导影像信息,容易造成手眼不协调的问题。
为解决临床血管内微创诊疗导航手术存在的问题,国内外相关研究不断展开。首先,为了实现影像定量分析,Sandhu等[4]通过实现血管造影图自动分割算法,对血管异常、血管堵塞严重程度进行定量评估。但基于2D血管造影图的分析方法,会因不合适的投影角度使图像出现线性放大,导致定量评估精度低。血管内超声(Intravascular Ultrasound,IVUS)作为介入式血管内成像新方式,临床证明IVUS比传统的血管造影对血管成像更清晰,对血管钙化和斑块程度的诊断更准确。Wong等[5]比较了血管造影、血管镜和血管内超声影像对病变血管的管腔直径和面积的评估,认为血管内超声可以正确评估管腔直径大小和内膜缺陷。关于IVUS影像自动分割算法也相继展开[6-7],如利用一些曲线变形和统计学分类的方法。但这些算法需要医生进行较复杂的参数设置且对噪声敏感。特别是对IVUS图像中存在的伪影噪声、Ring-down噪声、导丝噪声和斑块弱边缘等。除了结构影像,一些研究也从血管功能成像出发,采用吲哚青绿(Indocyanine Green,ICG)荧光染料,利用荧光分子成像对血管进行细胞分子水平成像[8-9],但受限于光学成像的约束、功能成像深度浅,只能实现血管表层微米级成像。
其次为了解决术中X线过度辐射问题,Sandhu等[4]提出利用电磁线圈定位系统跟踪导管导丝的方式来取代传统的基于X线透视图的追踪方式。但是单一的电磁定位信息并不能直观反映导丝导管与目标血管区域的距离,所以在临床应用中需结合部分术中X线透视图或者血管造影图,这样的方式并不能显著解决辐射量问题。一些研究也提出将磁定位和术前CT影像结合,但该方式缺少术中组织成像,缺少术中组织变形信息,影响导航精度[10]。此外,一些研究利用超声来取代X线透视图,引导血管内诊疗导航。Onogi等[11]提出利用3D超声引导,来判断血管分支与流向并重建血管网来实现血管内治疗。Ormesher等[12]提出利用3D对比度增强的超声来引导血管内导航。但是,术中实时3D超声影像在临床手术中的使用率比较低,所以该方式的临床实用性需进一步提高,而且多普勒超声作为血管常用的成像方式,并没有被有效使用。作为血管内导航方式,利用单一模态的超声影像,其导航精度难以满足临床需求。
为了使术中导航影像更直观,为医生提供三维解剖信息,一种利用多方向透视图来重建3D影像、提供三维导航信息的方法被提出[13]。但这样的方式至少需要3个方向的透视图,才能完成重建,会延长手术时间,且增加了术中辐射量。George等[14]通过外部标志点实现术前MR与术中X-ray影像的融合来引导介入手术,模型实验精度为2.4 mm,未进行动物或病人实验,难以满足临床应用准确性要求。一些研究[15-16]也提出将X-ray透视图与IVUS进行融合,通过在X透视图中分割出血管的中心线,来实现IVUS序列的重排,为医生提供一个具有三维结构的目标血管,但这样的方式受限于IVUS成像深度问题,无法直观反映出血管分支信息,且提供的三维信息不全,周围组织三维解剖信息无法呈现。这样的结合方式自动化程度差,一般需要医生进行手动干预,临床实用性低。
为解决现有血管内微创介入方式的不足,相关的医疗公司也提出了一些解决方案。如美国强生公司开发的CARTO Merge(Biosense Webster,USA)系统[17]和圣犹达医疗公司开发的EnsiteNavX(St Jude Medical,USA)系统[18]将术前影像和心肌组织三维重建图进行结合为医生提供三维导航信息,采用磁电双定位(Advanced Catheter Location,ACL)原理,通过电场感知定位导管。该系统能减少射线辐射,但主要基于术前影像,术中实时结构影像信息少,无法提供给医生定量的血管诊断信息,且设备较昂贵。
上述相关研究未能解决临床中影像引导血管内介入诊疗的不足,所以本文从基于影像分析的术前先验、术前术中影像结合与引导、直观的血管内影像引导显示3个方面展开,提出了术中无辐射的影像引导血管内介入诊疗方法,为辐射量少、3D定量、显示直观的影像引导辅助血管内诊疗的实现提供新思路。
2 影像引导血管内精准介入诊疗中的关键技术
2.1 基于术前影像精确分析的先验信息
2.1.1 基于CTA影像的血管变形分析
以颈动脉为研究对象,Ohya等[19]分析了颈动脉周围骨骼(如头骨颌段、颈椎等)对颈动脉5个分支点变形的影响。利用一些常用的医学影像处理软件如Mimics、3D slicer对6组病人的两类CT血管影像(CTA)进行分割处理,提取出颈动脉周围骨骼以及颈动脉并标识出5个重要的分支点。为保证分割的准确性,以同一个病人两类CTA数据集分割得到的骨对象的DICE系数>0.95为检测标准。CT扫描过程中,病人位姿的不一致(如仰卧位、俯卧位及侧卧位)会导致不同病人术前CTA坐标系的不一致。为了保证采集到的多组病人数据在相同的坐标系下,引入了一个新的标准化的坐标系统。该坐标系统以颌面骨段的惯性主轴为主方向建立。把两类CTA影像中得到的骨模型及颈动脉模型过渡到该标准化坐标系后,通过图像配准的方式,获得两类骨模型及颈动脉模型之间的变形量,该变形通过X、Y、Z三个轴方向的平移和旋转欧拉角来表示。为实现两类点集模型的精确配准,使用迭代最近点(Iterative Closest Point,ICP)算法。最后通过线性回归的方式,分析周围骨组织位移与颈动脉变形之间的关系。基于CTA影像的血管变形分析,确定颈动脉变形先验信息,为术中提高导管导航的准确性,提供一定参考。如利用非侵入式的骨固定转置或者侵入式的头销方式来减少周围骨移位,防止颈动脉变形。或者通过术中周围骨影像与术前骨影像位移测定量来矫正术中颈动脉变形,而不需要术中血管造影成像,从而减少术中辐射量和造影剂的使用。
2.1.2 基于IVUS影像处理的斑块等级分析
血管内超声(IVUS)成像是一种基于导管的血管内成像技术,可用于辅助诊断血管疾病如动脉粥样硬化。IVUS图像分析或管腔膜和内外膜的自动识别是血管形态学特征定量分析的关键步骤,也为评估病人斑块严重程度提供了参考。血管内超声影像的自动分析是一个复杂的过程,存在着各种图像噪声(如导丝和环状伪影等),为提高自动分割的精度,提出了一种将图像纹理特征与血管膜曲线形态特征结合的IVUS影像分割方法。该方法先提取图像的laws纹理特征后,通过训练得到有监督的支持向量机分类器[20]。通过图像测试,得到基于纹理特征的分类结果,利用该分类结果与曲线变形模型[21](如参数变形模型和几何变形模型)结合,实现自动初始曲线获取,自动变形参数调整以及对图像噪声的去除。该方法将图像纹理和血管轮廓拓扑结构结合,克服了传统的变形模型分割算法的不足,可实现自动的IVUS图像术前分析,且参数和初始曲线的自动设置大大减少了临床医生繁杂的手动辅助过程。
2.2 术前、术中影像与电磁定位结合实现术中无辐射影像引导
2.2.1 术前与术中影像融合技术
在血管内介入诊疗手术中,2DUS或者X-ray影像由于实时成像的特性,往往被用于对术中组织或者介入导管及设备的成像。但是受限于图像质量和2D影像的限制,单一的术中影像常难以满足临床需求。术前高质量的CT/MR影像不仅可用于术前诊断,且通过术前术中影像的融合,可提高术中影像的清晰度和影像范围来提供更有效的影像导航信息。在血管内介入诊疗手术中,为了减少X线辐射,术中US作为血管血流成像的重要影像模态,可用于术中导航。
但是US影像成像质量低、成像范围有限且对骨头等组织穿透力差,需要与高质量的术前影像融合,来提高术中影像的清晰度。但是,由于两种影像维度和模态的差异,实时的术前与术中影像融合是一个挑战[22]。为解决该问题,在术前利用一个已标定的三维超声探头进行一次扫描,得到术前3D超声影像,并记录探头在跟踪定位系统转置下的位姿。对术中2D超声探头,同样在探头上固定定位小球或线圈,实时记录2D超声探头在术中扫描时在跟踪定位系统下的位姿。为了获得2DUS和3DUS的粗配准关系,需要融合2DUS探头和3DUS探头的标定矩阵和(标定矩阵代表了超声图像坐标系与超声探头坐标系之间的转换关系)和2D、3D超声探头的位姿信息(如公式1)。对于不同的超声探头,将选择不同的探头标定方法,对于2D探头,设计N-线标定板。改变标定板中的绕线方式,可得到IXI线标定板,用于3D超声探头的标定。2DUS与3DUS的粗配准关系由下式求得:

基于粗配准关系,利用图像信息进一步实现2D-3DUS图像的精配准。考虑到2D-3DUS具有相同的图像模态,图像归一化相关系数是图像间配准优化度量的合适选择,同时结合Powell优化方式得到最优的配准参数。为实现术前3DUS和3DMR的配准,对两组术前影像进行分割处理后,得到组织模型,并在3DSlicer平台下手动完成两者的配准,获得配准关系。融合2DUS-3DUS同模态配准和3DUS-3DMR同维度配准,最终得到术前3DMR-术中2DUS间不同维度不同模态配准关系,如下式

Chen等[23]提出的配准框架将大部分任务(如超声标定、耗时的三维配准等)在术前完成,术中只需完成基于图像信息的局部微调,故可保证配准的速度和精度。以一个动态的心脏模型为研究对象,搭建实验平台,得到的2DUS与3DMR配准结果,见图1。经融合后,术中2DUS与术前3DMR中心室轮廓可实现匹配。
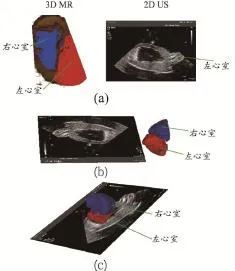
图1 术中术前影像融合图
人体正常的呼吸作用会引起组织变形,给图像的配准融合带来困难。为解决该问题,为医生提供更精确的影像信息,一种基于可变弹簧模型的非刚性配准方法被提出[24],通过加入一个物理约束项来保证变形中不违背器官的弹性特征。假设人体器官为弹性体,利用与连接各相邻体素的3D弹簧体作为模拟。配准中以B样条变形的非刚性方式,配准优化度量是图像信息与弹簧势能相结合:

其中,Ei代表图像信息,Ep为弹簧势能,α为权重变量对于同模态影像,图像信息选择平方差,对于不同模态影像选择互信息作为图像信息。该方法不但考虑了不同组织图像信息的一致而且考虑了组织弹性特性(如硬度和柔软度)。该方法对变形影像配准精度高,能更好去除呼吸作用影响。
2.2.2 术前CT/MR影像、术中US结合磁定位引导血管内介入诊疗
传统的术中X-ray影像引导方式,只能提供给医生2D的组织结构信息和介入导管的2D相对位置信息。而且术中需要大量重复的X线辐射并对病人重复注射造影剂。为了实现术中无辐射情况下的血管分支判别,提出了一种结合术中Freehand 2D超声(Doppler 效应)、术前3DCT及电磁定位的图像引导血管内导管介入的方式[25]。跟踪系统坐标系下,介入导管的路径和位置通过电磁线圈定位的方式获得。术中Freehand 3D US运行在功率Doppler状态,将得到的US图像、导管路径与术前影像结合,可获得精确的术中血管3D图像,提供给医生目标血管与导管的相对位置信息,进行术中无辐射的影像引导。
该导航方式涉及3个重要的坐标系:病人坐标系、跟踪系统坐标系和术前图像坐标系,这些坐标系统之间的相互转换流程,见图2。由于导管路径是在电磁跟踪系统坐标系下探测的,所以导管路径能直接过渡到跟踪系统坐标系下。考虑到所记录的导管路径会受到噪声点的影响,使用最小二乘样条曲线拟合,得到一个光滑的导管路径。Freehand的Doppler超声图像利用探头标定矩阵和电磁系统下探头位姿信息,也过渡到电磁跟踪系统坐标系下。对获得的Doppler图像,通过图像分割获得代表血管的彩色像素点,利用这些像素点经三角面片化得到术中血管模型。从导管路径和术中Doppler获得的血管模型,难以得到血管分支信息,因为术中超声成像范围有限。术前CT影像成像质量高,成像范围广,所以将术中影像与术前影像结合,可以解决分支判别的问题。在3D slicer软件平台下对术前CT影像分割,可得到术前图像的血管中心线。导管路径与超声图像中血管中心线已经过渡到了跟踪系统坐标系下。应用迭代最近点(Iterative Closest Point,ICP)算法实现术前图像中血管中心线与术中超声图像中血管中心线的自动配准,将术前影像过渡到跟踪系统坐标系下。这样导管路径、术中血管、术前血管都过渡到了相同坐标系下,通过渲染显示为医生提供影像和导管的位置信息,引导血管内介入手术。

图2 坐标系统
术前影像、术中US结合磁定位的血管内引导方法,在动物猪(44.5 kg)颈动脉(血管内直径约3 mm)进行了导管介入实验。实验证实,目标血管分支定位误差为2.4 mm,结果表明所提出的引导方式可以准确引导导管介入目标血管进行治疗。
2.3 导航影像直观的显示方式
传统血管内诊疗导航通过屏幕2D显示的方式仅供医生进行二维观察,缺乏对目标血管和血管内病灶的空间信息感知。为医生提供更直观的引导影像显示方式,能让医生对血管内病变情况及介入导管与血管相对位置信息有直接的信息反馈,是影像引导血管内介入诊疗领域的一个研究重点。
2.3.1 基于虚拟视觉反馈的无辐射血管内影像引导方法
数字减影血管造影(Digital Subtraction Angiography,DSA)和X线透视作为目前导管介入的引导影像,由于缺乏事实的血管内视觉反馈,难以将一个柔性导管放置到形态复杂的目标血管位置。为此,提出了一种基于虚拟视觉反馈的无辐射血管内影像引导方法[26]。从术前CTA影像中分割出血管,建立术前信息树(图3a),完成路径规划。术中在介入导管的前端和拐角处固定两个磁定位线圈,并利用数学建模确定两个磁定位线圈固定点与导管形状之间的关系图(图3b)。则术中通过对电磁定位确定线圈处位姿信息,可进一步推导出导管模型形态。为了实现跟踪系统和CT术前影像之间的配准关系,在术前CT扫描时,先在病人的头部和颈部放置一些皮肤标志点。这些标志点在术前CT中的坐标位置可获得,同时利用磁线圈可获得这些标志点在磁定位跟踪系统下的坐标位置。利用基于点配准的方式可获得术前CT影像与磁定位坐标系之间的转换矩阵,点配准中利用无迹卡尔曼滤波来减少误差。确定了两个坐标系间的转换关系,即可确定导管在术前CT信息树中的位姿信息。最后通过导管位姿来确定虚拟内窥镜的视角和镜头方向,基于虚拟内窥镜技术,实现虚拟视觉反馈,获得血管内成像图。所以通过将电磁跟踪与虚拟血管成像和路径规划相结合,为柔性导管介入提高直观的视觉反馈导航图像,从而减少术中X线辐射和对比剂剂量。
为了验证基于虚拟视觉反馈的无辐射血管内影像引导方法,搭建了颅骨模型颈动脉导管介入系统(图4)。术前采集CT影像,图像尺寸为512×512×258,物理分辨率为0.43 mm × 0.43 mm× 0.7 mm。术前CT影像与电磁跟踪系统配置误差为0.73 mm。该方法的导管定位精度为(1.80±0.85)mm。在一名专业临床医生的帮助下,利用提出的影像引导方式,在5 min内成功地将导管放置到目标位置处。传统影像导航方式下,往往需要20 min~2 h的导管放置时间,这取决于病人情况和医生技能。初步的实验结果证明了该方法的可行性及有效性。
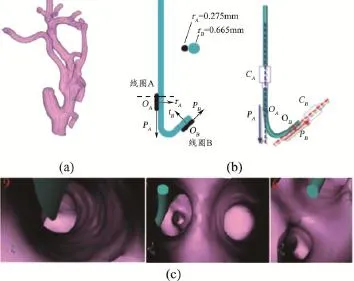
图3 基于导管定位建模和虚拟视觉反馈的影像引导与显示[26]注:a.术前路径规划与血管信息树;b.双线圈导管定位;c.视觉反馈导航图像。

图4 头颅模型颈动脉导管介入实验[26]
2.3.2 原位透视融合显示与血管内诊疗影像引导
DSA和X线透视作为引导影像通过2D屏幕显示的方式,需要医生在屏幕和患者病灶区域之间进行视野切换,来判断手术入口、介入导管和目标血管之间的相对位置。这样就会带来手眼不协调问题,且2D屏幕导航显示方式缺乏深度空间信息感知。原位透视融合显示技术[27-28]能够提供给医生叠加到真实病灶组织中的医学影像信息,见图5。该显示导航方式能够满足三维原位可视化的临床需求,解决手眼不协调问题,提高导航精度。该技术已经应用于膝关节、导针穿刺、牙科和微创手术模型、动物实验中,也将进一步被应用到血管内介入诊疗中。

图5 心脏原位透视融合手术显示效果
3 结论与展望
医学影像分析与引导为血管内微创精准介入诊疗提供了可能,辅助医生判断介入装置或导管与目标血管病灶区和周边组织的相对位置关系,从而保证血管内手术的安全、提高手术成功率。但是传统的术中X-ray、DSA影像引导的方式,只能提供给医生2D引导信息,术中过于依赖医生经验,对术前影像未有效利用,且2D屏幕的显示方式很不直观。另外,术中重复的X线辐射和造影剂的使用会带来不安全因素。
本文从基于术前影像精确分析的先验信息、术前、术中影像与电磁定位结合,实现术中无辐射影像引导和导航影像直观的显示方式三个方面展开,介绍了目前影像分析与引导在血管内介入诊疗中的关键技术。术前影像分析主要包括基于术前CTA影像的血管变形分析和基于IVUS影像处理的斑块等级分析。通过术前影像分析为医生提供组织和病情的先验信息,辅助术中治疗。术前术中影像结合与引导包括术前与术中影像融合技术及术前影像、术中影像结合磁定位引导血管内介入导航方法。术前术中影像并与磁定位跟踪结合,可实现术中3D影像信息和无辐射的术中导航环境。导航影像直观的显示方式部分主要介绍了基于虚拟相机的血管内虚拟视觉反馈技术和原位透视融合显示技术。直观的显示方式能够解决手眼不协调问题,提高导管介入效率和精度。相较于传统的X线导航血管内介入诊疗的方式,本文介绍的影像引导血管内介入诊疗的相关技术为3D直观术中无辐射的影像引导血管内介入诊疗提供了可行的解决方案,虽然还存在一定的技术制约,如图像处理的实时性和US影像对组织成像质量需要提高,且所提出的技术需要更多的临床试验实现系统效率与可行性的评估。
可以预见,安全精确的血管内影像导航方式是血管内介入诊疗重要的发展方向。其相关研究包括:① 影像分析的精确定量化,即利用机器学习和深度学习的相关处理算法,实现影像的定量化分析;② 术前高空间分辨率影像与术中高时间分辨率影像结合,通过时空分辨率互补来丰富导航影像;③ 通过新型影像显示方式来提高导航影像的直观性;④ 开发设计诊疗一体化的介入设备,在诊断的同时进行高效治疗。引导方式的安全性、导航影像的精确直观性,以及介入设备的诊疗一体化将会为更精准安全的血管内微创介入诊疗提供可能。
致谢
感谢国家自然科学基金(81427803、61361160417、81271735),北京市科委《生命科学领域前沿技术》专项(Z151100003915079)及“985工程”项目的资助。
[1] Mozaffarian D,Benjamin EJ,Go AS,et al.Heart disease and stroke statistics--2015 update: a report from the American Heart Association[J].Circulation,2015,131(4):e29-322.
[2] http://www.who.int/mediacentre/factsheets/fs317/zh/.
[3] Vykoukal D,Chinnadurai P,Davies MG.Cardiovascular Imaging, Navigation and Intervention: Hybrid Imaging and Therapeutics[M].Computational Surgery and Dual Training. Springer New York,2014:125-148.
[4] Sandhu D,Kim JH,Vasquez C,et al.Abstract T P25: Angiographic Predictors Of Hemorrhagic Transformation In Acute Endovascular Treatment Of Ischemic Stroke: A Retrospective Review[J].Stroke,2015,46(Suppl 1):ATP25-ATP25.
[5] Wong CKW, Adviser-Chung AC.Segmentation algorithms for quantitative analysis of vascular abnormalities on three dimensional angiography[D].Hong Kong:Hong Kong University of Science and Technology (People's Republic of China),2006.
[6] Mendizabal-Ruiz EG,Rivera M,Kakadiaris IA.Segmentation of the luminal border in intravascular ultrasound B-mode images using a probabilistic approach[J].Med Image Anal,2013,17(6):649-670.
[7] Gao Z,Hau WK,Lu M,et al.Automated Framework for Detecting Lumen and Media–Adventitia Borders in Intravascular Ultrasound Images[J].Ultrasound Med Biol,2015,41(7):2001-2021.
[8] Sheth RA,Tam JM,Maricevich MA,et al.Quantitative endovascular fluorescence-based molecular imaging through blood of arterial wall infammation[J].Radiology,2009,251(3):813-821.
[9] Weber CN,Hunt S,Ge BH,et al.Translational rat model of arteriovenous fistula for the study of the pathophysiology and molecular imaging of dialysis access stenosis and development of endovascular therapies[J].J Vasc IntervRadiol,2015,26(2):S164.
[10] Ludwig DR,Menon PG,Schwartzman D.CT-Electromagnetic Three-Dimensional Tracking for Renal Endovascular Sympathetic Ablation Catheter Positioning in an Animal Model[J].J Vasc Interv Radiol,2015,26(5):741-745.
[11] Onogi S,Phan TH,Bossard A,et al.3D ultrasound navigation system with reconstruction of blood vessel network for microbubble delivery therapy[J].Advanced Biomedical Engineering,2014,3: 29-36.
[12] Ormesher DC,Lowe C,Sedgwick N,et al.Use of threedimensional contrast-enhanced duplex ultrasound imaging during endovascular aneurysm repair[J].J Vasc Surg,2014,60(6):1468-1472.
[13] Stárek Z,Lehar F,Jež J,et al.3D X-ray imaging methods in support catheter ablations of cardiac arrhythmias[J].Int J Cardiovasc Imaging,2014,30(7):1207-1223.
[14] George AK,Sonmez M,Lederman RJ,et al.Robust automatic rigid registration of MRI and X-ray using external fiducial markers for XFM-guided interventional procedures[J].Med Phys,2011,38(1):125-141.
[15] Doulaverakis C,Tsampoulatidis I,Antoniadis AP,et al.IVUSAngio tool: a publicly available software for fast and accurate 3D reconstruction of coronary arteries[J].Comput Biol Med,2013,43(11):1793-1803.
[16] Lang P,Seslija P,Chu MW,et al.US-fuoroscopy registration for transcatheter aortic valve implantation[J].IEEE Trans Biomed Eng,2012,59(5):1444-1453.
[17] Martinek M,Nesser HJ,Aichinger J,et al.Impact of integration of multislice computed tomography imaging into three-dimensional electroanatomic mapping on clinical outcomes, safety, and efficacy using radiofrequency ablation for atrial fibrillation[J].Pacing Clin Electrophysiol, 2007,30(10):1215-1223.
[18] Richmond L,Rajappan K,Voth E,et al.Validation of computed tomography image integration into the EnSite NavX mapping system to perform catheter ablation of atrial fibrillation[J].J Cardiovasc Electrophysiol,2008,19(8):821-827.
[19] Ohya T,Iwai T,Luan K,et al.Analysis of carotid artery deformation in different head and neck positions for maxillofacial catheter navigation in advanced oral cancer treatment[J].Biomed Eng Online,2012,11:65
[20] Kwang Kim,Keechul Jung,Se Hyun Park.Support vector machines for texture classification[J].IEEE Transactions on Pattern Analysis and Machine Intelligence, 2002,24(11):1542-1550.
[21] Xu C,Prince JL.Snakes, shapes, and gradient vector fow[J].IEEE Trans Image Process,1998,7(3):359-369.
[22] Markelj P,Tomaževič D,Likar B,et al.A review of 3D/2D registration methods for image-guided interventions[J].Med Image Anal,2012,16(3):642-661.
[23] Chen F,Liao R,Liao H.Fast Registration of Intraoperative Ultrasound and Preoperative MR Images Based on Calibrations of 2D and 3D Ultrasound Probes[C].World Congress on Medical Physics and Biomedical Engineering,2015,Toronto,Canada. Springer International Publishing,2015:220-223.
[24] Herlambang N,Liao H,Matsumiya K,et al.Physically accurate B-spline based non-rigid registration using variable spring model[C].Biomedical Imaging:From Nano to Macro,2007. IEEE International Symposium on,2007:748-751.
[25] Luan K,Ohya T,Liao H,et al.Vessel bifurcation localization based on intraoperative three-dimensional ultrasound and catheter path for image-guided catheter intervention of oral cancers[J].Comput Med Imaging Graph,2013,37(2):113-122.
[26] Wang J,Ohya T,Liao H,et al.Intravascular catheter navigation using path planning and virtual visual feedback for oral cancer treatment[J].Int J Med Robot,2011,7(2):214-224.
[27] Herlambang N,Liao H,Matsumiya K,et al.Real-time autostereoscopic visualization of registration-generated 4D MR image of beating heart[M].Medical Imaging and Augmented Reality.Springer Berlin Heidelberg,2008:349-358.
[28] Liao H,Inomata T,Sakuma I,et al.3-D augmented reality for MRI-guided surgery using integral videography autostereoscopic image overlay[J].IEEE Trans Biomed Eng,2010,57(6):1476-1486.
Image-guided Endovascular Interventional Diagnosis and Treatment
CHEN Fang, MA Long-fei, LIAO Hong-en
Department of Biomedical Engineering, School of Medicine, Tsinghua University, Beijing 100084, China
As the leading cause of death in the world, the diagnosis and treatment of vascular diseases has received more and more attention. The minimally invasive endovascular procedures which require effective intraoperative guidance, such as 2D X ray fuoroscopy, become the preferred option for patients because the patient trauma, risk of complications and recovery times can be reduced. The 2D-fuoroscopyguided endovascular navigation, however, is limited by a number of factors: insufficient analysis of the preoperative images; lacking of 3D real-time images of instruments and surrounding anatomy and exposure to repeated doses of X-ray radiation. To solve these problems, an intraoperative fuoroscopyfree endovascular navigation method is introduced in this paper from three aspects: the preoperative prior information based on image analysis, the fusion of preoperative and intraoperative images and the intuitive navigation images. The proposed intraoperative fuoroscopy-free navigation method can provide 3D quantitative and intuitive navigation information for doctors to assist endovascular interventional therapy.
image guidance; endovascular diagnosis and treatment; 3D intuitive; fuoroscopy-free
R197.39
B
10.3969/j.issn.1674-1633.2016.06.006
1674-1633(2016)06-0029-07
2015-11-15
2015-12-16
国家自然科学基金(81427803,61361160417,81271735),北京市科委《生命科学领域前沿技术》专项(Z151100003915079)及“985工程”等支持。
廖洪恩,教授。
通讯作者邮箱:liao@tsinghua.edu.cn

