镉对不同发育阶段中华稻蝗抗氧化性的影响
张晓明,李丽君,马恩波,张建珍,郭亚平,3
(1.山西省农业科学院农业环境与资源研究所,山西太原030031;2.山西大学生物应用学研究所,山西太原030006;3.山西大学生命科学学院,山西太原030006)
镉对不同发育阶段中华稻蝗抗氧化性的影响
张晓明1,李丽君1,马恩波2,张建珍2,郭亚平2,3
(1.山西省农业科学院农业环境与资源研究所,山西太原030031;2.山西大学生物应用学研究所,山西太原030006;3.山西大学生命科学学院,山西太原030006)
采用急性染毒方法研究Cd2+胁迫对不同发育阶段中华稻蝗胸部、腹部谷胱甘肽过氧化物酶(GPx)活性、谷胱甘肽硫转移酶(GST)活性和总抗氧化能力(T-AOC)的影响。结果表明,不同质量浓度的Cd2+作用于不同发育阶段中华稻蝗体内时,其胸部和腹部的GPx,GST活性及T-AOC对Cd2+胁迫的应激反应程度不同。说明Cd2+可影响中华稻蝗的GPx,GST活性及T-AOC,中华稻蝗对Cd2+有一定的耐受性,且这种耐受性与中华稻蝗的龄期及性别有关。中华稻蝗在受到Cd2+胁迫时将调动其体内的抗氧化机制,维持H2O2产生与清除的平衡,有效地清除过量的ROS,保护机体免受外界不利因素的损害,进而避免机体DNA、蛋白质等功能的损伤。中华稻蝗可作为农业环境中Cd2+的指示生物。
中华稻蝗;镉;总抗氧化能力;谷胱甘肽过氧化物酶;谷胱甘肽硫转移酶
镉(Cd)属于毒性较强的重金属元素之一,是生物体非必需元素。随着经济的飞速发展,镉由工农业生产等途径带入农田环境,富集于作物体内,通过食物链危及人类健康[1-4]。据文献报道,Cd可参与生物体内的氧化还原反应,产生大量的活性氧自由基(ROS),导致机体内DNA断裂、脂质过氧化、酶失活等系列氧化应激。生物体为了减轻和防止ROS损伤,在长期的进化中,形成一套完整的抗氧化系统。
谷胱甘肽系统是生物体内主要的抗氧化防御体系,它包括还原型谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GPx)和谷胱甘肽硫转移酶(GST)等。GPx在抗氧化系统中起着维持ROS产生与清除平衡的重要作用[5]。GPx具有清除生物体内H2O2的作用,在抗氧化机制中起着至关重要的作用[6]。GST是生物体内的重要解毒酶,可保护DNA及一些蛋白质免受不利因素的损伤。GST活性因外界不利因素如:化学污染物、脂质代谢和某些病理原因被诱导而发生变化[7]。抗氧化系统中各成分单独或协同作用,降低ROS浓度,起到抗氧化的作用[6]。总抗氧化能力(T-AOC)表示生物体内酶促和非酶促2个体系抗氧化的总体水平,起着制约和清除机体过多ROS、保护细胞正常功能、维持机体正常代谢的作用,反映机体脂质过氧化水平以及ROS对机体损伤程度[8-10]。目前对未染毒、慢性染毒的中华稻蝗体内GPx活性、T-AOC有少量报道,但Cd2+急性胁迫对中华稻蝗不同发育阶段GPx,GST活性及T-AOC的影响研究未见报道。
本试验以中华稻蝗为材料,研究Cd2+对不同龄期中华稻蝗腹部、胸部GPx,GST活性及T-AOC的影响,探讨不同龄期中华稻蝗对Cd2+胁迫的反应机制,丰富生态毒理学内容,旨在为研究昆虫抗重金属污染的适应机制提供基础资料,为环境重金属污染治理、提高环境安全性提供参考资料。
1 材料和方法
1.1 供试昆虫
试验用中华稻蝗于2008年7—8月采自山西省太原市(E112°36′,N37°46′)晋阳湖附近的废弃农田中。用网捕法采集中华稻蝗后,将其带回实验室,在室温条件下饲喂1~2 d。按照龄期,将大小均匀一致的雌、雄中华稻蝗各30头分笼喂养。
1.2 急性染毒试验
将CdCl2·2.5H2O溶于三蒸水中配制50,100,150,200 mg/L梯度的溶液,对照为三蒸水。每个处理3次重复。急性染毒、虫体冻存方法参考文献[11]进行。
1.3 酶液制取
测定酶活性时,将中华稻蝗从-80℃冰箱中取出,用眼科手术剪刀迅速将冰冻虫体的胸部及腹部剪下,放入匀浆液中,制备所需酶液。酶液制备按照南京建成生物工程研究所提供的试剂盒方法。
1.4 生化分析
按照南京建成生物工程研究所提供的分光光度法在酶标仪(Spectra MAX 190,美国)上测定GPx,GST活性及T-AOC、蛋白含量。每个处理组的GPx,GST活性及T-AOC、蛋白质含量均重复测定3次。
1.5 数据分析
利用SPSS 11.5[12]软件系统,对中华稻蝗胸部、腹部GPx,GST活性及T-AOC数据分别进行方差分析与Duncan多重比较。
2 结果与分析
2.1 中华稻蝗GPx活性对Cd2+胁迫的应答
2.1.1 中华稻蝗胸部GPx活性对Cd2+胁迫的应答从图1-A可以看出,随着Cd2+质量浓度的不断提高,雌性中华稻蝗3,5龄若虫及成虫GPx活性均表现为先升高后降低的趋势;4龄若虫表现为升高趋势。当Cd2+为150 mg/L时,3龄若虫的GPx活性达到最高。当Cd2+为200 mg/L时,4龄若虫的GPx活性达到最高,与对照间差异显著。当Cd2+为150 mg/L时,5龄若虫GPx活性显著高于对照。ANOVA显示,各龄期不同处理间GPx活性差异达极显著水平(P<0.01)。

从图1-B可以看出,当Cd2+作用于雄性中华稻蝗时,随着Cd2+质量浓度的不断提高,3,4龄若虫GPx活性均表现为先升高后降低的趋势。当Cd2+为150 mg/L时,3,4龄若虫的GPx活性均达到最高。对于5龄若虫及成虫,随着Cd2+质量浓度的提高,GPx活性整体上表现为升高趋势,且当Cd2+质量浓度为150,200 mg/L时,GPx活性显著高于对照。ANOVA显示,各龄期不同处理间GPx活性差异极显著(P<0.01)。
2.1.2 中华稻蝗腹部GPx活性对Cd2+胁迫的应答
从图2-A可以看出,当Cd2+作用于雌性中华稻蝗时,随着Cd2+质量浓度的不断提高,3,4龄若虫GPx活性表现为先升高后降低的趋势;5龄若虫及成虫GPx活性表现为先降低后升高的趋势。当Cd2+为150 mg/L时,3龄若虫的GPx活性达到最高,与对照间差异显著。当Cd2+为100 mg/L时,4龄若虫的GPx活性达到最高,但与对照间差异不显著。当Cd2+为150,200 mg/L时,5龄若虫GPx活性显著高于对照。ANOVA显示,3龄若虫及成虫不同处理间GPx活性差异显著(P<0.05),4,5龄若虫不同处理间GPx活性差异极显著(P<0.01)。
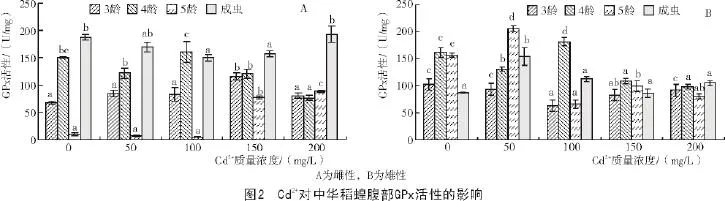
从图2-B可以看出,当Cd2+作用于雄性中华稻蝗时,随着Cd2+质量浓度的不断提高,3龄若虫GPx活性均低于对照,4,5龄若虫及成虫GPx活性整体上均表现为先升高后降低的趋势。对于3龄若虫来讲,对照的GPx活性最高,虫体的GPx活性受到抑制;当Cd2+为100 mg/L时,4龄若虫的GPx活性达到最高,与对照间差异显著。当Cd2+为50 mg/L时,5龄若虫及成虫的GPx活性达到最高,且显著高于对照。ANOVA显示,3龄若虫不同处理间GPx活性差异显著(P<0.05),4,5龄若虫及成虫不同处理间GPx活性差异极显著(P<0.01)。
2.2 中华稻蝗GST活性对Cd2+胁迫的应答
2.2.1 中华稻蝗胸部GST活性对Cd2+胁迫的应答
从图3-A可以看出,当Cd2+作用于雌性中华稻蝗时,随着Cd2+质量浓度的不断提高,3龄若虫GST活性均表现为先升高后降低的趋势,4,5龄若虫GST活性均表现为降低趋势,成虫表现为升高趋势。当Cd2+为100 mg/L时,3龄若虫的GST活性达到最高;且当Cd2+作用于3龄中华稻蝗时,对GST活性表现为抑制作用。当Cd2+为150,200 mg/L时,4龄若虫的GST活性与对照间差异不显著,5龄若虫各处理的GST活性显著低于对照。对于成虫,随着Cd2+质量浓度的提高,GST活性逐渐提高。Cd2+≥100 mg/L时,5龄若虫的GST活性显著低于对照。ANOVA显示,3,5龄若虫及成虫不同处理间GST活性差异极显著(P<0.01),4龄若虫不同处理间GST活性差异显著(P<0.05)。

从图3-B可以看出,随着Cd2+质量浓度的不断提高,雄性各龄期GST活性均表现为先升高后降低的趋势。当Cd2+为150 mg/L时,3龄若虫的GST活性达到最高。当Cd2+为100 mg/L时,4,5龄若虫的GST活性达到最高,但与对照间差异显著。当Cd2+为50 mg/L时,成虫的GST活性达到最高,且显著高于对照。ANOVA显示,各龄期若虫不同处理间GST活性差异极显著(P<0.01),成虫不同处理间GST活性差异显著(P<0.05)。
2.2.2 中华稻蝗腹部GST活性对Cd2+胁迫的应答
从图4-A可以看出,随着Cd2+质量浓度的不断提高,雌性3龄若虫GST活性表现为先升高后降低的趋势,4龄若虫表现为降低趋势,5龄若虫及成虫GST活性均表现为先降低后升高的趋势。当Cd2+为 100 mg/L时,3龄若虫的GST活性达到最高;当Cd2+为0 mg/L时,4龄若虫与成虫的GST活性达到最高。当Cd2+为150 mg/L时,5龄若虫的GST活性达到最高。ANOVA显示,各龄期不同处理间GST活性差异极显著(P<0.01)。

从图4-B可以看出,当Cd2+作用于雄性中华稻蝗时,随着Cd2+质量浓度的不断提高,3龄若虫及成虫的GST活性均表现为先降低后升高趋势,4,5龄若虫GST活性均表现为先升高后降低趋势。当Cd2+为150 mg/L时,3龄若虫的GST活性达到最高。当Cd2+为100 mg/L时,4,5龄若虫及成虫的GST活性均达到最高,4,5龄若虫的GST活性与对照间差异显著,而成虫的GST活性与对照间差异不显著。ANOVA显示,各龄若虫不同处理间GST活性差异极显著(P<0.01),成虫不同处理间GST活性差异显著(P<0.05)。
2.3 中华稻蝗T-AOC对Cd2+胁迫的应答
2.3.1 中华稻蝗胸部T-AOC对Cd2+胁迫的应答
从图5-A可以看出,随着Cd2+质量浓度的不断提高,雌性3,4,5龄若虫T-AOC均表现为先升高后降低的趋势。当Cd2+为150 mg/L时,3龄若虫的T-AOC达到最高。当Cd2+为50 mg/L时,4龄若虫的T-AOC达到最高,但与对照间差异不显著。当Cd2+为100 mg/L时,5龄若虫T-AOC显著高于对照。随着Cd2+质量浓度的提高,成虫的T-AOC逐渐提高。当Cd2+质量浓度为150,200 mg/L时,成虫T-AOC显著高于对照。ANOVA显示,3龄若虫及成虫不同处理之间T-AOC差异极显著(P<0.01),4,5龄若虫不同处理之间T-AOC差异显著(P<0.05)。

对于雄性中华稻蝗(图5-B)来讲,随着Cd2+胁迫浓度的不断提高,3龄若虫T-AOC逐渐增加,当Cd2+为50 mg/L时,3龄若虫T-AOC达到最高,为2.91 U/mg,随后3龄若虫的T-AOC表现出降低趋势。当Cd2+为50,100 mg/L时,3龄若虫的T-AOC显著高于对照。随着Cd2+质量浓度的提高,4,5龄若虫T-AOC表现为升高趋势。当Cd2+为200 mg/L时,4龄若虫T-AOC达到最高,且显著高于对照。当Cd2+质量浓度为150,200 mg/L时,5龄若虫T-AOC显著高于对照。当Cd2+为50 mg/L时,成虫T-AOC显著低于对照,其余Cd2+质量浓度对T-AOC未产生显著影响。ANOVA显示,3,4,5龄若虫不同处理间T-AOC差异显著(P<0.05),成虫不同处理间T-AOC差异极显著(P<0.01)。
2.3.2 中华稻蝗腹部T-AOC对Cd2+胁迫的应答
从图6-A可以看出,雌性中华稻蝗受到Cd2+胁迫后,随着Cd2+质量浓度的不断提高,3,4龄若虫及成虫的T-AOC逐渐增加,随后则表现出降低趋势。当Cd2+为100 mg/L时,3,4龄若虫T-AOC达到最高,且显著高于对照。当Cd2+为50,200 mg/L时,成虫T-AOC显著高于对照。当5龄若虫受到Cd2+胁迫时,各处理的T-AOC均低于对照。ANOVA显示,3龄若虫不同处理间T-AOC差异极显著(P<0.01),4,5龄若虫、成虫不同处理间T-AOC差异显著(P<0.05)。

从图6-B可以看出,当Cd2+作用于不同龄期的雄性中华稻蝗时,T-AOC变化趋势相同,均为随着Cd2+质量浓度的不断提高,T-AOC逐渐增加,而后表现出降低趋势。对于3龄若虫来讲,当Cd2+为50,100 mg/L时,T-AOC显著高于对照,且Cd2+为50 mg/L时T-AOC达到最高。当Cd2+为100 mg/L时,4龄若虫的T-AOC达到最高,但与对照间差异不显著。当Cd2+为100,150mg/L时,5龄若虫T-AOC显著高于对照。当Cd2+为50,100,150 mg/L时,成虫的T-AOC均显著高于对照,而Cd2+为200 mg/L的T-AOC显著低于对照。ANOVA显示,3,4龄若虫、成虫不同处理间T-AOC差异极显著(P<0.01),5龄若虫不同处理间T-AOC差异显著(P<0.05)。
3 讨论
中华稻蝗胸部是其运动中心,由大量肌肉和外骨骼组成,内部脏器包括前肠的食道部分、唾液腺及前胸腺等内分泌腺体;腹部是虫体的代谢中心,大部分肠道、马氏管、生殖腺、血淋巴和脂肪体等大量脏器存在其中,是重金属累积的主要器官[13]。本研究结果显示,Cd2+的急性胁迫对虫体胸部及腹部产生不同程度的氧化胁迫。
生物体内存在完善的抗氧化系统,起着调节活性氧自由基(ROS)生成与清除的动态作用。在正常情况下,机体内ROS的产生、利用和清除保持动态平衡,ROS维持在较低水平。当环境中存在污染胁迫时,机体内的氧化还原反应将产生大量的ROS[14]。当ROS在机体内的累积超过抗氧化系统的清除能力时,则会产生氧化损伤,使机体处于氧化应激状态[15]。谷胱甘肽系统是生物体主要的抗氧化防御体系,在维持细胞内环境稳态及机体的解毒代谢中起重要作用[16-17]。T-AOC是近年研究发现的反映机体抗氧化酶系统和非酶系统对外来刺激的代偿能力以及机体自由基代谢的状态综合性指标,是机体颉颃ROS的主要体系,起着制约和清除机体产生过多ROS、保护细胞正常功能、维持机体正常代谢的作用[15]。
本研究结果表明,当不同质量浓度Cd2+作用于中华稻蝗时,不同龄期虫体的GPx,GST活性及T-AOC均发生不同变化,因此,可将中华稻蝗作为农业环境中Cd2+的指示生物。同时,表明Cd2+作用导致虫体内ROS浓度提高,虫体则启动其抗氧化系统清除过量的ROS,保护机体免受其损害,而T-AOC的变化是机体内各抗氧化酶活性改变共同作用的结果[18],这一结果与李丽君等[11,19]报道的急性Cd2+染毒可影响虫体抗氧化酶活性一致。
本研究还表明,在Cd2+的作用下,不同龄期、性别虫体的GPx,GST活性及T-AOC发生不同变化。随着Cd2+质量浓度的提高,三者分别表现为先升高后降低的趋势。表明低质量浓度Cd2+的存在激活了中华稻蝗体内GPx,GST的合成途径,T-AOC随之提高,GPx,GST可起到维持H2O2产生与清除平衡的作用,降低Cd2+毒性的作用,达到保护中华稻蝗的目的[20];但高质量浓度Cd2+导致GPx,GST活性呈下降趋势,T-AOC受到抑制,表明中华稻蝗抗氧化系统对Cd2+的耐受性有一定的极限值。超过这一极限值时,随着Cd2+质量浓度继续提高,一些未被清除的自由基对细胞产生不可逆的伤害,导致酶活性逐渐降低,GST的解毒作用被抑制[5,7,21-22]。
随着Cd2+质量浓度的提高,三者分别表现为升高趋势,在Cd2+的胁迫下,中华稻蝗体内发生一系列氧化还原反应,产生大量的ROS,表现为GPx,GST活性及T-AOC的提高,提高中华稻蝗机体抗氧化能力,起到积极清除过量ROS的作用,使ROS对中华稻蝗的危害降到最小,保证机体进行正常的代谢活动[5,7,14]。
随着Cd2+质量浓度的提高,三者分别表现为先降低后升高趋势,表明低质量浓度Cd2+作用于中华稻蝗时,机体内未产生大量的ROS,Cd2+未对机体产生毒害作用;高质量浓度Cd2+可导致ROS浓度提高,因此,只有抗氧化酶系统和非酶系统中不同成分协同作用,提高T-AOC,使过量ROS的清除远远超出产生速度,进而降低机体的脂质过氧化水平以及ROS对机体的损害程度[10,14]。Cd2+的存在导致GPx,GST活性及T-AOC降低,表明低质量浓度的Cd2+即可对中华稻蝗GPx,GST合成途径产生毒害作用,致使细胞内自由基累积,造成基因损伤,导致细胞凋亡和功能丧失[5,23],致使T-AOC表现为下降趋势,Cd2+对机体造成一系列的损害[15]。
4 结论
不同质量浓度的Cd2+作用于不同发育阶段中华稻蝗体内时,其胸部和腹部的GPx,GST活性及T-AOC对Cd2+胁迫的表现应激反应程度不同,中华稻蝗可作为农业环境中Cd2+的指示生物。中华稻蝗在受到Cd2+胁迫时将调动其体内的抗氧化机制,维持H2O2产生与清除的平衡,有效地清除过量的ROS,保护机体免受外界不利因素的损害,进而避免机体DNA、蛋白质等功能的损伤。
[1]何俊瑜,任艳芳,朱诚期,等.镉胁迫对镉敏感水稻突变体活性氧代谢及抗氧化酶活性的影响[J].生态环境,2008,17(3):1004-1008.
[2]侯青叶,杨忠芳,杨晓燕,等.成都平原区水稻土成土剖面Cd形态分布特征及影响因素研究[J].地学前缘,2008,15(5):37-46.
[3]王新,周启星.土壤重金属污染生态过程、效应及修复[J].生态科学,2004,23(3):278-281.
[4]顾继光,周启星,王新.土壤重金属污染的治理途径及其研究进展[J].应用基础与工程科学学报,2003,11(2):143-151.
[5]刘娜,闫博,李涌泉,等.Cd2+对长江华溪蟹谷胱甘肽系统的影响[J].环境科学,2008,29(8):2302-2307.
[6]李丽君,郭亚平,刘平,等.镉长期暴露对中华稻蝗抗氧化机制的影响[J].农业环境科学学报,2011,30(3):443-448.
[7]田志环,申保忠.废旧干电池污染液对泥鳅谷胱甘肽硫转移酶活性的影响[J].滨州学院学报,2007,23(3):47-50.
[8]刘汝祥,侯明海,李彦芹,等.不同维生素A水平对荷斯坦种公牛血液抗氧化指标的影响[J].西南农业学报,2008,21(3):798-801.
[9]冯望宝,王安,艾涛.不同锌水平对笼养育成蛋鸭生长性能及总抗氧化能力的影响[J].东北农业大学学报,2007,38(5):654-659.
[10]吴伟,聂凤琴,瞿建宏,等.2,2′,4,4′-四溴联苯醚对鲫鱼离体肝脏组织的氧化胁迫[J].农业环境科学学报,2009,28(5):1005-1009.
[11]Li L,Liu X,GuoY,et al.Activity of the enzymes of the antioxidative system in cadmium-treated Oxya chinensis(Orthoptera Acridoidae)[J].Environmental Toxicology and Pharmacology,2005,20:412-416.
[12]洪楠,林爱花,李志辉,等.统计分析教程[M].北京:电子工业出版社,2000:134-148.
[13]孙鸽,吴海花,席玉英,等.长期取食染镉小麦后中华稻蝗体内镉的累积分布[J].农业环境科学学报,2009,28(9):1812-1817.
[14]孟凡平,王伟,李莹,等.苯并芘和VE对红鳍东方鲀抗氧化酶影响研究[J].水产科学,2012,31(5):270-274.
[15]文静,林志伟,周绪霞,等.枯草芽孢杆菌B10对饲喂高脂日粮小鼠抗氧化功能的影响[J].中国兽医学报,2012,32(1):111-114.
[16]廖一骁,胡振英,程富胜,等.酵母硒对肉鸡血清中GSH-Px、GSTs活性的影响[J].湖北农业科学,2010,49(8):1918-1920.
[17]马恩波,葛娉婷,张建琴,等.飞蝗两种群羧酸酯酶及谷胱甘肽S-转移酶活性与马拉硫磷敏感性关系的研究[J].山西大学学报:自然科学版,2012,35(2):383-387.
[18]高春生,王春秀,张书松.水体铜对黄河鲤肝胰脏抗氧化酶活性和总抗氧化能力的影响[J].农业环境科学学报,2008,27(3):1157-1162.
[19]李丽君,郭亚平,武文丽,等.镉对中华稻蝗保护酶系统的毒性效应[J].农业环境科学学报,2010,29(8):1448-1454.
[20]韩雨哲,姜志强,任同军,等.氧化鱼油与棕榈油对花鲈肝脏抗氧化酶及组织结构的影响[J].中国水产科学,2010,17(4):798-806.
[21]张彬彬.乙草胺对泥鳅肝脏乙酰胆碱酯酶和谷胱甘肽硫转移酶的影响[J].淡水渔业,2008,38(4):73-75.
[22]王芸,李健,李吉涛,等.pH胁迫对中国明对虾抗氧化系统酶活力及基因表达的影响[J].中国水产科学,2011,18(3):556-564.
[23]王丽丽,夏斌,陈碧鹃,等.镉胁迫对虾夷扇贝抗氧化防御系统的影响[J].海洋环境科学,2012,31(1):39-42.
Effects of Cd2+on Anti-oxidative Capacity in Different Developing Stage of Oxya chinensis(Orthoptera Acridoidae)
ZHANG Xiao-ming1,LI Li-jun1,MA En-bo2,ZHANG Jian-zhen2,GUO Ya-ping2,3
(1.Institute of Agricultural Environment and Resource,Shanxi Academy of Agricultural Sciences,Taiyuan 030031,China;2.Institute of
Applied Biology,Shanxi University,Taiyuan 030006,China;3.College of Life Sciences,Shanxi University,Taiyuan 030006,China)
To explore and clarify the responses of Oxya chinensis to Cd2+stress,provide the scientific evaluation of Cd2+tolerance, the toxic effect of Cd2+on activities of glutathione peroxidase(GPx)and glutathione S-transferase(GST),and the total anti-oxidative capacity(T-AOC)in different developing stage of O.chinensis injected with Cd2+were determined.Different developing stages O. chinensis were injected with Cd2+at different concentrations(0,50,100,150,200 mg/L),and they were collected after 24 h.The results showed that the effect of Cd2+on GPx and GST activities and T-AOC were different within the experimental gradient.The GPx and GST activities,and T-AOC depended on the content of oxygen species(ROS)under Cd2+stress in the experiment,and Cd2+could induce damage of antioxidant defense system in O.chinensis,but O.chinensis kept its GPx and GST activities,and T-AOC increasing from Cd2+damage in some Cd2+contents.The tolerance of Cd2+changed in different developing stages and male or female O.chinensis.Variety of GPx and GST activities,and T-AOC in different developing stages and male or female O.chinensis might act as indicative functions for Cd2+contamination.
Oxya chinensis;cadmium(Cd);total anti-oxidative capacity(T-AOC);glutathione S-transferase(GST);glutathione peroxidase(GPx)
X174
A
1002-2481(2016)02-0152-06
10.3969/j.issn.1002-2481.2016.02.06
2015-08-28
国家自然科学基金项目(31071980);高等学校博士点基金项目(20111401110006);山西省回国留学人员科研资助项目(2008114);山西省农业科学院博士基金项目(YBSJJ0702)
张晓明(1958-),男,山西沁县人,助理研究员,主要从事昆虫毒理学研究工作。郭亚平为通信作者。

