硫酸沙丁胺醇肺吸缓释微球的制备与评价
李 颖,郑思骞,寸冬梅
(沈阳药科大学 药学院,辽宁 沈阳 110016)
硫酸沙丁胺醇肺吸缓释微球的制备与评价
李 颖,郑思骞,寸冬梅*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的制备可通过肺部吸入方式给药的硫酸沙丁胺醇缓释微球。方法以透明质酸为载体材料,采用乳化溶剂挥发法制备硫酸沙丁胺醇的透明质酸微球,以微球的体积平均直径为指标考察不同工艺和处方因素的影响,并对优化处方的微球进行体外释放评价。结果经优化,得到的最佳制备工艺和处方为:透明质酸质量浓度为6 g·L-1,油相为含质量分数1.0% Span80的蓖麻油,药物与载体的质量比为1∶1,内外相的质量比为1∶10,匀质转速为1.2×104r·min-1,超声功率为500 W。制备得到的最优硫酸沙丁胺醇微球, 粒径较小, 平均粒径为(4.75±2.56) μm;粒径分布较窄,跨距为1.55±0.09;表面粗糙;其体外释放行为表现出一定的缓释效果。结论透明质酸的质量浓度、乳化方式、超声功率是影响微球粒径的重要因素,透明质酸的性质对微球的体外释放行为有显著影响。
药剂学;透明质酸缓释微球;乳化溶剂挥发法;硫酸沙丁胺醇;体外释放;肺部给药研究
硫酸沙丁胺醇(salbutamol sulfate, SAS)是选择性β2受体激动剂,用于轻度或重症哮喘的治疗[1]。硫酸沙丁胺醇半衰期较短,约4.5 h,需多次给药[2]。且该药首过效应大,口服生物利用度仅为10%~30%,而其肺部生物利用度却能高达 90%[3]。因此,开发其肺吸干粉制剂不仅可以提高药物的生物利用度,还能改善病人的顺应性。
通常1~5 μm被认为是适宜肺部给药的粒径范围,大于5 μm,微粉易在口咽部沉积,小于1 μm,则易随呼吸呼出,难以获得较高的肺部沉积率。肺部高效的清除机制如黏液纤毛剃、巨噬细胞吞噬、咳嗽等[4-6],是影响吸入性药物在肺部滞留的重要因素。透明质酸(hyaluronic acid, HA)是人体内源性物质,分子质量较大,并具有生物黏附性,能对抗肺黏膜纤毛活动剃的清除作用,从而延长制剂在肺部的滞留时间[7]。因此,本文作者尝试应用透明质酸制备粒径在1~5 μm内、适合肺部吸入且具有缓释特性的硫酸沙丁胺醇微球制剂。目前关于此方面的研究尚未有文献报道。
1 仪器与材料
HPLC系统包括L-2130液相色谱泵、L-2420可变波长紫外吸收检测器(日本Hitachi公司),Kromasil®C18色谱柱(200 mm×4.6 mm,5 μm,Eka Chemicals,瑞典),DF-101S数显恒温水浴锅(巩义予华仪器制造有限公司),FJ200-S数显高速分散均质机(上海标本模型厂),JY92-2D超声波细胞破碎仪(宁波新芝生物科技股份有限公司),LS230贝克曼激光粒度测定仪(美国 Beckman Coulter有限公司),S-3400N扫描电镜(日本Hitachi公司),WHY-2往返水浴恒温振荡器(金坛大地自动化仪器厂)。
硫酸沙丁胺醇(阿法埃莎(天津)化学有限公司,批号 A18544),透明质酸钠(MW为1.47×106u,山东福瑞达生物医药有限公司,批号 120326),药用蓖麻油(江西吉水香料厂),Span80(分析纯,天津博迪化工有限公司),正己烷(分析纯,天津富宇精细化工有限公司),磷酸二氢钠(分析纯,西陇化工有限公司),磷酸(分析纯,天津科密欧化工有限公司),甲醇(色谱纯,江苏汉邦实业有限公司)。
2 方法与结果
2.1 微球的制备
作者参照S.T.Lim等[8]的方法并加以改进,采用W/O 乳化溶剂挥发法制备硫酸沙丁胺醇透明质酸微球。将一定量的透明质酸钠和药物加至重蒸水中,搅拌12 h使透明质酸钠充分溶胀,得到药物-载体溶液;在匀质机转速为8 000 r·min-1速度下,将药物-载体(质量比1∶1)溶液逐滴加至一定体积含有质量分数1.0%Span80的蓖麻油中,制成初乳;将制成的初乳转移到剩余的预热好的油相中,在50 ℃、450 r·min-1条件下搅拌10 h;离心,正己烷洗涤3次,真空干燥箱常温干燥,即得硫酸沙丁胺醇透明质酸微球。
2.2 微球粒径的测定及表面形态观察
采用LS230激光粒度仪,测定粒子的粒径。每个样品平行测定3次,结果取平均值即得体积平均粒径(VMD,dv)。粒度分布以跨距SPAN作为衡量指标,其值可通过下式计算得到:
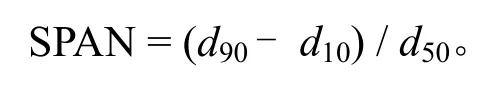
其中,d10、d50、d90分别表示样品的累计粒度分布数达到10%、50%和90%时所对应的粒径;跨度越大,则表明粒径分布越不均匀。
采用S-3400N扫描电子显微镜,对微球的形状及表面形态进行观察。取少量干燥样品粉末,用导电双面胶布固定于金属盘上,置于真空条件下喷金40 s使各个样品表面覆盖薄薄的一层金属金,置于S-3400N扫描电子显微镜上观察并采集图像,扫描电镜观测时的操作加速电压为15 kV。
2.3 微球回收率、载药量及包封率的测定
收集干燥后的微球并称质量,通过下述公式计算得到微球的回收率:回收率 = 收集的微球的质量 /(投药量+载体质量)×100%。
精密称定载药微球10.0 mg,加至10 mL量瓶中,用重蒸水充分溶解后,定容,摇匀。取1 mL 在1.6×104r·min-1下离心5 min,取上清液用0.22 μm滤膜过滤后,采用HPLC法在波长276 nm处测定微球中药物的质量浓度,结果硫酸沙丁胺醇质量浓度在0.5~40 mg·L-1内呈良好线性,相关系数R = 0.999 5,精密度、准确度均符合测定要求。根据下列公式,可分别计算得到载药量和包封率:
载药量 = 微球的实际药物含量 / 微球的质量 × 100%;包封率 = 微球的实际载药量 / 微球的理论载药量 × 100%。
2.4 体外释放的测定方法
称取微球10 mg,加至5 mL pH值为7.4的PBS缓冲液中,置于水平-恒温振荡仪中进行体外释放度的测定。振荡速度为200 r·min-1,释药温度为 37 ℃。在每个取样时间点,将所取样品于4 000 r·min-1转速离心1 min,取出上清液1 mL,同时补充1 mL已预热的新鲜PBS。取出的上清液用0.22 μm微孔滤膜过滤后用HPLC法分析,测定其中硫酸沙丁胺醇的浓度。根据测定的浓度、微球的载药量和释放介质体积计算出各个取样时刻的药物累积释放量(Qt),其计算如下:
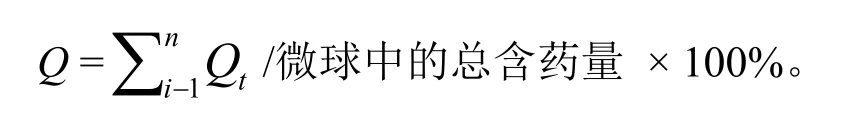
以微球的累积释放率(Q)为纵坐标,以释放时间(t,min)为横坐标,即可绘制微球的体外累积释放曲线。
2.5 处方和工艺因素对微球粒径的影响
乳化溶剂挥发法制备微球时,影响微球粒径的处方和工艺因素较多。作者通过单因素分析,重点考察了透明质酸的质量浓度、乳化方式、超声功率以及乳化剂的质量浓度几个因素对微球粒径的影响。
2.5.1 透明质酸质量浓度对微球粒径的影响
透明质酸钠为具有高度黏弾性的高分子聚合物,其浓度对微球的粒径有显著的影响。随着透明质酸钠质量浓度的增加,内水相黏度也随之增加,乳化时需克服的阻力更大,形成的乳滴粒径更大,因而制备得到的微球粒径也更大。由表1可知,透明质酸的质量浓度从8 g·L-1减小至6 g·L-1时,微球的粒径显著减小。
Table 1 Effect of concentration of hyaluronic acid on the average size of SAS-loaded HA microspheres(x±s, n=3)表1 透明质酸质量浓度对微球平均粒径的影响(±s, n=3)

Table 1 Effect of concentration of hyaluronic acid on the average size of SAS-loaded HA microspheres(x±s, n=3)表1 透明质酸质量浓度对微球平均粒径的影响(±s, n=3)
Formulation ρ(HA) /( g·L-1) dv/ µm SPAN F1 8 65.9±38.7 2.19±0.65 F2 6 56.2±36.4 2.02±0.51
2.5.2 乳化方式及超声功率对微球粒径的影响
对于乳化方式的影响,主要考察了匀质和超声两种方式。由表2可知,在匀质破碎方式中,匀质机转速从初始处方的8×103r·min-1(F2)增加到1.2×104r·min-1(F3)时,微球的粒径由(56.2±36.4)µm相应的减小到(46.5±33.6)µm;而在超声破碎方式中,当超声功率由200 W增大至500 W时,微球粒径由(25.6±13.9)μm降至(14.3±9.32)μm。上述结果表明,超声破碎方式较匀质破碎方式所得微球的粒径要小,但粒径仍未达到理想的1~5 μm内。
Table 2 Effect of emulsion techniques and ultrasonic power on the average size of SAS-loaded HA microspheres (±s, n=3)表2 乳化方式及超声功率对微球平均粒径的影响(±s, n=3)

Table 2 Effect of emulsion techniques and ultrasonic power on the average size of SAS-loaded HA microspheres (±s, n=3)表2 乳化方式及超声功率对微球平均粒径的影响(±s, n=3)
Formulation n(homogenization) / (r·min-1) P(ultrasonic) / W dv/ µm SPAN F2 8×103 56.2±36.4 2.02±0.51 F3 1.2×104 46.5±33.6 1.93±0.35 F4 200 25.6±13.9 1.86±0.23 F5 500 14.3±9.32 1.66±0.15
2.5.3 乳化剂质量分数对微球粒径的影响
微球制备过程中,乳化剂的质量分数与形成的乳滴大小密切相关,并且直接影响形成的微球的粒径。实验中考察了4种质量分数的Span80对微球粒径的影响,结果见表3。当Span80的质量分数从初始处方中的1.0%(F5)增加到1.5%、2.0%和3.0%时,相应微球的粒径也略有降低,但其变化并不显著,可能是由于在现有实验条件下,1.0% Span80已经能够满足体系的需求,表现出了良好的乳化效果。进一步增大乳化剂的质量分数,虽然粒径无明显变化,但其增溶作用会增强,使药物在油相中的溶解度增加,进而降低微球的载药量。因此,优化处方中Span80的质量分数仍确定在1.0%。
Table 3 Effect of concentration of surfactant of SAS-loaded HA microspheres(±s, n=3)±s, n=3)表3 乳化剂质量分数对微球平均粒径的影响(

Table 3 Effect of concentration of surfactant of SAS-loaded HA microspheres(±s, n=3)±s, n=3)表3 乳化剂质量分数对微球平均粒径的影响(
Formulation w(Span80 ) / % dv/ µm SPAN F5 1.0 F6 1.5 13.72±9.137 1.62±0.14 F7 2.0 12.04±7.927 1.58±0.10 F8 3.0 11.86±7.459 1.56±0.11
2.6 优化微球处方及微球表面形态观察
单因素考察的结果显示,乳化的方式以及超声功率的大小对粒径的影响非常显著,因此将匀质与超声2种乳化方式相结合,将乳化方式定为先以1.2×104r·min-1匀质8 min,再在500 W超声5 min,其他处方因素依次为:透明质酸溶液质量浓度为6 g·L-1、油相为含质量分数1.0% Span80的蓖麻油、药物与载体的质量比为1∶1、内外相质量比为1∶10。按此优化条件制备的微球,其体积平均直径为(4.75±2.56)μm,跨距约1.55±0.09,回收率为(37.0±1.89)%。
电镜下观察,绝大部分微球的粒径都小于5 μm,与贝克曼测定的粒径大小基本一致。粒子形状较规则,为球形,表面不光滑,有突起(图 1)。据报道[9],表面多褶皱粒子的空气动力学行为较平滑的好,可能是由于粒子表面褶皱的存在,使得粒子之间的接触机会减少,减少彼此之间的聚集,更有利于保持分散的状态。

Fig. 1 SEM images of optimal HA microspheres prepared by emulsion solvent evaporation at different magnifications图1 乳化溶剂挥发法制备的优化处方微球在不同放大倍数下的扫描电镜图
2.7 载药量及影响因素探讨
HPLC法测定优化处方中的硫酸沙丁胺醇微球的载药量,测得载药量为(3.95±0.690)%,包封率为(8.24±1.22)%。进一步提高药物载体质量比,载药量亦无明显的改善。
为找到包封率低的原因,分别测定微球、制备微球后分离得到的含Span 80的蓖麻油和洗涤溶剂正己烷三部分样品中硫酸沙丁胺醇的含量。具体操作如下:微球制备后,收集所有分离后的蓖麻油和正己烷,称质量后,分别精密称定20 g,置于分液漏斗中,加入饱和NaCl溶液20 mL作为萃取剂,充分振摇后静置30 min使分层。分离并收集下面的水层,准确测定体积,取1 mL于1.6×10 r·min-1离心5 min,取上清液经0.22 μm微孔滤膜过滤后,进样,HPLC法测定。分别测得分离的蓖麻油和正己烷中药物的含量,平行操作3次,求平均值,结果见表4。
Table 4 Mass distribution of SAS after the preparation of SAS-loaded microspheres(±s, n=3)表4 微球制备后硫酸沙丁胺醇在各部分的质量分布(±s, n=3)

Table 4 Mass distribution of SAS after the preparation of SAS-loaded microspheres(±s, n=3)表4 微球制备后硫酸沙丁胺醇在各部分的质量分布(±s, n=3)
Items w(SAS ) / % Microspheres3.58 ± 0.942Castor oil 51.6 ± 3.56 n-hexane 6.37×10-2± 3.24×10-2
从表4中所显示的结果看,绝大部分的药物在制备过程中从内水相泄露到油相中是造成药物载药量和包封率低的直接原因。蓖麻油的主要成分是蓖麻油酸,是一种含羟基的不饱和脂肪酸,可通过氢键与硫酸沙丁胺醇相互作用[10],因而在以蓖麻油作为油相制备硫酸沙丁胺醇微球的过程中,绝大部分的药物向蓖麻油中转移,使得形成的微球载药量较低。
另外,需要说明的是三部分中回收的药物总质量为54%,这是由于油相中含有1.0%的Span80,在萃取过程中乳化非常严重,虽然有饱和NaCl帮助破乳,但效果不是十分明显,因而有部分药物形成了乳剂,造成了回收损失。
2.8 体外释药度评价
硫酸沙丁胺醇透明质酸微球的体外释放度测定结果见图 2。从释放曲线来看,药物从微球中的释放分为两个阶段:第一阶段为突释期,SAS在初始的1 min内的释放量接近62%,突释现象比较明显。这是由于应用乳化溶剂挥发法制备微球时,相当一部分药物会吸附在微球表面,在接触释放介质后,这部分药物迅速释放,使得制备得到的微球具有明显的突释效应[11-12]。第二阶段为药物的缓释期,该阶段药物的释放发生了明显的迟滞现象,持续时间约1 h。因为近表面药物已经在第一阶段释放完全,埋藏在微球内部的药物受到透明质酸高分子链的阻碍,使得扩散变得缓慢。此时释放介质PBS已向HA内部渗入,形成的溶胀性的HA骨架具有较大的黏度,使SAS通过的阻力增加,药物释放大大减缓。

Fig. 2 Cumulative in vitro release of SAS from HA microspheres using constant temperature bath oscillator and pH 7.4 PBS at 37 ℃ (±s, n=3)图2 硫酸沙丁胺醇从透明质酸微球中的累积释放曲线(恒温水浴振荡仪,pH 7.4、37 ℃ PBS为释放介质)
为了探讨药物从微球中释放的机制,作者对微球的释放曲线与以下4种数学模型进行拟合(表5),各模型的线性相关系数依次为:Ritger-Peppas>一级释放模型>Higuchi释放模型>零级释放模型。其中Ritger-Peppas方程的拟合度最好,其中k为常数,n表示释放机制的特征参数,与制剂的骨架的形状有关,对于球状骨架,其值< 0.43时,药物的释放特点服从Fick扩散。即对于硫酸沙丁胺醇微球,药物均匀地分散在透明质酸高分子材料中,外层的药物暴露在释放介质中,会首先溶解,然后扩散到骨架外面,此过程不断地在制剂内部和释放介质之间进行。在此期间,透明质酸为可生物降解的聚合物,与水溶性PBS接触后膨胀,形成凝胶屏障而控制药物的释放。硫酸沙丁胺醇微球的释药速率很大程度上取决于骨架中药物的初始质量浓度、药物溶解度和透明质酸聚合物的性质。
Table 5 Release fitted equation and correlation coefficients of SAS released from HA microspheres(±s, n=3)表5 硫酸沙丁胺醇微球释放曲线模型拟合(±s, n=3)

Table 5 Release fitted equation and correlation coefficients of SAS released from HA microspheres(±s, n=3)表5 硫酸沙丁胺醇微球释放曲线模型拟合(±s, n=3)
Kinetic model Fitted equation R2Zero-order Q =71.14+34.86t 0.829 6 First-order ln(1-Q) =-0.827-3.951t 0.965 0 Higuchi model Q =59.59+44.16t½ 0.958 4 Ritger-peppas lnQ = 4.095+0.124lnt 0.971 1
3 讨论
a. 作者采用乳化溶剂挥发法,应用高分子透明质酸为载体材料,制备了硫酸沙丁胺醇透明质酸微球,微球的粒径小,为(4.75±2.56)μm,且其体外释放表现出一定的缓释效果。目前,关于透明质酸应用于硫酸沙丁胺醇微球制备方面的研究尚未有文献报道。
b. 应用乳化溶剂挥发法制备微球时,处方和工艺因素对微球粒径影响较大。其中透明质酸的质量浓度、乳化方式、超声功率会对微球的粒径产生显著性影响,且相比于匀质,采用超声破碎方式得到微球的粒径更小。
c. 由于蓖麻油分子中有氢键存在,会与硫酸沙丁胺醇通过氢键相互作用,两者之间亲和力大大增加,从而在制备过程中,药物会向外相的蓖麻油中缓慢转移,造成药物从微球中“泄漏”,从而形成的微球载药量较低。
d. 硫酸沙丁胺醇从透明质酸微球中的释放表现为Fick扩散行为,即分散在微球中的药物不断溶解,并逐步扩散到释放介质中,此过程中透明质酸遇水后膨胀,形成的溶胀性的HA骨架具有较大的黏度,使SAS通过的阻力增加,药物释放大大减缓。硫酸沙丁胺醇微球的释药速率很大程度上取决于骨架中药物的初始质量浓度、药物溶解度和透明质酸聚合物的性质。
[1] PRASANTH V, CHAKRABORTY A, MATHEW S T, et al. Formulation and evaluation of salbutamol sulphate microspheres by solvent evaporation method[J]. Journal of Applied Pharmaceutical Science, 2011, 1(5): 133-137.
[2] AMPERIADOU A, GEORGARAKIS M. Controlled release salbutamol sulphate microcapsules prepared by emulsion solvent-evaporation technique and study on the release affected parameters[J]. Int J Pharm, 1995, 115(1): 1-8.
[3] EHRHARDT C, KNEUER C, BIES C, et al. Salbutamol is actively absorbed across human bronchial epithelial cell layers[J]. Pulmonary Pharmacology & Therapeutics, 2005, 18(3): 165-170.
[4] OBERDORSTER G. Lung clearance of inhaled insoluble and soluble particles[J]. Journal of Aerosol Medicine, 1988, 1(4): 289-330.
[5] PUCHELLE E, ZAHM J M, GIRARD F, et al. Mucociliary transport in vivo and in vitro. Relations to sputum properties in chronic bronchitis[J]. European Journal of Respiratory Diseases, 1980, 61(5): 254-264.
[6] STAHLHOFEN W, KOEBRICH R, Rudolf G, et al. Short-term and long-term clearance of particles from the upper human respiratory tract as function of particle size[J]. Journal of Aerosol Science, 1990, 21: 407-410.
[7] ROUSE J, WHATELEYT L, THOMAS M, et al. Controlled drug delivery to the lung: Influence of hyaluronic acid solution conformation on its adsorption to hydrophobic drug particles[J]. International Journal of Pharmaceutics, 2007,330(1): 175-182.
[8] LIM S T, MARTIN G P, BERRY D J, et al. Preparation and evaluation of the in vitro drug release properties and mucoadhesion of novel microspheres of hyaluronic acid and chitosan[J]. Journal of Controlled Release, 2000, 66(2): 281-292.
[9] BOSQUILLON C, LOMBRY C, PREAT V, et al. Influence of formulation excipients and physical characteristics of inhalation dry powders on their aerosolization performance[J]. Journal of Controlled Release, 2001, 70(3): 329-339.
[10] BARBOSA D D C, SERRA T M, MENEGHETTI S M P, et al. Biodiesel production by ethanolysis of mixed castor and soybean oils[J]. Fuel, 2010, 89(12): 3791-3794.
[11] O'DONNELL P B, MCGINITY J W. Preparation of microspheres by the solvent evaporation technique[J]. Advanced Drug Delivery Reviews, 1997, 28(1): 25-42.
[12] FREITAS S, MERKLE H P, GANDER B. Microencapsulation by solvent extraction/evaporation: reviewing the state of the art of microsphere preparation process technology[J]. Journal of Controlled Release, 2005, 102(2): 313-332.
Preparation and evaluation of sustained release salbutamol sulfate microspheres for pulmonary drug delivery
LI Ying, ZHENG Siqian, CUN Dongmei*
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveTo prepare sustained release microspheres suitable for pulmonary drug delivery.MethodsHyaluronic acid was used as carrier material and salbutamol sulfate was applied as model drug to prepare salbutamol sulfate loaded hyaluronic acid microspheres by emulsion solvent evaporation method. Effects of various parameters of formulation and process on volume mean diameter of microspheres were studied, and the in vitro release study of optimal microspheres was conducted as well.ResultsOptimal formulation was set as follows: 6 g·L-1HA as dispersed phase, castor oil contained 1.0% Span80 as continuous phase, ratio of drug polymer ratio as 1∶1, ratio of dispersed phase to continuous phase as 1∶10, homogenization speed (1.2×104r·min-1, 10 min) and ultrasonic power (500 W, 5 min). The drug-loaded HA microspheres prepared from optimal formulation were spherical with rough surfaces and possessed a average diameter of (4.75±2.56) μm, and also possessed small particle size distribution of 1.55±0.09. The in vitro release study suggests microspheres formed had a sustained release effect.ConclusionsPolymer concentration, emulsification techniques and surfactant concentration show significant influence on the particle sizes of microspheres. The characteristics of hyaluronic acid significantly affect the in vitro release behavior of prepared microspheres.
pharmaceutics; hyaluronic acid sustained release microspheres; emulsion solvent evaporation method; salbutamol sulphate; in vitro release; pulmonary drug delivery
(本篇责任编辑:赵桂芝)
R 94
A
(2016)05-0143-08
10.14146/j.cnki.cjp.2016.05.001
2015-05-07
国家自然科学基金资助项目(81302720)
李颖(1990-), 女(汉族), 湖南岳阳人, 硕士研究生,E-maildilemmaly@126.com;*
寸冬梅(1977-), 女(白族), 云南大理人, 副教授, 博士,硕士生导师,主要从事肺部药物传递系统及生物大分子药物传递系统研究,Tel.024-23986330,E-mailcundongmei@163.com。

