反应条件对合成苯氨基甲酸甲酯乙酸锌催化剂结构的影响
岳红杉,李 芳,高丽雅,张东升,王延吉
(河北工业大学 化工学院,天津 300130)
反应条件对合成苯氨基甲酸甲酯乙酸锌催化剂结构的影响
岳红杉,李 芳,高丽雅,张东升,王延吉
(河北工业大学 化工学院,天津 300130)
利用苯胺和碳酸二甲酯(DMC)为原料合成苯氨基甲酸甲酯(MPC)是一条清洁合成工艺路线,乙酸锌对于该反应具有优异的催化活性.本文对乙酸锌的在催化合成 MPC过程中的结构变化进行了研究.研究发现,不同条件反应后的乙酸锌会转化为不同结构的物质,在110℃反应7 h后,催化剂Zn OAc2会转化成层状羟基复盐Zn5OH8OAc22H2O(LHZA);随着反应温度的升高(130℃、150℃、170℃),LHZA易分解为ZnO;当反应温度增加至190℃时,则会生成碱式碳酸锌;当反应温度为130℃时,随着反应时间的延长,Zn OAc2先转化为LHZA,继而再生成ZnO,同时LHZA的层间距增大;nDMC∶nAN也会对生成的LHZA的层间距有较明显的影响,随着nDMC∶nAN的减少,LHZA的层间距随之增大.
苯胺;碳酸二甲酯;苯氨基甲酸甲酯;乙酸锌;结构
0 引言
聚氨酯制品的应用越来越受到各行业的广泛关注,合成聚氨酯的重要原料之一就是二苯甲烷二异氰酸酯(MDI),而MDI的合成尤以光气法为目前工业化的主要方法.但该方法存在原料剧毒、污染环境、副产物盐酸腐蚀设备等缺点而逐步被淘汰.近些年诸位学者将目光投向非光气路线的研究,其中碳酸二甲酯胺解法是生产MDI很有前景的路线之一,将碳酸二甲酯取代“剧毒”光气,同时反应条件温和.因此,本方法中苯氨基甲酸甲酯(MPC)是1个非常重要中间体,MPC制备方法的研究显得尤为重要.
碳酸二甲酯胺解法合成MDI的方程式如下:

该工艺仅副产甲醇和水,而甲醇又是氧化羰基化合成碳酸二甲酯的原料,因此该方法符合化工向清洁化发展的趋势[1].
该路线的第1步为关键步骤,目前报道的用于合成MPC的催化剂主要包括铅化合物[2-4]、锌化合物[5-13]及其他类型的催化剂[14-18]等.其中锌化合物具有优异的催化活性,而尤以乙酸锌最为突出.Gurgiolo等[5]以乙酸锌为催化剂催化苯胺和DMC合成苯氨基甲酸甲酯(MPC),在140℃反应6 h,MPC的收率为88.6%.由于乙酸锌为均相催化剂,存在分离和回收困难等问题.为此,本文制备了负载型乙酸锌催化剂,其中,ZnOAc2/SiO2的催化活性与Zn OAc2接近,当Zn OAc2负载量为30 w t%、焙烧温度为300℃时,苯胺的转化率和MPC收率分别为98.1%和93.8%[8].此外,对于其他芳胺和DMC的反应,乙酸锌也表现出优异的催化活性.Baba等[9]在反应温度为180℃,反应时间为2 h的条件下,以Zn OAc22H2O和Zn OAc2为催化剂时,二苯甲烷二胺(MDA)和DMC合成MDC的收率分别为87%和98%.Baba等[10]以乙酸锌为催化剂分别研究了2,4-甲苯二胺(TDA)和MDA与DMC的反应,在180℃反应2 h,2,4-甲苯二氨基甲酸甲酯(TDC)和MDC的收率分别为96%和98%.另外,Reixach等[11]发现乙酸锌催化剂对于TDA、MDA和碳酸二乙酯的反应也具有很好的催化活性,相应的氨基甲酸乙酯的收率均大于93%.他们还发现,Zn4O OAc6[12]对于芳胺和DMC的反应也具有良好的催化性能.然而其制备步骤复杂,成本较高.
综上可知,乙酸锌催化剂对于合成氨基甲酸甲酯表现出优异的催化活性.但乙酸锌催化剂易失活,文献所报道的其失活原因是由于其和该反应副产的甲醇生成对合成MPC没有活性的ZnO所致[8,19].然而,本课题组发现,不同反应条件下乙酸锌会转化成不同的物质,鉴于此,本文对乙酸锌催化合成MPC过程中的结构变化进行了探讨.
1 实验方法
1.1 实验主要试剂
苯胺,分析纯,天津化学试剂一厂;碳酸二甲酯(99.5%),唐山朝阳化工有限公司;乙酸锌,分析纯,天津市科密欧化学试剂有限公司;甲醇,色谱纯,天津市科密欧化学试剂有限公司;硝基苯,分析纯,国药集团上海化学试剂公司;苯氨基甲酸甲酯(>98.0%),东京化成工业株式会社.
1.2 催化剂活性评价
利用间歇釜式反应器评价催化剂的活性,将一定量的苯胺、DMC和无水乙酸锌置于反应釜中,在设定温度下反应一定时间.反应结束后冷却至室温,取出反应混合物,滤除固体催化剂,得到反应液,反应液利用高效液相色谱(HPLC)进行定量分析.
1.3 产物分析方法及催化剂表征
利用美国Waters公司的高效液相色谱仪(HPLC)对反应液进行内标法定量分析,分析条件为:流动相:v CH3OH:v H2O=70∶30;流速:0.4 m l/m in;色谱柱:KromasilTMC18,直径4.6mm×150mm;粒径:5m;紫外检测波长:=254 nm.
利用日本理学D/MAX2500型X射线衍射仪对催化剂进行表征.
2 结果与讨论
本文在实验中发现,不同反应条件下乙酸锌会转化为不同的物质,为此考察了反应条件对乙酸锌活性的影响,同时将反应后的乙酸锌催化剂进行了XRD表征,研究乙酸锌在催化MPC反应过程中的变化.
2.1 反应温度的影响
图1是反应温度对Zn OAc2催化合成MPC反应性能的影响.可以看出,随着反应温度的升高,苯胺转化率和MPC产率均随之升高.当反应温度为130℃时,苯胺转化率、MPC产率达到最高,分别为98.0%,97.3%;继续升高温度,苯胺转化率基本保持不变,而MPC产率反而略有下降.对不同温度下的产物进行分析发现,当反应温度为130℃、150℃时,产物中除MPC外,还发现有二苯基脲(DPU)的生成(其产物中的质量百分含量均为0.6%);当反应温度升至170℃、190℃,产物中出现了N-甲基苯胺(NMA),其在产物中的质量百分含量分别为0.9%和1.1%,而产物中DPU的含量几乎为0,这可能是由于DPU在高温下发生醇解反应,生成了MPC所致.由此可以看出,高温下易于N-甲基化产物的生成,导致MPC的产率下降.因此,130℃为最佳反应温度.
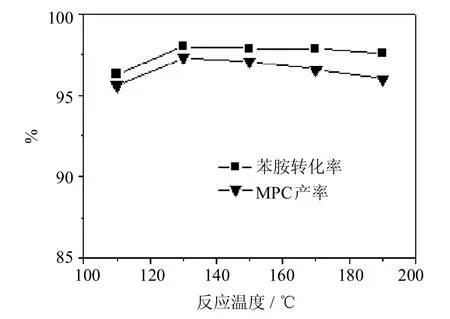
图1 反应温度对乙酸锌催化性能的影响Fig.1 Effectof reaction temperatureon catalytic performanceof Zn(OAc)2Reaction conditions:mZn(OAc)2:mAN=0.27:1;nDMC:nAN=20:1;t=7 h
图2是不同温度反应后催化剂的XRD谱图.可看出,当反应温度为110℃时,反应后催化剂在2分别为5.1°、33.4°和59.3°出现了明显的衍射峰,分别对应于层状羟基复盐Zn5OH8OAc22H2O(简称LHZA)(001)、(100)和(110)晶面的衍射峰[20-22],这说明了110℃反应后的乙酸锌转变为层状羟基复盐LHZA.Hosono等人[23-25]以ZnOAc22H2O为原料、以甲醇为溶剂制备ZnO时发现会形成中间体LHZA,LHZA再发生水解和聚合反应得到ZnO,其反应方程式如下:

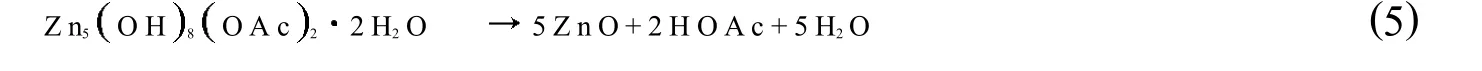

图2 不同温度反应后催化剂的XRD谱图Fig.2XRD patternsof the catalystsafter reaction ata temperature of a)110℃,b)130℃,c)150℃,d)170℃,e)190℃
可以看出,发生上述反应使用的是带有结晶水的乙酸锌,然而,在催化苯胺和DMC的反应中,使用的是无水Zn OAc2.然而,同样Zn OAc2也会发生转变生成LHZA.生成LHZA时所需的水有两个来源,一方面来自于DMC中微量的水,另一方面,DMC水解时会生成甲醇,另外,苯胺和DMC反应生成MPC时也会副产甲醇,而甲醇会与上述方程式中副产的乙酸发生酯化反应生成H2O.由此可见,H2O的存在会加速ZnOAc2的失活.为了延长Zn OAc2催化剂的使用寿命,应对原料DMC进行脱水处理;另外,还要及时移除反应中生成的甲醇,从而降低甲醇和副产的乙酸发生酯化反应的几率.
当反应温度升至130℃时,反应后的催化剂同时出现了LHZA和ZnO的衍射峰,其中LHZA的 (001)晶面衍射峰向小角度发生偏移,说明LHZA的层间距变大.当反应温度分别为150℃和170℃时,反应后的催化剂仅出现了ZnO的衍射峰,而当反应温度升至190℃时,反应后的催化剂则同时出现ZnO和Zn5OH6CO32的衍射峰.Hales等[25]发现在水和CO2存在的条件下ZnO易生成Zn5OH6CO32.由于DMC中含有微量的水,在高温下易发生水解反应生成甲醇和CO2,温度越高,其水解程度增大,使得反应体系中CO2的量增大,由此我们认为在高温下利于 DMC的水解,从而使得反应体系中 CO2的量增大,从而会有利于 ZnO转化为Zn5OH6CO32.
2.2 反应时间的影响
当反应温度为130℃时,考察了反应时间对ZnOAc2催化合成MPC反应性能的影响,结果见图3所示.可以看出,随着反应时间的延长,苯胺转化率及MPC产率均随之升高,当反应时间为3h时,苯胺和MDA接近完全转化,同时,MPC的产率达到最大,为97.4%;继续延长反应时间,MPC的产率几乎不变,由此可以看出,3h为最佳反应时间.
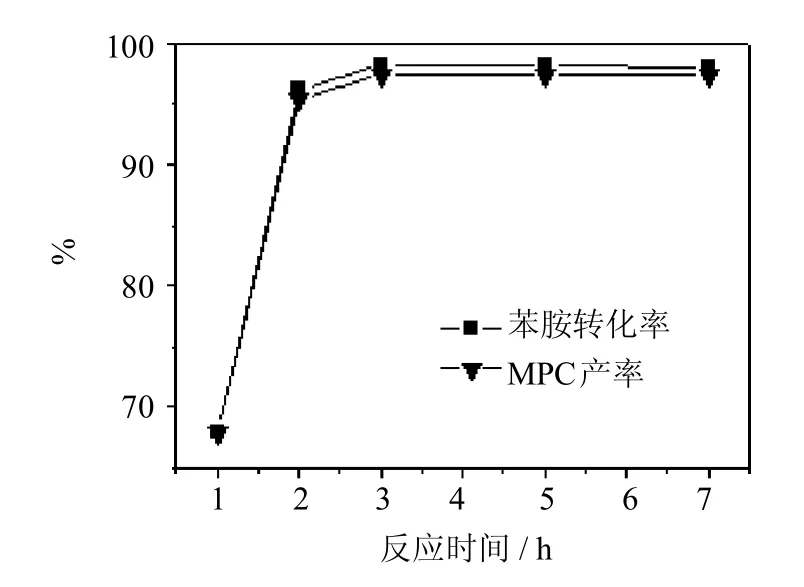
图3 反应时间对乙酸锌催化活性的影响Fig.3 Effectof reaction timeon catalytic performanceof Zn(OAc)2Reaction conditions:mZn(OAc)2∶mAN=0.27∶1nDMC:nAN=20∶1;T=130℃
图4是不同反应时间后催化剂的XRD谱图.可看出,当反应时间低于5 h时,催化剂仅出现LHZA的衍射峰.反应时间为1h时,LHZA仅在6.2°(001)处出现了特征衍射峰,可能因为反应时间较短时,LHZA正处于形成过程,其在轴向(001)晶面优先定向生长的缘故[26].而当反应时间延长至7 h,则同时出现 ZnO和LHZA的衍射峰,由此可看出,随着反应时间的延长,LHZA会逐渐转化为ZnO,这与Xia等人的研究结果是一致的[20].此外,随着反应时间的延长,LHZA(001)晶面处的衍射峰位置向小角度发生了偏移,说明LHZA的层间距变大,这说明反应时间会影响LHZA层间距.
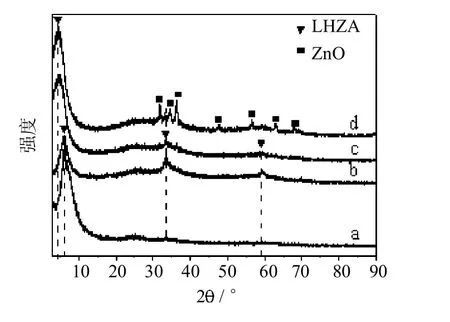
图4 反应温度为130℃不同反应时间后催化剂的XRD谱图Fig.4 XRD patternsof the catalystsafter reaction ata temperatureof 130℃and a reaction timeof a)1h,b)3h,c)5h,d)7h
2.3 催化剂用量的影响
当反应温度为130℃、反应时间为3 h时,考察了催化剂Zn OAc2用量对于合成MPC反应性能的影响,结果见图5所示.可以看出,随着催化剂Zn OAc2用量的增加,苯胺的转化率和MPC的产率随之增大,当mZnOAc2mAN为0.14∶1时,苯胺的转化率和MPC的产率分别为96.3%,95.4%;继续增大Zn OAc2用量,苯胺的转化率和MPC的产率几乎不变.

图5 催化剂用量对乙酸锌催化性能的影响Fig.5 Effectof catalystamounton catalytic performanceof Zn(OAc)2Reaction conditions:nDMC:nAN=20∶1;T=130℃;t=3h
图6是不同mZnOAc2∶mAN反应后催化剂的XRD谱图.可以看出,当mZnOAc2∶mAN介于0.068与0.27之间时,反应后的乙酸锌均转化为LHZA.此外,当mZnOAc2∶mAN为0.068时,还在2为12.2°和18.3°处出现了衍射峰,分别对应层状羟基复盐LHZA(002)和 (003)晶面[20].需要指出的是,当mZnOAc2∶mAN为0.068时,LHZA(001)晶面衍射峰的半峰宽明显小于其他条件下生成的LHZA (001)晶面衍射峰,这说明当mZnOAc2∶mAN为0.068时生成的LHZA晶粒较大,因此LHZA(002)和(003)晶面的衍射峰仅在mZnOAc2∶mAN为0.068的条件下出现.
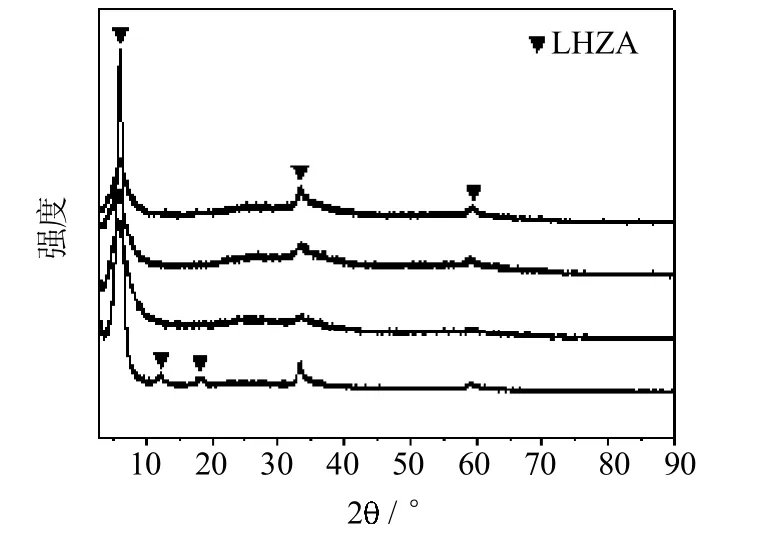
图6 不同催化剂用量下反应后催化剂的XRD谱图Fig.6 XRD patternsof catalystsafter reaction of differentcatalyst amountsa-mZn(OAc)2∶mAN=0.068;b-mZn(OAc)2∶mAN=0.10;c-mZn(OAc)2∶mAN=0.14;d-mZn(OAc)2:mAN=0.27
2.4 原料配比的影响
考察了原料配比对催化剂Zn OAc2催化合成MPC反应性能的影响,结果见图7所示.随着nDMC∶nAN增加,苯胺转化率和MPC产率随之增大,当nDMC∶nAN为20时,苯胺转化率和MPC产率达到最高,分别为96.3%,95.4%;继续增大nDMC∶nAN苯胺转化率和MPC产率几乎不变.
图8是不同nDMC∶nAN条件下反应后催化剂的XRD表征.可以看出,当nDMC∶nAN介于15~20时,反应后乙酸锌均转化为LHZA.此外,随着nDMC∶nAN的减少,LHZA(001)晶面处的衍射峰位置向小角度发生了偏移,说明LHZA的层间距变大,由此可以看出,DMC用量减少,会使得LHZA的层间距变大.
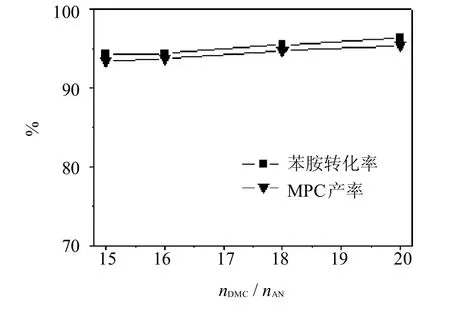
图7 原料配比对乙酸锌催化性能的影响Fig.7 Effectof raw material ratio on catalytic performanceof ZnOAc2Reaction conditions:mZn(OAc)2∶mAN=0.14∶1;T=130℃;t=3 h
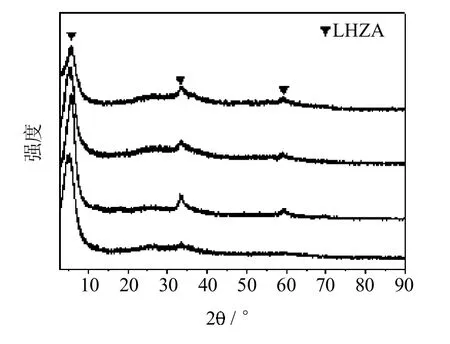
图8 不同nDMC∶nAN条件下反应后催化剂XRD谱图Fig.8 XRD patternsof catalystsafter reaction atdifferent nDMC∶nANa-nDMC∶nAN=15;b-nDMC∶nAN=16;c-nDMC∶nAN=18;d-nDMC∶nAN=20
通过上述讨论可知,乙酸锌在催化苯胺和DMC反应合成MPC时,会先转化为LHZA,继而再转化为ZnO、碱式碳酸锌.而生成LHZA时需要H2O的参与,其中H2O来源于DMC中微量的H2O以及甲醇和乙酸锌反应时副产的H2O.由此可以看出,反应中H2O的存在会利于LHZA的生成,从而导致Zn OAc2的失活.为了减缓Zn OAc2的失活,应对原料DMC进行脱水处理,如利用分子筛脱水、膜分离技术脱水[27],此外,还应及时将反应副产的甲醇采取反应精馏的方法从反应体系移出或将其原位消耗掉,这是我们今后的研究方向.
3 结论
1)优化了乙酸锌催化合成MPC和MDC的反应条件,当mZnOAc2∶mAN=0.14∶1、nDMC∶nAN=20∶1、T= 130℃、t=3 h时,苯胺转化率和MPC产率达到最大,分别是96.3%、95.4%;
2)不同条件反应后的乙酸锌会转化为不同的物质,在110℃反应7h后,催化剂Zn OAc2会转化成LHZA;随着反应温度的升高(130℃、150℃、170℃),LHZA易分解为ZnO;当反应温度增加至190℃时,则会生成碱式碳酸锌;当反应温度为130℃时,随着反应时间的延长,Zn OAc2先转化为LHZA,继而再生成ZnO,同时LHZA的层间距增大;nDMC∶nAN也会对生成的LHZA的层间距有较明显的影响,随着nDMC∶nAN的减少,LHZA的层间距随之增大.
[1]王延吉,赵新强.绿色催化过程与工艺 [M].北京:化学工业出版社,2002,172.
[2]Fu ZH,Ono Y.SynthesisofmethylN-phenylcarbamatebymethoxycarbonylationofanilinew ith dimethylcarbonateusing Pb compoundsascatalysts [J].JMolCatal A:Chem,1994,91(3):399-405.
[3]Wang SP,Zhang G L,Ma X B,etal.Investigationsof catalytic activity,deactivation,and regeneration of Pb OAc2formethoxycarbonylation of 2,4-Toluene diaminewith dimethyl carbonate[J].Ind Eng Chem Res,2007,46(21):6858-6864.
[4]PeiY X,LiHQ,Liu H T,etal.Kinetic study ofmethoxycarbonylation ofmethylenedianilinew ith dimethylcarbonateusing lead acetate catalyst [J].Ind Eng Chem Res,2011,50(4):1955-1961.
[5]Gurgiolo A E,Lake J.Preparation of carbamates from aromatic aminesand organic carbonates[P].US 4268683,1981-05-19.
[6]BosettiA,CestiP,Calderazzo F.Process for the production of aromatic carbamates[P].US 5698731,1997-12-16.
[7]王延吉,张文会.二苯甲烷二异氰酸酯清洁合成过程研究 [J].石油学报(石油加工),1999,15(6):9-14.
[8]Li F,LiW B,Li J,etal.Investigation of supported ZnOAc2catalystand its stability in N-phenyl carbamate synthesis[J].Appl Catal A:Gen,2014,475:355-362.
[9]Baba T,KobayashiA,YamauchiT,etal.Catalyticmethoxycarbonylationofaromatic diamineswithdimethylcarbonate to theirdicarbamatesusing zinc acetate[J].Catal Lett,2002,82(3-4):193-197.
[10]Baba T,KobayashiA,Kawanam iY,etal.Characteristicsofmethoxycarbonylation of aromatic diam inewith dimethyl carbonate to dicarbamate using a zinc acetate catalyst[J].Green Chem,2005,7(3):159-165.
[11]Reixach E,Bonet N,Rius-Ruiz FX,etal.Zinc acetates as efficientcatalysts for the synthesisof bis-isocyanate precursors[J].Ind Eng ChemRes,2010,49(14):6362-6366.
[12]Reixach E,Haak RM,Wershofen S,etal.A lkoxycarbonylation of Industrially RelevantAnilinesUsing Zn4O O2CCH36asCatalyst[J].Ind Eng Chem Res,2012,51(50):16165-16170.
[13]LiF,Wang Y J,XueW,etal.Clean synthesisofmethylN-phenyl carbamate over ZnO-TiO2catalyst[J].JChem Technol Biotechnol,2009,84(1):48-53.
[14]LiF,M iao J,Wang Y J,etal.SynthesisofmethylN-phenylcarbamate from anilineand dimethylcarbonateoversupported zirconia catalyst[J].Ind Eng Chem Res,2006,45(14):4892-4897.
[15]李其峰,王军威,董文生,等.苯胺与碳酸二甲酯反应合成苯氨基甲酸甲酯 [J].催化学报,2003,24(8):639-642.
[16]Juárez R,Pennemann H,GarcíaH.Continuous flow carbamoylation of anilineby dimethylcarbonateusing amicroreactor coated w ith a thin film of ceria supported gold nanoparticles[J].Catal Today,2011,159(1):25-28.
[17]Katada N,Fujinaga H,Nakamura Y,et al.Catalytic activity ofmesoporous silica for synthesis ofmethyl N-phenyl carbamate from dimethyl carbonateand aniline[J].Catal Lett,2002,80(1-2):47-51.
[18]LucasN,Am rute A P,PalrajK,etal.Non-phosgene route for the synthesisofmethylphenylcarbamateusing ordered AISBA-15 catalyst[J].J MolCatalA:Chem,2008,295(1-2):29-33.
[19]Tonto P,Mekasuwandum rong O,PhatanasriS,etal.Preparationof ZnO nanorod by solvothermal reactionofzinc acetate in variousalcohols[J].Ceram Int,2008,34(1):57-62.
[20]Xia ZB,Wang YW,Fang Y J,etal.Understanding theorigin of ferromagnetism in ZnO porousm icrospheresby systematic investigationsof the thermaldecomposition of Zn5OH8Ac22H2O to ZnO[J].JPhysChem C,2011,115(30):14576-14582.
[21]PoulL,JouiniN,FiévetF.Layered hydroxideMetalacetates(Metal=Zinc,Cobalt,and Nickel):Elaboration viahydrolysisin polyolmedium and comparative study[J].Chem Mater,2000,12(10):3123-3132.
[22]Hosono E,Fujihara S,Kimura T,etal.Grow th of layered basic zinc acetate inmethanolic solutionsand its pyrolytic transformation into porous zinc oxide films[J].JColloid Interface Sci,2004,272(2):391-398.
[23]Znaidi L.Sol-gel-diposited ZnO thin films:A review[J].Mater SciEng B,2010,174(3):18-30.
[24]Hosono E,FujiharaS,Kimura T,etal.Non-basicsolution routes to prepare ZnOnanoparticles[J].JSol-gelSciTechnol,2004,29(4):71-79.
[25]HalesM C,FrostR L.Thermalanalysisof sm ithsoniteand hydrozincite[J].JTherm AnalCal,2008,91(3):855-860.
[26]Reinoso D M,DamianiD E,Tonetto GM.Synthesisof biodiesel from soybean oilusing zinc layered hydroxide saltsas heterogeneous catalysts [J].Catal SciTechnol,2014,4:1803-1812.
[27]WonaW,FengaX,Law lessD.Pervaporationw ith chitosanmembranes:separationofdimethylcarbonate/methanol/waterm ixtures[J].JMembr Sci,2002,209:493-508.
[责任编辑 田 丰 夏红梅]
Effectof reaction conditionson of Zn OAc2inmethylN-phenyl carbamate synthesis
YUEHongshan,LIFang,GAO Liya,ZHANG Dongsheng,WANG Yanji
(Schoolof Chem icalEngineering,HebeiUniversity of Technology,Tianjin300130,China)
ThesynthesisofmethylN-phenylcarbamate(MPC)from anilineand dimethylcarbonate(DMC)isacleaning route.Zn OAc2showsexcellentcatalytic performance forMPC synthesis.The transformation of Zn OAc2in MPC synthesiswasinvestigated and itwas found thatZn OAc2is transformed into differentsubstancesundervarious reaction conditions.After the reactionata temperatureof110℃for7 h,Zn OAc2isinitially transformed into Zn5OH8OAc22H2O (LHZA).With the reaction temperature increasing(130℃,150℃,170℃),LHZA subsequently decomposes to ZnO and then forms Zn5OH6CO32at190℃.At130℃,and the reaction time increases from 1 h to 3 h,LHZA interlayer distance increases.With the further increase in reaction time,LHZA is transformed into ZnO.Changes of the value of nDMC∶nANaffectsonly the LHZA interlayerdistance.With thedecreased nDMC∶nANvalues,the interlayerdistanceof LHZA increases.
aniline;dimethyl carbonate;methylN-phenyl carbamate;Zn OAc2;transformation
TQ245.24
A
1007-2373(2016)02-0080-06
10.14081/j.cnki.hgdxb.2016.02.014
2015-03-03
国家自然科学基金(21106031,21106029);河北省科技计划项目(12217635)
岳红杉(1987-),女(汉族),硕士生.通讯作者:王延吉(1962-),男(汉族),教授.
数字出版日期:2016-04-26 数字出版网址:http://www.cnki.net/kcms/detail/13.1208.T.20160426.0949.014.htm l

