水分胁迫下不同抗旱性小麦品种叶片转录因子表达差异研究
秦 鹏,刘秉焱,韩翠英,刘虎岐
(西北农林科技大学 生命科学学院,陕西杨陵 712100)
水分胁迫下不同抗旱性小麦品种叶片转录因子表达差异研究
秦 鹏,刘秉焱,韩翠英,刘虎岐*
(西北农林科技大学 生命科学学院,陕西杨陵 712100)
通过研究不同抗旱性小麦品种中转录因子表达水平的差异,为阐明小麦抗旱机制奠定基础。依据候选基因序列设计PCR引物,以干旱胁迫后0、3、6、9、12和24 h的小麦叶片为实验材料,以26S rRNA为内参,运用荧光定量PCR技术,检测Wdreb2、Wlip19基因在干旱敏感性和干旱耐受性小麦叶片中的相对表达量。定量PCR结果显示:干旱胁迫后,Wdreb2、Wlip19基因在干旱敏感性小麦叶片中的表达明显低于干旱耐受性小麦,在不同品种叶片中的响应时间和表达趋势存在差异。研究认为,Wdreb2、Wlip19基因在不同品种小麦受到干旱胁迫后的表达差异,与该品种小麦的抗旱能力具有一定的相关性。
小麦;干旱胁迫;转录因子;实时荧光定量PCR
干旱是影响西北地区作物产量的重要因素之一。植物在受到干旱胁迫时,体内会被诱导产生多种调控因子和功能蛋白来对抗干旱胁迫[1,2]。转录因子作为调控因子,它可以激活一系列胁迫耐受应答基因表达,产物包括相溶性溶质、胚胎晚期丰富蛋白、活性氧清道夫和热激蛋白等等,从而综合提高植物的胁迫耐受能力。现已有多种调控干旱相关基因表达的转录因子基因被克隆出来。在拟南芥(Arabidopsisthaliana)中,已经有超过50个家族至少1 700个编码转录因子的基因被克隆出来[3-7],其中有相当一部分与干旱胁迫应答相关[8-9]。例如:bZIP家族的AREB/ABF基因可对干旱产生响应[10],AP2/ERF基因家族的DREB1亚家族转录因子受脱水和冷诱导[11],NAC家族的ANACO19、ANACO55和ANACO72则被干旱、高盐和ABA诱导表达[12]。大量研究表明,在植物对抗干旱胁迫过程中,转录因子起着非常重要的作用[13-16]。
根据文献报道,DREB和bZIP这两类转录因子在小麦对抗干旱过程中扮演着重要角色[17-19]。在前人的研究当中,Wdreb2、Wlip19被证实是能够明显提高小麦抗旱能力的2个基因[20-21]。本研究通过SYBR Green染料实时定量PCR,以小麦基因26S rRNA为内参,采用相对定量方法,从mRNA转录水平定量检测Wdreb2和Wlip19这2个基因在西北地区常见的10种不同品种小麦(5种干旱敏感性,5种干旱耐受性)受到干旱胁迫后叶片中的表达差异,试图发现不同抗旱转录因子在小麦抗旱机理中发挥的作用程度,进一步为小麦抗旱机理的研究奠定基础。
1 材料和方法
1.1 植物材料与处理
植物材料为10个品种的小麦幼苗,分为干旱敏感性:西农979、西农165、中麦895、小偃22、周麦18;干旱耐受性:晋麦47、运旱805、普冰9946、普冰143、普冰151。
采用水培法,种子用蒸馏水清洗2次,然后用10 %次氯酸钠消毒10 min,再用蒸馏水清洗干净。在培养皿底部铺2层滤纸,将种子均匀铺上,加入蒸馏水,暗室催芽12 h~24 h,出芽后置于光照恒温培养箱(32 ℃、光照12 h)中培养。在小麦生长至6~7 d时,采用20% PEG 6000模拟干旱胁迫,并相应设置水处理对照。取经干旱胁迫处理0、3、6、9、12和24 h及对照植株的叶片,用液氮速冻,置-70 ℃保存备用。
1.2 候选基因与引物
根据Wdreb2(GenBank登记号为AB193608)、Wlip19(GenBank登记号为AB193552)基因在NCBI上公布的序列,使用Primer Premier 5.0软件,分别设计2对特异性引物,上游引物Wdreb2-F:(5′-AGATGTTGCTTCTTCCTTGCC-3′);Wlip19-F:(5′-CAGCCTCGTTTCTTCCACTTT-3′),下游引物Wdreb2-R:(5′-GATGTGCTCCTTGAAATGCTTG-3′);Wlip19-R:(5′-GACATGGTCGGTCGGGTTC-3′)。内参根据小麦26S rRNA(GenBank登记号为NC022714)基因的序列,设计1对特异性引物,上游引物26S-F:(5′-GAAGAAGGTCCCAAGGGTTC-3′),下游引物26S-R:(5′-TCTCCCTTTAACACCAACGG-3′)。引物由华大基因公司合成。通过梯度PCR确定最佳退火温度,作为实时荧光定量PCR的退火温度,20 g/L的琼脂糖凝胶电泳鉴定引物的正确性。
1.3 RNA提取与反转录
采用Trizol试剂(TaKaRa公司),按其说明书的方法提取小麦幼叶总RNA。经超微量紫外分光光度计检测,计算OD260/OD280、OD260/OD230,确定RNA的纯度,再利用琼脂凝胶电泳检测RNA的完整性。选取较完整、纯度高且没有降解的RNA进行cDNA合成,cDNA第1链合成参照PrimeScript RT reagent Kit With gDNA Eraser(TaKaRa公司)操作方法。
1.4 PCR条件的优化
对设计出的引物按照退火温度55~65 ℃、引物浓度0.2~0.6 mol/L、循环数30~35分别进行普通PCR扩增,以得到扩增产物凝胶电泳结果没有非特异性条件,并且目的条带清晰的最佳PCR条件,并按照该条件进行下一步的实时荧光定量PCR扩增。
1.5 实时荧光定量PCR
采用TaKaRa公司SYBR Premix EXTaqTM(Perfect Real Time)试剂盒,10 μL体系里包含5 μL SYBR®Premix EXTaqTM、上下游引物各0.2 μL 、0.8 μL cDNA模板、3.8 μL 灭菌超纯水。使用CFX96型号PCR仪(Bio-Rad公司)进行反应,每个样品重复检测3次。PCR反应采用2步法:95 ℃预变性5 min,95 ℃变性10 s,Tm ℃退火及延伸30 s,循环35次,延伸阶段收集荧光信号;反应结束后65 ℃ 5 s,并以0.5 ℃/s的速度升至95 ℃进行溶解曲线分析。
1.6 数据的分析
实验采用实时定量PCR相对定量方法,选择2-ΔΔCt方法[22]计算胁迫处理的样品和对照组样品中目标基因的相对表达量。
2 结果与分析
2.1 小麦叶片总RNA质量的检测
不同处理时间和不同品种小麦叶片样品的总RNA经超微量紫外分光光度计检测表明,OD260/OD280均在1.8~2.1,OD260/OD230在1.9~2.2,说明提取的RNA纯度较高;经变性琼脂糖凝胶电泳检测得知,各组织总RNA均有较清晰的3条带,分别为5S、18S和28S rRNA,且无严重弥散现象(图1)。说明提取样品的总RNA无明显降解现象,完全能够满足后续试验要求。
2.2 Wdreb2、Wlip19与26S rRNA的反转录检测
琼脂糖凝胶电泳检测结果(图2)显示,PCR扩增产物条带单一,无非特异性扩增及引物二聚体出现,Wdreb2、Wlip19与26S rRNA均与预期片段大小一致,说明引物可以正确扩增出响应片段,可用于实时定量PCR分析。

图1 小麦叶片总RNA的电泳检测结果Fig.1 Agarose gel analysis of total RNA of wheat leaves
2.3 Wdreb2与Wlip19表达的实时荧光定量PCR检测
按照公式相对表达量=2-ΔΔCt,以26S rRNA为内参基因,以水培养的小麦叶片组织的Wdreb2,Wlip19基因为参照因子,设为1,分别得到受到干旱胁迫处理3、6、9、12和24 h的叶片组织中Wdreb2,Wlip19基因的表达数据曲线(图3,图4)。
2.3.1Wdreb2在不同小麦品种中的表达 与水培对照组相比,5个敏感性小麦(西农979、西农165、小偃22、周麦18、中麦895)在处理组中Wdreb2基因的表达均呈现先上调后下调且趋于稳定的趋势,表达量到达峰值的时间大部分集中在6 h处,其中,小偃22集中在9 h处,较其他2个品种慢。
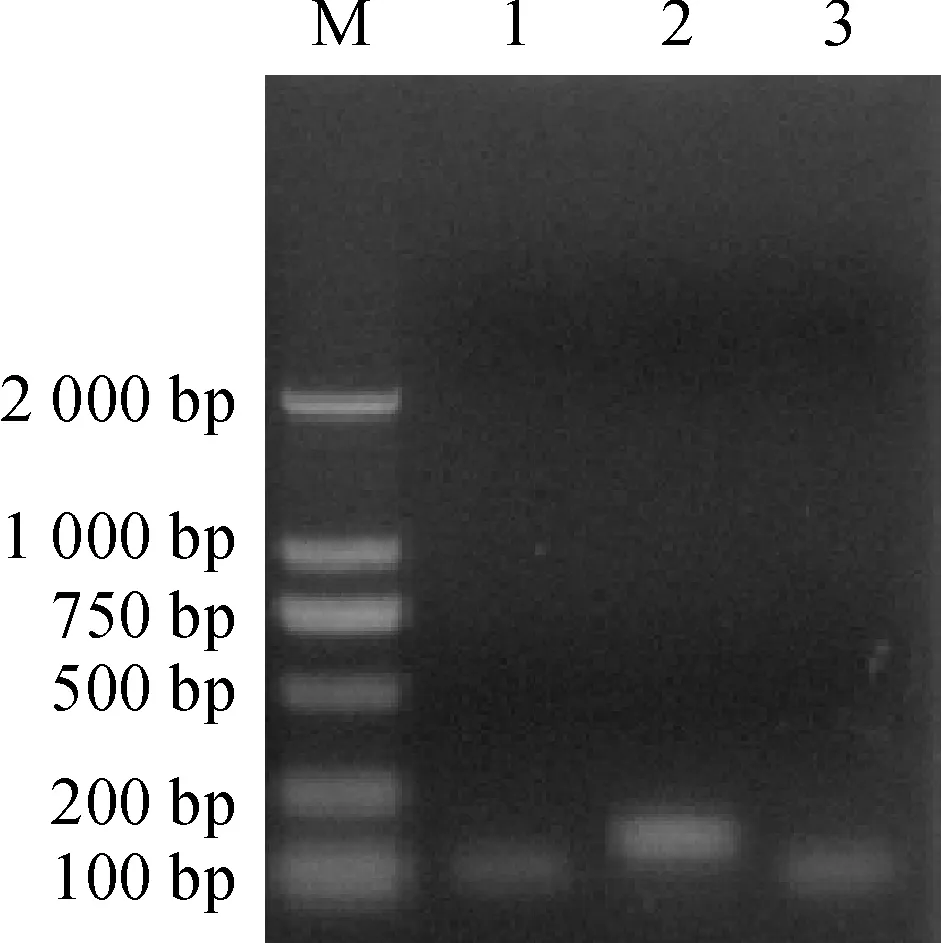
M.DNA marker D2000;1.26S rRNA;2.Wdreb2;3.Wlip19图2 Wdreb2、Wlip19和内参基因26S rRNA PCR扩增产物的琼脂糖凝胶电泳检测结果Fig.2 PCR amplification product of Wdreb2,Wlip19 and reference gene 26S rRNA
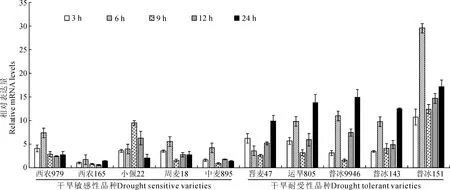
图3 10种小麦品种中Wdreb2基因相对表达量的变化Fig.3 Relative expression levels of Wdreb2 in leaves of ten wheat varieties

图4 10种小麦品种中Wlip19基因相对表达量的变化Fig.4 Relative expression levels of Wlip19 in leaves of ten wheat varieties
5个耐受性小麦(晋麦47、运旱805、普冰9946、普冰143、普冰151)经处理后,5个处理组中的表达均呈现先上调后下调再上调的趋势,具有两个表达峰值,主要集中在6 h处和24 h处(晋麦47集中在3 h和24 h处)。虽然Wdreb2基因在各个品种中的相对表达量不一样,但具有大体一致的表达趋势,进一步说明Wdreb2基因参与干旱应答过程。
2.3.2Wlip19在不同小麦品种中的表达 与水培对照组相比,敏感性小麦(西农979、小偃22、周麦18、西农165和中麦895)经处理后,5个敏感性品种处理组中Wlip19的表达均呈现先上调后下调再上调的趋势,均具有两个表达峰值,且均集中在6 h处和24 h处,这两个峰值与对照组均呈现显著性差异;同时所有处理组的表达均无下调现象。其中西农979和小偃22在3 h处表达明显高于对照组,均在2倍以上,说明Wlip19基因在这2个品种中对干旱响应较其他3个品种早。
5个耐受性小麦(晋麦47、运旱805、普冰9946、普冰143、普冰151)经处理后,所有品种处理组中的表达量与对照组相比均有显著性差异,其中在3 h处表达量最高,为对照组的6~10倍,随后逐渐下降且趋于稳定。
3 讨 论
Wdreb2、Wlip19在小麦受到干旱胁迫后作为正调控因子对小麦干旱胁迫起调控作用。Wdreb2、Wlip19在干旱耐受性小麦与干旱敏感性小麦叶片中的表达都受干旱胁迫影响呈上调趋势,这与已报道的研究结论基本一致[23-26]。这表明Wdreb2、Wlip19在小麦对抗干旱过程中起着比较重要的调控作用。
Wdreb2、Wlip19在不同品种小麦叶片中呈现差异性表达。从结果中可以看出,Wdreb2、Wlip19在干旱耐受性小麦叶片中表达量明显比在干旱敏感性小麦叶片中高。说明Wdreb2、Wlip19存在基因型表达特异性。在小麦受到干旱胁迫后,Wdreb2、Wlip19在干旱诱导下表达量开始上调,从而合成更多的转录因子,与顺式作用元件结合,调控不同的抗旱基因的表达,对干旱胁迫做出响应。
Wdreb2、Wlip19在不同品种小麦叶片中胁迫响应时间存在差异。Wdreb2基因在干旱耐受性小麦与干旱敏感性小麦叶片中对于PEG胁迫的响应时间都集中在6 h,而Wlip19基因在干旱耐受性小麦叶片中对于PEG胁迫的响应时间要比干旱敏感性小麦叶片中早,前者集中在3 h,后者集中在6 h。原因分析可能是由于Wlip19的表达受ABA的诱导,在不同品种小麦中,ABA的含量变化不同,在干旱耐受性小麦受到干旱胁迫后,ABA含量增加的速度快,所以Wlip19在干旱耐受性小麦叶片中对干旱胁迫响应的时间要比敏感性小麦早。
Wdreb2、Wlip19在不同品种小麦叶片中表达趋势存在差异。在干旱耐受性小麦叶片的实时定量结果中,Wdreb2出现了两个表达峰,在第一次表达量上调到峰值后,其表达量开始出现下调,待下调到一定程度后,表达量又会上调,即表现出 “上调-下调-上调”的趋势;Wlip19出现了一个表达峰,在上调到峰值后,开始逐渐下调,并趋于稳定。在敏感性小麦叶片中,Wdreb2只出现了一个表达峰,在表达量上调到峰值后,其表达量开始下调,到达一定程度后趋于稳定;Wlip19出现了两个表达峰,表现出一个“上调-下调-上调”的趋势。分析原因,我们认为这是由于品系间差异性所致,调控抗旱基因表达的途径和转录因子太多,其表达在不同品系中具有选择性。
在干旱胁迫下,各品种小麦均有多个信号途径协同作用,且发挥的作用不同,响应时间也各不相同[17],这从本实验得到的结果中得到了验证。从当前我们研究的这两个基因来看,不同品种间也是存在一定共性的,如:这两个基因均在敏感品种“西农165中”表达量最低、在抗旱品种“普冰151”中表达量最高、抗旱品种中的表达均明显高于敏感品种,等等。通过实验结果可以看出,Wdreb2、Wlip19作为正调控因子对小麦干旱胁迫起调控作用,在小麦对抗干旱的分子机制中起着重要作用,并与该品种小麦抗旱能力正相关。对于Wdreb2、Wlip19与其他抗旱基因相比较,作用于小麦对抗干旱过程中的重要程度,还有待于进一步的研究。
[1] NAKASHIMA K, ITO Y, YAMAGUCHI-SHINOZAKI K. Transcriptional regulatory networks in response to abiotic stresses inArabidopsisand grasses[J].PlantPhysiol., 2009, 149(1): 88-95.
[2] SHOU H, BORDALLO P, FAN J B,etal. Expression of an active tobacco mitogen-activated protein kinase kinase kinase enhances freezing tolerance in transgenic maize[J].Proc.Natl.Acad.Sci.USA, 2004, 101(9): 3 298-3 303.
[3] YANG S, VANDERBELD B, WAN J,etal. Narrowing down the targets: towards successful genetic engineer-ing of drought-tolerant crops[J].Mol.Plant, 2010, 3(3): 469-490.
[4] PALANISWAMY S K, JAMES S, SUN H,etal. AGRIS and AtRegNet. a platform to linkcis-regulatory elements and transcription factors into regulatory networks[J].PlantPhysiol., 2006, 140(3): 818-829.
[5] RIANO-PACHON D M, RUZICIC S, DREYER I,etal. PlnTFDB: an integrative plant transcription factor database[J].BMCBioinformatics, 2007, 8: 42.
[6] GUO A Y, CHEN X, GAO G,etal. PlantTFDB: a comprehensive plant transcription factor database[J].NucleicAcidsRes, 2008, 36(Database issue): D966-D969.
[7] XIONG Y, LIU T, TIAN C,etal. Transcription factors in rice: a genome-wide comparative analysis between monocots and eudicots[J].PlantMol.Biol., 2005, 59(1): 191-203.
[8] BARTELS D D U D, SUNKAR R. Drought and salt tolerance in plants[J].CriticalReviewsinPlantSciences, 2005, 24(1): 23-58.
[9] UMEZAWA T, FUJITA M, FUJITA Y,etal. Engineering drought tolerance in plants: discovering and tailoring genes to unlock the future[J].Curr.Opin.Biotechnol., 2006, 17(2): 113-122.
[10] OH S J, SONG S I, KIM Y S,etal. Arabidopsis CBF3/DREB1A and ABF3 in transgenic rice increased tolerance to abiotic stress without stunting growth[J].PlantPhysiol., 2005, 138(1): 341-351.
[11] LIU Q, KASUGA M, SAKUMA Y,etal. Two transcription factors, DREB1 and DREB2, with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought-and low-temperature-responsive gene expression, respectively, in Arabidopsis[J].PlantCell, 1998, 10(8):1 391-1 406.
[12] TRAN L S, NAKASHIMA K, SAKUMA Y,etal. Isolation and functional analysis ofArabidopsisstress-inducible NAC transcription factors that bind to a drought-responsivecis-element in theearlyresponsivetodehydrationstress1 promoter[J].PlantCell, 2004, 16(9): 2 481-2 498.
[13] QIN F, SAKUMA Y, LI J,etal. Cloning and functional analysis of a novel DREB1/CBF transcription factor involved in cold-responsive gene expression inZeamaysL[J].PlantCellPhysiol, 2004, 45(8): 1 042-1 052.
[14] 才 华,朱延明,柏 锡,等. 野生大豆DREB基因cDNA的克隆与分析[J]. 草业科学, 2009,26(8): 17-23.
CAI H, ZHU Y M, BO Y,etal. Cloning and analysis of a novel DREB gene ofGlycinesoja[J].PrataculturalScience. 2009,26(8): 17-23.
[15] SAKAMOTO H, MARUYAMA K, SAKUMA Y,etal. Arabidopsis Cys2/His2-type zinc-finger proteins function as transcription repressors under drought, cold, and high-salinity stress conditions[J].PlantPhysiol., 2004, 136(1): 2 734-2 746.
[16] 刘艳香,董宽虎. 转录因子CBF及其抗寒作用机制[J]. 草业科学, 2009,26(5): 86-94.
LIU Y X, DONG K H. Transcription factor CBF and its cold tolerance mechanism[J].PrataculturalScience(草业科学), 2009,26(5): 86-94.
[17] 唐益苗,赵昌平,髙士庆,等. 植物抗旱相关基因研究进展[J]. 麦类作物学报, 2009,29(1) :166-173.
TANG Y M, ZHAO CH P, GAO SH Q,etal. Advances in genes related to plant drought tolerance[J].JournalofTriticeaeCrops,2009,29(1): 166-173 .
[18] 倪志勇,徐兆师,李连城,等. DREB转录因子在植物抗逆胁迫中的作用机理及应用研究进展[J]. 麦类作物学报, 2008,28(6):1 100-1 106.
NI ZH Y, XU ZH S, LI L CH,etal. Mechanism and application prospect of DREB transcription factors in plant stress resistance[J].JournalofTriticeaeCrops,2008,28(6): 1 100-1 106.
[19] JAKOBY M, WEISSHAAR B, DROGE-LASER W,etal. bZIP transcription factors in Arabidopsis[J].TrendsPlantSci., 2002, 7(3): 106-111.
[20] EGAWA C, KOBAYASHI F, ISHIBASHI M,etal. Differential regulation of transcript accumulation and alternative splicing of a DREB2 homolog under abiotic stress conditions in common wheat[J].GenesGenetSyst., 2006, 81(2): 77-91.
[21] KOBAYASHI F, MAETA E, TERASHIMA A,etal. Development of abiotic stress tolerance via bZIP-type transcription factor LIP19 in common wheat[J].J.Exp.Bot., 2008, 59(4): 891-905.
[22] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J].Methods, 2001, 25(4): 402-408.
[23] GILMOUR S J, FOWLER S G, THOMASHOW M F. Arabidopsis transcriptional activators CBF1, CBF2, and CBF3 have matching functional activities[J].PlantMol.Biol., 2004, 54(5): 767-781.
[24] CHEN M, WANG Q Y, CHENG X G,etal.GmDREB2, a soybean DRE-binding transcription factor, confer-red drought and high-salt tolerance in transgenic plants[J].Biochem.Biophys.Res.Commun., 2007, 353(2):299-305.
[25] AGARWAL P, AGARWAL P K, NAIR S,etal. Stress-inducible DREB2A transcription factor fromPenniset-umglaucumis a phosphoprotein and its phosphorylation negatively regulates its DNA-binding activity[J].Mol.Genet.Genomics, 2007, 277(2): 189-198.
[26] CHEN B, WANG Y, HU Y,etal. Cloning and characterization of a drought-inducible MYB gene fromBoeacrassifolia[J].PlantScience(Oxford), 2005, 168(2): 493-500.
(编辑:宋亚珍)
Comparative Expression of Two Function-known Transcription Genes in Different Drought Tolerance Wheat Cultivars under Water Deficit Stress
QIN Peng, LIU Bingyan,HAN Cuiying,LIU Huqi*
(College of Life Science,Northwest A&F University,Yangling,Shaanxi 712100,China)
This study aimed to investigate the expression ofWdreb2 andWlip19 in ten different varieties of wheat leaves under drought stress, and lay a foundation for wheat drought resistance mechanism. Primers were designed according to gene sequences, using wheat leaves under different degrees of drought stress (including 0,3,6,9,12 and 24 h) as experimental materials, and 26S rRNA as the internal control. The florescent real-time quantitative PCR was used to detect relative expression levels ofWdreb2 andWlip19 in different varieties of wheat. RT-PCR results showed that, the expression ofWdreb2 andWlip19 gene in drought sensitivity wheat leaf significantly lower than that in drought tolerant wheat under drought stress. There are some differences in response time and express trends in different varieties. These results indicated that the different expression levels ofWdreb2 andWlip19 in different varieties of wheat under drought stress were related to the drought resistant ability.
wheat;drought stress;transcription factor;real-time quantitative PCR
1000-4025(2016)11-2267-06
10.7606/j.issn.1000-4025.2016.11.2267
2016-04-16;修改稿收到日期:2016-11-15
西北农林科技大学青年学术骨干研究基金(01140302)
秦 鹏(1988-),男,在读硕士研究生,主要从事植物抗逆分子生物学研究。E-mail:77824518@qq.com
*通信作者:刘虎岐,博士,副教授,硕士生导师,主要从事植物分子遗传学、昆虫杀虫剂抗性分子机理和脑缺氧损伤分子机理研究。E-mail: liuhuqi@yahoo.com.cn
Q786
A

