大鼠脑损伤海水浸泡后损伤脑组织小胶质细胞炎性改变
王伟 赵全军 刘爽 王涛 史铁钧 王淑为 郭欣茹
大鼠脑损伤海水浸泡后损伤脑组织小胶质细胞炎性改变
王伟 赵全军 刘爽 王涛 史铁钧 王淑为 郭欣茹
目的 观察创伤性脑损伤合并海水浸泡后损伤脑组织的炎性反应及小胶质细胞的炎性改变。方法 利用改良的自由落体打击模型构建重型创伤性脑损伤大鼠模型,并于损伤处持续滴注海水45 min。分别于海水浸泡结束后第24、48、72、96 h取脑组织,以HE染色观察损伤脑组织病理变化,以免疫组化DAB显色,观察小胶质细胞的特异性抗体CD11b/c和CD68阳性细胞的数量及分布情况。结果 HE染色可见海水浸泡组24 h可见神经细胞水肿明显,细胞核深染,核周大量空泡形成并伴有明显的出血;48 h细胞水肿更加明显,细胞杂乱无章,核固缩畸形,细胞周围开始出现大空泡并伴有大量血细胞浸润;海水浸泡72 h及96 h组局部出血消退,脑细胞水肿不再继续加重,仍可见明显细胞核固缩畸形,细胞周围大小空泡浸润脑组织呈网格状改。DAB显色可见海水浸泡组24 h时CD11b/c及CD68阳性小胶质细胞大量聚集、活化于损伤组织表面,48 h时聚集于损伤脑组织内,可呈多层分布,可见明显的吞噬行为;72 h及96 h组细胞数目已较48 h组明显减少,可见局部组织中细胞密度降低,细胞吞噬行为明显减少;相同时间点CD68阳性的细胞数目均明显多于CD11b/c阳性细胞(均P<0.01)。结论 脑损伤海水浸泡后72 h内脑组织炎性反应最为强烈,小胶质细胞大量聚集活化,72 h及96 h后逐渐减弱并趋于平稳。
创伤性脑损伤;海水浸泡;炎症;小胶质细胞;CD11b/c;CD68
既往海水浸泡颅脑损伤的主要原因是海上作战及军事登陆作战,随着人们生活水平提高,海边度假村的盛行,以及海难发生的增多,使海水浸泡颅脑损伤在普通人群中的发生率也逐年升高。研究表明,单纯创伤性脑损伤的死亡率高达58%以上[1],脑外伤患者约25%会出现终生残疾[2]。海水中高离子浓度及其高渗透性会加重脑组织的炎性反应及脑损害,炎性反应所导致的二次损伤是后期各种功能缺陷的主要原因[3],因此海水浸泡脑损伤死亡率及致残率均较高。本研究中对创伤性脑损伤海水浸泡后不同时段脑出血、水肿及小胶质细胞聚集活化的情况进行观察,探究创伤性脑损伤海水浸泡后神经炎性病理改变,以期为临床治疗海水浸泡颅脑损伤积累实验资料。
1 材料和方法
1.1 材料
1.1.1 实验动物及分组:实验所用动物均为清洁级雄性SD大鼠40只,体质量230~250 g,由海军总医院实验动物中心提供并帮助饲养。
1.1.2 主要仪器与试剂:Narishige脑立体定位仪(型号SR-5R,日本成茂显微操作系统公司);奥林巴斯BX63荧光显微镜(上海土森视觉科技有限公司)。实验所用海水为配制海水(配方由国家第三海洋局提供)具体成分(单位mmol/L):NaCl 443.66、KCl 9.73、CaCl212. 70、MgCl225.76、MgSO427.54、NaHCO32. 40、NaBr 0. 81,PH8.2,渗透压1200 mOsm/L;甲醛溶液(北京科艺源技术服务中心);水合氯醛溶液(解放军第306医院提供);Anti-CD11b/c、anti-CD68及相应二抗均购自上海abcam公司;DAPI(批号AR1177,武汉博士德公司)。
1.2 方法
1.2.1 动物模型构建:创伤性脑损伤模型采用改良自由落体损伤模型方法[1,4]造模。0.1 g/L水合氯醛按体质量5 mL/kg剂量腹腔注射对大鼠进行麻醉后将其固定于立体定位仪上,作头皮正中切口2.5 cm,参照包新民大鼠脑立体定向图谱于前囟后2.0 mm,正中线旁开3.5 mm为中心,5.0 mm为直径,用牙科钻去除直径5 mm的颅骨瓣,暴露硬脑膜(注意保护硬脑膜完整),以40 g砝码20 cm高度自由下落打击硬脑膜。损伤后局部进行海水浸泡45 min,清除伤口周围血肿并缝合切口。此种方法致伤力度为800 g·cm;海水浸泡45 min模拟了伤者落水及被救起后送去就医的时间,此观察时间是参照预实验结果(海水浸泡大鼠脑损伤模型30 min、45 min、60 min,60 min组大鼠损伤24 h因重度脑水肿死亡)及既往研究结果[4-6]确定的。造模后根据改良的神经功能评分(mNSS)选择得分大于12分[7-8]的重度损伤大鼠纳入实验组并进行随机分组;空白对照组麻醉后单纯去除颅骨骨瓣,缝合头皮切口,不进行自由落体打击及海水浸泡。造模完成后动物放回笼内正常饮食。最终分为空白对照组及海水浸泡脑损伤24 h、48 h、72 h、96 h组五组(后四组简称海水浸泡24 h、48 h、72 h、96 h组),每组5只,共计25只。
1.2.2 HE染色及免疫组化DAB显色:海水浸泡24、48、72、96 h组分别于造模后24、48、72、96 h,空白对照组于脑损伤后24 h对大鼠进行甲醛灌注内固定取脑。脑灌注内固定方法:大鼠麻醉后迅速开胸腔,充分暴露心脏后,钝性撕开心包并暴露主动脉,从心尖处插入灌注针头至主动脉内(注意不要损伤主动脉),剪开右心耳同时迅速用400 mL生理盐水全速灌注,灌注过程中可见肝脏血液逐渐消失殆尽,最后呈黄白色,鼠尾苍白。之后用4%(体积分数)甲醛溶液400 mL进行灌注固定,前200 mL需全速灌注,后期为更好的固定,后200 mL则尽量慢速滴注。待灌注固定完成后对大鼠进行断头取脑。将取出的鼠脑置于4%(体积分数)甲酫中过夜后切取损伤处的脑组织,再经20%(体积分数)甲酫溶液固定后进行脱水,包埋制作组织蜡块。对组织蜡块进行切片,脱蜡至水后进行相应染色,每个切片厚约5 μm。
(1)HE染色:取每只鼠5张切片进行常规HE染色,观察脑组织损伤周围出血、水肿及组织结构改变。
(2)DAB染色:取每只鼠切片5张,室温下置5%(质量分数)双氧水中15 min,微波炉中高火EDTA修复15 min,自然冷却后,PBS洗5 min×3次;滴加山羊血清后置37℃恒温箱中20 min;滴加一抗(CD11b/c比例为1︰100,CD68比例为1︰200)4℃冰箱过夜;PBS洗5 min×3次;滴加二抗(耦联剂),于37 ℃恒温箱中20 min;PBS洗5 min×3次;滴加三抗(辣根酶),37 ℃恒温箱中20 min;PBS洗5 min×3次;DAB显色,荧光显微镜下观察细胞显色是否充分(以便根据细胞色差及时调整抗体浓度);染核(DAPI),脱水,封片。400倍镜下观察免疫荧光阳性细胞(镜下绿色荧光细胞)在不同时间点的数量、分布及聚集情况,并计数镜下阳性细胞数。每张切片于400倍镜下任取5个视野进行计数,取其均值作为此片小胶质细胞数目。小胶质细胞的密度=均值/实际镜下面积。每个400倍镜下视野实际面积为0.24 mm2。
1.3 统计学处理 以IBM SPSS 19.0统计软件进行分析。数据以均数±标准差表示,经正态性及方差齐性检验均服从正态分布且方差齐,多组间比较one-way ANOVA进行分析,组间两两比较采用Dunnett-t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 各组脑组织脑出血及脑水肿变化比较 100倍镜下可见各海水浸泡组均有明显的组织缺损,海水浸泡48 h出现明显的局部出血,与海水浸泡24 h及72 h比较均明显严重,72 h及96 h时损伤局部已无明显出血现象。400倍镜下可见空白对照组脑组织中有少许小空泡出现,神经细胞结构大致正常,未见细胞水肿及明显的出血(图1A);海水浸泡组24 h可见神经细胞水肿明显,细胞核深染,核周大量空泡形成并伴有明显的出血(图1B);48 h细胞水肿更加明显,细胞杂乱无章,核固缩畸形,细胞周围开始出现大空泡并伴有大量血细胞浸润(图1C);海水浸泡72 h及96 h组可见局部出血已消退,脑细胞水肿已不再继续加重,96 h组局部出血及水肿已有明显恢复,但两组仍可见明显细胞核固缩畸形,细胞周围大小空泡浸润脑组织呈网格状改变(图1C、D)。
2.2 各组损伤脑组织CD11b/c及CD68表达比较 100倍镜下,同空白对照组相比较,海水浸泡组24h时CD11b/c阳性小胶质细胞即已经大量聚集、活化,集中部位主要位于损伤组织表面;48 h后细胞大量聚集于损伤脑组织内,有多处细胞呈多层分布,并可见明显的吞噬行为;72 h及96 h组细胞数目已较48 h组明显减少,可见局部组织中细胞密度降低,细胞吞噬行为明显减少。400倍镜下可见更加明显的细胞分布变化情况(图2)。与空白对照组比较,海水浸泡组24 h(因多层分布而无法准确计数)、48 h小胶质细胞数量明显增高,至72 h及 96 h已明显下降,空白对照组、48 h组、72 h组、96 h组四组间CD11b/c阳性细胞密度比较,差异有统计学意义(F=2162.19,P<0.01;表1),且各组间两两比较差异均有统计学意义(均P<0.01)。
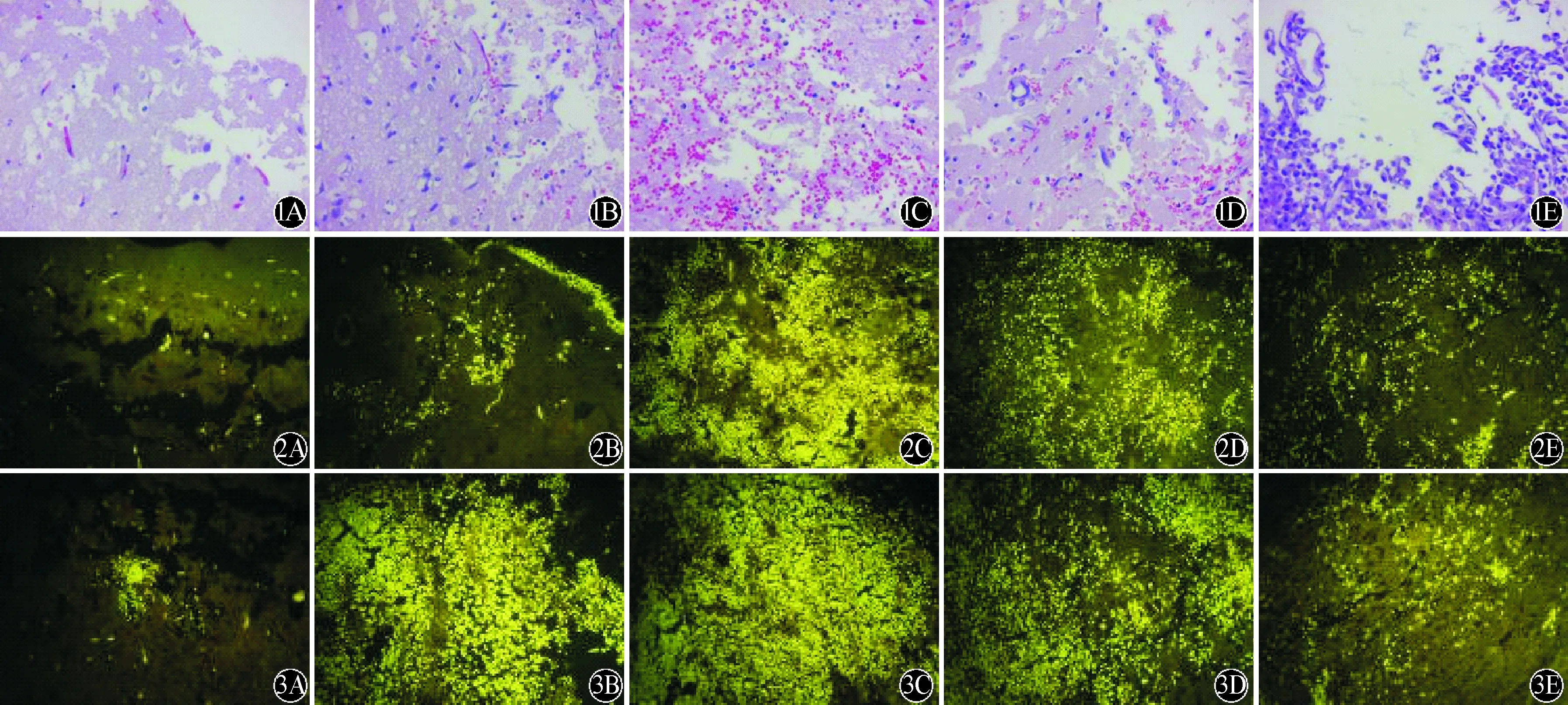
A:空白对照组;B:海水浸泡24 h;C:海水浸泡48 h;D:海水浸泡72 h;E:海水浸泡96 h 图2 各组损伤脑组织CD11b/c表达比较(DAB×400) A:空白对照组;B:海水浸泡24 h;C:海水浸泡48 h;D:海水浸泡72 h;E:海水浸泡96 h 图1 各组损伤处脑组织病理改变比较(HE×400) A:空白对照组;B:海水浸泡24 h;C:海水浸泡48 h;D:海水浸泡72 h;E:海水浸泡96 h 图3 各组损伤脑组织CD68表达比较(DAB×400)
CD68阳性细胞在海水浸泡24 h时即可见有大量细胞聚集于损伤处,24 h、48 h细胞数目均明显增多且聚集覆盖于损伤处无法计数,72 h可见细胞数目已明显减少,96 h细胞数量减少更加显著,而且分布较散乱。CD68阳性细胞各个时间点的分布趋势与CD11b/c阳性细胞基本相同,但相同时间点CD68阳性的细胞数目明显多于CD11b/c阳性细胞(图3、表1)。
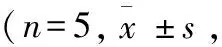

组别CD11b/cCD68海水浸泡96h370.40±18.31∗#401.40±8.79∗▲海水浸泡72h471.80±11.14∗#543.98±10.57∗▲海水浸泡48h991.20±28.80∗—海水浸泡24h—— 空白对照组90.60±4.67121.20±14.58▲
注:表中“—”表示者细胞数量大,分层分布,显微镜下无法计数;与空白对照组比较,*P<0.01;与海水浸泡48 h组比较,#P<0.01;与海水浸泡72 h组比较,△P<0.01;与CD11b/c细胞数量比较,▲P<0.01
3 讨论
3.1 海水浸泡脑损伤后脑出血、脑水肿随时间的进展 外伤性脑损伤后继发性脑损伤的主要病理改变是脑水肿的形成,是脑损伤死亡的主要原因,约占脑损伤死因的50%[9]。海水中高离子浓度也是脑损伤后期加重创伤性脑水肿的重要因素[5],细胞内钙离子超载被认为是脑水肿后神经细胞死亡的最后通路[10],海水中高浓度的钙离子必然会加速脑水肿后期神经细胞的死亡。有研究表明单纯性脑损伤伤后3 h出现明显水肿改变,8 h后水肿依旧;海水浸泡颅脑损伤伤后8 h才出现明显的水肿且呈进一步加重的趋势,这可能与海水低温及高镁对脑组织具有一定的保护作用有关[6]。本研究中同样也观察到损伤后24 h神经细胞核深染,周围大量空泡形成,表明损伤后24 h已出现明显的脑水肿,48 h时水肿进一步加重,至72及96 h时神经细胞排列更加紊乱,正常脑组织结构已完全破环。这些表现同时间的关系与先前文献描述类似[4-6,11-12]。但除海水外,炎性介质也是造成脑水肿的一大重要因素。脑损伤后炎性反应以一系列级联反应为特点,各种炎性介质的释放使免疫细胞聚集,生成过敏毒素使血脑屏障通透性增加,脑水肿加剧[13]。既往研究表明,损伤脑组织炎性反应所导致的二次损伤是持续损伤及后期各种功能缺陷的主要原因,其特征主要包括白细胞聚集,小胶质细胞的活化,各种炎性介质的上调[14]。外伤性脑损伤后主要的炎性介质包括IL-1、IL-6、IL-10、TNF、IFN等,有研究表明大鼠脑出血后24~48 h炎性细胞浸润最为严重,而24~72 h TNF、IL-6、NF-κB、ICAM-1等出现表达高峰[15]。国外针对外伤性脑损伤后各种炎性介质表达的研究表明,损伤后前48 h炎性反应最为强烈,48~72 h候逐渐降低并趋于平稳,炎性因子IL-1、TNF等均于损伤后6 h达高峰,6 h候逐渐下降,48 h候趋于平稳[16]。本研究未单独探讨海水因素对脑细胞的影响,也未对主要的炎性介质进行检测研究,在以后研究中可进一步对此两种因素进行研究。
3.2 小胶质细胞聚集活化的高峰期 炎性反应的参与者主要是炎性细胞及炎性介质。小胶质细胞作为中枢神经系统主要免疫细胞,是脑组织的常驻守卫细胞。外伤性脑损伤后血脑屏障被破坏,血液中的免疫物质进入脑组织形成炎性反应并激活小胶质细胞,触发中枢免疫反应。有研究表明大鼠脑损伤7天后小胶质细胞细胞深染,包体肿胀,分布密度减小,突起粗短,呈网状(典型活化状态),且持续至28天依然呈活化状态[17],而针对更早期神经炎性改变的研究发现小胶质细胞在脑出血后4 h即已出现,持续长达4周[18]。针对小胶质细胞的超微研究显示损伤早期小胶质细胞形状不规则,且参与皮层脊髓束的退行性改变,吞噬退行的轴突神经[19],这说明小胶质细胞在损伤早期即以开始活化,且进行吞噬活动。诸多实验研究小胶质细胞的活化状态,持续时间,但针对其活化数目随时间的变化趋势却少见报道。而小胶质细胞所行使的吞噬作用对新移植至脑内的细胞尤为关键,所以避开小胶质细胞聚集活化的高峰期,对细胞移植治疗的效果影响极大。本次实验针对小胶质细胞数目随时间的变化进行观察,发现海水浸泡脑损伤后48 h细胞大量聚集于损伤脑组织内,有多处细胞呈多层分布,并可见明显的吞噬行为。72~96 h细胞数目逐渐减少,密度降低,细胞吞噬行为明显减少。表明小胶质细胞在72 h内数量已达高峰,96 h后已大量减少。但关于活化高峰出现的具体时间仍待继续研究观察。
小胶质细胞属于巨噬细胞系统,外周巨噬细胞主要表达CD68表型,而脑组织中巨噬细胞可以表达CD11b/c和CD68两种表型。目前,国内外有关于免疫标记的动物实验均未具体阐述CD11b/c和CD68的区别[16,20]。当血脑屏障被破坏,外周大量巨噬细胞进入大脑,吞噬退行性神经细胞。本实验中发现海水浸泡脑损伤后相同时期(24及72 h)CD68+细胞数量要远多于CD11b/c+细胞,海水浸泡颅脑损伤96 h后两种表型的细胞数量无明显差异(P=0.07),表明此时可能炎性反应高峰已渐消退,血脑屏障功能逐渐恢复。本研究中空白对照组CD68+细胞数量也多于CD11b/c+细胞(P=0.03),推测可能是由于去骨瓣时对血脑屏障造成轻微损伤导致的。
综上可见,大鼠脑损伤海水浸泡后损伤脑组织炎性反应明显,小胶质细胞活性增强,关于海水浸泡后脑损伤的治疗还需进一步观察研究。
[1]章翔, 程岗. 创伤性脑损伤炎症反应研究进展[J]. 中华创伤杂志, 2011,27(3):193-196.
[2]廖启伟. 创伤性脑损伤与中枢炎症反应[J]. 医学信息, 2015,28(11):356.
[3]Kumar A, Loane DJ. Neuroinflammation after traumatic brain injury: opportunities for therapeutic intervention[J].Brain Behav Immun, 2012,26(8):1191-1201.
[4]田君, 荆俊杰, 王守森. 大鼠二次脑损伤合并海水浸泡后脑组织病理变化的实验研究[J]. 中国医疗前沿, 2013(5):33-34.
[5]刘锐, 刘宗惠, 虞积耀, 等. 海水浸泡对创伤性脑水肿影响的实验研究[J]. 第二军医大学学报, 2002,23(2):159-162.
[6]杨立斌, 余新光, 荆俊杰, 等. 开放性颅脑损伤合并海水浸泡脑组织病理变化的实验研究[J]. 第一军医大学学报, 2003,23(5):452-454.
[7]Kawamata T, Alexis NE, Dietrich WD, et al. Intracisternal basic fibroblast growth factor (bFGF) enhances behavioral recovery following focal cerebral infarction in the rat[J]. J Cereb Blood Flow Metab, 1996,16(4):542-547.
[8]万东, 祝慧凤, 罗勇, 等. 梓醇促进脑缺血大鼠神经修复的行为学观察与评价[J]. 中国药理学通报, 2012(09):1208-1214.
[9]Marmarou A. Pathophysiology of traumatic brain edema: current concepts[J]. Acta Neurochir Suppl, 2003,86(86):7-10.
[10]Dempsey RJ, Ba Kaya MK, Do An A. Attenuation of brain edema, blood-brain barrier breakdown, and injury volume by ifenprodil, a polyamine-site N-methyl-D-aspartate receptor antagonist, after experimental traumatic brain injury in rats.[J]. Neurosurgery, 2000,47(2):399-406.
[11]Bedi SS, Hetz R, Thomas C, et al. Intravenous multipotent adult progenitor cell therapy attenuates activated microglial/macrophage response and improves spatial learning after traumatic brain injury[J]. Stem Cell Transl Med, 2013,2(12):953-960.
[12]Lee DH, Lee JY, Oh BM, et al. Functional recovery after injury of motor cortex in rats: effects of rehabilitation and stem cell transplantation in a traumatic brain injury model of cortical resection[J]. Childs Nerv Syst, 2013,29(3):403-411.
[13]齐向前, 于明琨. 颅脑损伤后炎症反应与脑水肿[J]. 中华神经医学杂志, 2007,6(8):850-852.
[14]Morganti-Kossmann MC, Satgunaseelan L, Bye N, et al. Modulation of immune response by head injury[J]. Injury, 2007,38(12):1392-1400.
[15]张祥建, 李春岩, 刘春燕, 等. 炎症反应与大鼠脑出血后脑损伤的相关性[J]. 中华神经科杂志, 2005(06):396-397.
[16]Harting MT, Jimenez F, Adams SD, et al. Acute, regional inflammatory response after traumatic brain injury: Implications for cellular therapy[J]. Surgery, 2008,144(5):803-813.
[17]Cao T, Thomas TC, Ziebell JM, et al. Morphological and genetic activation of microglia after diffuse traumatic brain injury in the rat[J]. Neuroscience, 2012,225:65-75.
[18]Xue M, Del BM. Intracerebral injection of autologous whole blood in rats: time course of inflammation and cell death[J].Neurosci Lett, 2000,283(3):230-232.
[19]Jacobowitz DM, Cole JT, McDaniel DP,et al.Microglia activation along the corticospinal tract following traumatic brain injury in the rat: a neuroanatomical study[J]. Brain Res, 2012,1465(29):80-89.
[20]Batchelor PE, Liberatore GT, Wong JY, et al. Activated macrophages and microglia induce dopaminergic sprouting in the injured striatum and express brain-derived neurotrophic factor and glial cell line-derived neurotrophic factor[J]. J Neurosci, 1999,19(5):1708-1716.
(本文编辑:邹晨双)
Change of pathology on neuroinflammation after traumatic brain injury immerged with sea water in rats
WANGWei,ZHAOQuanjun*,LIUShuang,WANGTao,SHITiejun,WANGShuwei,GUOXinru.
*DepartmentofNeurosurgery,306HospitalofPLA,Beijing100101,China
Corresponding author:ZHAOQuanjun, Email: docto@sina.com
Objectives To observe the inflammatory responses of brain tissues and the inflammatory change of microglia in rats with traumatic brain injury(TBI)and sea water immersion. Methods Serious TBI was constructed using freeney’s weight drop device, sea water immersion continuous infusion was adopted immediately for 45 minutes after TBI model building. The brain tissues were collected at 24 h, 48 h, 72 h, 96 h after injury and observed by HE staining and immunohistochemical staining with CD11b/c and CD68 antibody.The number and distribution of the positive cells were observed. Results TBI with sea water immersion induced an obvious neuroinflammation which showed nerve cell edema was obvious, the nucleus was stained, and a large number of vacuoles were formed and accompanied with obvious hemorrhage at 24 h after injury.The cell edema was more obvious, the cell was disorganized, the nuclear condensation and big vacuoles were observed, a lot of blood cell infiltrated at 48 h.Local bleeding subsided, brain edema did not increase, obvious nuclear condensation was observed and the vacuoles surrounding the cells changed into grid-like patternat 72-96 h after injury. A large number of CD11b/c and CD68 positive microglia gathered and activated on the surface of injured tissue by DAB stainingand the cells gathered in the injured brain tissueat 48 h, there was a multi-layer distribution which showed obvious phagocytosis.Cell number at 72 h and 96 h significantly decreased compared with the 48 h group, the cell density in the local tissue decreased, and the phagocytic behavior significantly decreased.At the same time, the number of CD68 positive cells was significantly higher than that of CD11b/c positive cells(P<0.01, respectively). Conclusions The neuroinflammation of TBI rats immerged with sea water was the most serious in the initial 72 hours and a large number of microglia aggregates and activates. Then the changes start to level off after 72-96 h.
traumatic brain injury;sea water immersion;neuroinflammation;microglia;CD11b/c;CD68
10.3969/j.issn.1006-2963.2016.06.008
军队后勤科研资助项目(CHJ12J022)
510515南方医科大学第三临床医学院(王伟);100101中国人民解放军第306医院神经外科(赵全军、王涛、史铁钧);100048 中国人民解放军海军总医院神经外科(刘爽、王淑为、郭欣茹)
赵全军,Email:docto@sina.com
R364.7
A
1006-2963(2016)06-0421-05
2015-12-02)

