草坪草红丝病与粉斑病病原菌生物学特性研究与杀菌剂室内毒力测定
章武,胡美姣,高兆银,李敏,刘国道,南志标
(1.草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020;2.岭南师范学院,广东 湛江 524048;3.中国热带农业科学院环境与植物保护研究所,海南 海口571101;4.中国热带农业科学院热带作物品种资源研究所,海南 儋州571737)
草坪草红丝病与粉斑病病原菌生物学特性研究与杀菌剂室内毒力测定
章武1,2,胡美姣3,高兆银3,李敏3,刘国道4,南志标1*
(1.草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020;2.岭南师范学院,广东 湛江 524048;3.中国热带农业科学院环境与植物保护研究所,海南 海口571101;4.中国热带农业科学院热带作物品种资源研究所,海南 儋州571737)
草坪草红丝病与粉斑病是发生于世界范围内可危害多个草种的重要草坪草病害。本研究对我国首次报道的红丝病和粉斑病病原菌生物学特性进行了研究并在室内测定了14种杀菌剂对该两种病原菌的毒力。研究结果表明:红丝病和粉斑病病原菌菌丝适宜生长pH为5~7,最适生长pH为6,菌丝的致死温度为50 ℃水浴处理10 min。红丝病和粉斑病病原菌能够利用多种碳氮源,最适碳源和最适氮源分别为可溶性淀粉和L-谷氨酰胺。红丝病病原菌最适培养基为燕麦片煎液琼脂培养基(OMA);粉斑病病原菌最适培养基为马铃薯葡萄糖琼脂培养基(PDA)和马铃薯蔗糖琼脂培养基(PSA)。5%烯唑醇在14种供试杀菌剂中对红丝病病原菌和粉斑病病原菌毒力最高,其EC50值分别为0.113和0.282 mg/L;然而,15%甲霜灵·10%霜霉威毒力最低,其EC50值分别为121.522和214.532 mg/L。研究结果为深入了解病原菌的基础生物学及制定防治策略提供科学依据。
红丝病;粉斑病;生物学特性;室内毒力测定
伴随着我国经济高速发展,城市化进程的加快与城市绿化标准的提高,为草坪业的发展创造了良好的条件。面积不断增加的各类草坪不仅美化了人民生活环境,而且促进了环境保护、体育运动和休闲娱乐等相关事业的发展,草坪业已成为一项新兴产业,种植草坪是减少大气污染、维护生态平衡、保护环境卫生、美化城乡面貌的有效措施之一[1]。然而,病害是造成草坪草早衰与毁灭的主要原因之一。草坪草真菌病害是草坪草上的主要病害,约占病害总数的80%。其降低草坪质量,减少草坪使用年限,从而降低其应用价值。随着草坪业的迅猛发展,草坪草病害的种类和发生范围呈逐年增加的趋势。在《中国牧草真菌病害名录》中,列出了包括草坪草在内的禾本科草类植物病害1289种,占我国已知草类植物病害总数的45.5%[2]。我国草坪草病害科技工作者也多次发现包括草坪草红丝病(Laetisariafuciformis)和粉斑病(Limonomycesroseipellis)等重要草坪草病害在内的国内、省内新记录种和已知种的新分布[3-5]。
草坪草红丝病与粉斑病是发生于世界范围内的重要草坪草病害[6-7]。红丝病主要分布在欧洲、北美、澳大利亚的冷湿地区[8],该病害在一年的不同时间均可发生,尤其在春秋两季为害最为严重[7-8]。草坪染病后,易形成圆形或不规则形状的枯草斑,直径可达0.6 m[9]。这时,红褐色的病草斑块,散乱地分布于健草之间,使草坪呈现一片衰败的景象。在染病叶片尖端形成丝状菌丝束和粉红色的节孢子团是红丝病的主要危害特征[8]。红丝病病原菌可危害剪股颖属(Agrostisspp.)、羊茅属(Festucaspp.)、黑麦草属(Loliumspp.)、早熟禾属(Poaspp.)、猫尾草属(Phleumspp.)等多种的禾本科草坪草及牧草,其中对多年生黑麦草(Loliumperenne)及紫羊茅(Festucarubra)危害最为严重[9]。
粉斑病主要分布在英国、荷兰[10]和意大利[11]等地。粉斑病因其危害症状、病害循环、寄主范围与红丝病十分相似,曾被误认为是红丝病[12]。然而,粉斑病病菌不能产生红丝状菌核和棉絮状节孢子团,因此粉斑病传播速度较慢。粉斑病症状与红丝病十分相似,草坪染病后多形成直径为5~10 cm粉红色至淡黄褐色的圆形或不规则枯草斑。病原菌侵染草坪后不会显著降低草坪草的生长速度,并且被病原菌侵染的叶片褪绿不明显。粉斑病病原菌可侵染剪股颖属、狗牙根属(Cynodonspp.)、羊茅属、黑麦草属、早熟禾属等草坪草[9]。
2012年,我国首次报道了红丝病危害海南省高尔夫球场海滨雀稗草坪[13],之后Zhang等[14]发现了粉斑病可危害果岭杂交狗牙根草坪。经过为期4年的调查,Zhang等[15]研究表明红丝病和粉斑病在我国海南省发生普遍且可危害多种暖季型草坪草,均为我国首次报道。现阶段,我国对草坪草红丝病与粉斑病的研究较少。研究病原菌的生物学特性和室内测定杀菌剂对病原菌的毒力,对揭示其所引致病害的发生规律和制定有效的防治措施具有重要的意义。因此,本研究对病原菌的生物学特性和14种杀菌剂对病原菌的毒力进行深入详细的研究,以期为科学防治这两种草坪草病害奠定基础。
1 材料与方法
1.1 供试菌株和接种菌饼的制备
2014年3-5月,选取分离自不同地区和寄主来源的7个红丝病菌株(HK-ML136,HK-TD132,WN-KLY221,WC-WC01,QH-BAXC225,DZ-HD02,SY-LQG81)和3个粉斑病菌株(HK-TD121,SY-LXG101,WN-KLY531)用于生物学特性鉴定,其中红丝病菌株HK-ML136和粉斑病菌株HK-TD121用于碳氮源、不同培养基对菌丝生长影响以及杀菌剂对病原菌毒力的测定。菌株的详细信息见表1。
表1 不同地区和寄主来源的红丝病和粉斑病菌株
Table 1L.fuciformisandLi.roseipellisisolates from different locations and hosts

菌株编号Isolatesnumber寄主(品种)Hosts(Cultivars)地点Locations收集日期Collectiondate(年-月-日Year-month-day)红丝病病原菌L.fuciformisHK-ML136‘Salam’SP海口Haikou2011-08-06HK-TD132‘Tifton419’BD海口Haikou2012-07-05WN-KLY221‘SeaIsle2000’SP万宁Wanning2012-03-13WC-WC01‘SeaIsle2000’SP文昌Wenchang2012-03-26QH-BAXC225‘Platinum’SP琼海Qionghai2012-03-18DZ-HD02Mascarenegrass儋州Danzhou2012-07-11SY-LQG81‘SeaIsle2000’SP三亚Sanya2012-03-15粉斑病病原菌Li.roseipellisHK-TD121‘Tifton328’BD海口Haikou2012-02-29SY-LQG101‘SeaIsle2000’SP三亚Sanya2012-03-15WN-KLY531‘Platinum’SP万宁Wanning2012-03-11
SP:海滨雀稗 Seashore paspalum;BD:杂交狗牙根 Hybrid bermudagrass.
将各供试菌株接种于新鲜的PDA培养基上,置于全黑暗25 ℃的条件下培养4 d。在生长良好的菌落边缘用直径为5 mm的打孔器围绕同心圆打孔,将所得菌饼分别接种于如下处理的平板当中。
1.2 pH值对菌丝生长的影响
PDA灭菌之后,在无菌条件下用1 mol/L NaOH和1 mol/L HCl将pH值分别调节至4,5,6,7,8,9,10七个梯度。将菌饼分别接种于不同pH值的平板上,每皿为1个重复,每处理4次重复,置于25 ℃黑暗培养箱中培养。接种96 h后量取菌落直径,并计算菌落生长速率。
1.3 菌丝致死温度的测定
挑取菌饼放入10 mL离心管中,加入1 mL无菌水,分别在35,40,45,50,55,60,65 ℃的恒温水浴中处理10 min,以未经水浴处理的菌饼作为对照。将菌饼取出后移至PDA平板培养基上,置于25 ℃黑暗培养箱中培养。每皿为1个重复,每处理4次重复。4 d后观察各菌株的存活状况。菌落可以生长视为存活,不能生长视为死亡。
1.4 碳、氮源对菌丝生长的影响
以Czapek培养液(2.00 g KNO3, 1.00 g KH2PO4, 0.5 g KCl, 0.5 g MgSO4·7H2O, 0.01 g FeSO4, 30.0 g蔗糖, 1000 mL蒸馏水)为基础培养基。分别用含相同摩尔质量碳元素的12种不同碳源:乳糖、D-果糖、D-木糖、D-半乳糖、可溶性淀粉、葡萄糖、D-山梨醇、甘露醇、L-鼠李糖、麦芽糖、D-甘露醇、纤维二糖代替原培养基中的蔗糖,以不加葡萄糖的培养基作为对照,分别制成含有不同碳源的平板;分别用含相同摩尔质量氮元素的11种不同氮源:NaNO3、NH4H2PO4、(NH4)2HPO4、H2NCONH2、(NH4)2SO4、NH4Cl、CH3COON、甘氨酸、蛋白胨、L-亮氨酸、L-谷氨酰胺,代替原培养基中的KNO3,以不加氮源的培养基作为对照,分别制成含有不同氮源的平板。将菌饼分别接种于不同碳、氮源的平板上,每皿为1个重复,每处理4次重复,置于25 ℃黑暗培养箱中培养。接种96 h后量取菌落直径,并计算菌落生长速率。
1.5 不同培养基对菌丝生长的影响
将菌饼分别接种于玉米粉琼脂培养基(corn meal agar, CMA)、查彼固体培养基(czapek)、营养牛肉琼脂培养基(nutrient agar, NA)、燕麦片煎液琼脂培养基(oat meal aga, OMA)、马铃薯胡萝卜煎液培养基(potato carrot agar, PCA)、马铃薯葡萄糖琼脂培养基(potato dextrose agar, PDA)、马铃薯蔗糖琼脂培养基(potato sucrose agar, PSA)、理查德固体培养基(richard)、海水营养琼脂培养基(saltwater nutrient agar, SNA)、V-8培养基(V-8 agar, V-8)、结缕草煎液琼脂培养基(zoysia grass decoction agar, ZDA)、海滨雀稗煎液琼脂培养基(seashore paspalum decoction agar, SPDA)、水琼脂培养基(water agar, WA)共13种培养基平板上。各种培养基的制备参照Li等[16]的方法。每皿为1个重复,每处理4次重复,置于25 ℃黑暗培养箱中培养。接种96 h后量取菌落直径,并计算菌落生长速率。
1.6 杀菌剂对病原菌室内毒力测定
1.6.1 供试杀菌剂 供试杀菌剂为田间常用于防治草坪草病害的14种杀菌剂,如下:1)70%代森锰锌可湿性粉剂,四川国光农化有限公司;2)70%甲基托布津可湿性粉剂,江苏龙灯化学有限公司;3)64%精甲霜灵·4%代森锰锌水分散粒剂,瑞士先正达作物保护有限公司;4)75%百菌清可湿性粉剂,利民化工股份有限公司;5)50%多菌灵可湿性粉剂,四川国光农化有限公司;6)20%三唑酮乳油,四川国光农化有限公司;7)40%氟硅唑,上海杜邦农化有限公司;8)43%戊唑醇悬浮剂,拜耳作物科学(中国)有限公司;9)15%甲霜灵·10%霜霉威可湿性粉剂,江苏宝灵化工股份有限公司;10)12.5%腈菌唑乳油,华北制药集团爱诺制药有限公司;11)50%异菌脲悬浮剂,拜耳作物科学(中国)有限公司;12)12.5%烯唑醇可湿性粉剂,上海爱帮农科技有限责任公司;13)50%咪酰胺锰盐可湿性粉剂,拜耳作物科学(中国)有限公司;14)70%恶霉灵可湿性粉剂,京博农化科技股份有限公司。
1.6.2 室内毒力测定 采用菌丝生长速率法进行测定。在生长状况良好培养了4 d的菌落边缘打取菌饼并移至于预先配制好的含各浓度分别为0、0.1、1.0 和100.0 mg/L的杀菌剂PDA培养基上,在25 ℃的培养箱中培养4 d后观察菌落生长情况,然后测量菌落直径,从而计算出抑菌率。根据菌株在不同浓度杀菌剂的抑菌率大小,设置各杀菌剂的浓度梯度用于毒力的测定,每种杀菌剂均设为5个不同的浓度梯度(表2),每皿为1个重复,每个浓度4个重复,置于25 ℃的培养箱中培养4 d后量取菌落直径,计算出各菌落的净生长量和相对抑菌率,从而根据杀菌剂浓度的对数值(x)和相对抑菌率的概率值(y)得出回归方程,计算得到相关系数和EC50值。
净生长量(mm)=菌落直径(mm)-菌饼直径(mm)
相对抑制率=[(对照净生长量-处理净生长量)/对照净生长量]×100
1.7 数据统计与分析
用Excel 2007软件录入制表,并统计分析数据,计算标准误差并制图。采用SAS(version 9.0; SAS Institute, Cary, NC)软件进行方差分析(ANOVA),并用最小显著差数法(LSD)比较不同处理的差异显著性(P<0.05)。
2 结果与讨论
2.1 pH值对菌丝生长的影响
表2 各杀菌剂的毒力测定浓度梯度
Table 2 Concentration gradient of fungicides for toxicity determination mg/L

药剂名称Fungicides有效成分浓度梯度Concentrationgradientofactiveingredients70%代森锰锌70%mancozeb20,4,0.8,0.16,0.03270%甲基托布津70%thiophanate-methyl1000,200,40,8,1.664%精甲霜灵·4%代森锰锌64%metalaxyl-M·4%mancozeb20,4,0.8,0.16,0.03275%百菌清75%chlorothalonil1000,200,40,8,1.650%多菌灵50%carbendazim50,10,2,0.4,0.0820%三唑酮20%triazolone100,20,4,0.8,0.1640%氟硅唑40%flusilazole50,10,2,0.4,0.0843%戊唑醇43%tebuconazole500,100,20,4,0.815%甲霜灵·10%霜霉威15%metal-axyl·10%propamocarb500,100,20,4,0.812.5%腈菌唑12.5%myclobutanil20,4,0.8,0.16,0.03250%异菌脲50%iprodione100,20,4,0.8,0.165%烯唑醇5%diniconazole4,0.8,0.16,0.032,0.006450%咪酰胺锰盐50%prochloraz100,20,4,0.8,0.1670%恶霉灵70%hymexazol100,20,4,0.8,0.16
红丝病和粉斑病病原菌各菌株菌丝在pH值为4~10时均可生长,pH值为5~7时各菌株生长状况较好,其中pH值为6时生长状况最佳。各菌株在各酸碱度条件生长速度一致,总体来看,偏酸性的环境条件下有利于菌丝的生长(表3)。
2.2 菌丝致死温度的测定
35~45 ℃处理10 min后,红丝病和粉斑病病原菌各菌落全部生长正常;在45 ℃处理后,有部分菌株的个别菌落不再生长,且能够生长的菌落生长速率明显小于低温处理的菌株;50 ℃处理后,所有菌落均完全停止生长。结果说明,各菌株菌丝的致死温度均为50 ℃/10 min (表4)。
表3 pH值对菌丝生长的影响
Table 3 Effect of pH on the hyphae growth mm/d

pHHK-ML136HK-TD132WN-KLY221WC-WC01QH-BAXC225DZ-HD02SY-LQG81HK-TD121SY-LXG101WN-KLY5314.06.8d7.9c6.4d5.7d7.3d6.4e5.6d9.1e7.3e8.6e5.011.6a11.4b11.3b11.1b11.6b11.7b10.1b18.6b15.3b17.4b6.012.2a12.6a12.1a11.7a12.4a12.5a11.9a20.3a16.3a18.9a7.010.7b11.2b11.1b10.8b10.9c10.5c9.8b18.7b15.2b17.3b8.07.6c8.4c7.2c6.9c7.6d8.1d6.7c15.9c13.8c15.4c9.04.0e4.3d3.8e3.9e4.1e4.3f3.7e11.6d9.6d10.8d10.00.9f1.2e0.7f0.8f1.1f1.2g0.6f3.3f2.2f2.8f
注:不同小写字母表示差异显著(P<0.05)。
Note: Different letters indicate significant differences (P<0.05).
表4 各菌株经不同温度水浴处理后的存活情况
Table 4 The survival situation of isolates under different water bath treatment

菌株Isolates水浴处理温度Thesurvivalsituationofisolatesunderdifferentwaterbathtreatment35℃40℃45℃50℃55℃60℃65℃HK-ML1365/55/52/50/50/50/50/5HK-TD1325/55/55/50/50/50/50/5WN-KLY2215/55/53/50/50/50/50/5WC-WC015/55/55/50/50/50/50/5QH-BAXC2255/55/53/50/50/50/50/5DZ-HD025/55/52/50/50/50/50/5SY-LQG815/55/55/50/50/50/50/5HK-TD1215/55/53/50/50/50/50/5SY-LXG1015/55/55/50/50/50/50/5WN-KLY5315/55/55/50/50/50/50/5
注: 表中数据用+/-表示,“+”代表能够生长的菌落数量,“-”代表不能生长的菌落数量。
Note:The data in the Table were shown as +/-,“+”show the number of colony can grow, “-”show the number of colony can’t grow.
2.3 碳、氮源对菌丝生长的影响
在供试的13种碳源中,红丝病和粉斑病病原菌各菌株能够利用多种碳源,但是各菌株对碳源选择存在差异,红丝病病原菌对可溶性淀粉利用率最高,其次为D-山梨醇,而对纤维二糖的利用率较低。粉斑病病原菌对可溶性淀粉利用率最高,其次为甘露醇和麦芽糖,而对乳糖的利用率较低。在各供试的碳源中,红丝病和粉斑病病原菌利用碳源的效果基本一致,然而,红丝病病原菌利用乳糖、D-木糖、D-半乳糖比粉斑病病原菌的效果好(图1)。
在供试的12种氮源中,以L-谷氨酰胺为氮源的培养基最适合红丝病病原菌的生长,其次是磷酸氢二氨,红丝病病原菌在以乙酸铵为氮源的培养基上不生长。粉斑病病原菌对L-谷氨酰胺利用率最高,其次为硝酸钠、硝酸钾、蛋白胨、L-亮氨酸,而对磷酸二氢铵、甘氨酸、乙酸铵的利用率较低(图2)。
2.4 不同培养基对菌丝生长的影响
红丝病病原菌在燕麦片煎液琼脂培养基(OMA)上生长速率最快,其次为马铃薯蔗糖琼脂培养基(PSA),而在查彼固体培养基(Czapek)和营养牛肉琼脂培养基(NA)上的生长速率最慢。粉斑病病原菌在马铃薯蔗糖琼脂培养基(PSA)和马铃薯葡萄糖琼脂培养基(PDA)上生长速率最快,其次为燕麦片煎液琼脂培养基(OMA)、马铃薯胡萝卜煎液培养基(PCA),而在查彼固体培养基(Czapek)、理查固体培养基(Richard)、海水营养琼脂培养基(SNA)这类用无机元素配制的培养基上生长速率较慢,在营养牛肉琼脂培养基(NA)上的生长速率最慢(图3)。
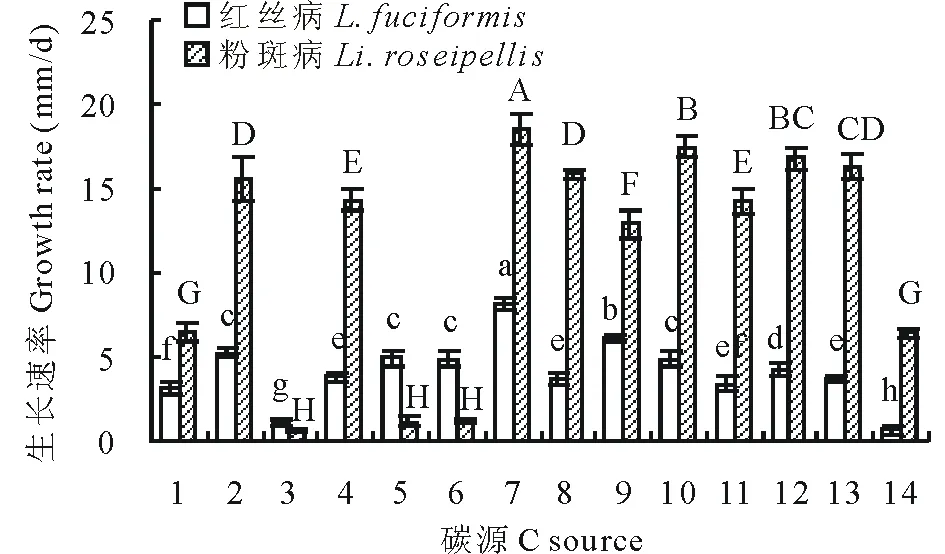
图1 碳源对菌丝生长的影响Fig.1 Effect of carbon sources on the hyphae growth
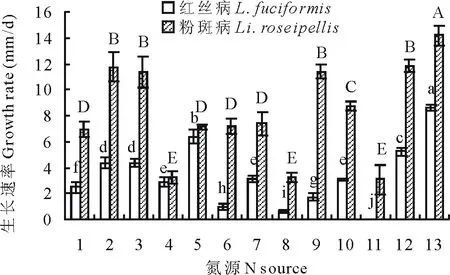
图2 氮源对菌丝生长的影响Fig.2 Effect of nitrogen sources on the hyphae growth
1:CK Control;2:蔗糖 Sucrose;3:乳糖 Lactose;4:D-果糖 D-fructose 5:D-木糖 D-xylose;6:D-半乳糖 D-galactose;7:可溶性淀粉 Soluble starch;8:葡萄糖 Glucose;9:D-山梨醇 D-sorbitol;10:甘露醇 Mannitol;11:L-鼠李糖 L-rhamnose;12:麦芽糖Maltose;13:D-甘露醇 D-Mannitol;14:纤维二糖 Cellobiose。不同大小写字母分别表示同一病原菌不同处理间差异显著(P<0.05),下同。Different letters indicate significant differences in the same pathogen of different treatments (P<0.05), the same below. 1:对照CK;2:硝酸钠Sodium nitrate;3:硝酸钾Potassium nitrate;4:磷酸二氢铵Ammonium dihydrogen phosphate;5:磷酸氢二氨Diammonium phosphate;6:脲Carbamide;7:硫酸铵 Ammonium sulfate;8:甘氨酸Glycine;9:蛋白胨Peptone;10:氯化铵 Ammonium chloride;11:乙酸铵 Ammonium acetate;12:L-亮氨酸L-aminocaproic acid;13:L-谷氨酰胺 L-glutamine.
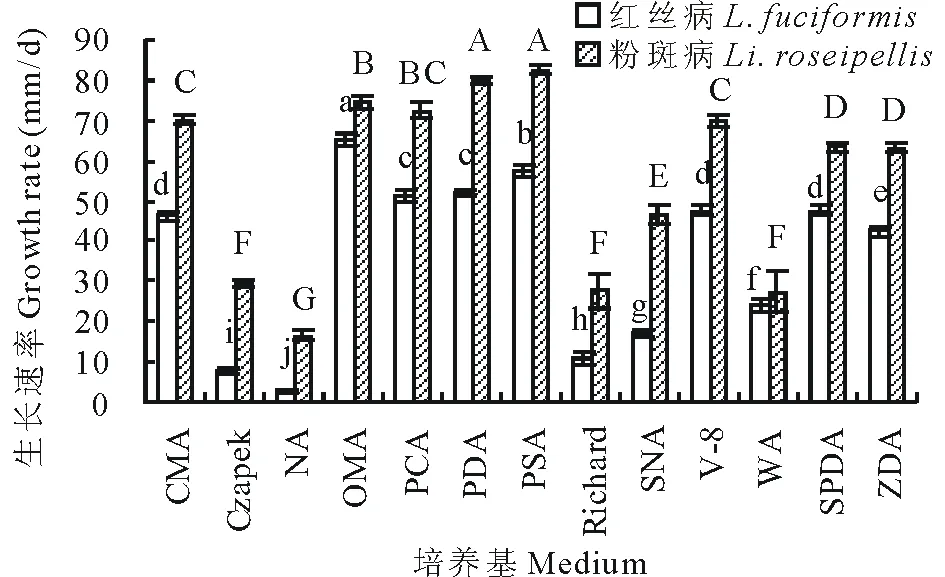
图3 不同培养基对菌丝生长的影响Fig.3 Effect of different media on the hyphae growth CMA: 玉米粉琼脂培养基Corn meal agar; NA: 营养牛肉琼脂培养基Nutrient agar; OMA: 燕麦片煎液琼脂培养基Oat meal agar; PCA: 马铃薯胡萝卜煎液培养基Potato carrot agar; PDA: 马铃薯葡萄糖琼脂培养基Potato dextrose agar; PSA: 马铃薯蔗糖琼脂培养基Potato sucrose agar; SNA: 海水营养琼脂培养基Saltwater nutrient agar; V-8: V-8培养基V-8 agar; WA: 水琼脂培养基Water agar; SPDA: 海滨雀稗煎液琼脂培养基Seashore paspalum decoction agar; ZDA: 结缕草煎液琼脂培养基Zoysia grass decoction agar.
2.5 杀菌剂对病原菌的毒力
应用生长速率测定法在PDA平板上测定14种杀菌剂对L.fuciformis菌丝生长的抑制作用,结果表明,在供试的14种药剂中以5%烯唑醇对红丝病病原菌的毒力最高,其EC50值仅为0.113 mg/L,其次是64%精甲霜灵·4%代森锰锌,其EC50值为0.161 mg/L,毒力最低的是15%甲霜灵·10%霜霉威,其EC50值为121.522 mg/L(表5)。
应用生长速率测定法在PDA平板上测定14种杀菌剂对粉斑病病原菌的毒力,结果表明,在供试的14种药剂中以5%烯唑醇对粉斑病病原菌的毒力最高,其EC50值仅为0.282 mg/L,其次是12.5%腈菌唑,其EC50值为0.328 mg/L,毒力最低的是15%甲霜灵·10%霜霉威,其EC50值为214.532 mg/L(表6)。
3 讨论
红丝病和粉斑病曾被认为是世界范围内冷暖地区危害冷季型草坪草的常见病害[9]。而Zhang等[15]调查发现L.fuciformis和Li.roseipellis广泛地分布于我国热带地区(海南省),红丝病在海南省主要发展高尔夫产业的6个市县当中均有发现,粉斑病在其中3个市县当中有分布。红丝病和粉斑病均可严重危害海滨雀稗、杂交狗牙根,这两种草种因其优良的坪用特性而被广泛地运用于海南高尔夫球场和城市绿化草坪建植。该两种病原菌近期才在我国报道,因此对其生物学特性及化学防治方法进行研究具有重要的意义。
表5 14种杀菌剂对红丝病病菌的毒力
Table 5 Toxicity of 14 fungicide toL.fuciformis

药剂名称Fungicides毒力回归方程Regressionequation相关系数Correlationcoefficient(R2)EC50(mg/L)70%代森锰锌70%mancozeby=1.109x+5.5370.9870.32870%甲基托布津70%thiophanate-methyly=0.436x+4.1360.99396.11664%精甲霜灵·4%代森锰锌64%metalaxyl-M·4%mancozeby=1.527x+6.2100.9410.16175%百菌清75%chlorothalonily=0.724x+4.1350.95915.65950%多菌灵50%carbendazimy=1.027x+4.2460.9535.42220%三唑酮20%triazoloney=1.964x+4.2110.9452.52240%氟硅唑40%flusilazoley=0.988x+5.4490.9640.35143%戊唑醇43%tebuconazoley=0.601x+4.9250.9561.33315%甲霜灵·10%霜霉威15%metalaxyl·10%propamocarby=0.378x+4.2120.970121.52212.5%腈菌唑12.5%myclobutanily=1.342x+5.3580.9680.54150%异菌脲50%iprodioney=2.013x+4.7090.9641.3955%烯唑醇5%diniconazoley=0.774x+6.5210.9960.11350%咪酰胺锰盐50%prochlorazy=1.137x+4.1480.9955.61570%恶霉灵70%hymexazoly=0.878x+4.9680.9891.088
EC50:抑制中浓度 Median effective concentration. 下同 The same below.
表6 14种杀菌剂对粉斑病病菌的毒力
Table 6 Toxicity of 14 fungicide toLi.roseipellis
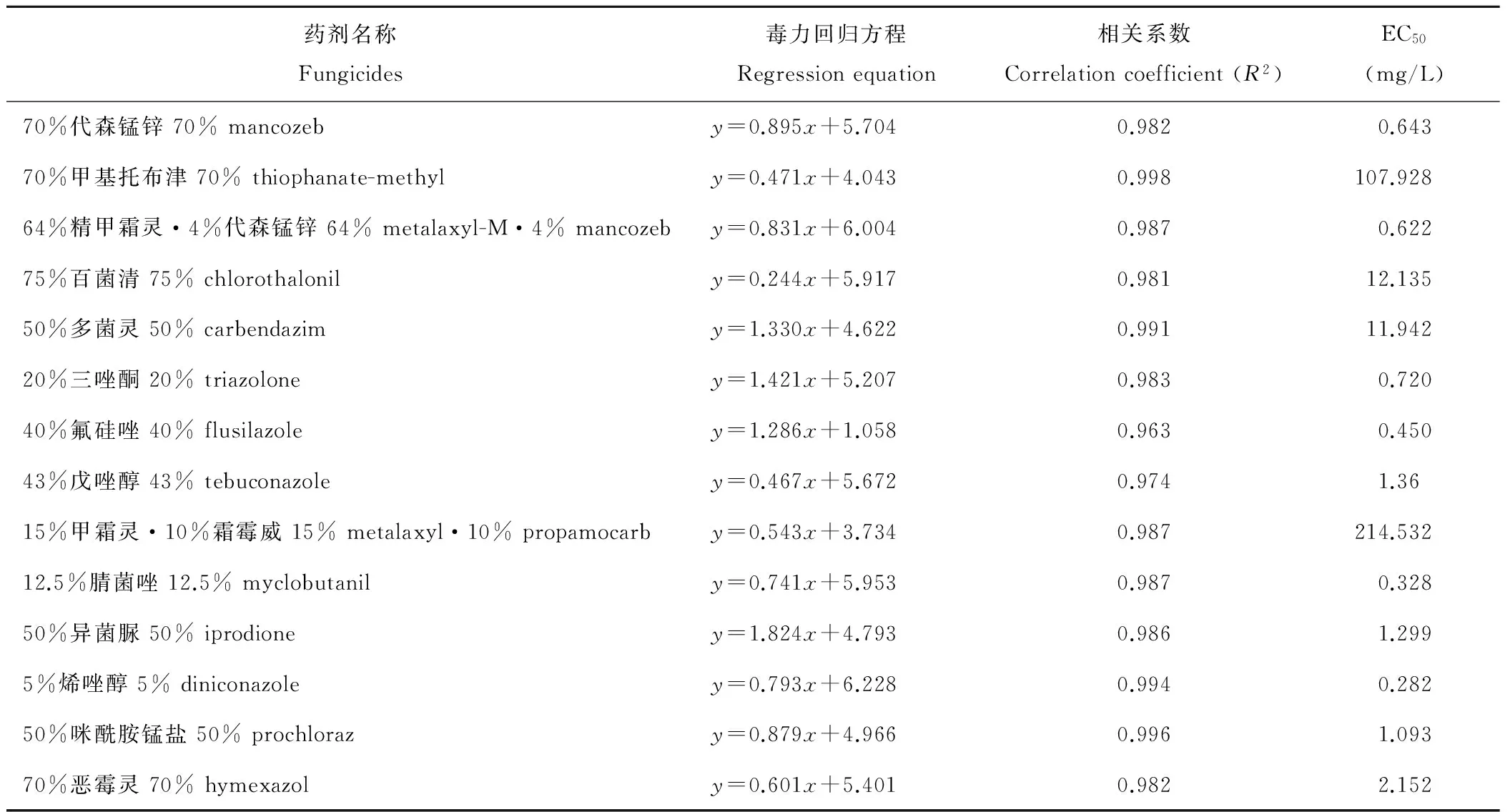
药剂名称Fungicides毒力回归方程Regressionequation相关系数Correlationcoefficient(R2)EC50(mg/L)70%代森锰锌70%mancozeby=0.895x+5.7040.9820.64370%甲基托布津70%thiophanate-methyly=0.471x+4.0430.998107.92864%精甲霜灵·4%代森锰锌64%metalaxyl-M·4%mancozeby=0.831x+6.0040.9870.62275%百菌清75%chlorothalonily=0.244x+5.9170.98112.13550%多菌灵50%carbendazimy=1.330x+4.6220.99111.94220%三唑酮20%triazoloney=1.421x+5.2070.9830.72040%氟硅唑40%flusilazoley=1.286x+1.0580.9630.45043%戊唑醇43%tebuconazoley=0.467x+5.6720.9741.3615%甲霜灵·10%霜霉威15%metalaxyl·10%propamocarby=0.543x+3.7340.987214.53212.5%腈菌唑12.5%myclobutanily=0.741x+5.9530.9870.32850%异菌脲50%iprodioney=1.824x+4.7930.9861.2995%烯唑醇5%diniconazoley=0.793x+6.2280.9940.28250%咪酰胺锰盐50%prochlorazy=0.879x+4.9660.9961.09370%恶霉灵70%hymexazoly=0.601x+5.4010.9822.152
本试验对病原菌生物学特性研究表明,L.fuciformis和Li.roseipellis对酸碱度的适应能力较强,在pH值为4~10的条件下均能较好地生长,偏酸性的条件有利于菌丝的生长,这与海南省当地土壤环境为偏酸性相一致,因此改善土壤酸碱度可以有效预防病害的发生。碳氮源对L.fuciformis和Li.roseipellis菌丝生长影响的结果表明,这两种病原菌可利用多种碳氮源,说明这两种病原菌除了从寄主植物中获取所需养分外也可利用大田环境中的各种碳氮源,从而增加对环境的适应性。L.fuciformis和Li.roseipellis对供试的13种碳源和12种氮源有一定的选择性,可溶性淀粉和硝酸铵分别是最佳碳源和最佳氮源,研究还发现,在不加碳源和氮源的培养基中,菌丝虽然能生长,但菌丝稀薄生长状况不佳,说明碳源和氮源对L.fuciformis和Li.roseipellis的生长起着重要的作用。L.fuciformis的最适合生长培养基为OMA,而Li.roseipellis最适合生长的培养基为PSA和PDA。这两种病原菌在PSA、PDA、OMA、PCA等植物性有机培养基上生长状况良好,在Czapek、Richard、SNA等用无机元素配制的培养基上生长情况较差,说明这两种病原菌利用的营养元素较为复杂,Li.roseipellis和L.fuciformis作为植物病原菌,菌丝的生长除了需要Czapek、Richard、SNA等培养基中的营养元素外,还需要植物中的一些微量元素。这与Li等[16]研究沙打旺黄矮根腐病病原埃里砖隔孢(Embellisiaastragali)的营养利用情况结果一致。
本研究测定了14种杀菌剂对L.fuciformis和Li.roseipellis的毒力,结果表明,供试的14种杀菌剂对L.fuciformis和Li.roseipellis均有一定的抑制作用,但是差异较大。5%烯唑醇,40%氟硅唑,12.5%腈菌唑和20%三唑酮等14-α-脱甲基反应抑制剂有效抑制了L.fuciformis和Li.roseipellis的菌丝生长,其中,5%烯唑醇对L.fuciformis和Li.roseipellis的毒力最大,其EC50值最小,可作为防治红丝病与粉斑病的有效杀菌剂。试验结果表明,20%三唑酮对L.fuciformis和Li.roseipellis也具有较强的毒力,其EC50值分别为2.522和0.720 mg/L,这与Gould等[17]研究结果一致。14-α-脱甲基反应抑制剂属于多作用位点杀菌剂,属于低等抗性风险药剂,且抗性菌株环境适应能力较差,因此只要田间合理施药,不易形成抗性群体[18]。而甲基托布津对L.fuciformis和Li.roseipellis菌丝生长的抑制效果较差,其EC50值分别为96.116和107.928 mg/L,同样作为苯并咪唑类杀菌剂的多菌灵对两种病原菌的抑制效果也较差,其EC50值分别为5.422和11.922 mg/L。说明分离自海南省的菌株可能已经对苯并咪唑类杀菌剂产生了抗药性。包括甲基托布津和多菌灵在内的苯并咪唑类杀菌剂因其杀菌效果好、范围广等特点已被广泛用于草坪草真菌病害的防治当中,然而因其作用位点单一,随着长期、重复单一的使用同一种杀菌剂,抗性问题变得越来越严重。已有研究表明禾生炭疽菌(Colletotrichumgraminicola)[19-20]与禾草币斑病菌(Sclerotiniahomoeocarpa)[21-24]等草坪草病原菌已对苯并咪唑类杀菌剂产生了严重抗性问题。因此,还需进一步对L.fuciformis和Li.roseipellis群体抗药性进行深入研究才能了解其对苯并咪唑类杀菌剂的抗性水平。
本研究测定了草坪草红丝病和粉斑病病原菌的生物学特性及多种杀菌剂对病原菌的毒力。这些研究结果为深入了解病原菌的基础生物学提供科学依据,并可帮助人们更好地制定防治策略。在实际管理中,农药对病害的防控能够起到比较好的效果[25],但是,同样会给环境及人类的健康造成不良的影响。许多发达国家如美国和加拿大的许多地区已经明令禁止草坪养护过程中过多使用化学药剂,我国也已通过一系列的生物防治手段增加草坪草的抗逆性[26-27]。草坪草红丝病与粉斑病的发生受环境[9]、寄主[28-29]和水肥[30-31]影响较大。因此,暖季型草坪草红丝病和粉斑病需采用综合防治策略。
[1] Xu B L. The Lawn Protection[M]. Beijing: Chinese Forestry Press, 2013.
[2] Nan Z B, Li C J. The directory of forage grasses diseases in China. Pratacultural Science, 1994, 13(Supplementary issue): 1-160.
[3] Lv C, Luo L, Hsiang T. First report of dollar spot of seashore paspalum (Paspalumvaginatum) caused bySclerotiniahomoeocarpain South China. Plant Disease, 2010, 94(3): 373.
[4] Zhang W, Nan Z B, Liu G D,etal. First report of leaf and sheath spot caused byWaiteacircinatavar. zeae onPaspalumvaginatumandZoysiatenuifoliain China. Plant Disease, 2014, 98(10): 1436.
[5] Zhang W, Liu G D, Nan Z B. Identification and biological charactertistics ofSclerotiniahomoeoparpacausing dollar spot on 4 warm-season turfgrass. Acta Prataculturae Sinica, 2015, 24(1): 124-131.
[6] Zhang W, Nan Z B, Tian P,etal.Microdochiumpaspali, a new species causing seashore paspalum disease in south China. Mycologia, 2015, 107(1): 80-89.
[7] Couch H B. Disease of Turfgrass[M]. Malabar, F L: Krieger Publishing Company, 1995.
[8] Kaplan J D, Jackson N. Red thread and pink patch diseases of turfgrasses. Plant Disease, 1983, 67(2): 159-162.
[9] Smiley R W, Dernoeden P H, Clarke B B. Compendium of Turf grass Diseases[M]. St. Paul: American Phytopathological Society (APS Press), 2005.
[10] Stalpers J A, Loerakker W M.LaetisariaandLimonomycesspecies (Corticiaceae) causing pink diseases in turfgrasses. Canadian Journal of Botany, 1982, 60(5): 529-537.
[11] Maccaroni M, Corazza L, Buonaurio R,etal. Occurrence of pink patch of perennial ryegrass caused byLimonomycesroseipellisin Italy. Plant Disease, 2002, 86(1): 74.
[12] Burdsall H H.Laetisaria(Aphyllophorales, Corticiaceae), a new genus for the teleomorph ofIsariafuciformis. Transaction of the British Mycological Society, 1979, 72(3): 419-422.
[13] Zhang W, Nan Z B, Liu G D. First report ofLaetisariafuciformiscausing red thread on seashore paspalum (Paspalumvaginatum) in south China. Plant Disease, 2012, 96(9): 1374.
[14] Zhang W, Nan Z B, Liu G D. First report ofLimonomycesroseipelliscausing pink patch on bermudagrass in south China. Plant Disease, 2013, 97(4): 561.
[15] Zhang W, Hu M J, Liu G D,etal. Investigation and characterization of red thread and pink patch on warm-season turfgrasses in Hainan Province, tropical China. European Journal of Plant Pathology, 2015, 141(2): 311-325.
[16] Li Y Z, Nan Z B. Nutritional study onEmbellisiaastragali, a fungal pathogen of milk vetch (Astragalusadsurgens). Antonie van Leeuwenhoek, 2009, 95(3): 275-284.
[17] Gould C J, Goss R L, Vassey W E. Fungicidal tests for control ofCorticiumred thread in the Pacific North West. Journal of the Sports Turf Research Institute, 1976, 51: 62-66.
[18] Koch P L, Grau C R, Jo Y K,etal. Thiophanate-methyl and propiconazole sensitivity inSclerotiniahomoeocarpapopulations from golf courses in Wisconsin and Massachusetts. Plant Disease, 2009, 93(1): 100-105.
[19] Young J R, Tomaso-Peterson M, De la Cerda K,etal. Two mutations in β-tubulin 2 gene associated with thiophanate-methyl resistance inColletotrichumcerealeisolates from creeping bentgrass in Mississippi and Alabama. Plant Disease, 2010, 94(2): 207-212.
[20] Wong F P, De la Cerda K A, Hernandez-Martinez R,etal. Detection and characterization of benzimidazole resistance in California populations ofColletotrichumcereale. Plant Disease, 2008, 92(2): 239-246.
[21] Putman A I, Jung G, Kaminski J E. Geographic distribution of fungicide-insensitiveSclerotiniahomoeocarpaisolates from golf courses in the northeastern United States. Plant Disease, 2010, 94(2): 186-195.
[22] Warren C G, Sanders P, Cole H J,etal. Relative fitness of benzimidazole- and cadmium-tolerant populations ofSclerotiniahomoeocarpain the absence and presence of fungicides. Phytopathology, 1977, 67: 704-708.
[23] Warren C G, Sanders P, Cole H.Sclerotiniahomoeocarpatolerance to benzimidazole configuration fungicides. Phytopathology, 1974, 64: 1139-1142.
[24] Detweiler A R, Vargas Jr J M, Danneberger T K. Resistance ofSclerotiniahomoeocarpato iprodione and benomyl. Plant Disease, 1983, 67(6): 627-630.
[25] Wang J H, Duo D. Effect of paclobutrazol on drought resistance of six turfgrass cultivars during the seeding stage. Acta Prataculturae Sinica, 2014, 23(6): 253-258.
[26] Liu Q, Yao T, Ma H L. Combined effects of bio-fertilizer and citric acid on turf quality and soil biology on a calcareous soil. Acta Prataculturae Sinica, 2014, 23(5): 223-230.
[27] Li X Y, Wang Y R, Jia C Z. Effect of urea fertilizer on growth and performance ofCleistogenessongoricaturfgrass. Acta Prataculturae Sinica, 2014, 23(6): 136-141.
[28] Woolhouse A R. Assessment of perennial ryegrass cultivars for susceptibility to red thread disease. Journal of the Sports Turf Research Institute, 1996, 67: 147-152.
[29] Raikes C, Leep N W, Canaway P M. The effect of red thread (Laetisariafuciformis) incidence on wear tolerance of monostands of perennial ryegrass (Loliumperenne) cultivars under three nitrogen. Journal of the Sports Turf Research Institute, 1996, 72: 61-66.
[30] Cahill J V, Murray J J, Dernoeden P H. Interrelationships between fertility and red thread fungal disease of turf grasses. Plant Disease, 1983, 67(10): 1080-1083.
[31] Tredway L P, Soika M D, Clarke B B. Red thread development in perennial ryegrass in response to nitrogen, phosphorus, and potassium fertilizer applications. International Turfgrass Society Research Journal, 2001, 9: 715-721.
[1] 徐秉良. 草坪保护学[M]. 北京: 中国林业出版社, 2013.
[2] 南志标, 李春杰. 中国牧草真菌病害名录. 草业科学, 1994, 13(增刊): 1-160.
[5] 章武, 刘国道, 南志标. 4种暖季型草坪草币斑病病原菌鉴定及其生物学特性. 草业学报, 2015, 24(1): 124-131.
[25] 王竞红, 多多. 多效唑对6种草坪草苗期抗旱性影响的研究. 草业学报, 2014, 23(6): 253-258.
[26] 刘强, 姚拓, 马晖玲. 菌肥与柠檬酸互作对石灰性土壤生物学特性及草坪质量的影响. 草业学报, 2014, 23(5): 223-230.
[27] 李欣勇, 王彦荣, 贾存智. 施尿素对无芒隐子草草坪生长特性的影响. 草业学报, 2014, 23(6): 136-141.
Biological characteristics ofLaetisariafuciformisandLimonomycesroseipellisand their responses to different fungicides
ZHANG Wu1,2, HU Mei-Jiao3, GAO Zhao-Yin3, LI Min3, LIU Guo-Dao4, NAN Zhi-Biao1*
1.StateKeyLaboratoryofGrasslandAgro-ecosystems,CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China; 2.LingnanNormalCollege,Zhanjiang524048,China; 3.EnvironmentandPlantProtectionInstitute,ChineseAcademyofTropicalAgriculturalSciences,Haikou571101,China; 4.TropicalCropsGeneticResourcesInstitute,ChineseAcademyofTropicalAgriculturalSciences,Danzhou571737,China
Red thread and pink patch, caused by the fungiLaetisariafuciformisandLimonomycesroseipellis, respectively, are important diseases of many turfgrass species worldwide. In this study, we analyzed the biological characteristics of these two pathogens and evaluated their responses to 14 different fungicides. The results showed thatL.fuciformisandLi.roseipellisgrew well at pHs ranging from 5 to 7, and the optimal pH value was 6. The hyphae of both pathogens lost viability in agar plugs that were incubated at 50 ℃ for 10 min. The optimal carbon and nitrogen sources forL.fuciformisandLi.roseipelliswere soluble starch and L-glutamine, respectively. The optimal medium forL.fuciformiswas oatmeal agar (OMA) and that forLi.roseipelliswas potato dextrose agar (PDA) or potato sucrose agar (PSA). Among the 14 fungicides, diniconazole had the strongest inhibitory effects onL.fuciformisandLi.roseipelliswith EC50values of 0.113 mg/L and 0.282 mg/L, respectively. The fungicide with the weakest inhibitory effects was 15% metalaxyl·10% propamocarb, with EC50values of 121.522 and 214.532 mg/L forL.fuciformisandLi.roseipellis, respectively. The results provide a scientific basis for understanding the basic biology of these pathogens, and may be useful for the development of new management strategies.
Laetisariafuciformis;Limonomycesroseipellis; charactertistic; toxicity response
10.11686/cyxb2016058
http://cyxb.lzu.edu.cn
2016-02-01;改回日期:2016-06-06
国家公益性行业农业科技专项(201303057),国家自然科学基金(31602002)和广东省教育厅重点平台及科研项目——青年创新人才类项目(2015KQNCX093)资助。
章武(1987-),男,江西抚州人,讲师。E-mail:ldzw1987@163.com*通信作者Corresponding author. E-mail:zhibiao@lzu.edu.cn
章武, 胡美姣, 高兆银, 李敏, 刘国道, 南志标. 草坪草红丝病与粉斑病病原菌生物学特性研究与杀菌剂室内毒力测定. 草业学报, 2016, 25(12): 140-149.
ZHANG Wu, HU Mei-Jiao, GAO Zhao-Yin, LI Min, LIU Guo-Dao, NAN Zhi-Biao. Biological characteristics ofLaetisariafuciformisandLimonomycesroseipellisand their responses to different fungicides. Acta Prataculturae Sinica, 2016, 25(12): 140-149.

