模拟微重力环境及普通环境下小球藻的培养
张志忍,王成成,王为国,汪铁林,王存文
武汉工程大学化工与制药学院,湖北武汉430074
模拟微重力环境及普通环境下小球藻的培养
张志忍,王成成,王为国,汪铁林*,王存文
武汉工程大学化工与制药学院,湖北武汉430074
利用旋转细胞培养系统模拟微重力场,考察模拟微重力场及添加不同质量密度葡萄糖对小球藻(Chlorella sp.)生长情况的影响.研究结果表明,以BG-11为基础培养基,模拟微重力环境对小球藻生长有明显促进作用.当小球藻细胞接种密度为1.42×107个/毫升,培养时间为12 d时,普通环境下培养的小球藻最高细胞密度仅为5.80×107个/毫升,而在相同培养条件下模拟微重力环境下生长的小球藻细胞密度达到1.58×108个/毫升.在培养基中添加葡萄糖作为额外碳源后,微藻生长周期显著缩短,适宜小球藻生长的葡萄糖质量密度为10 g/L.当添加10 g/L葡萄糖,小球藻接种密度为5.76×107个/毫升,培养时间为5 d时,普通环境和模拟微重力环境下培养的小球藻的最高细胞密度分别可达3.85×108个/毫升和5.42×108个/毫升.
模拟微重力;小球藻;葡萄糖
1 引言
由于对传统化石能源的过分依赖,能源安全和气候变化已成为当今人类社会所关注的两大热点问题[1-2].推行低碳经济已成为全球共识,生物质能源的开发和利用已成为“后石油时代”世界能源发展战略性转变的方向.微藻生物质与其他陆生生物质相比,由于具有光合作用效率高、油脂含量高[3]、生长周期短、生长速度快、生态分布广[4]、不占耕地等优势,因此作为一种生物质能源原料倍受关注.利用富油微藻不仅可以制取生物燃料,而且微藻在培养过程中还可以吸收大气中的二氧化碳,有利于环境保护.
筛选出大量优良的微藻品种是发展由微藻制取绿色生物质能源的首要前提.已筛选出的微藻品种主要有斜生栅藻、葡萄藻、盐生杜氏藻、小球藻、灰色念珠藻等,其中小球藻是一种公认的大规模培养制备微藻燃料的优良藻种.
能否大规模、高密度、低成本培养是制约富油微藻产业化的重要因素之一.近年来,为了加强对富油微藻生长特性的了解,优化其生长条件,探索短耗时、低成本的培养途径,已开展了关于光照强度、温度、pH值、盐度等环境因子影响微藻生长的研究[5-9].研究结果表明,若环境因子发生变动,微藻会对其做出相应的反应.改变培养方法、培养基的类型、所添加营养物质种类与含量、微藻生长时的外界环境(如温度、光照、pH值)等条件,都会使微藻细胞内产生酶、藻蛋白、藻多糖、多不饱和脂肪酸(PUFAs)等物质的能力受到影响[10],进而影响到微藻细胞密度和细胞组成.
微重力环境可能会对轮藻、杜氏盐藻等微藻的代谢、发育、生殖、衰老等各方面生理生化过程产生影响[11-13].太空飞行和地面回转器的实验结果似乎说明,微重力改变了微藻机体与介质环境的相互联系,从而影响微藻的代谢.为探索高密度、短耗时的大规模微藻培养途径,本研究以小球藻(Chlorella sp.)为培养对象,以BG-11为基础培养基,利用旋转细胞培养系统(the rotary cell culture system,RCCS)模拟微重力场,考察了模拟微重力场对小球藻生长的影响,并在pH值、温度、光照强度等培养条件相同的情况下,考察了添加不同浓度葡萄糖对小球藻生长的影响.
2 实验部分
2.1 材料与试剂
本实验中使用的微藻藻种是小球藻(Chlorella sp.),其编号为FACHB-9,由武汉水生生物所提供.采用BG-11培养基作为基础培养基;实验中所用试剂均为分析纯.
2.2 仪器与设备
紫外-可见光分光光度仪(UV-6000,上海元析仪器有限公司),旋转细胞培养系统(美国Synthecon INC公司),二氧化碳人工气候箱(LRH-300-GSIT,上海银泽仪器设备有限公司),托马细胞计数器(上海求精生化试剂仪器有限公司).
2.3 实验方法
2.3.1 小球藻的培养用经过高压灭菌后的BG-11培养基将处于成熟期的小球藻藻液稀释10倍,再将藻液均分为多个组别,分别向其中添加不同浓度葡萄糖作为额外碳源后用于实验.
将预处理后含不同浓度葡萄糖的藻液分别注入RCCS的回转器中作为实验组,同时将等体积的藻液注入100 mL的锥形瓶中作为对照组.将实验组与对照组置于人工气候箱中培养,每24 h测量一次细胞密度,以研究普通环境和微重力环境下小球藻的生长情况.以上实验培养条件均为:温度(25±2)℃、冷白荧光光照强度4 000 lx/cm2、光照时间比12∶12.
2.3.2 藻液密度的测定藻液密度的测定采用分光光度法测量,采用UV-6000紫外-可见光分光光度计在680 nm波长处测量藻液光密度(OD680,当光密度大于1.0时适当稀释藻液),并采用托马细胞计数器测量该藻液中的藻细胞数量.
2.3.3 比生长速率的计算测出藻细胞密度后,再按公式(1)计算出特定时间内的比生长速率[14].

式中K表示比生长速率(d-1),N2、N1分别表示在T2和T1时刻的小球藻的细胞密度.
3 结果与讨论
3.1 普通环境下葡萄糖对小球藻生长状况的影响
细胞生长过程中必须依靠碳源提供能量和组成碳骨架.大量研究表明,许多微藻均具有利用外加碳源进行兼养及异养的能力.在微藻的异养培养研究中,葡萄糖是一种广泛采用有机碳源,其对微藻细胞生长的促进作用明显优于碳酸氢钠等无机碳源[15].将初始藻液细胞密度为5.76×107个/毫升的小球藻在25℃、光照强度4 000 lx/cm2、光照比12∶12的普通环境下培养5 d.由图1可知,添加了葡萄糖的实验组中微藻的生长情况都较良好,最大藻细胞密度均超过3×108个/毫升,而没有添加葡萄糖作为外加碳源的对照组中最大藻细胞密度仅为1.17×108个/毫升.
由图1可以看出,在培养的第1 d,不同葡萄糖浓度培养基下的生长微藻细胞浓度增长均不明显,此段时间可能是微藻生长中对环境的一个适应阶段.但从第2 d开始,添加葡萄糖的实验组中微藻细胞的数量迅速增加,该生长阶段为小球藻的指数生长期,在光学显微镜下可以观察到,藻细胞的体积增大并且藻体形态不一,此时对外界环境因子比较敏感.而与之相比,未添加葡萄糖的对照组中微藻的生长缓慢,藻细胞浓度几乎没有表现出明显的增长趋势.
微藻对葡萄糖的吸收利用可能存在两种机制[16]:一种是低浓度下微藻的吸收就会达到饱和,在高浓度环境下微藻易死亡;另一种是较高浓度下微藻细胞吸收才能达到饱和.本实验研究结果显示,当葡萄糖质量密度低于10 g/L时,小球藻最大比生长速率随葡萄糖质量密度增加而明显增加,但当葡萄糖质量密度处于10 g/L~20 g/L时,其最大比生长速率生长反而随葡萄糖质量密度上升而下降,说明高浓度葡萄糖对小球藻细胞生长有一定抑制作用,因此可以认为小球藻对葡萄糖的吸收为第一种机制.
由图1可知,添加葡萄糖作为额外碳源的小球藻在普通环境下均于第5 d进入稳定生长期,而未添加葡萄糖的对照组则保持缓慢的生长速率,说明葡萄糖的添加显著缩短了小球藻的生长周期.7组不同处理组中5 g/L和10 g/L葡萄糖质量密度的培养基的最大,比生长速率分别达到1.71/d和1.73/d,并且添加质量密度为10 g/L的葡萄糖时,最高藻细胞密度可达到3.85×108个/毫升,细胞生长情况较其他浓度处理组都较好(见图2),所以本实验确定普通环境下小球藻生长的最适宜葡萄糖质量密度为10 g/L.
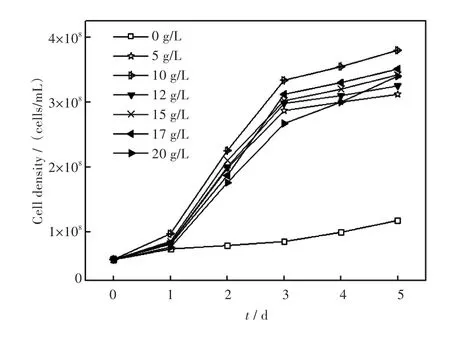
图1 普通环境下小球藻在含不同质量密度葡萄糖培养基中的生长曲线(接种藻密度5.76×107个/毫升,温度25℃,光强4 000 lx/cm2,培养时间5 d)Fig.1Growth curves of C.sp.cultivated with different mass densities of glucose in general condition(the initial cell density=5.76×107cells/mL,temperature=25℃,illumination intensity=4 000 lx/cm2,culture time=5 d)
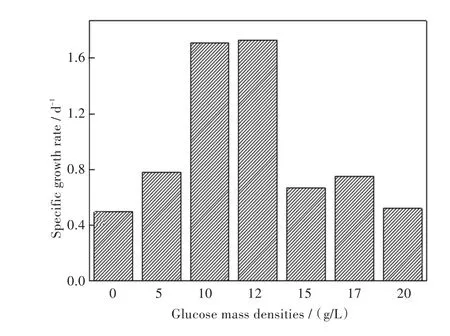
图2 普通环境下小球藻在含不同质量浓度葡萄糖的培养基中的最大比生长速率(接种藻密度5.76×107个/毫升,温度25℃,光强4 000 lx/cm2,培养时间5 d)Fig.2Growth rates of C.sp.cultivated with different mass densities of glucose in the general condition(the initial cell density=5.76×107cells/mL,temperature=25℃,illumination intensity=4 000 lx/cm2,culture time=5 d)
3.2 模拟微重力环境下葡萄糖质量密度对微藻生长影响
自上世纪末就有实验表明螺旋藻等微藻在经历微重力环境后,藻细胞的存活率、生物代谢等多种特性均发生改变,尤其是藻细胞的生长速率会明显加快[17].结合普通环境下葡萄糖对小球藻生长速率和细胞产量的明显促进作用,本实验进一步研究在模拟微重力环境下加入不同质量密度葡萄糖对微藻生长情况所产生的影响.将初始藻液密度为5.76×107个/毫升的小球藻在25℃、光照强度4 000 lx/cm2、光照比12∶12的模拟微重力环境下培养5 d,生长情况如图3及图4所示.实验结果表明添加葡萄糖后,微藻细胞浓度明显增高.从图3可以看出,随着葡萄糖质量密度的增高,获得的藻细胞密度先增加,但当葡萄糖密度过高时其藻细胞生长速率反而会有一定的下降.RCCS在转动的过程中使微藻能够充分的与培养基接触,吸收其中的养份,加快小球藻的生长,同时高质量浓度葡萄糖刺激微藻细胞大量繁殖快速代谢,但在有限的封闭生存环境中无法容纳过大的生物量以及过高溶氧,致使细胞死亡,微藻生长速率明显下降.
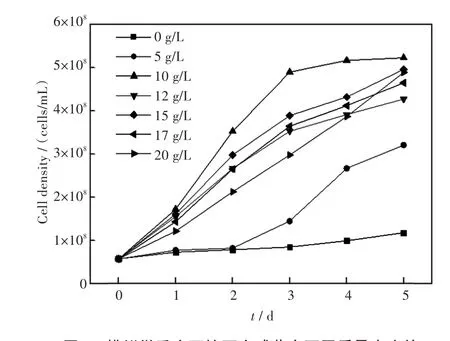
图3 模拟微重力环境下小球藻在不同质量密度的葡萄糖培养基中的生长情况(接种藻密度5.76×107个/毫升,温度25℃,光强4 000 lx/cm2,培养时间5 d)Fig.3Growth curves of C.sp.cultivated with different mass densities of glucose under the simulated microgravity condition(the initial cell density=5.76×107cells/mL,temperature=25℃,illumination intensity=4 000 lx/cm2,culture time=5 d)
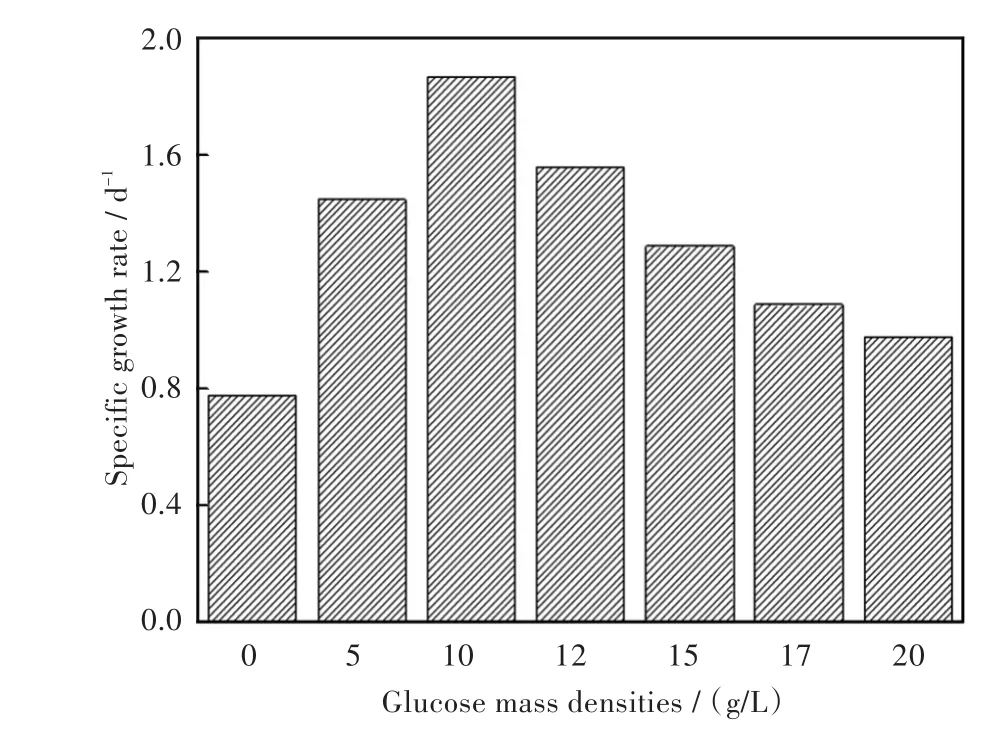
图4 模拟微重力环境下小球藻在不同质量密度的葡萄糖培养基中的比生长速率(接种藻密度5.76×107个/毫升,温度25℃,光强4 000 lx/cm2,培养时间5 d)Fig.4Growth rates of C.sp.cultivated with different mass densities of glucose under the simulated microgravity conditions(the initial cell density=5.76×107cells/mL,temperature=25℃,illumination intensity=4 000 lx/cm2,culture time=5 d)
结合图1以及图3,可以看出在第1 d普通环境下微藻处于调节适应期,生长速率明显低于第2 d的到第3 d的,而在模拟微重力环境下的微藻生长并未进入微藻调节适应的阶段.模拟微重力效应反应器的培养系统缩短了小球藻对高密度的葡萄糖培养基的适应时间,出现这一现象的原因可能在于小球藻在RCCS中生长时,会随回转器绕水平轴不断做圆周运动,在一个旋转周期内小球藻经历加速下降和减速上升等过程,导致藻细胞处于一个周期性超重和失重交错的变化重力场中,从而产生一个连续的自由落体状态,使藻细胞表现出微重力下的生物效应.而RCCS产生的微重力效应对微藻产生刺激,导致微藻生长分化加速.这与刘永定等[18-19]的实验结果相似.微藻在普通环境下生长时,细胞内微环境是平衡的,而突然进入微重力环境后,这种平衡被打破,微藻调节到新的微环境需要消耗能量,导致ATP酶活性增加并促使细胞自噬效应提高,从而引起细胞分裂分化加速.
图5和图6进一步对普通环境和微重力环境下小球藻生长情况进行对比.在同样的接种浓度及未添加葡萄糖的条件下,培养12 d后普通环境下生长的微藻细胞密度为5.8×107个/毫升,而模拟微重力环境下生长的微藻细胞密度达1.58×108个/毫升.在不同环境条件下微藻细胞密度的生长曲线都是随着培养时间增长而逐步上升,并且无论添加葡萄糖与否,RCCS中生长的微藻均表现出区别于普通环境下微藻的生长优势.除了模拟微重力生物学效应,另外一个原因可能在于普通环境下藻细胞易在重力作用下沉降聚集在培养容器底部,从而抑制藻细胞生长.而在模拟微重力环境下,藻细胞均匀悬浮于三维空间中,充分与培养基接触,促进藻细胞与培养基之间的物质交换,提高细胞生长速率.
对比图1和图3可见微重力情况下添加10 g/L葡萄糖的小球藻在第3 d就达到了最高生物量,较普通环境下生长的小球藻达到最高生物量缩短了2 d.同时在微重力环境下小球藻的最大藻细胞密度和最大比生长率均高于普通环境下培养的小球藻.因此,模拟微重力环境时有利于微藻生长,且在微重力环境下适合小球藻生长的最适葡萄糖质量密度约为10 g/L.该实验结果可为小球藻的高密度、短耗时培养研究提供一定的依据.
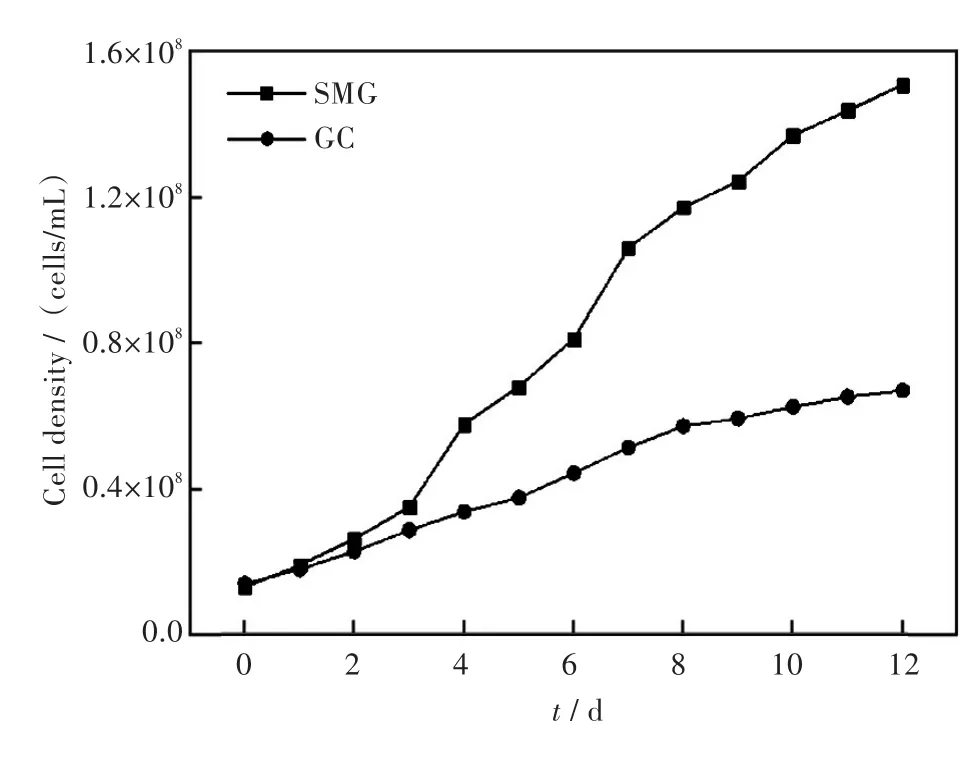
图5 不添加葡萄糖的小球藻在微重力(SMG)与普通环境(GC)下的生长曲线(接种藻密度1.423×107个/毫升,温度25℃,光强4 000 lx/cm2,培养时间12 d)Fig.5Growth curves of C.sp.cultivated without glucose under the microgravity and general conditions(the initial cell density=1.423×107cells/mL,temperature=25℃,illumination intensity=4 000 lx/cm2,culture time=12 d)
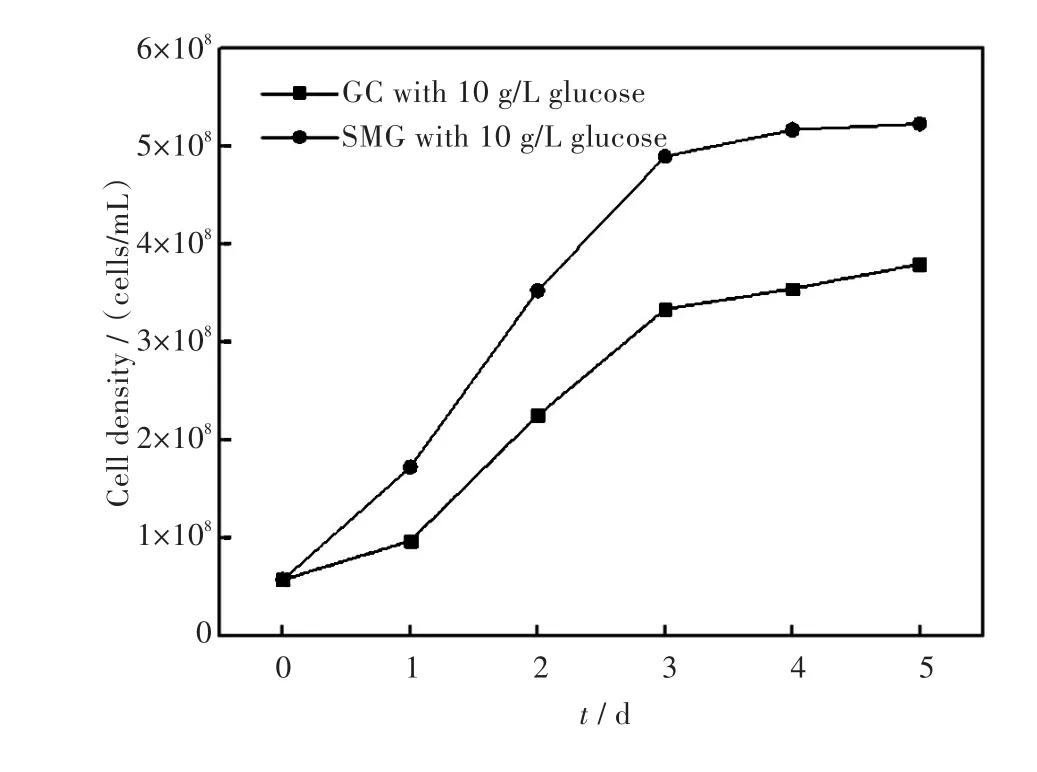
图6 小球藻在微重力环境(SMG)下及普通环境(GC)下生长情况(10 g/L的葡萄糖)(接种藻密度5.76×107个/毫升,温度25℃,光强4 000 lx/cm2,培养时间5 d)Fig.6Growth curves of C.sp.cultivated under the microgravity and general conditions in the medium with 10 g/L of glucose(the initial cell density=5.76×107cells/mL,temperature=25℃,illumination intensity=4 000 lx/cm2,culture time=5 d)
4 结语
分别对普通环境和模拟微重力环境下葡萄糖浓度对小球藻的生长特性进行了研究,结果显示不同浓度葡萄糖作为额外碳源在两种环境下均明显促进了小球藻的生长,缩短了藻细胞的生长周期,使最高藻细胞密度显著增加.并且两种环境下,小球藻的最适葡萄糖质量密度均为10 g/L.
模拟微重力环境对小球藻的生长具有明显的促进作用.在相同培养条件下,模拟微重力环境下培养的小球藻较普通环境生长速度更快,藻细胞密度也更高.本研究结果可为小球藻高密度、短耗时的大规模培养提供一定的依据.
[1]CHISTI Y.Biodiesel from microalgae[J].Biotechnology advances,2007,25(3):294-306.
[2]沈丰菊.利用污水大规模培养微藻生产生物柴油技术研究现状[J].农业工程技术(新能源产业),2012(2):19-22.
SHEN F J.Study on cultivation of microalgae on wastewater to produce lipid[J].Agricultural engineering technology,2012(2):19-22.
[3]VOLKMAN J K,JEFFRE S W,NICHOLS P D,et al. Fatty acid and lipid composition of 10 species of microalgaeusedinmariculture[J].Journalof experimental marine biology and ecology,1989,128(3):219-240.
[4]王逸云,王长海.无菌条件下的小球藻培养条件优化[J].烟台大学学报(自然科学与工程版),2006,19(2):125-129.
WANGYY,WANGCH.Culturecondition optimization of Chlorella sp.[J].Journal of Yantai university(natural science and engineering edition),2006,19(2):125-129.
[5]陆贻超,王丽丽,刘双,等.CO2浓度对小球藻生长和生化组成的影响[J].可再生能源,2013,31(7):64-69.
LU Y C,WANG L L,LIU S,et al.Effect of CO2concentration on growth and biochemical component of Chlorella sorokiniana[J].Renewable energy resources,2013,31(7):64-69.
[6]CONVERTI A,CASAZZA A A,ORTIZ E Y,et al. Effect of temperature and nitrogen concentration on the growth and lipid content of nannochloropsis oculata and chlorella vulgaris for biodiesel production[J].Chemical engineering and processing:process intensification,2009,48(6):1146-1151.
[7]胡慧慧.培养条件对小球藻生长和油脂积累的影响[D].宁波:宁波大学,2012.
[8]欧阳峥嵘,温小斌,耿亚红,等.光照强度,温度,pH,盐度对小球藻(Chlorella)光合作用的影响[J].植物科学学报,2010,28(1):49-55.
OUYANG Z R,WEN X B,GENG Y H,et al.The effectsoflightintensities,temperatures,pHand sanilities on photosynthesis of Chlorella[J].Journal of Wuhan botanical research,2010,28(1):49-55.
[9]CRESSWELL R C,REES T A V,SHAH N.Algal and cyanobacterial biotechnology[M].Manhattan:Longman scientific&technical,Wiley,1989.
[10]FUENTES M R,FERNÁNDEZ G A,PÉREZ J S,et al. Biomass nutrient profiles of the microalga Porphyridium cruentum[J].Food chemistry,2000,70(3):345-353.
[11]WEISENSEEL M H,MEYER A J.Bioelectricity,gravity and plants[J].Planta,1997,203(1):S98-S106.
[12]BRAUN M,BUCHEN B,SIEVERS A.Electron microscopic analysis of gravisensing Chara rhizoids developed under microgravity conditions[J].The federation of American societies for experimental biology journal,1999,13(sup901):S113-S120.
[13]HU Z,LIU Y.Cell responses of Dunaliella salinaFACHB435(GreenAlga)tomicrogravitational stimulationbyclinorotation[J].Chinesescience bulletin,1998(20):1737-1742.
[14]陈德辉,章宗涉,陈坚.藻类批量培养中的比增长率最大值[J].水生生物学报,1998(1):26-32.
CHEN D H,ZHANG Z S,CHEN J.Maximum specific growth rate of six algal species determined in batch culture[J].Acta hydrobiologica sinica,1998(1):26-32.
[15]刘香华,刘雷,曾惠卿.不同碳源和光照对小球藻生长及产油脂的影响[J].安全与环境学报,2012,12(3):6-10.
LIU X H,LIU L,ZENG H Q.Effects of different carbon sources and light intensities on the growth and the lipid properties of Chlorella vulgaris[J].Journal of safety and environment,2012,12(3):6-10.
[16]王秀锦,李兆胜,邢冠岚,等.蛋白核小球藻Chlorella pyrenoidosa-15的异养培养条件优化及污水养殖[J].环境科学,2012,33(8):2735-2740.
WANG X J,LI Z S,XING G L,et al.Optimization of Chlorellapyrenoidosa-15photoheterotrophicculture and its use in wastewater treatment[J].Environment science,2012,33(8):2735-2740.
[17]裴静琛,王能达,童伯伦,等.航天因素对螺旋藻生长的影响[J]航天医学与医学工程,1992,5(4):277-280.
PEI J C,WANG N D,TONG B L,et al.Influence of space-flight factors on growth of Spirulina[J].Space medicine and medical engineering,1992,5(4):277-280.
[18]胡章立,刘永定.盐生杜氏藻细胞对回转器模拟微重力刺激的反应[J].科学通报,1998(16):1750-1754.
HU Z L,LIU Y D.Cell responses of Dunaliella salina to microgravitational stimulation by clinorotation[J]. Chinese science bulletin,1998(16):1750-1754.
[19]胡章立,刘永定,涂欢.回转器模拟微重力刺激对不同品系稻田鱼腥藻代谢特性的影响[J].微生物学报,2001,41(4):489-493.
HU Z L,LIU Y D,TU H.Effect of microgravity simulationwithclinostatondifferentstrainsin Anabeanaoryza[J].Actamicrobiologicasinica,2001,41(4):489-493.
本文编辑:张瑞
Culture of Chlorella sp.in Simulated Microgravity and General Conditions
ZHANG Zhiren,WANG Chengcheng,WANG Weiguo,WANG Tielin*,WANG Cunwen
School of Chemical Engineering and Pharmacy,Wuhan Institute of Technology,Wuhan 430074,China
The simulated microgravity condition was produced by the Rotary Cell Culture System to investigate effect of glucose mass density and simulated microgravity on the growth of Chlorella sp..The results show that the simulated microgravity has an obvious promotion effect on the growth of microalgae.The algae cell density under general environment is 5.80×107cells/mL when the initial cell density is 1.42×107cells/mL and culture time is 12 days,meanwhile the algae cell density under simulated microgravity condition can reach 1.58×108cells/mL.Furthermore,the microalgae growth circle is obviously shortened when glucose is added intotheculturemediumascarbonsource.TheoptimalglucosemassdensityfortheChlorellasp.growthis10g/L.When the initial cell density is 5.76×107cells/mL and culture time is 5 days,the maximum densities of microalgae cultured in simulated microgravity and general conditions reach 5.42×108cells/mL and 3.85×108cells/mL,respectively.
simulated microgravity;microalgae;glucose
Q949
A
10.3969/j.issn.1674-2869.2016.06.002
1674-2869(2016)06-0521-06
2016-08-15
湖北省自然科学基金(2015CFB580)
张志忍,硕士研究生.E-mail:690940120@qq.com
*通讯作者:汪铁林,博士,教授.E-mail:witwangtl@hotmail.com

