柱前衍生超高效液相色谱法分析太子参多糖中单糖的组成
郭守斌
(江苏省连云港市第一人民医院药学部,江苏 连云港 222000)
论著
柱前衍生超高效液相色谱法分析太子参多糖中单糖的组成
郭守斌
(江苏省连云港市第一人民医院药学部,江苏 连云港 222000)
目的建立柱前衍生超高效液相色谱(UPLC)法,测定太子参多糖中单糖的组成。方法采用水提醇沉法提取太子参多糖,2 mol/L硫酸水解后加入1-苯基-3-甲基-5-吡唑啉酮进行衍生化,采用UPLC法测定太子参多糖中单糖的衍生物。采用沃特世C18超高效液相色谱柱(100.0 mm×2.1 mm,1.7μm)色谱柱,以乙腈为流动相A,0.1 mol/L磷酸盐(pH 6.8)缓冲液为流动相B,梯度洗脱,检测波长250 nm。通过聚类分析和主成分分析,对不同产地太子参单糖进行质量评价。结果太子参多糖由半乳糖、D-甘露糖、鼠李糖、阿拉伯糖、D-无水葡萄糖、D-葡萄糖醛酸、D-半乳糖醛酸7种单糖组成,不同产地太子参多糖中单糖组成稍有差别,通过主成分分析和聚类分析评价,10个不同产地太子参单糖聚成3类,并按照单糖含量对各产地进行排名。结论柱前衍生UPLC法表明,太子参多糖主要由半乳糖醛酸、半乳糖和阿拉伯糖构成,并且贵州施秉县地区产太子参单糖含量较高。
太子参多糖;柱前衍生化;超高效液相色谱;聚类分析;主成分分析;单糖
Keywords:P.heterophylla polysaccharide;pre-column derivation;ultra performance liquid chromatography;cluster analysis;principal component analysis;monosaccharide
太子参为石竹科植物孩儿参的干燥块根。性味甘、微苦,平,归脾、肺经。临床主要用于益气健脾、生津润肺,用于脾虚体倦、食欲不振、病后虚弱、气阴不足、自汗口渴、肺燥干咳等症候[1]。药理学研究表明,太子参多糖具有增强机体免疫功能、降糖降脂及保护肝脏等作用,是太子参的主要有效成分之一[2-3]。太子参多糖为中性葡聚糖,有关太子参多糖含量测定的研究很多,主要采用体积排阻高效液相色谱法[4]、高效液相色谱-蒸发光散射法[5]及硫酸-苯酚比色法[6-7],其单糖组成迄今未见报道,而多糖的单糖组成分析是进行多糖质量控制和获取多糖基本信息的重要环节。因此,本实验以1-苯基-3-甲基-5-吡唑啉酮(3-Methyl-1-phenyl-2-pyrazolin-5-one,PMP)为衍生物,在碱性条件下与单糖缩合生成单糖-PMP衍生物,应用超高效液相色谱(ultra performance liquid chromatography,UPLC)法,对太子参多糖进行单糖组成方面的研究,并利用主成分分析和聚类分析对单糖进行评价,为太子参开发利用和质量控制提供可靠依据。
1 资料与方法
1.1 仪器与试药
Waters ACQUITY UPLC H-CLASS超高效液相色谱仪、Empower色谱工作站购自美国沃特世公司,DFY-300型摇摆式高速万能粉碎机(江苏省江阴市康和药化机械制造有限公司),TG16-WS离心机(湖南湘仪实验室仪器开发有限公司),ABS-135S电子天平(上海梅特勒-托利多仪器有限公司),KB-500 DB超声波清洗器(浙江省昆山市超声仪器有限公司),LGJ-10冷冻干燥机(北京市松源华兴生物技术有限公司)。
经作者鉴定为石竹科植物孩儿参的干燥块根。D-无水葡萄糖(D-glucose anhydrous,Glu)(中国药品生物制品检定所,110833-201205,含量为99.5%),D-甘露糖(D-mannose,Man)(中国药品生物制品检定所,140651-201403,含量为99.6%),D-葡萄糖醛酸(D-glucuronic acid,GluUA)(中国药品生物制品检定所,140648-200602),半乳糖(Galactose,Gal)(中国药品生物制品检定所,100226-201105,含量为99.9%),L-阿拉伯糖(L-Arabinose,Arab)(中国药品生物制品检定所,1506-200001),D-半乳糖醛酸(α-D-galacturonic acid monohydrate,GalUA)(中国药品生物制品检定所,111646-200301),鼠李糖(L-rhamnose monohydrate,Rha)(中国药品生物制品检定所,111683-201502)。乙腈为色谱纯,PMP为分析纯,水为实验室自制去离子水,其他试剂均为分析纯。见表1。
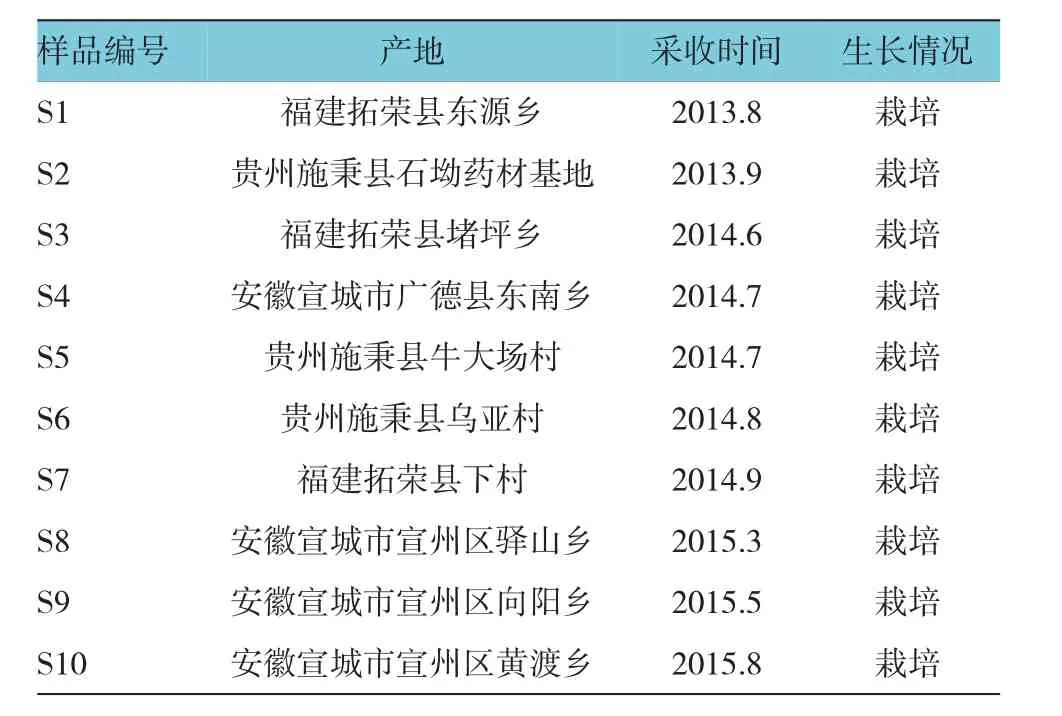
表1 太子参样品来源
1.2 实验方法
1.2.1 色谱条件沃特世C18超高效液相色谱柱(100.0mm×2.1mm,1.7μm);流动相:乙腈-0.05mol/L磷酸盐缓冲液(pH 6.8),梯度洗脱(0~5 min,10%A;5~15 min,10%~15%A;15~25 min,15%~20%A);检测波长250 nm;柱温30℃;流速0.25 ml/min;进样量2μl。
1.2.2 太子参多糖的提取取太子参(S1-S10)干燥粉末(过四号筛)各约6 g,精密称定,加85%乙醇60 ml回流提取3次,3 h/次,提取液弃去,太子参药渣加50 ml水,水浴回流提取3次,3 h/次,收集提取液,减压浓缩至约25 ml,用Sevage法除去太子参多糖提取液中蛋白成分后,加乙醇80 ml,静置过夜,取提取液3 000 r/min离心10 min,弃上清液,反复离心至上清液无色,沉淀物依次加无水乙醇-乙醚-丙酮洗涤3次,冷冻干燥,得太子参多糖。
1.2.3 溶液的制备①供试品溶液。精密称取太子参多糖约20mg置安瓿中,加2mol/L硫酸溶液2.0ml,用氮气排走空气,封口,置水域中水解8 h,冷却至室温,用4 mol/L NaOH溶液调节pH至7.0,用0.45μm微孔滤膜滤过,备用。②混合对照品溶液。分别取Glu、Man、GluUA、Gal、Arab、GalUA、Rha对照品各适量,精密称定,置10 ml量瓶中,加水溶解并稀释至刻度,摇匀,配制成每1 ml分别含Glu1 642μmol/L、Man 1023μmol/L、GluUA682μmol/L、GalUA1568μmol/L、半乳糖1 260μmol/L、Arab 1 888μmol/L、Rha 985 μmol/L的混合对照品溶液,备用。
1.2.4 衍生化产物的制备精密量取混合对照品溶液和太子参多糖水解液各200μl置10 ml离心管中,分别依次加入200μl PMP甲醇溶液和0.3 mol/L NaOH溶液,混合均匀,置70℃水域中反应30 min,冷却至室温,分别加入200μl 0.3 mol/L盐酸溶液中和,充分混匀,加入1 ml氯仿进行萃取,充分震荡混匀,4 000 r/min离心10 min,弃去下层有机相,重复萃取3次,合并上层水相,0.45μm微孔滤膜滤过,备用[8]。
1.2.5 方法学考察①线性关系和最小检测限。分别精密吸取混合对照品溶液0.2、0.5、1.0、2.0、4.0和10.0 ml,置10 ml容量瓶中,加水稀释至刻度,充分摇匀,按1.2.4方法衍生化制备,配制系列浓度对照品混合溶液。按1.2.1色谱条件试验,记录色谱图,以对照品摩尔浓度(X)为横坐标,以色谱峰峰面积(Y)为纵坐标绘制标准曲线。再将最低浓度混合对照溶液稀释至信噪比为3时所对应溶液的摩尔浓度以确定为最低检测限(见表2)。②精密度试验。取混合对照品溶液,按1.2.4方法进行衍生,依照1.2.1色谱条件,连续进样6次,记录色谱图。结果Glu、Man、Glu UA、Gal、Arab、GalUA、Rha峰面积的相对标准偏差(relative standard deviation,RSD)分别为0.6%、0.4%、0.8%、0.7%、0.6%、0.4%和0.9%,表明仪器精密度良好。③重复性试验。取太子参(S1)多糖6份,按1.2.3方法制备样品溶液,再按1.2.4方法进行衍生化处理,依照1.2.1色谱条件,依次测定,记录峰面积。结果Glu、Man、GluUA、Gal、Arab、GalUA、Rha峰面积的RSD分别为0.5%、0.7%、0.3%、0.3%、0.2%、0.7%和0.6%,表明方法重复性良好。④稳定性试验。取太子参(S1)多糖,按1.2.3方法水解成单糖,再按1.2.4方法进行衍生化处理,分别于0、2、4、6、8和12 h测定,记录峰面积。结果Glu、Man、GluUA、Gal、Arab、Gal UA、Rha峰面积的RSD分别为1.2%、1.3%、1.3%、1.6%、0.8%、1.1%和1.6%,表明太子参中单糖衍生物在12 h内稳定。⑤加样回收率试验。取已知含量太子参(S1)多糖(约10 mg)6份,精密称定,置具塞试管中,分别精密加入相当样品含有量的Glu、Man、GluUA、Gal、Arab、GalUA、Rha对照品,按1.2.3方法水解成单糖,再按1.2.4方法进行衍生化处理,依1.2.1色谱条件测定,记录色谱图。结果Glu、Man、GluUA、Gal、Arab、GalUA、Rha平均回收率分别为98.6%(RSD 1.0%)、98.9%(RSD 0.9%)、98.8%(RSD 1.2%)、99.1%(RSD 1.2%)、98.4%(RSD 1.0%)、97.8%(RSD 0.9%)和98.8%(RSD 0.6%)。
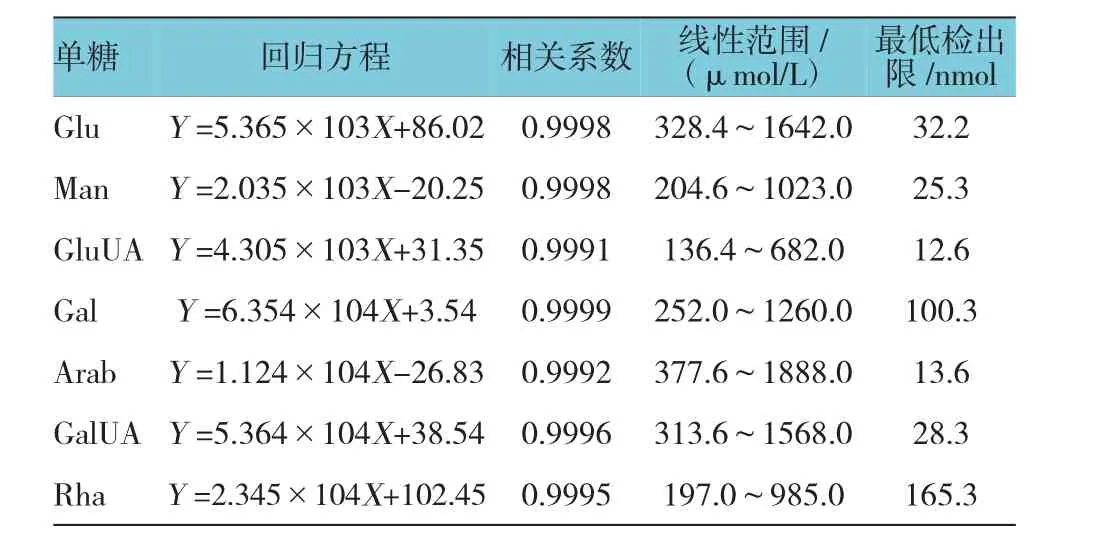
表27 种单糖衍生物的线性关系
1.2.6 样品测定取不同产地太子参(S1-S10)多糖,按1.2.3方法水解成单糖,再按1.2.4方法进行衍生化处理,依1.2.1色谱条件测定,记录色谱图。采用外表一点法求得各单糖含量,并计算太子参多糖中Glu、Man、GluUA、Gal、Arab、GalUA、Rha的摩尔比。见图1和表3。
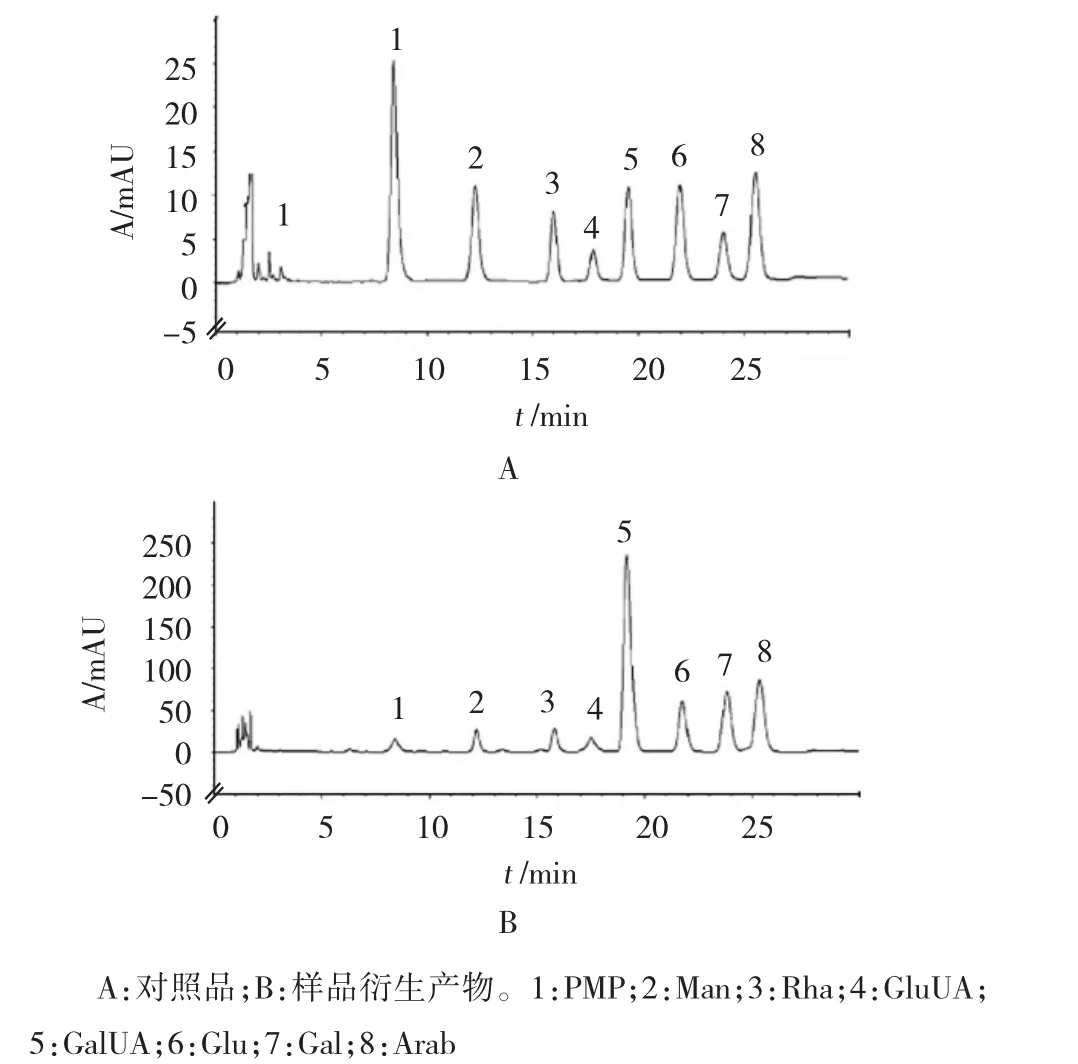
图1 对照品与样品衍生产物色谱图
1.3统计学方法
采用SPSS 22.0统计软件进行数据分析,通过聚类分析和主成分分析对10个产地太子参多糖中单糖进行评价,P<0.05为差异有统计学意义。
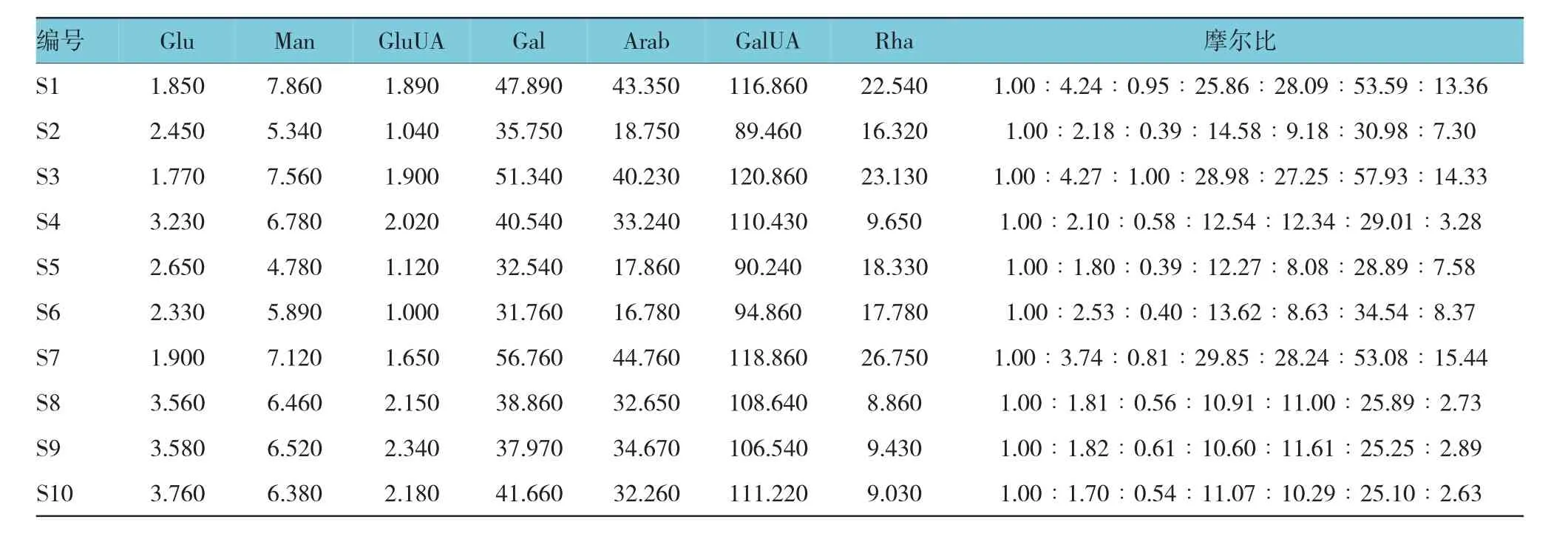
表3 太子参样品单糖组成及含量
2 结果
2.1 主成分分析
将表2数据导入SPSS 22.0统计软件,以各产地单糖作为变量,利用主成分分析,将7个单糖进行降维,提取出2个主成分,分析个主成分主要贡献单糖种类,并依据主成分得分对各产地太子进行排名。分析得出的主成分特征值与贡献率。见图2和表4。
特征值在某种程度上可以被看成是表示主成分影响力度大小的指标,通过表3(方差分解主成分提取分析)和图2可以看出,主成分3之前连线较为陡峭,即前3个主成分对解释变量的贡献最大,又有前2个成分累计贡献值达95.906%,所以提取2个主成分。从表4可知Man、Gal、Arab、GalUA在第一主成分上有较高载荷(相关系数>0.9),说明第一主成分基本反映这些指标的信息;而Glu在第二主成分上有较高载荷。提取2个主成分基本囊括7个单糖成分,基本能反映全部指标的信息,所以决定用2个新变量来代替原来的7个变量开展评价。

图2 主成分分析碎石图
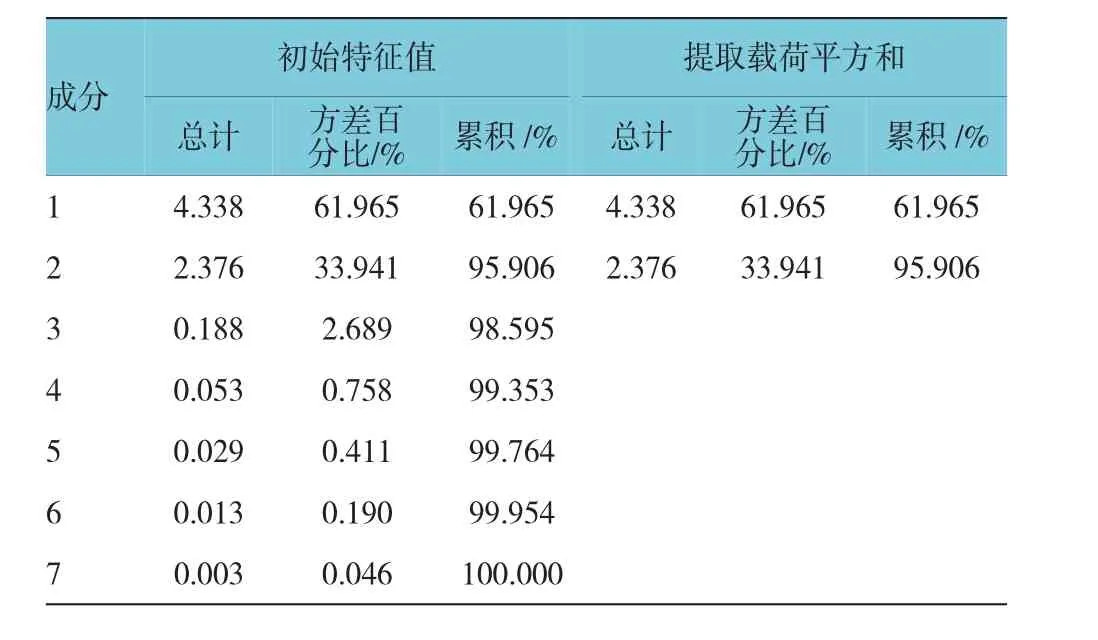
表4 主成分分析的特征值与方差贡献率
用每个产地分别对应于2个主成分的初始因子载荷值除以主成分相对应的特征值(λ1=4.338,λ2= 2.376)开平方根即可得到每个指标分别对应的2个主成分的特征向量(特征向量代表各原指标对于主成分的重要程度),将得到的特征向量与标准化后的数据相乘,然后就可以推导出2个主成分表达式,并可算出主成分综合模型,利用2个主成分的表达式和主成分综合模式可计算出太子参个各产地分值,并按分值大小进行排名。见表5。
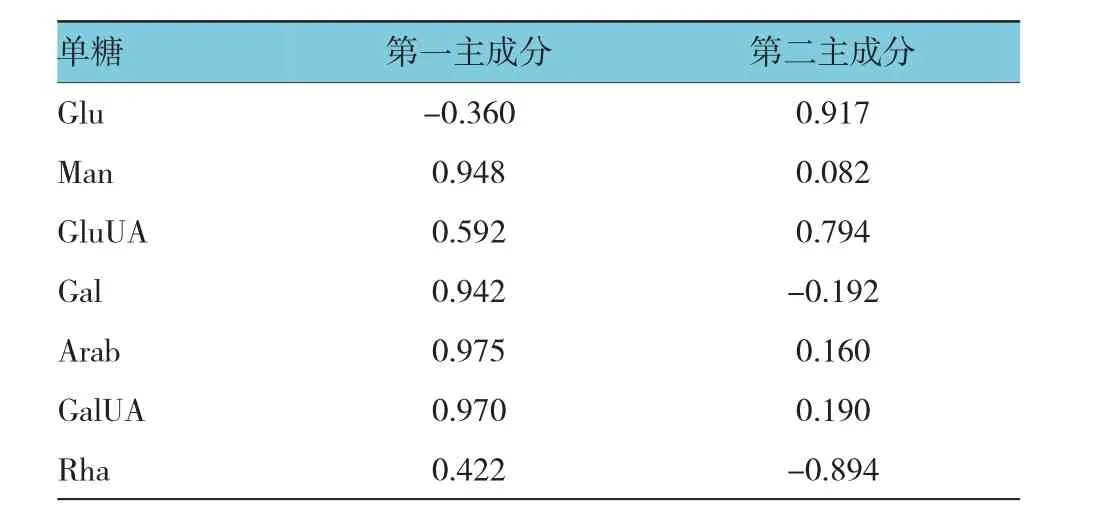
表5 初始因子载荷矩阵
第一、二主成分对7个变量的解释有>95%的贡献值,而Man、Gal、Arab、GalUA、Glu在第二个主成分上有较高载荷,所以用以上5个单糖指标可以对太子参多糖进行评价,可以看出以产地为福建拓荣县的太子参较好。见表6。
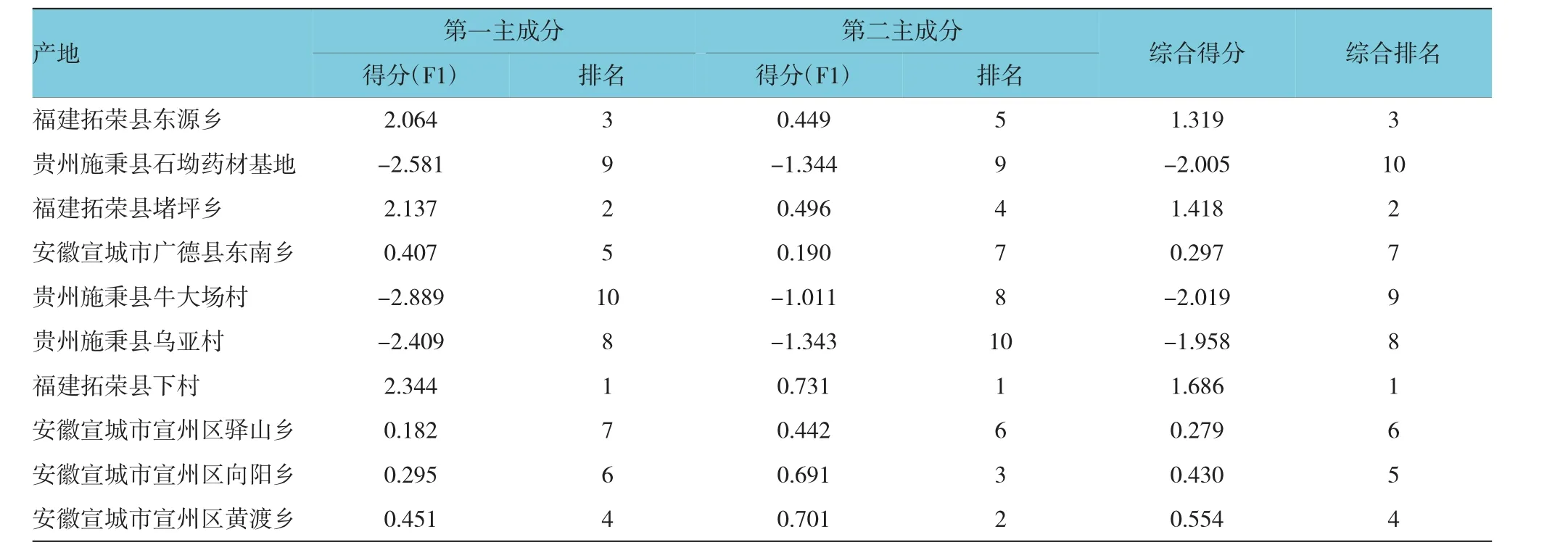
表6 不同产地太子参单糖得分及排名
2.2 聚类分析
将表2数据导入SPSS 22.0统计软件,以各产地单糖作为变量,采用组间连接法,选用欧氏距离对10个不同产地太子参单糖进行聚类分析,可看出其中来自Y福建拓荣县太子参聚为一类,其他另外2个产地分别聚为一类,说明同一地区不同地点太子参,单糖组成及含量有着一定相似度。见图3。
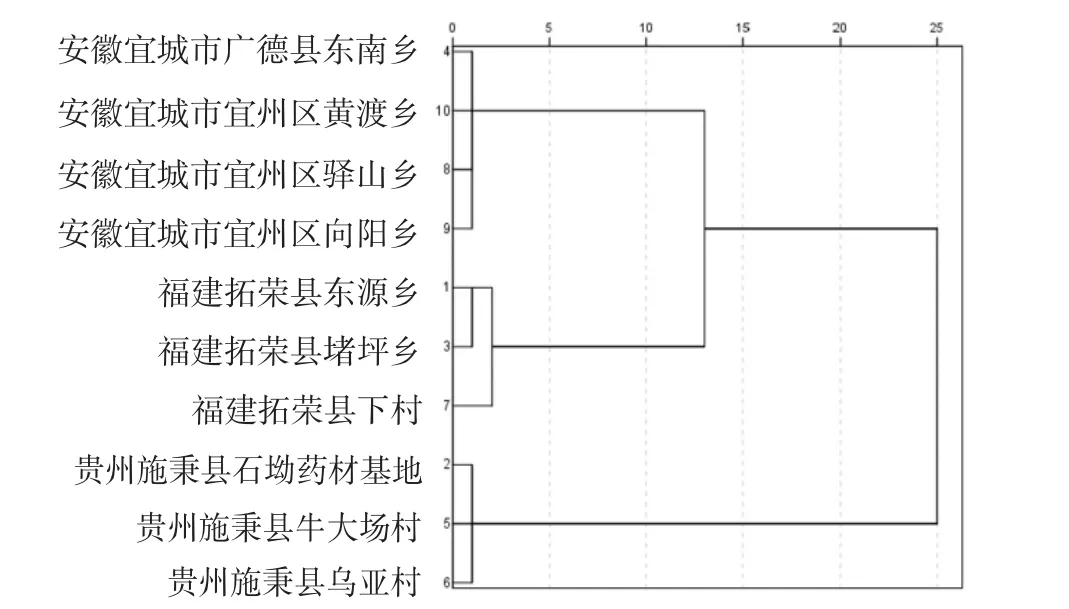
图3 太子参单糖聚类分析图
3 讨论
太子参是一种常用又珍贵药材,有补气健脾、养阴益血等功效,可作为人参替代品,老少皆宜服用。多糖是其有效成分之一,有调节和促进机体免疫力等作用。而UPLC法具有分离效率高、节能、省时等优点,在中药质量分析中运用逐渐广泛。通常多糖水解样品的制备过程需经过复杂干燥过程,干燥衍生化后氯仿萃取后的水层溶液,挥弃PMP残留衍生化试剂,以达到纯化单糖衍生物的目的。但在本实验色谱条件下,PMP溶剂峰出峰时间明显早于各单糖衍生物保留时间,所以制备过程中可以省去干燥过程,用NaOH中和水解液后,直接PMP衍生化处理,几乎无糖损失,缩短样品制备时间,简化实验操作。
本研究建立衍生化-UPLC检测太子参多糖中单糖组成的方法,通过与标准单糖衍生物的比对,对7个色谱峰进行指认,可提供太子参多糖的单糖组成基本信息。本方法简单灵敏,操作方便快速,为发展太子参多糖的在线定性定量UPLC检测奠定基础,为进一步开发利用太子参产品提供科学依据。
[1]国家药典委员会编.中华人民共和国药典(一部)(2015年版)[M].北京:化学工业出版社,2015:68.
[2]刘训红,陈彬,王玉玺.太子参多糖抗应激和免疫增强作用的实验研究[J].江苏中医,2000,21(10):51-53.
[3]刘晓满.人参多糖降糖机制的初探[D].长春:东北师范大学,2009.
[4]陈芸芸,王伟,丁怡,等.SE-HPLC测定太子神悦胶囊中多糖相对分子质量分布及含量[J].中国药学杂志,2005,40(7):540-542.
[5]宋建平,曾艳萍,刘训红,等.HPLC-ELSD测定不同产地太子参中多糖的含量[J].上海中医药杂志,2008,42(10):77-79.
[6]刘训红,谈献和,曾艳萍,等.不同产地太子参的质量比较研究[J].现代中药研究与实践,2007,21(2):36-38.
[7]罗国海,盛柳青,张秋霞,等.太子参药材主根与参尾的多糖含量比较[J].中药研究与开发,2006,13(11):50-51.
[8]范刚,唐策,李艳,等.柱前衍生HPLC分析黄连多糖的单糖组成[J].中国实验方剂学杂志,2014,20(11):74-78.
(童颖丹 编辑)
Analysis of monosaccharide composition ofPseudostellaria heterophyllapolysaccharides by pre-column derivatization ultra performance liquid chromatography
Shou-bin Guo
(Department of Pharmacy,the First People's Hospital of Lianyungang, Lianyungang,Jiangsu 222000,China)
Objective To establish a pre-column derivation ultra performance liquid chromatography(UPLC)for determining monosaccharide composition inPseudostellaria heterophyllapolysaccharides.Methods The polysaccharides were extracted by hot distilled water,precipitated by alcohol,and hydrolyzed with 2 mol/L sulfuric acid and derived by 1-phenyl-3-methyl-5-pyrazolone(PMP).The analysis of monosaccharide composition ofP.heterophyllapolysaccharides was carried out by reversed-phase UPLC on a Waters ACQUITY UPLC BEH HILIC C18 column(100.0 mm×2.1 mm,1.7 μm)with a mobile phase composed of 0.1 mol/L phosphate (pH 6.8)and Acetonitrile in a gradient elution manner.The detection wavelength was set at 250 nm.Cluster analysis(CA)and principal component analysis(PCA)were used to evaluateP.heterophyllamonosaccharide in different producing areas.Results TheP.heterophyllapolysaccharides were composed of galactose,D-mannose,rhamnose,arabinose,D-glucose,D-glucuronic acid and D-galacturonic acid.Totally 10 batches ofP. heterophyllapolysaccharides could be classified into three clusters,and the producing areas were sorted based on the content of monosaccharides.Conclusions The UPLC with pre-column derivation shows thatP.heterophyllapolysaccharides mainly consist of galacturonic acid,galactose and arabinose.P.heterophyllaof Shibing County has higher content of monosaccharides.
R284.1
A
10.3969/j.issn.1005-8982.2016.23.008
1005-8982(2016)23-0037-05
2016-07-14

