缺氧对前列腺癌细胞糖酵解及迁移侵袭能力的影响
王享利
(中南大学湘雅医院卫生部纳米生物技术重点实验室,湖南 长沙 410008)
论著
缺氧对前列腺癌细胞糖酵解及迁移侵袭能力的影响
王享利
(中南大学湘雅医院卫生部纳米生物技术重点实验室,湖南 长沙 410008)
目的探讨缺氧状态下前列腺癌细胞糖酵解和体外迁移侵袭能力的改变。方法将前列腺癌细胞DU145和/或PC-3分别置于常氧及缺氧环境中培养24和48 h,侵袭小室实验检测前列腺癌细胞体外迁移及侵袭能力改变。分别检测上清液中葡萄糖含量、乳酸含量;实时定量逆转录-聚合酶链反应(qRT-PCR)检测糖酵解相关基因的表达改变。结果前列腺癌细胞DU145经缺氧处理后,体外迁移及侵袭能力较常氧处理增强。同时缺氧处理后,DU145和PC-3细胞培养上清液中葡萄糖含量减少,肿瘤细胞摄入葡萄糖能力提高,糖酵解代谢产物乳酸在上清液中增加。qRT-PCR结果表明,缺氧处理后DU145细胞糖酵解相关基因。结论缺氧处理能增强前列腺癌细胞的体外迁移及侵袭能力,同时通过改变糖酵解相关基因的表达,对前列腺癌细胞的糖酵解过程发挥调控作用。
前列腺癌;缺氧;糖酵解;迁移;侵袭
缺氧是大部分实体肿瘤微环境改变的主要特征。肿瘤缺氧微环境能够促进肿瘤细胞的恶性进展,包括引起转移、耐药及放疗抵抗等[1-2]。缺氧是肿瘤细胞恶性进展及有利于肿瘤细胞生存的微环境重建的关键因素。现有研究表明,肿瘤细胞自身存在着对缺血、缺氧的自身调节和适应机制,其主要是通过诱导肿瘤新生血管和能量代谢转换来适应新的环境,产生生存优势[3-4]。其中肿瘤细胞能量代谢转换,主要指肿瘤细胞通过提高葡萄糖转运利用能力,发生无氧状态下的糖酵解,以供肿瘤细胞生存恶性进展所需能量和生物大分子合成所需的原料[5-6]。本研究旨在探讨缺氧处理对前列腺癌细胞侵袭转移能力的影响,以及糖酵解过程的变化情况。
1 材料与方法
1.1 前列腺癌细胞培养
本研究所选用的前列腺癌细胞株有DU145和PC-3细胞。两种细胞均购自中南大学细胞生物中心,培养所用培养基为改良伊格尔培养基/F12(1∶1),外加浓度10%的优质胎牛血清和1%的双抗(100 u/ml青霉素和100 u/ml链霉素)。上述细胞常规处理均在37℃、5%二氧化碳CO2、21%氧气O2、74%氮气N2饱和湿度环境下进行培养。实验所选用细胞均为对数生长期、无污染细胞。
1.2 缺氧处理
将前列腺癌细胞DU145和PC-3放置于37℃、5%CO2,1%O2、94%N2饱和湿度环境下进行培养,细胞培养时间根据实验目的而定。实验所选用细胞均为对数生长期、无污染细胞。
1.3 前列腺癌细胞缺氧及常氧处理后细胞迁移和侵袭能力检测
细胞迁移和侵袭实验迁移实验所用的Transwell小室内无需铺基质胶,置于24孔板中。侵袭实验基质胶用无血清培养基1∶8稀释,50 ml/小室均匀铺于小室底部,于37℃放置2 h后置于24孔板中。将5×105个细胞(200 ml)接种于上室,下室加入500 ml完全培养基,处理组加入不同药物。培养48 h后计数下室和上室细胞数,计算迁移率和侵袭率[下室细胞数/(上室细胞数+下室细胞数)×100%]。
1.4 前列腺癌细胞缺氧及常氧处理后上清液葡萄糖和乳酸含量检测
前列腺癌细胞经常氧和缺氧处理24和48 h后,收集细胞培养上清液,用葡萄糖氧化酶-过氧化物酶法检测上清液中葡萄糖含量。采用比色法检测上清液乳酸含量,试剂盒购自南京建成生物公司。
1.5 实时定量逆转录-聚合酶链反应
采用microRNA(miRNA)提取试剂盒分别提取各组细胞总RNA,严格按说明书进行操作。用生化分析仪2100 Bioanalyzer定量,琼脂糖凝胶电泳鉴定总RNA的完整性。总RNA反转录后的第一链互补脱氧核糖核酸为模板进行聚合酶链反应扩增;反应条件为95℃预变性20 s,95℃变性10 s,60℃退火20 s,70℃延伸10 s,共40个循环,以U6小核核糖核酸(small nuclear ribonucleic acid,snRNA)作为内参,绘制扩增融解图,将样本miRNA与U6 snRNA基因含量的差值作为评价miRNAs相对表达水平的指标,据公式ΔCt=[Ct(miRNA)]-[ct(U6snRNA)],取ΔCt的均数±标准差(±s)为检测结果。
1.6统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用t检验或随机区组设计的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 缺氧增强前列腺癌DU145细胞的体外迁移及侵袭能力
缺氧处理48 h后Transwell侵袭小室实验结果显示,前列腺癌DU145细胞的迁移和侵袭能力较常氧处理组细胞提高(P<0.05),表明前列腺癌DU145细胞在缺氧处理后,体外迁移及侵袭能力均较常氧情况下提高。见图1。
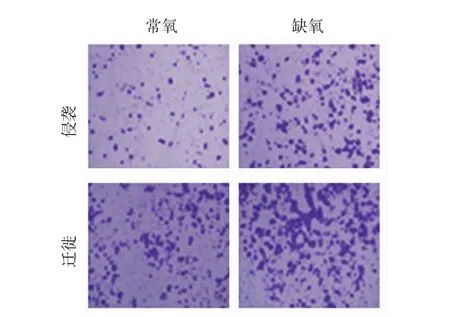
图1 常氧和缺氧条件下DU145迁移和侵袭能力比较
2.2 缺氧降低前列腺癌细胞上清液中葡萄糖,增加乳酸含量
前列腺癌细胞DU145和PC-3细胞分别经过24和48 h常氧及缺氧处理,并于不同处理时间收取两种细胞的培养液,离心去沉渣后,检测上清液中残留的葡萄糖和乳酸含量。结果表明,前列腺癌细胞DU145及PC-3经缺氧处理后,与常氧处理细胞细胞相比,两种细胞上清液中的葡萄糖含量下降,而乳酸含量升高。该结果初步提示缺氧处理后,前列腺癌细胞利用葡萄糖的能力可能明显增加,才导致上清液中葡萄糖含量的显著减少,并导致产生更多的代谢产物乳酸。见表1、2。
表1 缺氧处理后前列腺癌细胞利用葡萄糖的变化(μg/ml±s)
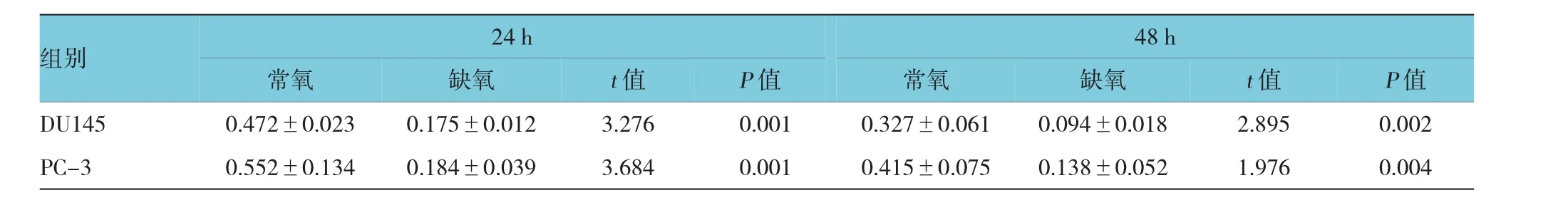
表1 缺氧处理后前列腺癌细胞利用葡萄糖的变化(μg/ml±s)
组别24 h 48 h常氧缺氧t值常氧缺氧t值P值DU1450.472±0.0230.175±0.0123.2760.0010.327±0.0610.094±0.0182.8950.002 PC-30.552±0.1340.184±0.0393.6840.0010.415±0.0750.138±0.0521.9760.004 P值
表2 缺氧处理后前列腺癌细胞利用乳糖的变化(μg/ml±s)
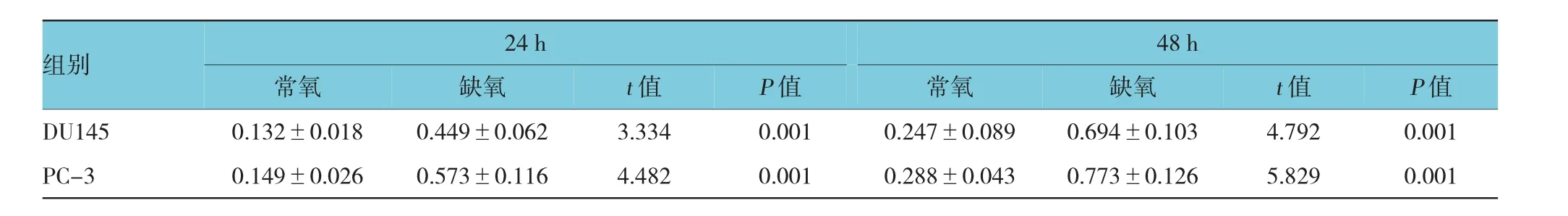
表2 缺氧处理后前列腺癌细胞利用乳糖的变化(μg/ml±s)
组别24 h 48 h常氧缺氧t值常氧缺氧t值P值DU1450.132±0.0180.449±0.0623.3340.0010.247±0.0890.694±0.1034.7920.001 PC-30.149±0.0260.573±0.1164.4820.0010.288±0.0430.773±0.1265.8290.001 P值
2.3 缺氧调控前列腺癌细胞糖酵解相关基因的表达
结果表明,前列腺癌细胞在缺氧情况下,糖酵解能力显著提高。因此,笔者进一步检测糖酵解过程相关基因的表达。对所有基因qRT-PCR检测的结果进行随机区组设计方差分析发现,各基因组改变幅度不同(F=13.752,P=0.001),前列腺癌DU145细胞缺氧处理6、24和48 h,葡萄糖转运蛋白1改变幅度最大,且在缺氧处理6 h就出现明显变化(见图2)。而随着时间的延长,胃蛋白酶原、磷酸甘油酸激酶、6-磷酸果糖激酶2和单羧酸转运蛋白-1(monocarboxylate transporter-1,MCT1)亦出现显著升高。表明缺氧处理,通过改变缺氧相关代谢酶的表达水平,进而引起肿瘤细胞无氧糖酵解水平的提高。
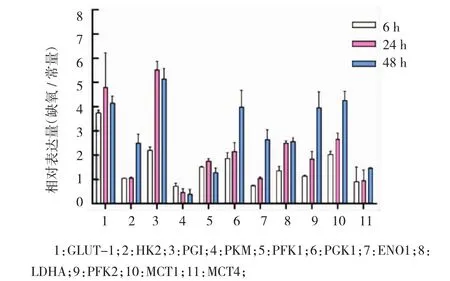
图2 前列腺癌DU145细胞经缺氧处理后糖酵解代谢相关基因的表达(±s)
3 讨论
糖代谢是细胞的主要能量来源。葡萄糖在体内经糖酵解和氧化磷酸化两条主要途径氧化分解。糖酵解过程首先通过胞膜上的葡萄糖转运体将葡萄糖转运入胞内,通过糖酵解途径生成丙酮酸,这一过程称为糖酵解。丙酮酸在缺氧条件下转化成乳酸,而在有氧条件下经三羧酸循环和线粒体氧化磷酸化代谢途径产生能量。细胞活性与自身能量代谢状态紧密相关。恶性肿瘤细胞生长迅速,常伴有摄入胞内的葡萄糖量增高、糖酵解活性提高和乳酸堆积等能量代谢转变的现象。除此以外,肿瘤细胞糖代谢另外一个重要特点,即使在常氧及有氧状况下,肿瘤细胞均可以利用糖酵解过程为自身所用。在供氧充足的情况,葡萄糖依旧向乳酸转换,肿瘤细胞的该种糖代谢方式称为有氧酵解或Warburg效应。相对而言,在缺氧状态下,发生的糖酵解过程,则称为无氧糖酵解[7]。
在缺氧状态下及线粒体功能紊乱情况下,肿瘤细胞出现糖酵解的能量转换容易理解,且该种能量转换方式对肿瘤细胞的生存很重要。然而在有氧状态下,肿瘤细胞同样可以出现糖酵解。肿瘤细胞自身常伴随着线粒体损伤及线粒体氧化磷酸化缺陷。线粒体DNA突变能影响与其氧化磷酸化相关酶的功能及活性,包括与三羧酸循环相关的酶,如琥珀酸脱氢酶,延胡索酸脱氢酶及异柠檬酸脱氢酶[8]。另外,肿瘤细胞糖酵解、三羧酸循环及氧化磷酸化途径相关酶基因的突变,可造成肿瘤细胞能量代谢重组。例如,琥珀酸脱氢酶基因的突变,其会导致肿瘤细胞琥珀酸的积聚,进而抑制脯氨酰羟化酶的活性,稳定低氧诱导因子-1,这被称为伪组织缺氧。由此可见,肿瘤细胞线粒体功能缺陷可导致其能量代谢的转变,在促肿瘤恶性进展过程中具有重要作用。但值得一提的是,线粒体DNA基因突变是把双刃剑,发生线粒体DNA基因突变及功能紊乱的肿瘤细胞,其体外克隆形成能力及体内成瘤能力明显减弱,从该方面发挥抑瘤作用。
较多研究表明,糖酵解过程在恶性肿瘤细胞的多种恶性生物学行为进展中发挥重要作用:①糖酵解增强肿瘤细胞的放疗抵抗能力。MEIJER等[9]研究证实缺氧情况下的糖酵解能增强肿瘤细胞的抗氧化杀伤能力,因此多层面同时靶向抑制关键缺氧应答因子低氧诱导因子-1α及肿瘤的糖酵解过程,能降低肿瘤细胞的抗氧化能力,影响肿瘤微环境,提高肿瘤细胞的放疗敏感性。MENG等[10]亦在体内外研究中阐明,抑制丙酮酸激酶M2能提高非小细胞肺癌的放疗敏感性。②糖酵解能使肿瘤细胞对紫杉醇、5氟尿嘧啶、顺铂等多种化疗药物产生耐药性[11]。③最新研究证实,肿瘤细胞与其微环境中的肿瘤浸润免疫细胞竞争微环境中的葡萄糖。而肿瘤细胞增强的糖酵解能力,使其在竞争中具有明显优势,因而造成包括T细胞在内的免疫细胞发生功能缺陷,处于免疫抑制状态,进而促进肿瘤进展[12-13]。④至于糖酵解在肿瘤侵袭转移中的近年来报道较多,均表明糖酵解过程在肿瘤侵袭转移过程中发挥积极作用。笔者在本研究中发现,前列腺癌细胞在缺氧处理后,出现迁移及侵袭能力的相应提高,该过程中伴随着前列腺癌细胞糖酵解过程的提高。提示缺氧可促进前列腺癌细胞的侵袭转移,与ZOU等[14]在喉癌中的报道一致。现有研究多表明,缺氧可引起相关癌基因的表达,从而参与到肿瘤的侵袭转移[15]。
本研究发现,缺氧处理情况下,前列腺癌细胞对葡萄糖的摄入和对乳酸的排出水平均提高。乳酸作为糖酵解过程的主要产物,是一种抗氧化剂,在肿瘤恶性进展中亦发挥重要作用:①能保护肿瘤细胞免受内源性活性氧物质及细胞毒性药物治疗的损。②乳酸能稳定转录因子低氧诱导因子-1α,而低氧诱导因子-1α由缺氧及促肿瘤信号途径诱导产生并稳定,其活化同时能增加其他糖酵解基因的表达。③肿瘤组织内乳酸的增加能促进肿瘤血管新生并促进转移的发生。④乳酸能损伤抗肿瘤免疫反应,主要通过增加髓源性抑制细胞和减少NK细胞的细胞毒作用。⑤乳酸可被耗氧肿瘤细胞利用,提供能量。CURRY等[16]在口腔癌中的研究发现,富含线粒体增殖能力旺盛的肿瘤细胞高表达MCT1,MCT1则调控肿瘤细胞对乳酸的摄入能力。同时上述肿瘤细胞周围存在线粒体不足增殖能力弱的肿瘤细胞,则高表达MCT4,MCT4则主要是被动地从糖酵解肿瘤细胞中转运出乳酸。因此,笔者提出Metabolic compartmentalization模型,认为肿瘤组织中增殖能力弱,发生糖酵解的肿瘤细胞能释放乳酸,以供增殖能力旺盛富含线粒体的肿瘤细胞利用,促进肿瘤的生长和转移。然而,有关该模型尚存在争议。
与产生三磷酸腺甘(adenosine triphosphate,ATP)多的线粒体氧化磷酸化能量代谢方式比较,肿瘤细胞为何选用产能少的糖酵解代谢途径?现有研究给笔者提出以下解释:①糖酵解虽单次产生的ATP相对线粒体氧化磷酸化能量代谢方式产能少。然而肿瘤细胞糖酵解将葡萄糖转化为乳酸的循环速度快,产生的总体ATP高。糖酵解能量代谢的ATP生成速度比线粒体氧化磷酸化能量代谢方式快>100倍。②除给肿瘤细胞提供足够的ATP外,糖酵解途径给肿瘤细胞提供细胞生物合成所需的必要代谢中间产物和前体。糖酵解代谢产物促进磷酸戊糖途径,生成还原型辅酶Ⅱ(triphosphopyridine nucleotide,NADPH)和核糖-5-磷酸,这两种物质均是脂肪及核酸合成所必需的。③有氧糖酵解促使肿瘤细胞产生化疗耐药和放疗抵抗。NADPH能给肿瘤细胞提供足够的抗氧化剂还原型谷胱甘肽,从而保护肿瘤细胞免受化疗药物杀伤作用。④除影响糖酵解外,糖酵解过程相关酶及代谢中间产物可发挥癌基因作用,参与肿瘤进展。1,6-果糖二磷酸能保持细胞色素C的还原非活化状态,在肿瘤细胞中发挥抗凋亡作用。同样,丙酮酸促进耐药基因p-糖蛋白表达,诱导肿瘤细胞耐药的发生。单羧酸转运蛋白除介导乳酸进出入细胞外,还可诱导CD147的表达,促进肿瘤细胞的侵袭转移。乳酸脱氢酶沉默能下调转录因子人附睾蛋白4抑制胃癌的成瘤。
综上所述,前列腺癌细胞在缺氧情况下,出现糖酵解相关基因的表达改变及糖酵解程度增强,同时体外侵袭转移能力提高。前列腺癌细胞糖酵解及侵袭转移之间的内在关联有待于进一步研究。
[1]秦承东,任正刚,汤钊猷.缺氧微环境在肿瘤进展中的作用[J].肿瘤,2016,18(1):96-102.
[2]毛竹君,张慈安,赵胜佳,等.肿瘤缺氧微环境与黏附分子相关性的研究进展[J].中国肿瘤生物治疗杂志,2011,18(4):452-455.
[3]HU G,WEI Y,KANG Y.The multifaceted role of MTDH/AEG-1 in cancer progression[J].Clin Cancer Res,2009,15(18):5615-5620.
[4]MASOUD G N,LI W.HIF-1α pathway:role,regulation and intervention for cancer therapy[J].Acta Pharm Sin B,2015,5(5): 378-389.
[5]ACKERSTAFF E,ARTEMOV D,GILLIES R J,et al.Hypoxia andthepresenceofhumanvascularendothelialcellsaffect prostate cancer cell invasion and metabolism[J].Neoplasia,2007, 9(12):1138-1151.
[6]HUANGD,LIC,ZHANGH.Hypoxiaandcancercell metabolism[J].Acta Biochim Biophys Sin(Shanghai),2014,46(3): 214-219.
[7]HU G,CHONG R A,YANG Q,et al.MTDH activation by 8q22 genomic gain promotes chemoresistance and metastasis of poor-prognosis breast cancer[J].Cancer Cell,2009,15(2):9-20.
[8]EMDAD L,DAS S K,DASGUPTA S,et al.AEG-1/MTDH/LYRIC: signaling pathways,downstream genes,interacting proteins,and regulation of tumor angiogenesis[J].Adv Cancer Res,2013,120(21): 75-111.
[9]MEIJER T W,KAANDERS J H,SPAN P N,et al.Targeting hypoxia,HIF-1,and tumor glucose metabolism to improve radiotherapy efficacy[J].Clin Cancer Res,2012,18(20):5585-5594.
[10]MENG M B,WANG H H,GUO W H,et al.Targeting pyruvate kinase M2 contributes to radiosensitivity of non-small cell lung cancer cells in vitro and in vivo[J].Cancer Lett,2015,356(2 Pt B):985-993.
[11]BHATTACHARYA B,LOW S H,SOH C,et al.Increased drug resistance is associated with reduced glucose levels and an enhanced glycolysis phenotype[J].Br J Pharmacol,2014,171(13): 3255-3267.
[12]KIM B H,KIM S J,KIM K,et al.High metabolic tumor volume and total lesion glycolysis are associated with lateral lymph node metastasis in patients with incidentally detected thyroid carcinoma[J].Ann Nucl Med,2015,29(8):721-729.
[13]LEUNG C O,WONG C C,FAN D N,et al.PIM1 regulates glycolysis and promotes tumor progression in hepatocellular carcinoma[J].Oncotarget,2015,6(13):10880-10892.
[14]ZUO J,WEN J,LEI M,et al.Hypoxia promotes the invasion and metastasis of laryngeal cancer cells via EMT[J].Med Oncol, 2016,33(2):15.
[15]de OLIVEIRA J T,RIBEIRO C,BARROS R,et al.Hypoxia up-regulatesgalectin-3inmammarytumorprogressionand metastasis[J].PLoS One,2015,10(7):DOI:10.1371/journal.pone. 0134458.
[16]CURRY J M,TULUC M,WHITAKER-MENEZES D,et al. Cancer metabolism,stemness and tumor recurrence:MCT1 and MCT4 are functional biomarkers of metabolic symbiosis in head and neck cancer[J].Cell Cycle,2013,12(9):1371-1384.
(童颖丹 编辑)
Hypoxia regulates glycolysis and metastasis of prostatic cancerin vitro
Xiang-li Wang
(Key Laboratory of Nanobiological Technology of Chinese Ministry of Health,Xiangya Hospital of Central South University,Changsha,Hunan 410008,China)
Objective To investigate the changes of glycolysis and metastasis of prostatic cancer under hypoxia.Methods DU145 and PC-3 cells were cultured in normoxia and hypoxia for 24 hours and 48 hours, respectively.Then,Transwell invasion assay was used to detect the changes of migration and invasion.The content of glucose and lactate in the supernatant of each group was examined by commercial kits.Finally, genes associated with glycolysis were quantified by qRT-PCR.Results The migratory and invasive abilities of DU145 cells were significantly increased after hypoxia treatment.Meantime,compared with the cells cultured in normoxia,DU145 and PC-3 cells treated with hypoxia showed decreased supernatant glucose,enhanced glucose uptaking ability and lactate secretion.qRT-PCR results demonstrated that genes associated with glucose metabolism were correspondingly changed under hypoxia.Conclusions Hypoxia promotes the migration and invasion of prostatic cancer cellsin vitro.Meantime,hypoxia can regulate the glycolysis of prostatic cancer cells via modulating expression of the genes associated with glycolysis.
prostatic cancer;hypoxia;glycolysis;migration;invasion
R736.8
A
10.3969/j.issn.1005-8982.2016.23.007
1005-8982(2016)23-0032-05
2016-06-02

