氮气及温度、湿度条件对锈赤扁谷盗卵发育的影响
王明洁 蔡婷婷 汪 峰 邵小龙 蔡宏郁 鞠兴荣
(南京财经大学食品科学与工程学院1,南京 210046)(江苏省现代粮食流通与安全协同创新中心2,南京 210046)
氮气及温度、湿度条件对锈赤扁谷盗卵发育的影响
王明洁1,2蔡婷婷1汪 峰1,2邵小龙1,2蔡宏郁1鞠兴荣1,2
(南京财经大学食品科学与工程学院1,南京 210046)(江苏省现代粮食流通与安全协同创新中心2,南京 210046)
在3种氮气浓度(78.8%、83.0%、88.0%)、3种相对湿度(69.6%RH、75.1%RH、83.7%RH)及5种温度(19.9、25.0、29.3、34.7、39.8 ℃)组合条件下,研究了锈赤扁谷盗卵的孵化情况。结果表明:发育历期为2.2~18.9 d,发育起点温度为13.8~14.3 ℃,最高临界发育温度为40.4~43.0 ℃,有效积温为61.6~115.6 日度。发育历期、发育速率与温度之间分别是“指数”型及“S”型曲线关系。氮气及温度、湿度因素相互作用影响了卵的孵化,88.0%的氮气对孵化有显著的抑制效应,温度(>30.0 ℃)及湿度(>69.6%RH)强化了氮气对孵化的抑制效应。
锈赤扁谷盗 卵 氮气 温度 相对湿度
锈赤扁谷盗Cryptolestesferrugineus(Stephens)是第二食性害虫,现今因其逐渐对熏蒸剂产生了较强的抗性而备受关注[1-2]。气调储粮具有延缓品质劣变、抑杀虫霉及安全环保等优点,作为一种保护储粮的技术手段已被广泛认同。近些年开展了充氮气调控制储粮害虫的工作,这些研究多集中在氮气处理浓度超过90%的情况下对储粮害虫的抑杀效应上,如杨健、严晓平等[3-7]发现95%以上的氮气控制储粮害虫效果较好,而对90%以下的氮气的研究鲜见报道。有资料表明,锈赤扁谷盗的卵与幼虫、蛹和成虫等虫态相比,呼吸强度最小,因而也是最难防治的一个虫态[8]。为此,在氮气处理浓度低于90%的情况下,针对高水分稻谷,研究氮气及温度、湿度条件对锈赤扁谷盗卵发育的影响,以期为充氮气调防治稻谷储藏期害虫提供参考。
1 材料与方法
1.1 材料
试虫:成都粮食储藏研究所害虫防治中心,于南京财经大学粮食储运国家工程实验室在(28±1) ℃、相对湿度为(70±5)%的条件下,用碎小麦、燕麦粉、酵母粉按6∶3∶1混配成饲料常规饲养。
供试气源:南京天泽气体有限责任公司,配制3种氮氧压缩钢瓶气,按体积含量计,氮气分别为78.8%、83.0%和88.0%。
淮5粳稻:江苏农垦集团。稻谷初始水分为17.3%,将供试稻谷水分分别调至13.6%、14.5%及16.3%,破碎粒率调至2%。
氯化钾:南京化学试剂有限公司;碘化钾:国药集团化学试剂有限公司;氯化铜:上海振欣试剂厂;氯化钠、硝酸钠:西陇化工股份有限公司。所用试剂均为分析纯。
1.2 试验装置及设施
连续通气装置如图1所示。钢瓶内的氮氧混合气作为气源;流量计用以调控气体的流速[(50±5)mL/min];洗气瓶(500 mL)内装不同的盐溶液,用以调控流经的氮氧混合气的相对湿度;干燥器(直径21.0 cm)隔板上装有1 200 g的稻谷,将分别装有25个养虫管(直径1.1 cm,高度4.5 cm)的2个养虫缸(直径9.0 cm,高度5.5 cm)埋在稻谷下1.0 cm处;通气后气体流经这一试验装置后,通过墙壁排到养虫室外。
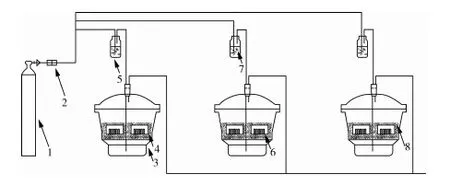
注:1 氮氧压缩气钢瓶,2 流量计;3 干燥器,4 养虫缸,5 洗气瓶,6 玻璃管,7 盐溶液,8 稻谷。
图1 试验装置
养虫室:用空调将5间养虫室的温度分别控制为(19.9±0.50)、(25.0±0.55)、(29.3±0.49)、(34.7±0.20)和(39.8±0.32) ℃。各养虫室内均设置3套连续通气装置,每套装置的供试气源按体积含量计,氮气分别为78.8%、83.0%和88.0%。
1.3 试验方法
1.3.1 配制饱和盐溶液
在一定的温度条件下,用密闭空间中的饱和盐溶液可以设定该空间的相对湿度[9],故让氮氧混合气流经特定的盐溶液就可以使其达到与稻谷的平衡水分相平衡的相对湿度(表1)。表1中稻谷的平衡水分可以由修正Chung-Pfost 解吸等温线模型计算得到[10]。该等温线模型为:
式中:RH为相对湿度;M为平衡含水量/(干基,%);t为温度/℃。C1=502.485,C2=45.276,C3=0.186 。
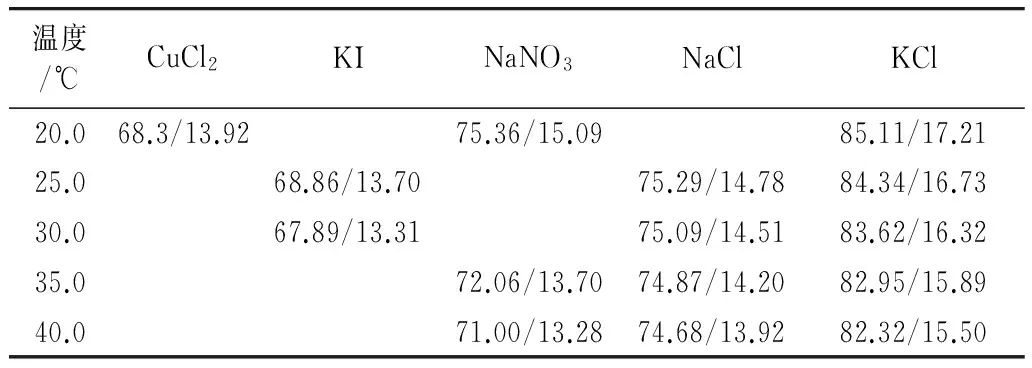
表1 5种饱和盐溶液设定的氮氧混合气相对湿度及对应的稻谷平衡水分/%
根据表1的数据,计算得出在5个温度条件下,氮氧混合气相对湿度均值及对应的稻谷平衡水分均值(湿基)分别为(69.62±1.81)%/(13.58±0.28)%、(75.06±0.28)%/(14.50±0.46)%和(83.67±1.10)%/(16.33±0.67)%。
按照表1配制饱和盐溶液,分别装入洗气瓶,连接在5间养虫室的3套装置上。
1.3.2 卵期的观察
在试验前5 d开启试验装置,检查其密封性,待气体流速稳定后开始试验,试验期间保持流速的稳定。
在双目体视显微镜下选取1粒24 h内产的卵,用毛笔轻轻拈起放入养虫管,然后将养虫管置于养虫缸中,每个干燥器中放入2个养虫缸,每个养虫缸中内置25个养虫管。养虫管及养虫缸均用尼龙筛网封口,将养虫缸埋入稻谷下1 cm处,逐日观察并记载卵的孵化情况。
2 结果与分析
2.1 不同氮气浓度及温度、湿度条件下锈赤扁谷盗卵的发育历期
2.1.1 氮气浓度及温度、湿度条件对卵发育历期的影响
卵发育历期表示卵完成发育所需要的时间。试验表明,卵的发育历期为2.2~18.9 d,受到氮气及温度、湿度条件的影响,变化较大(图2)。
卵发育历期曲线按照氮气浓度的不同分成明显的3组,3组曲线按照氮气浓度从小到大的顺序自下而上排列。此外,随着温度的升高各组之间的间距越来越小,温度升至30 ℃间距趋于稳定。比较相同湿度但不同氮气浓度的3根曲线之间的距离,发现湿度越高距离越大,此现象在20 ℃至30 ℃之间最为明显(图2)。上述现象表明:氮气浓度越高,卵发育历期越长;在低于30 ℃条件下,温度大大削弱了氮气对卵发育历期的延长作用;相对湿度强化了氮气对卵发育历期的延长作用。
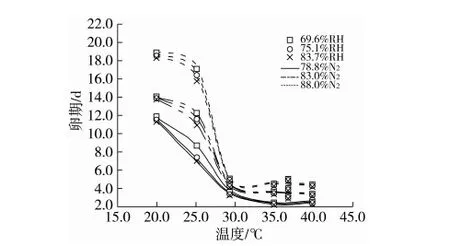
图2 不同氮气浓度及温度、湿度条件下锈赤扁谷盗卵的发育历期
除78.8%氮气处理浓度组曲线在35 ℃前随着温度的增加呈下降的趋势外,其余2组下降的趋势要持续至40 ℃。下降速度最大的温度区间为25~30 ℃,此现象在88.0%氮气浓度组曲线上表现的尤为突出(图2)。该现象说明,温度越高,卵发育历期越短,25 ~30 ℃是卵发育历期由长变短的温度转折期;氮气可以增强卵发育历期之于温度的敏感性。
各氮气浓度组内的3根曲线也不完全重合(图2)。69.6%RH的曲线居于各组最上方位置,75.1%RH与83.7%RH的曲线依次位于其下方。78.8%氮气组的3根曲线重合度最小,83.0%次之,88.0%最大,此现象在温度小于30 ℃,特别是在25 ℃左右极为明显。这说明在相同氮气浓度的情况下,相对湿度越大卵发育历期越短;氮气削弱了相对湿度对卵发育的促进作用;低于30 ℃的温度对于卵发育历期之于相对湿度敏感性的影响远大于30 ℃以上的温度。
2.1.2 卵发育历期与温度的回归方程的建立
在试验条件下,进行卵发育历期(Y)与温度(X)的一元回归方程的拟合。共对直线、指数、对数、幂函数、“S”型和二次函数等6种函数进行了拟合比较,得到的最优形式为Y=ae(-bX)(a>0,b>0),说明在20~40 ℃内,随着温度的升高,卵发育历期按照指数函数的形式逐渐缩短(表2)。
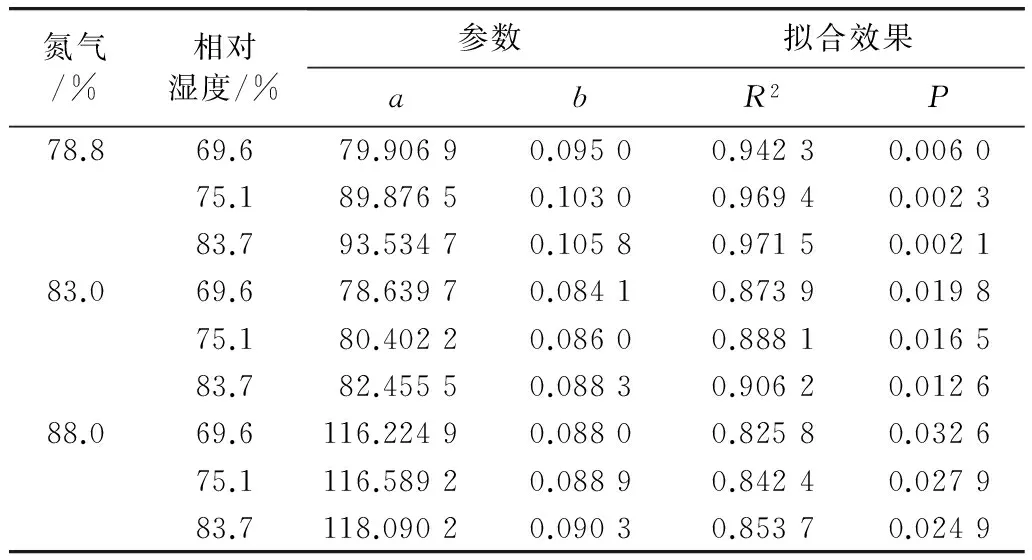
表2 拟合Y=ae(-bX)得到的参数(Y为卵发育历期/d,X为温度/℃)
2.2 不同氮气浓度及温度、湿度条件下锈赤扁谷盗卵的发育速率
2.2.1 氮气浓度及温度、湿度条件对发育速率的影响
发育速率为发育历期的倒数。与图2一样,发育速率曲线亦分为3组,但却是按照氮气浓度从小到大的顺序自上而下排列。此外,在温度升至30 ℃之后3组曲线的组间距极为明显。比较相同湿度但不同氮气浓度的3根曲线之间的距离,发现湿度越高距离越大(图3)。这些表明:氮气浓度越高,发育速率越低,说明氮气抑制卵发育,88.0%氮气的抑制效应最强。与78.8%氮气处理相比,相同湿度条件下在各温度88.0%氮气的发育速率起码要小0.032;温度(>30.0 ℃)极大地强化了氮气对卵发育的抑制效应,同样与78.8%氮气相比,当温度大于30 ℃时,相同湿度条件下88.0%氮气的发育速率起码要小0.076;相对湿度强化了氮气的抑制效应,与69.6% RH在各温度78.8%与88.0%氮气发育速率差的均值相比,75.1%RH与83.7%RH的均值分别要大0.012 6和0.018 0。
随着温度的增加,78.8%氮气浓度组的曲线经历了缓慢上升、急剧上升继而下降的过程,发育速率急剧上升的温度范围为25~35 ℃。与之不同,另2组曲线呈缓升、快升再慢升的趋势,“急剧上升温度范围”缩小为25~30 ℃(图3)。这些表明:温度与发育速率为“S”型曲线关系;氮气的“介入”使得“S”型曲线在高温阶段依旧缓慢上升,且“急剧上升温度范围”缩小。
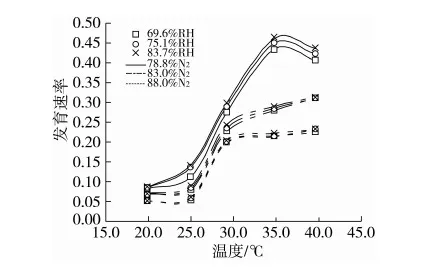
图3 不同氮气浓度及温度、湿度条件下锈赤扁谷盗卵的发育速率
与图2类似,在图3中,78.8%氮气组的3根曲线重合度最小,88.0%最大。但各组的69.6%RH曲线均居于该组最下方位置,而83.7%RH曲线位于最上方。在“急剧上升温度范围”之内,各组的三条曲线基本平行或重合。这些说明:在相同氮气浓度的情况下,相对湿度越大发育速率越高,氮氧混合气中的水分促进了卵的发育;氮气会极大地削弱相对湿度对卵发育速率的影响;就温度对于发育速率之于相对湿度敏感性的影响而言,“急剧上升温度范围”内的温度影响极微。
2.2.2 发育速率与温度的回归方程的建立
在试验条件下,用温度与发育速率的试验数据拟合 “王-兰-丁” 温度与发育速率关系模型(表3)。模型如下:
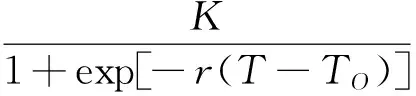
式中:K为高温下潜在的饱和发育速率,等于最适发育速率V(T0)的2倍;r是发育速率随温度变化的指数增长率;TL、TH各为最低、最高临界发育温度;T0为最适发育温度;δ为边界层的宽度,其相对大小反映了昆虫对极端温度的不同忍耐程度。
比较表3中的参数后发现:1)高温下潜在的最大发育速率(K)随着氮气浓度的升高而下降,当氮气浓度大于78.8%时相对湿度对K值影响极微;2)发育速率随温度变化的指数增长率(r)在氮气浓度升至83.0%以上有明显的增加,因相对湿度差异而至r值变化的幅度小于0.150;3)最适宜发育温度(T0)随着氮气浓度的增加逐渐下降,78.8%、83.0%与88.0%氮气浓度下69.6%RH、75.1%RH及83.7%RH的T0均值分别为27.4、26.9、26.5 ℃,另外,氮气浓度相同时因相对湿度差异而至T0变化的幅度小于0.7 ℃;4)各氮气浓度下3种相对湿度边界层的宽度(δ)都在氮气浓度升至83.0%时达到最大,而后随着氮气浓度的增加而下降。78.8%、83.0%与88.0%氮气浓度下3种相对湿度的δ均值依次为0.179 2、0.202 3和0.094 9。此外,各氮气浓度下,相对湿度越大,δ值就越小。结合2.2的分析说明,在氮气浓度升至88.0%时,氮气对卵的发育表现出明显的抑制效应;就对极端温度的忍耐程度而言,卵对氮气有1个适应和忍耐的限度,当浓度超过了83.0%,忍耐力就会明显下降,卵的发育会因此受到明显影响。此外,氮氧混合气中的水分降低了卵对极端温度的耐受力。
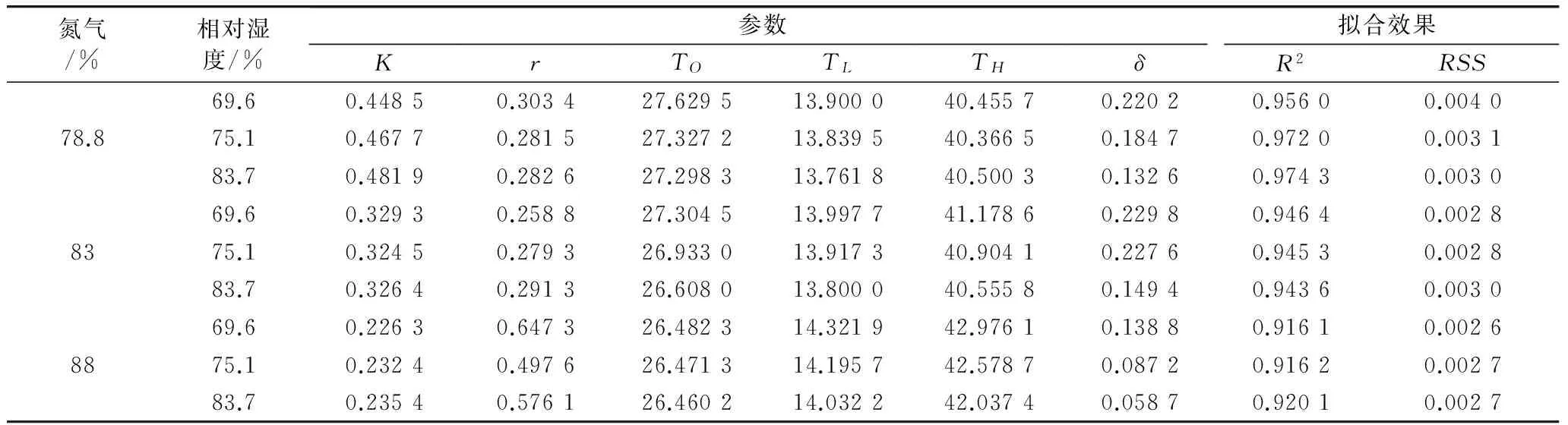
表3 用发育速率及温度观察值拟合“王-兰-丁”模型得到的参数
2.3 不同氮气浓度及相对湿度条件下锈赤扁谷盗卵的发育临界点温度及有效积温
发育临界点温度包括发育的最低和最高温度,即发育起点温度和最高临界发育温度。发育起点温度以上的温度之于生长发育才是有效温度,而完成某一发育阶段需要的有效温度之和是一个常数,将这个常数称为有效积温,其数学表达式如下:
Ki=Ni(Ti-C)
式中:Ki为有效积温/日度;Ni为发育历期/d;Ti为发育期的平均温度/℃;C为发育起点温度/℃。
用表3中的最低、最高临界发育温度来讨论发育临界点温度,有效积温用上述数学表达式计算得到(图4)。
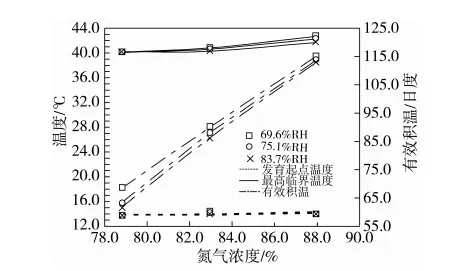
图4 不同氮气浓度及相对湿度条件下锈赤扁谷盗卵的发育临界点温度和有效积温
2.3.1 发育临界点温度
发育起点温度及最高临界发育温度分别为13.8~14.3 ℃和40.4~43.0 ℃,随氮气浓度增加而升高的幅度都不大,在0.42 ℃及2.52 ℃之内(表3,图4)。随着氮气浓度的增加,二者均呈上升的趋势,在氮气浓度升至83.0%以后上升趋势较为明显,且相对湿度越小,上升的趋势越明显。二者随氮气浓度变化曲线均按照相对湿度从大到小的顺序分成自下而上排列的三条曲线。这说明,提高氮气浓度,降低相对湿度,卵能够发育的最低与最高温度均会有有限的升高;就提高发育临界点温度而言,升氮与降湿之间是相互促进的关系。
Kawamoto等[11]在15~35 ℃、50%~90%RH的条件下发现该虫卵发育速率和温度是线性关系,并推算发育起点温度为15.3 ℃。而在78.8%氮气浓度、20~40 ℃、69.6%~83.7%RH条件下,发现40 ℃条件下的发育速率较35 ℃明显下降,因而发育速率和温度为S型曲线关系(图3),由此推算发育起点温度为13.8~13.9 ℃,较Kawamoto等[11]的要低。
2.3.2 有效积温
有效积温为61.6~115.6日度,随氮气浓度增加而升高。有效积温随氮气浓度变化的3条曲线亦按照相对湿度从大到小的顺序自下而上排列,但它们之间的差异随着氮气浓度的升高而减少(图4)。这些现象说明提高氮气浓度、降低相对湿度可显著的提高卵对有效积温的要求,“升氮”削弱了“降湿”对有效积温的升高效应。
3 结论
综上所述,在3种氮气浓度(78.8%、83.0%、88.0%)、3种相对湿度(69.6%RH、75.1%RH、83.7%RH)及5种温度(19.9、25.0、29.3、34.7和39.8 ℃)的条件下,氮气及温度、湿度因素相互作用影响了卵的孵化,88.0%的氮气对孵化有显著的抑制效应,温度(> 30.0 ℃)及湿度(> 69.6%RH)强化了氮气对孵化的抑制效应。这些有助于在生产实践中,从氮气、温度、湿度和粮食水分这几个因素入手,尤其是使用低于常规气调的氮气浓度,创造抑制储粮害虫发育的外部环境,最大限度地压低害虫种群增长速度,达到安全、经济、有效的防治效果。
志谢:何荣博士对论文的修改提供了宝贵意见,谨致谢意。
[1]王殿轩,原锴,武增强,等.锈赤扁谷盗与其它几种储粮害虫对磷化氢的耐受性比较[J].郑州工程学院学报,2004,25(1):4-8
Wang Dianxuan,Yuan Kai,Wu Zengqiang,et al. Comparison to relative phosphine resistance ofCryptolestesferrugineusand other species of insect pests in stored product[J]. Journal of Zhengzhou Institute of Technology,2004,25(1):4-8
[2]Nayak O K,Holloway J C,Emery R N,et al. Strong resistance to phosphine in the rusty grain beetle,Cryptolestesferrugineus(Stephens)(Coleoptera: Laemophloeidae): its characterisation, a rapid assay for diagnosis and its distribution in Australia[J]. Pest Management Science,2012,69(1):48-53
[3]Conyers S T,Bell C H. A novel use of modified atmospheres: Storage insect population control[J].Journal of Stored Products Research,2007,43(4):367-374
[4]张建军,曲贵强,李燕羽,等.高纯氮气对储粮害虫致死效果的研究[J].粮食储藏,2007,36(5):11-14
Zhang Jianjun,Qu Guiqiang,Li Yanyu,et al. A study of lethal effect of pure N2atmosphere to stored grain insect [J].Grain Storage,2007,36(5):11-14
[5]严晓平,宋永成,王强,等.一定条件下96%以上氮气控制主要储粮害虫试验[J],粮食储藏,2010,39(1):3-5
Yan Xiaoping,Song Yongcheng,Wang Qiang,et al. Test on stored grain insects exposed to over 96% nitrogen[J]. Grain Storage,2010,39(1):3-5
[6]杨健,吴芳,宋永成,等.30℃条件下不同氮气浓度对储粮害虫控制效果研究[J].粮食储藏,2011,40(6):7-12
Yang Jian,Wu Fang,Song Yongcheng,et al. Effect of different nitrogen concentration on stored grain insects at 30 ℃[J]. Grain Storage,2011,40(6):7-12
[7]孙相荣,杨健,吴芳,等.25℃条件下不同氮气浓度对储粮害虫控制效果研究[J].粮食储藏,2012,41(1):4-9
Sun Xiangrong,Yang Jian,Wu Fang,et al. A study on stored grain insects exposed to different nitrogen concentration at 25℃[J]. Grain Storage,2012,41(1):4-9
[8]Campbell A,Sinha R N. Bioenergetics of granivorous beetles,CryptolestesferrugineusandRhyzoperthadominica(Coleoptera:Cucujidae and Bostrichidae)[J].Canadian Journal Zoology,1978,56(1):624-633
[9]郝光宗,邢丽缘,梁强威.饱和盐水溶液湿度固定点(2):数据来源与盐溶液选择[J].传感器世界,1999,5 (12) :10-14.
Hao Guangzong,Xing Liyuan,Liang Qiangwei. Humidity fixed points of saturated aqueous solutions of salts(2):the sources of data and the selection of salt solutions[J]. Sensor World,1999,5 (12) :10-14
[10]李兴军,刘丁,王双林,等.采用水分解吸方程估算我国稻谷安全水分[J].中国粮油学报,2011,26(4): 81-84
Li Xingjun,Liu Ding,Wang Shuanglin,et al. Estimation of safe storage moisture content of chinese rough rice by fitted EMC/ERH model[J]. Journal of the Chinese Cereals and Oils Association,2011,26(4): 81-84
[11]Kawamoto H,Sinha R N,Muir W E. Effects of temperature and relative humidity on egg development ofCryptolestesferrugineuscompared withC.pusillus(Coleoptera:Cucujidae) [J]. Applied Entomology and Zoology,1990,25(1) :35-41.
The Influences of Nitrogen, Temperature and Relative Humidity on Egg Development of Rusty Grain Beetle,CryptolestesFerrugineus(Stephens)
Wang Mingjie1,2Cai Tingting1Wang Feng1,2Shao Xiaolong1,2Cai Hongyu1Ju Xingrong1,2
(College of Food Science and Engineering, Nanjing University of Finance and Economics1, Nanjing 210046)(Jiangsu Collaborative Innovation Center for Modern Grain Circulation and Safety2,Nanjing 210046)
Egg eclosion ofCryptolestesferrugineus(Stephens) was investigated under the combined conditions of nitrogen concentrations (78.8%, 83.0% and 88.0%) , relative humidity(69.6%RH, 75.1%RH, 83.7%RH) and temperatures(19.9,25.0,29.3,34.7,39.8 ℃). The results showed that the development period, the development zero, the maximum development temperature and the effective accumulated temperature were 2.2~18.9 d,13.8~14.3 ℃,40.4~43.0 ℃ and 61.6~115.6 day-degree, respectively. The curves between the development period, development rate and the temperatures were respective ‘index’ and ‘S’-shaped pattern. It was concluded that the interaction of nitrogen, temperature and humidity would affect egg eclosion;88% nitrogen had significant inhibitory effects on the eclosion;Temperature (>30.0 ℃) and humidity (>69.6%RH) enhanced the inhibitory effect of nitrogen on egg eclosion.
Cryptolestesferrugineus(Stephens), egg, nitrogen, temperature, relative humidity
S379.5
A
1003-0174(2016)12-0106-06
国家科技支撑计划(2011BAD03B02)
2015-04-23
王明洁,女,1963年出生,副教授,粮食储藏

