进展期胃癌No.12组淋巴结微转移检测的临床意义分析
陈维 张一帆 吕成余
(南京医科大学附属南京医院/南京市第一医院普外科,江苏 南京 210006)
·技术与方法·
进展期胃癌No.12组淋巴结微转移检测的临床意义分析
陈维 张一帆 吕成余△
(南京医科大学附属南京医院/南京市第一医院普外科,江苏 南京 210006)
目的 检测进展期胃癌患者No.12组淋巴结微转移,评估No.12组淋巴结转移情况及其临床意义。方法 收集行D2胃癌根治术的进展期胃癌患者35例,每例患者均行No.12组淋巴结清扫。常规病理检查阴性的No.12组淋巴结,经连续切片行CK20抗体免疫组织化学方法检测微转移。 分析No.12组淋巴结转移与临床病理参数以及各亚组之间的关系。结果 CK20抗体免疫组化染色法对淋巴结转移的检出率显著提高。不同年龄、性别、组织学类型及不同肿瘤部位的患者No.12淋巴结转移无统计学差异(P>0.05);是否穿透浆膜、不同浸润深度、TNM分期、Borrmann分型及不同肿瘤最大直径的患者No.12淋巴结转移有显著性差异(P<0.05)。No.12a的转移率明显高于No.12b和 No.12p(P<0.05)。 结论 采用CK20抗体免疫组织化学法进行胃癌淋巴结微转移的检测,可明显提高胃癌淋巴结转移的检出率。No.12组淋巴结微转移与否穿透浆膜、浸润深度、TNM分期、Borrmann分型及肿瘤大小有关,与患者的年龄、性别、组织学类型和肿瘤部位无关。进展期胃癌根治术应常规行No.12组淋巴结清扫,尤其是No.12a的清扫。
进展期胃癌; No.12组淋巴结; 微转移; 免疫组织化学
胃癌淋巴转移是判断胃癌生物学行为及预后的重要参考指标之一。目前对于进展期胃癌淋巴清扫范围以D2清扫术为标准[1]。No.12组淋巴结,即肝十二指肠韧带淋巴结,为D2清扫术的重要组成部分。淋巴结微转移是指通过传统的病理学检查不能发现或难以发现,<2 mm的淋巴结癌转移灶。美国癌症联合会(AJCC)发布的肿瘤分期系统第6版中将淋巴结转移分为孤立的肿瘤细胞、微转移和宏观转移[2]。本研究旨在检测进展期胃癌患者No.12组淋巴结微转移,评估No.12组淋巴结转移情况及其临床意义。
1 资料与方法
1.1 一般资料 收集我院胃肠外科2015年10月至2016年4月间行D2胃癌根治术的进展期胃癌患者35例,其中男26例,女9例;年龄46~85岁,平均66.8岁。所有患者临床病理分期按照AJCC第7版胃癌TNM分期方案。所有病例术前均未行放化疗。手术方式以及淋巴结的采集均参照日本胃癌学会制定的第14版日本胃癌规约进行[3]。每例患者均常规解剖裸露胆总管、肝动脉及门静脉,以清除No.12a、12b和12p淋巴结,共取出60个No.12组淋巴结。
1.2 免疫组化及微转移结果判定 术中取出No.12组淋巴结,标志后以10%甲醛固定24 h,然后经脱水、透明、浸蜡及包埋,连续切片每个蜡块各两张,其中一张切片HE染色行常规病理学检查,另一张以CK20抗体免疫组化染色法检测,SP法操作,DAB 显色。同一蜡块连续切片经HE染色诊断淋巴结未转移,而免疫组化染色提示CK20阳性的,即判断此标本存在淋巴结微转移。
1.3 统计学方法 采用SPSS 19.0软件进行统计学分析。各数据比较采用χ2检验及Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结 果
2.1 常规病理染色 在35例患者60个No.12组淋巴结中,3例患者的5个淋巴结经常规病理检查发现有转移, No.12淋巴结转移率为8.6%(3/35),淋巴结的检出率为8.33%(5/60)。
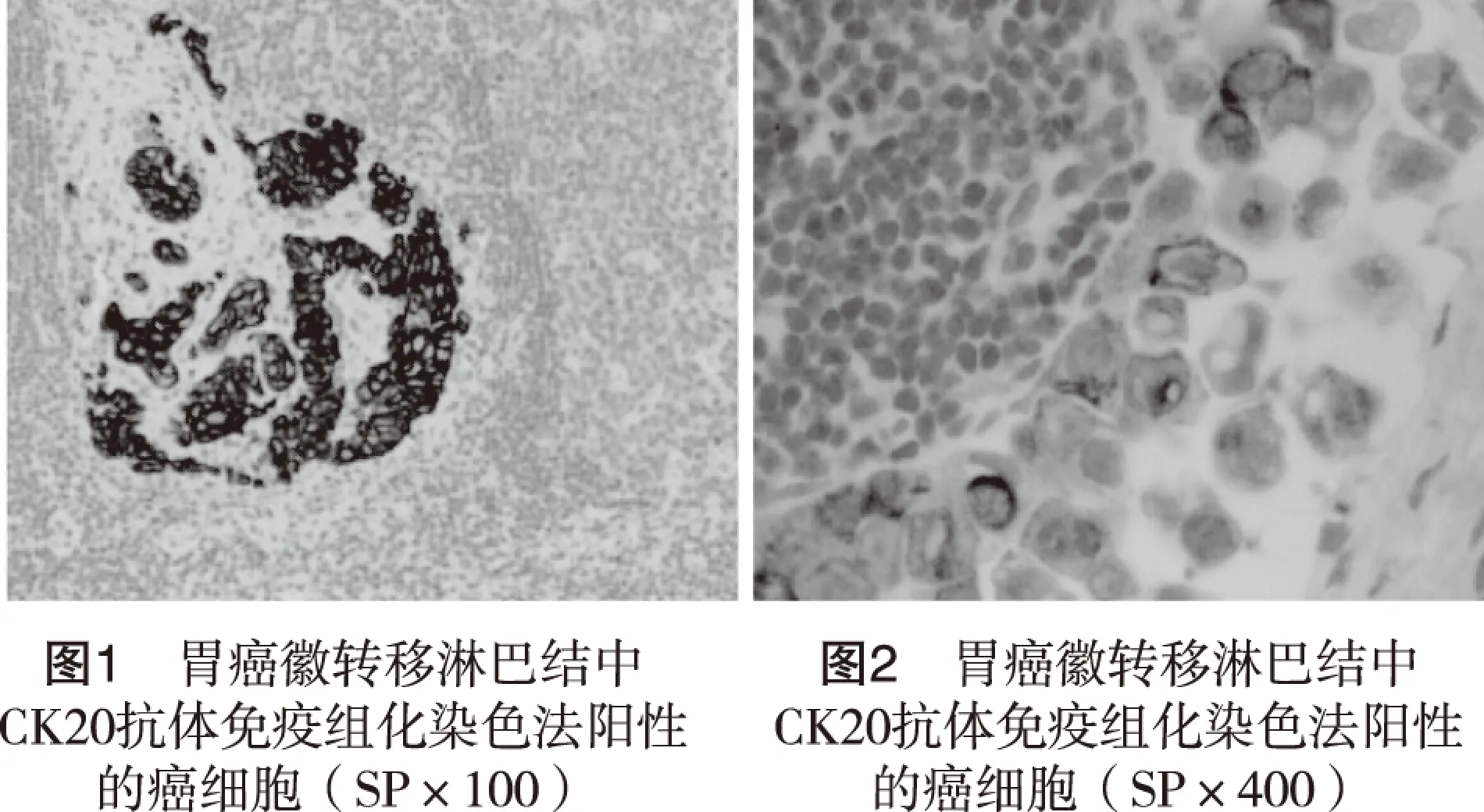
2.2 免疫组化结果 CK20抗体免疫组化染色法(SP法)阳性为细胞质内见到棕黄色颗粒(图1,图2)。上述5个常规病理染色阳性淋巴结的连续切片,行CK20抗体免疫组化染色法检测,结果均为阳性;同样方法对其余常规病理染色阴性淋巴结进行检测,有4例患者的6个淋巴结阳性表达,应用CK20抗体免疫组化染色法检测患者淋巴结转移发生总例数为7(3+4)例,发生率为20.0%(7/35),淋巴结转移检出总数为11(5+6)个,检出率为18.3%(11/60)。本组患者常规病理检查和CK20抗体免疫组化染色法两种检测方法对淋巴结转移检测结果有显著差异(P<0.05),后者淋巴结转移的检出率高于前者。
2.3 No.12淋巴结总体转移情况与临床病理参数关系 不同年龄、性别、组织学类型及不同肿瘤部位的患者No.12淋巴结转移无统计学差异(P>0.05);是否穿透浆膜、不同浸润深度、TNM分期、Borrmann分型及不同肿瘤最大直径的患者No.12淋巴结转移有显著性差异(P<0.05) ,见表1。
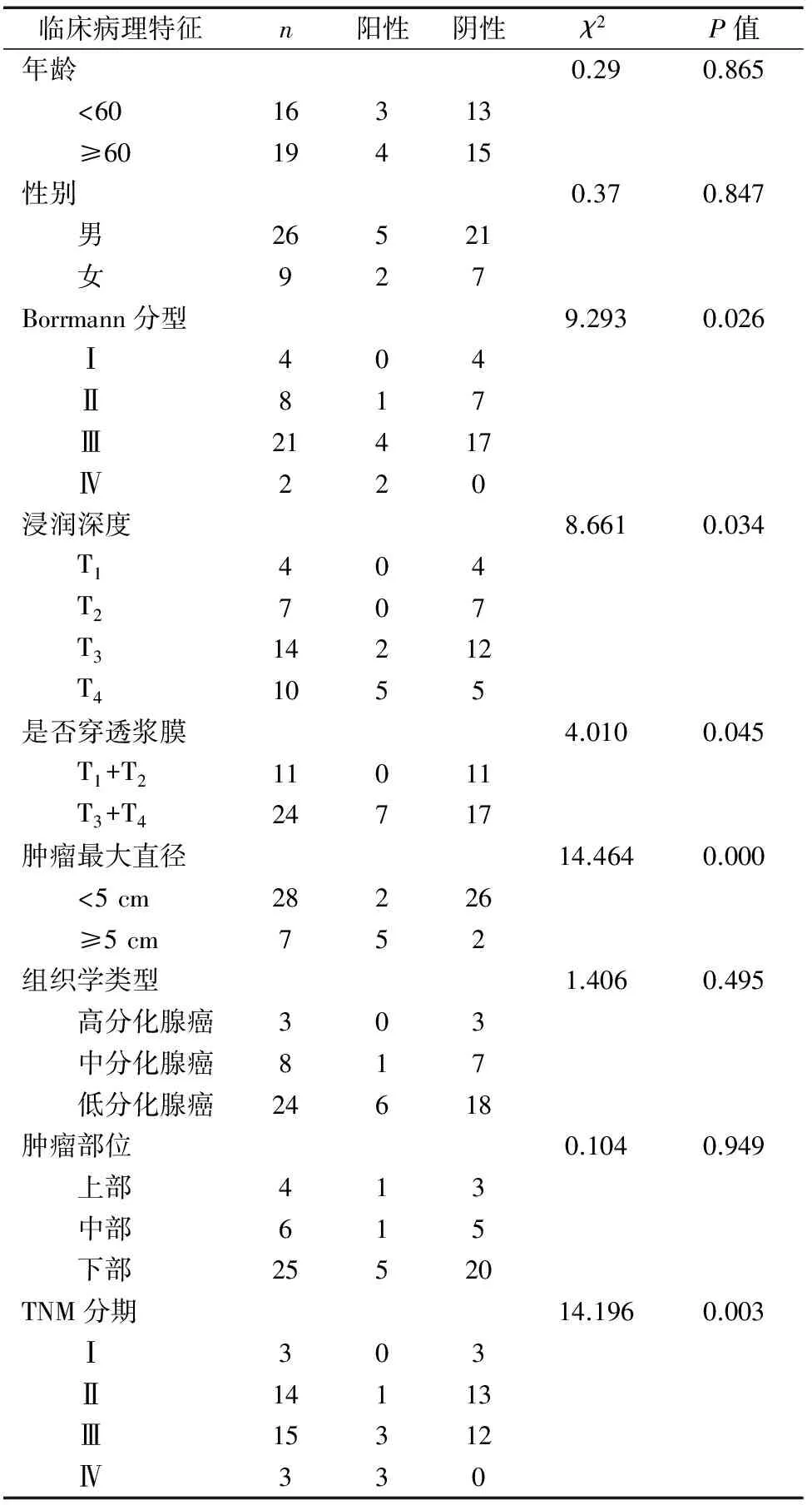
表1 No.12组淋巴结转移与临床病理参数的关系
2.4 No.12组淋巴结各亚组转移率结果 本组资料No.12a、12b和12p淋巴结转移率分别为30.4%(7/23)、20.0%(4/20)及0(0/17)。No.12a的转移率明显高于No.12b和 No.12p(P<0.05)。
3 讨 论
临床中常发现病理检查无淋巴结转移的进展期胃癌患者发生了早期转移复发,说明可能存在常规病理学检查难以发现的微转移灶[4]。存在淋巴结微转移的患者预后较无微转移的患者差[5]。目前检测胃癌淋巴结微转移的常用方法有连续切片法、免疫组织化学方法及分子生物学方法。免疫组化法灵敏度接近RT-PCR,且操作简单,有助于提高淋巴结微转移的诊断率。因此本研究选用免疫组织化学方法检测淋巴结微转移。免疫组织化学法检测胃癌淋巴结微转移的常用指标有CEA、EMA、CK等。细胞角蛋白(CK)在上皮组织中表达,在间叶组织无表达,在恶性转化和肿瘤发生过程中CK持续存在于上皮细胞肿瘤内 ,检测CK表达是免疫组化检测微转移的基础 ,而其中CK20的特异性最强[6]。 所以本实验选择CK20作为抗体来检测淋巴结微转移。在本实验中,No.12组淋巴结转移患者的阳性率为 20.0%(7/35),No.12组淋巴结转移的检出率为18.3%(11/60)。常规病理检查分别为8.6%(3/35)和8.3%(5/60)。二者具有显著性差异(P<0.05),前者淋巴结转移的检出率明显高于后者。因此采用以CK20为抗体的免疫组织化学法进行No.12组淋巴结微转移的检测,可明显提高No.12组淋巴结转移的检出率。
有相关文献[7-8]提示,胃癌肿瘤部位、大小、浸润深度及分化程度与No.12组淋巴结的转移有一定关系,而本研究数据提示是否穿透浆膜、不同浸润深度、TNM分期、Borrmann分型及不同肿瘤最大直径的患者,No.12组淋巴结转移有显著性差异,与上述结论基本一致。本组资料中,不同肿瘤部位No.12组淋巴结的转移无显著性差异,提示即使不是胃下部癌,No.12组淋巴结的清扫仍有其必要性。No.12组淋巴结清扫是否彻底,决定了胃癌D2根治术的质量。No.12组淋巴结彻底的清扫,不但可以提高淋巴结检出率,而且也为术后准确地分期,制定治疗方案创造条件[9]。本实验结果No.12a的转移率明显高于No.12b和 No.12p,支持该指南规定。本组资料中,No.12b的转移率虽然低于No.12a,但也有一定程度的转移率,而No.12p转移率极低,可能的原因是No.12a和No.12p通常是在脉络化肝十二指肠韧带内结构时整块切除,切除后分别标记困难且存在偏差,从而影响到No.12p阳性例数。有研究[10]表明国人胃癌No.12p淋巴结转移的相关危险因素包括肿瘤部位、肿瘤侵犯深度及Borrmann分型。综上所述,我们认为进展期胃癌均应常规行No.12组淋巴结清扫,尤其是No.12a的清扫。而对于胃下部癌、肿瘤穿透浆膜及直径≥5cm者,应考虑再清扫No.12b和No.12p淋巴结。
[1] Takahashi T,Saikawa Y,Kitagawa Y.Gastric cancer: current status of diagnosis and treatment[J].Cancers,2013,5(1) :48-63.
[2] Edge SB,Compton CC.The American joint committee on cancer:the 6th edition of the AJCC cancer staging manual and the future of TNM [J].Ann surg,2002,17(6):1471-1474.
[3] 日本胃癌学会.胃癌处理规约(改订第14版)[M].东京:金原出版株式会社,2009:1-17.
[4] Jeuck TLA,Wittekind C.Gastric carcinoma: stage migration by immunohistochemically detected lymph node micrometastases[J].Gastric Cancer,2015,18(1):100-108.
[5] Yasuda K.Prognostic effect of lymph node micrometastasis in patients with histologically node-negative gastric cancer[J].Ann Surg Oncol ,2002,9(8):771-774.
[6] Busam KJ,Jungbluth AA,Rekthman N,et al.Merkel cell polyomavirus expression in merkel cell carcinomas and its absence in combined tumors and pulmonary neuroendocrine carcinomas[J].Am J Surg Pathol ,2009,33(9):1378-1385.
[7] Zilberstein B,Mucerino DR,Yagi OK.et al.Results of D2 gastrectomy for gastric cancer:lymph node chain dissection or multiple node resection[J].Arq Bras Cir Dig,2012,25(3):161-164.
[8] Aurello P,Catracchia V,Petrucciani N,et al.What is the role of nodal ratio as a prognostic factor for gastric cancer nowadays Comparison with new TNM staging system and analysis accordingto the number of resected nodes[J].Am Surg,2013,79 (5):483-491.
[9] Marchet A,Mocellin S,Ambrosi A,et al.The ratio between metastatic and examined lymph nodes (N ratio) is an independent prognostic factor in gastric cancer regardless of the type of lymphadenectomy: results from an Italian multicentric study in 1853 patients[J].Ann Surg,2007,245 (4):543-552.
[10] Feng JF,Huang Y,Liu J,et al.Risk factors for No.12p and No.12b lymph node metastases in advanced gastric cancer in China[J].Ups J Med Sci,2013,118(1):9-15.
R735.2
B
1000-744X(2016)11-1195-03
2015-06-13)
△通信作者,E-mail: lcy_1234@aliyun.com

