鸢尾内生真菌Fusariumoxysporum YW1的分离鉴定及其次生代谢产物的研究
黄琪佳, 吴 敏, 黄玉莹, 廖矛川, 杨光忠, 林亲雄, 杨新洲
(中南民族大学 药学院, 武汉 430074)
鸢尾内生真菌FusariumoxysporumYW1的分离鉴定及其次生代谢产物的研究
黄琪佳, 吴 敏, 黄玉莹, 廖矛川, 杨光忠, 林亲雄*, 杨新洲*
(中南民族大学 药学院, 武汉 430074)
为了鉴定鸢尾(Iristectorum)内生真菌YW1菌株并研究其活性代谢产物,通过菌株形态和其rDNA的ITS序列分析,鉴定其为尖孢镰刀菌(Fusariumoxysporum);运用薄层色谱、凝胶色谱和高效制备液相色谱方法从其代谢产物分离到5个生物碱类化合物,经质谱、核磁共振波谱技术鉴定为白僵菌素(1),4-氧代-乙酰丙酸(2),N-(4-氧代戊基)-乙酰胺(3),5-丁基-2-吡啶羧酸(4),5-丁烯-2-吡啶羧酸(5).生物活性测定结果表明化合物1对金黄色葡萄球菌、大肠杆菌均有较强的抑菌活性.化合物1、4、5对HepG2和Hep3B细胞株具有一定的细胞毒活性,IC50值在65.3~120.5 μg/mL.
鸢尾; 内生真菌; 尖孢镰刀菌; 抗菌活性; 细胞毒活性;
植物内生真菌是指那些在其生活史的一定阶段或全部阶段生活于健康植物的各种组织和器官内部的真菌,被感染的宿主植物(至少是暂时)不表现出外在症状,可通过组织学方法或从严格表面消毒的植物组织中分离,或从植物组织内直接扩增出微生物DNA的方法来证明其内生[1].药用植物内生真菌代谢产物具有丰富的化学结构多样性和广泛的生物活性,是一类尚未被完全开发且极具潜力的药物研发资源.近年来,从药用植物内生真菌中寻找新的生物活性成分已成为研究热点[2].
本研究小组在研究药用植物内生菌次生代谢产物的过程中,从一株药用植株鸢尾(Iristectorum)的根部分离到一株内生真菌YW1,前期研究显示其发酵液含有明显的生物碱代谢产物,对G+、G-细菌均有较强的抑菌活性,对HepG2和Hep3B肝癌细胞有明显的体外抗癌活性.为鉴定内生真菌YW1并明确其生物活性成分,本研究通过形态特征和rDNA的ITS序列分析进行了菌株的鉴定,采用薄层色谱、凝胶色谱和高效制备液相色谱方法,从YW1菌株发酵液中分离鉴定了多种生物碱成分,并对其抗菌与抗肿瘤活性进行了评价.
1材料与方法
1.1实验器材
1.1.1鸢尾 于2014年8月采集于英山县吴家山,经中南民族大学刘新桥副教授鉴定为鸢尾(Iristectorum).
1.1.2培养基 PDA 培养基用于内生真菌分离及纯化; MH培养基(杭州大和微生物试剂有限公司) 用于病原细菌培养;RPMI 1640培养基(上海博升生物科技有限公司) 用于细胞培养.
1.1.3菌株与细胞株 金黄色葡萄球菌Staphylococcusaureus和大肠埃希氏菌Escherichiacoli,购自武汉大学微生物菌种保藏管理中心. HepG2、Hep3B肝癌细胞株,正常LO2肝细胞,本实验室保存.
1.1.4试剂 氨苄青霉素和链霉素、五氟尿嘧啶、Sephadex LH-20 购自上海国药集团化学试剂有限公司); 甲醇、乙腈(色谱级)( 美国Tedia 公司); 薄层目硅胶(200~300目,青岛海洋化工厂) ; 其它试剂均为市售分析纯.
1.1.5主要仪器 Q-TOF Micro LC-MS质谱仪;Bruker DRX-500 MHz核磁共振仪;Waters 2535半制备制备型高效液相;Sunfire C18半制备柱(Waters,250 mm × 19 mm,5 μm);RV10型旋转蒸发器(IKA公司);C1000 touch PCR仪(Bio-Rad公司).
1.2内生真菌的分离纯化
剪取鸢尾长约5 cm的侧根清洗干净,将一段侧根在75%酒精中浸泡2 min,再用0.5%的次氯酸浸泡2 min,表面灭菌后用无菌水冲洗根须3次,用无菌滤纸吸干水分,在无菌条件下用解剖刀将侧根切成0.5 cm长的小块移接到PDA培养基(含氨苄青霉素和链霉素各100 mg/L)上,28℃培养7~14 d,将侧根组织块中长出的菌丝用PDA培养基连续重复纯化3次.同时将另一段未进行表面消毒不做剪切的侧根置于PDA平板上作为对照,以此作为分离得到的真菌是否为植物内生真菌的主要参考依据. 分离菌株采用20%甘油低温冻存,菌种保存于本实验室微生物菌种库.
1.3真菌YW1菌株的鉴定
菌落形态观察:将YW1菌株接种在PDA平板上培养10 d,连续观察菌丝粗细、颜色、菌落形态等特征. 采用插片法显微观察菌丝、分生孢子、厚垣孢子等性状, 并依据Boothcs镰刀菌分类标准进行鉴定[3].
核糖体ITS序列的测定:取YW1适量菌丝接于PDA液体培养基中,28℃震荡(160 r/min)培养5 d,过滤得菌丝体,用无菌水冲洗3次,冷冻干燥后备用.YW1菌株总DNA的提取方法参照文献[4],提取总DNA经琼脂糖电泳检测合格后进行目的片段的PCR扩增与测序. ITS1:5’-TCCGTAGGTGAACCTGCGG-3’;ITS4:5’-TCCTCCGCTTA TTGATATGC-3’由武汉擎科生物有限公司合成.PCR反应体系包括:2.5 mmol/L的dNTP 2 μL,5 U/μL的Taq酶0.4 μL,25 mmol/L的MgCl23 μL,5 μL的10×PCR Buffer(试剂由大连宝生物工程有限公司提供),25 μmol/L的ITS1和ITS4各1 μL,10 ng的DNA模板,补足去离子水使总体积达到50 μL,PCR扩增产物由上海桑尼生物科技有限公司进行纯化和测序.
1.4真菌YW1代谢产物的提取分离
YW1菌株活化后,用PDA液体培养基,28℃、160 r/min避光振荡培养5 d,15 L发酵液用纱布过滤,滤液减压浓缩5倍后,按体积比1∶1用石油醚萃取3次;菌体按1∶1的体积比加入丙酮,超声2 h,减压浓缩除去丙酮,菌体按体积比1∶1用石油醚加热回流3次,合并石油醚萃取物,40℃真空减压浓缩得到浸膏0.14 g.将石油醚处理后的菌液与菌丝,用乙酸乙酯同法处理,得到乙酸乙酯部位的浸膏1.5 g.
石油醚部位浸膏经Sephadex LH-20柱层析(φ2.5 cm × 150 cm)分离,TLC检测合并得3个组分(Fr.1~Fr.3);Fr.1(90 mg)组分碘化铋钾显橙黄色,采用制备型高效液相直接进样进行分离,采用流动相梯度洗脱(90%水∶10%乙睛→0%水∶100%乙睛,20 min,流速9.0 mL/min,水相含0.1%三氟乙酸,检测波长254 nm),得到化合物1(41.0 mg). 乙酸乙酯部位浸膏经Sephadex LH-20柱层析分离,TLC检测合并得4个组分(Fr.1~Fr.4), Fr.2(134 mg)组分碘化铋钾显橙黄色,静置溶剂挥发后析出玫瑰红色的针状结晶,再采用制备型高效液相直接进样进行分离,流动相梯度洗脱(条件同上,仅水相含0.2%三氟乙酸不同),得到化合物4(21.2 mg)、化合物5(26.5 mg); Fr.3(110 mg)采用制备薄层(二氯甲烷∶甲醇∶甲酸=100∶5∶0.1)分离纯化得到化合物2(6.1 mg)和3(8.5 mg).
1.5化合物抗菌活性的测定
将冰箱保存的菌种用MH平板将其活化,接种到MH肉汤液体培养基,37℃、180 r/min恒温摇床培养4 h, 用0.9%生理盐水稀释200倍作为实验菌液.
将化合物用甲醇超声溶解,用生理盐水稀释至30 μg/mL,控制甲醇的浓度低于50%,再用0.45 μm滤膜过滤,滤液为待测样品溶液.
取200 μL上述菌液,均匀涂布于MH平板上,用灭菌打孔器在培养基上打直径5 mm的孔,每孔加50 μL样品液,每样品设3个复孔,将加样后的平板置于培养箱中,在37℃恒温培养16 h,然后测定抑菌圈的大小,计算抑菌圈的平均值.
1.6MTT法测试化合物的抗肝癌活性
方法[5]取对数生长期HepG2、Hep3B、L-O2等3种细胞株, 调节细胞浓度为5×104个/mL,每孔0.2 mL接种至96孔培养板,继续培养24 h后,每孔添加含待测样品的RPMI 1640培养液0.1 mL,使样品浓度分别为10、20、40、100、2 002 g/mL,每浓度设3复孔,同时设空白对照、阴性对照和五氟尿嘧啶阳性对照,培养24 h、48 h后分别换液1次,培养72 h后,加入5 mg/mL的MTT 202 L继续培养4 h后,吸去培养液,每孔加入0.15 mL DMSO,振摇30 min,充分溶解细胞内生成的紫色甲臜结晶,于550 nm下测定每孔的A值,以下列公式计算化合物对细胞的生长抑制率:
生长抑制率=[1-(实验组A值-空白组A值)/(对照组A值-空白组A值)]×100%. 按文献[6]计算半数抑制浓度(IC50).
2结果与分析
2.1真菌YW1菌株的形态特征与鉴定
菌落在PDA培养基上,菌丝最初白色质密,菌落呈突起絮状,菌丝体具有条纹,呈绒毛状,浅粉色至肉色,并带有紫色,密被气生菌丝(图2),菌落背面为红色. PDA培养基插片培养显微镜观察,可见大量大型分生孢子无色、多胞、镰刀形、略弯曲、两端细胞稍尖(图3). 少数厚垣孢子淡黄色,近球形,表面光滑间生或顶生于孢子梗上. 菌落与孢子的形态特征与Boothcs镰刀菌分类鉴定标准基本一致.
YW1菌株ITS序列的GeneBank登录号为KX262999. 在GenBank数据库中进行BLAST(http: //www. ncbi. nlm. nih. gov / blast /Blast. cgi) 分析,在GenBank数据库中获得ITS rDNA 序列与YW1菌株相近的菌株,计算YW1菌株与相近菌株的ITS序列的核苷酸差异值,以此进行最大同源性排序,采用Neighbor-joining法基于rDNA ITS序列构建与本菌株相近真菌种属的系统发生树(图3). 经序列同源性比对分析,YW1菌株的rDNA ITS序列与Fusariumoxysporumisolate SPS-03 KM250373.1、Fusariumoxysporumstrain YuZhu1 KU512835.1菌株的序列同源性均为100%. 根据菌落形态与5.8S ITS rDNA序列分析的结果,YW1菌株可鉴定为尖孢镰刀菌(Fusariumoxysporum).

图1 YW1菌株在PDA平板上的菌落形态(左:菌落正面;右:菌落背面)Fig.1 Colony morphology of fungus YW1 on the PDA culture medium(Left: Colony front; Right: Back of the colony)
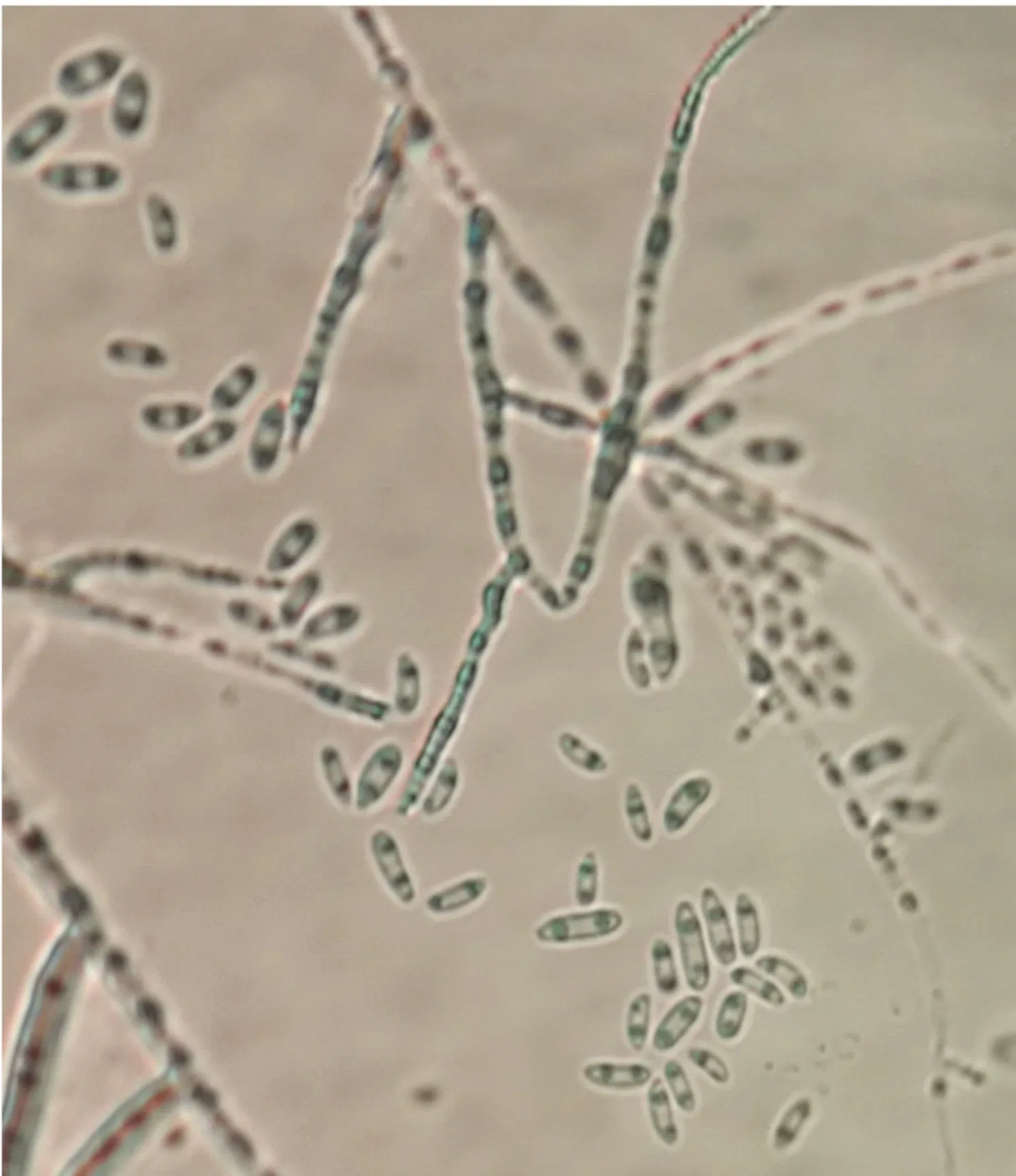
图2 YW1菌株分生孢子的形态Fig.2 conidium morphology of fungus YW1

图3 YW1菌株基于rDNA ITS序列的系统进化树Fig.3 Phylogenetic tree of fungus YW1 based on rDNA ITS sequence
2.2化合物结构鉴定
化合物1:白色针状结晶;ESIMSm/z: 784 [M+H]+;1H NMR (CDCl3, 500 MHz)δH: 7.13~7.26 (5H, m), 5.44 (1H, dd,J=11.1, 4.1 Hz), 4.92 (1H, d,J=8.6 Hz), 3.35 (1H, dd,J=14.6, 5.0 Hz), 2.97 (3H, s), 2.96 (1H, dd,J=14.6, 11.8 Hz), 2.01 (1H, m), 0.77 (3H, d,J=6.7 Hz), 0.43 (3H, d,J=6.8 Hz);13C NMR (CDCl3, 125 MHz)δC: 173.0 (C-1), 57.9 (C-2), 35.4 (C-3), 138.0 (C-4), 129.7 (C-5,9), 129.8 (C-6,8), 128.0 (C-7), 31.2 (C-10), 170.9 (C-11), 77.2 (C-12), 32.2 (C-13), 19.0 (C-14), 17.3 (C-15). 其波谱数据与文献报道的化合物一致[7],故鉴定化合物1为白僵菌素(beauvericin).
化合物2:无色油状物;ESIMSm/z: 117 [M+H]+;1H NMR (CDCl3, 500 MHz)δH:2.77 (2H, t,J=6.4 Hz), 2.54 (2H, t,J=6.4 Hz), 2.20 (3H, s);13C NMR (CDCl3, 125MHz)δC:175.1 (C-1), 27.4 (C-2), 37.4 (C-3), 208.4 (C-4), 29.7 (C-5). 其波谱数据与文献报道的化合物一致[8],故鉴定化合物2为4-氧代-乙酰丙酸(4-oxopentanoic acid).
化合物3:无色固体;ESIMSm/z: 144 [M+H]+;1H NMR (CD3OD, 500 MHz)δH:3.14 (2H, t,J=7.0 Hz), 2.52 (2H, t,J=7.2 Hz), 2.13 (3H, d,J=3.2 Hz), 1.92 (3H, d,J=3.3 Hz), 1.72 (2H, t,J=7.1 Hz);13C NMR (CDCl3, 125 MHz)δC:21.1 (C-1), 172.0 (C-2), 38.3 (C-4), 23.1 (C-5), 39.9 (C-6), 209.6 (C-7), 28.4 (C-8). 其波谱数据与文献报道的化合物一致[9],故鉴定化合物3为N-(4-氧代戊基)-乙酰胺(N-(4-oxopentyl)-acetamide).
化合物4:无色结晶;ESIMSm/z: 180 [M+H]+;1H NMR (CDCl3, 300 MHz)δH: 8.66 (1H, d,J=2.5 Hz), 8.18 (1H, d,J=8.0 Hz), 7.79 (1H,dd,J=8.0, 2.0 Hz), 2.75 (2H, t,J=7.5 Hz), 1.66 (2H, m,J=7.5 Hz), 1.38 (2H, m,J=7.5 Hz), 0.94 (3H, t,J=7.5 Hz, );13C NMR (CDCl3, 125 MHz)δC: 145.4 (C-2), 124.7 (C-3), 138.4 (C-4), 142.9 (C-5), 148.0 (C-6), 32.7 (C-7), 32.1 (C-8), 21.9 (C-9), 12.7 (C-10), 165.8 (C-11). 其波谱数据与文献报道的化合物一致[10],故鉴定化合物4为5-丁基-2-吡啶羧酸(5-butyl-2-pyridinecarboxylic acid).
化合物5:无色结晶;ESIMSm/z: 178 [M+H]+;1H NMR (CDCl3, 300 MHz)δH:8.51 (1H, d,J=1.2 Hz), 8.10 (1H, d,J=7.8 Hz), 7.88 (1H, dd,J=7.8, 1.2 Hz), 5.84 (1H, m), 5.00 (2H, q), 2.84 (2H, t,J=7.5 Hz), 2.43 (2H, q,J=6.6 Hz);13C NMR (CDCl3, 125 MHz)δC:145.5 (C-2), 124.7 (C-3), 138.5 (C-4), 142.0 (C-5), 148.2 (C-6), 31.7 (C-7), 34.4 (C-8), 136.7 (C-9), 116.0 (C-10), 165.7 (C-11). 其波谱数据与文献报道的化合物一致[10],故鉴定化合物5为5-丁烯-2-吡啶羧酸(5-butylene-2-pyridinecarboxylic acid).
化合物的结构式如图4所示.
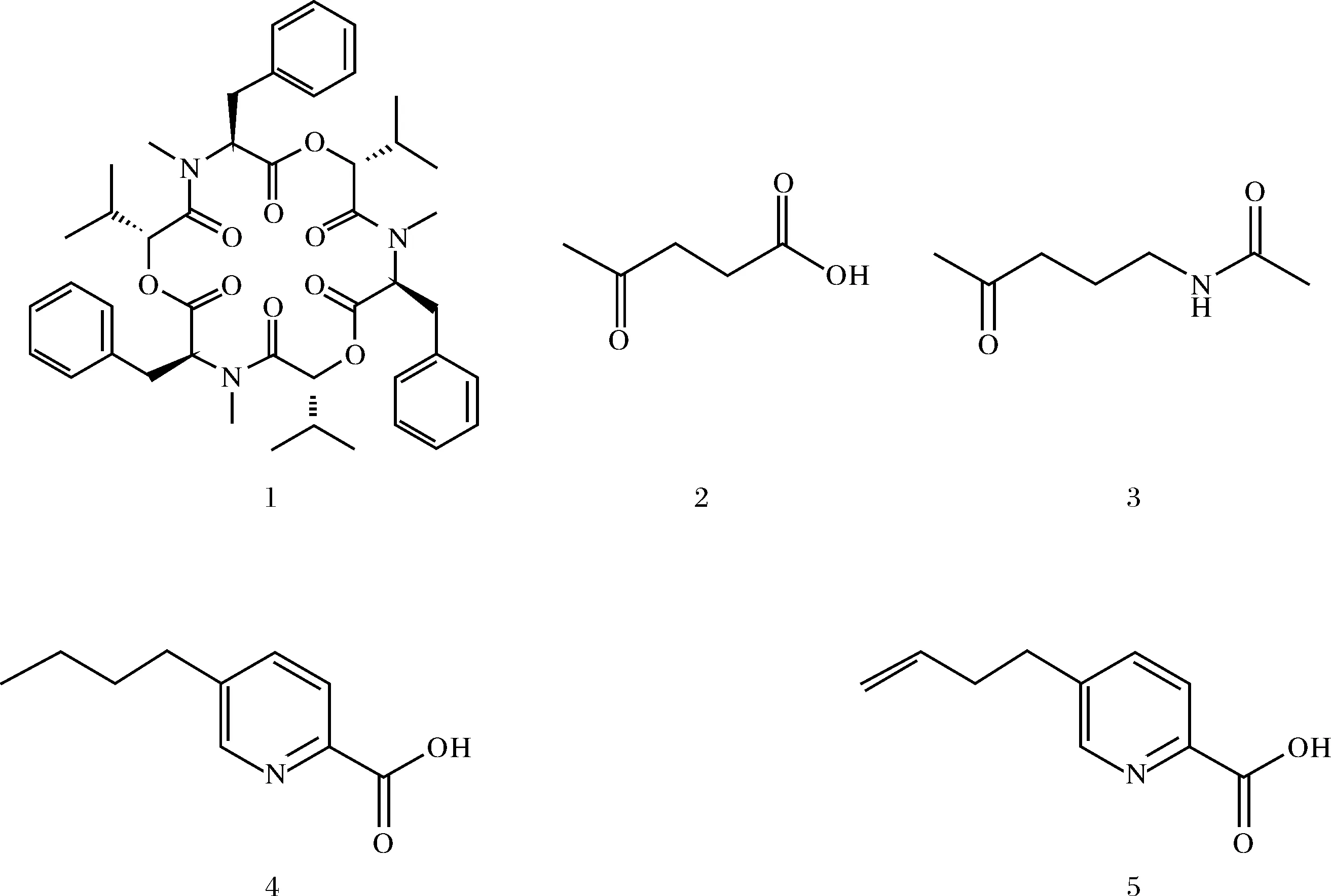
图4 化合物1~5的化学结构式Fig.4 Chemical structures of compounds 1~5
2.3化合物的抑菌与细胞毒活性
抗菌活性测定结果表明:化合物1(白僵菌素)对金黄色葡萄球菌、大肠杆菌均有较强的抗菌活性,30 μg/mL的化合物1对金黄色葡萄球菌、大肠杆菌抑菌圈直径分别为1.8 cm、1.5 cm.
MTT法测定结果(如表1)显示,化合物1、4、5对HepG2和Hep3B两个细胞株均显示弱的抗癌活性,其抗肝癌活性IC50值范围在65.3~120.5 μg/mL之间,但对正常LO2细胞毒性很小.

表1 化合物1~5细胞毒活性结果(IC50, μg/mL; mean ± SD, n=3)
a5-氟尿嘧啶作为阳性对照.
3结果与讨论
尖孢镰刀菌(Fusariumoxysporum)是一类既可侵染植物又可在土壤内生存的兼性寄生真菌.和其它植物病原菌一样,存在着种下分化,可侵染许多植物寄主,具有多种专化型[11].有研究报道从银杏、黄山石杉、椴树、粉背薯蓣、重阳木、长梗黄精中分离到尖孢镰刀菌[12].本研究从鸢尾植株根部分离到该菌尚属首次报道.
本研究首次从鸢尾内生真菌尖孢镰刀菌(Fusariumoxysporum)次级代谢产物中提取分离得到白僵菌素,该化合物最早在真菌Beauveriabassiana菌丝体中发现[4],它是脂肽类化合物,具有杀虫、胆甾醇酰基转移酶抑制(与风湿性关节炎、高胆固醇血症相关)、肿瘤细胞毒和引发细胞程序性凋亡等作用[13-14]. 白僵菌素对人体和动植物病原菌也有很强的抗菌活性,且对革兰氏阳性菌和革兰氏阴性菌无选择性[15].目前,国内外研究对白僵菌素的抗菌活性报道较多,可是对其抗菌机制报道较少,课题组将对其抗菌机制进行深入的研究.
参考文献:
[1] BACON C W, WHITE J F . Microbial Endophytes [M]. New York: Marcel Dekker, 2000: 3-29.
[2] 刘发贵, 邓艾平, 杨 进. 山蛩虫(SpirobolusbungiiBrandt)共生菌SQ12的次生代谢产物研究[J]. 华中师范大学学报(自然科学版), 2013, 47(2): 209-212.
[3] 布 斯. 镰刀属 [M]. 陈其焕, 译. 北京: 农业出版社, 1988:31-37.
[4] GUO L D, HYDE K D, LIEW E C. Detection andtaxonomic placement of endophytic fungi within frond tissues ofLivistonachinensisbased on rDNA sequences [J]. Mol Phylogenet Evol, 2001, 20 (1): 1-13.
[5] 杨新洲, 吕静南, 徐 婵, 等. 鬼箭锦鸡儿细胞毒活性成分研究[J]. 云南大学学报(自然科学版),2015, 37 (1): 134-139.
[6] SONG P, WANG Q, LV J N, et al. HPLC-based Activity profiling of Anti-hepatocellular crcinoma constituents from the Tibetan medicine,Caraganatibetica[J]. J Huazhong Univ Sci Tech Med Sci, 2015, 35 (3): 450-455.
[7] HAMILL R L, HIGGENS C E, BOAZ H E, et al. The structure of beauvericin, a new desipeptide antibiotic toxic to Artemia salina [J]. Tetrahedron Lett, 1969, 10(49): 4255-4258.
[8] PAJU A, KANGER T, PEHK T. Asymmetric oxidation of 3-alkyl-1,2-cyclopentanediones [J]. Tetrahedron: Asymmetry, 2003, 14: 1565-1573.
[9] NENAJDENKO V G, ZAKURDAEV E P, PRUSOV E V. Convenient synthesis of melatonin analogues: 2- and 3-substituted-N-acetylindolylalkylamines [J]. Tetrahedron, 2004, 60: 11719-11724.
[10] RENSLO A, DANHEISER R L. Synthesis of substituted pyridines via regiocontrolled [4+2] cycloadditions of oximinosulfonates [J]. J Org Chem, 1998, 63: 7840-7850.
[11] 朱育菁, 车建美. 尖孢镰刀菌的生长特性 [J]. 中国农学通报, 2007, 23 (8): 373-376.
[12] 孙 勇, 缪 倩, 孙 颖. 6种植物中内生镰刀菌的分离和鉴定[J]. 江苏农业科学, 2010(5): 437-439.
[13] LOGRIECO A, MORETTI A, CASTELLA G. Beauvericin production byFusariumspecies[J]. Appl Environ Microbiol, 1998, 64 (8): 3084.
[14] TOMODA H, NISHIDA H, HUANG X. New cyclode-pepsipeptides, enniantins D, E and F production byFusariumsp. FO-1305 [J]. J Antibiotics, 1992, 45(8): 1207.
[15] WANG Q G, XU L J. Beauvericin, a bioactive compound produced by fungi: a short review [J]. Molecules, 2012, 17: 2367-2377.
Study on isolation and taxonomy determination of the endophytic fungusFusariumoxysporumYW1 fromIristectorumand its secondary metabolites
HUANG Qijia, WU Min, HUANG Yuying, LIAO Maochuan,YANG Guangzhong, LIN Qinxiong, YANG Xinzhou
(College of Pharmacy, South-Central University for Nationalities, Wuhan 430074)
To identify endophytic fungi YW1 strains fromIristectorumand determine its active metabolites, the fungus YW1 was classificated asFusariumoxysporumbased on morphological features and its sequence. Five alkaloid compounds were isolated from the its fermentation broth by thin layer chromatography, Sephadex LH-20 gel column chromatography and preparative HPLC, and elucidated as beauvericin (1), 4-oxopentanoic acid (2), N-(4-oxopentyl)-acetamide (3), 5-butyl-2-pyridinecarboxylic acid (4), and 5-butylene-2-pyridinecarboxylic acid (5) by means of MS and NMR. The results of biological activity assay showed that compound 1 had strong antibacterial activities against Staphylococcus aureus and Escherichia coli, and compounds 1, 4 and 5 exhibited weak cytotoxic activities against HepG2 and Hep3B cell withIC50range of 65.3~120.5 μg/mL.
Iristectorum; endophytic fungi;Fusariumoxysporum; antibacterial activity; cytotoxic activity
2016-05-28.
国家自然科学基金项目(81573561,31560010).
1000-1190(2016)06-0880-06
Q819
A
*通讯联系人. 林亲雄,E-mail: linqinxiong@mail.scuec.edu.cn; 杨新洲, E-mail: xzyang@mail.scuec.edu.cn.

