山东省药品批发企业实施新版GSP认证检查中的缺陷项目分析
王 芳,冉大强,林晓明(山东省食品药品监督管理局审评认证中心,济南 250014)
山东省药品批发企业实施新版GSP认证检查中的缺陷项目分析
王 芳*,冉大强,林晓明#(山东省食品药品监督管理局审评认证中心,济南 250014)
目的:为山东省药品批发企业适应新版《药品经营质量管理规范》(GSP)的要求提供参考。方法:以2015年3-12月山东省完成新版GSP认证的160家(共177家/次)药品批发企业为研究对象,根据《GSP现场检查指导原则》(简称《指导原则》)所列15章节、258项条款,按照严重缺陷项目(6项)、主要缺陷项目(107项)、一般缺陷项目(145项)分为3类,统计各章节中3类缺陷项目出现的内容与频次,以及超过10%的企业出现的某项缺陷项目(高频缺陷项目)的内容与频次;从客观条件和主观因素两个方面分析主要缺陷项目和高频缺陷项目的成因,并提出防范措施。结果与结论:共发现缺陷项目120项,累计1 494频次,包括严重缺陷项目0项、0频次,主要缺陷项目5项、5频次,一般缺陷项目115项、1 489频次,多集中在设施与设备、质量管理体系文件、储存与养护、人员培训4个章节,分别达225、218、168、159频次;高频缺陷项目29项,累计999频次,均为一般缺陷项目。在5项主要缺陷和29项高频缺陷项目中,因客观条件(如企业硬件不足)造成的有5项、146频次;因主观因素(如企业人员对GSP的认识不足等)造成的有29项、853频次。对于因客观条件造成的缺陷,建议药品批发企业各岗位人员在工作中应及时发现问题,并反馈给企业管理层;对于因主观因素造成的缺陷,建议药品批发企业主要负责人应提高质量意识、重视质量管理专业人才、提升工作人员的专业素养。
山东省;药品经营质量管理规范;缺陷项目;防范措施
分别由国家卫生和计划生育委员会与国家食品药品监督管理总局(CFDA)于2013、2015年发布并实施的《药品经营质量管理规范》(GSP)(统称“新版GSP”),是我国药品流通监管政策的一次较大调整,对进一步加强药品经营管理和确保民众用药安全、有效具有重要的意义[1],也符合现代药品流通的特点,体现了药品市场监管的新模式。新版GSP对我国药品经营企业的软、硬件标准提出了更高的要求,规范了企业的经营行为。为了强化药品流通监管,指导GSP认证企业的现场检查工作,CFDA曾于2014年制定了《GSP现场检查指导原则》(简称《指导原则》),规定药品批发企业共涉及检查项目258项,包括严重缺陷项目6项、主要缺陷项目107项、一般缺陷项目145项[2]。CFDA要求,在2015年12月31日前,所有药品经营企业无论其经营许可证或GSP认证证书是否到期,都必须达到新版GSP的要求;从2016年1月1日起,未达到要求的企业将不得继续从事药品经营活动[3]。为了更为合理地实施药品批发企业的GSP认证工作,山东省申请新版GSP认证企业的现场检查由山东省食品药品监督管理局审评认证中心负责组织实施。本文汇总分析了2015年3-12月由山东省食品药品监督管理局审评认证中心组织检查的160家(共177家/次)药品批发企业出现的严重缺陷项目、主要缺陷项目和一般缺陷项目的数量与频次,以及检查中发现的超过10%的企业出现的某项缺陷项目(即高频缺陷项目,可视为企业存在的共性问题),并提出防范措施,为山东省药品批发企业适应新版GSP的要求提供参考。
1 资料与方法
1.1 资料来源
以2015年3-12月山东省食品药品监督管理局审评认证中心组织安排的实施新版GSP认证检查的160家(共177家/次)药品批发企业为研究对象,认证范围涵盖山东省的济南、青岛、菏泽等17个地、市。根据《GSP实施细则》对企业规模的定义,160家企业包括大型(年药品销售额超过20 000万元,如华润山东医药有限公司)、中型(年药品销售额达5 000万元~ 20 000万元,如山东九州坤泰医药有限公司)、小型(年药品销售额5 000万元以下,如平邑永胜药业有限公司)企业。
1.2 调查方法
《指导原则》规定,药品批发企业的检查项目分为15个章节、258项,分别为总则(2项)、质量管理体系(11项)、机构和质量管理职责(24项)、人员与培训(26项)、质量管理体系文件(20项)、设施与设备(32项)、校准与验证(9项)、计算机系统(8项)、采购(17项)、收货与验收(29项)、储存与养护(34项)、销售(8项)、出库(13项)、运输与配送(17项)、售后管理(8项)等。《指导原则》中的各项条款均由5位数字代码组成,其代码与GSP中的具体条款相对应。举例来说,《指导原则》中的02601项条款,与GSP第26条相对应(该条款的内容为培训内容,具体包括相关法律法规、药品专业知识及技能、质量管理制度、职责及岗位操作规程)。
山东省食品药品监督管理局审评认证中心派出的检查组依据相关法律法规对申请GSP认证的企业进行现场检查。检查中进行记录,完成检查作业;并最终以检查组为单位,形成书面检查报告和不合格项目情况表,反馈给审评认证中心。本文根据检查组反馈的情况,对检查中的缺陷项目进行汇总,统计出各章节出现的严重缺陷项目、主要缺陷项目和一般缺陷项目的内容与频次以及高频缺陷项目的内容与频次。
2 结果与分析
2.1 缺陷项目的内容与频次
本次收集的缺陷项目的内容与频次统计见表1。
由表1可见,177家/次检查共发现了120项缺陷项目,累计1 494频次。其中,严重缺陷项目0项、0频次,主要缺陷项目5项、5频次,一般缺陷项目115项、1 489频次。缺陷项目多集中在设施与设备、质量管理体系文件、储存与养护、人员与培训4个章节,分别达225、218、168、159频次。
2.2 主要缺陷项目和高频缺陷项目的内容与频次
《指导原则》规定:严重缺陷项目、主要缺陷项目和一般缺陷项目的数量将直接影响GSP的认证结果。由于此次检查中未发现严重缺陷项目,故笔者重点对主要缺陷项目和高频缺陷项目进行统计分析。在177家/次药品批发企业的现场检查中,主要缺陷项目有5条,每条缺项仅出现1次,占比较低,故文中所指的高频缺陷项目均为一般缺陷项目。根据主要缺陷项目和高频缺陷项目的具体内容,笔者将其分为由客观条件造成和主观因素造成这两种情况。前者主要是由于企业硬件不足造成的;后者主要是由于企业人员对GSP的认识不足及制度上的不足造成的。主要缺陷项目和高频缺陷项目的内容与频次统计见表2(注:表中“*”为主要缺陷项目)。
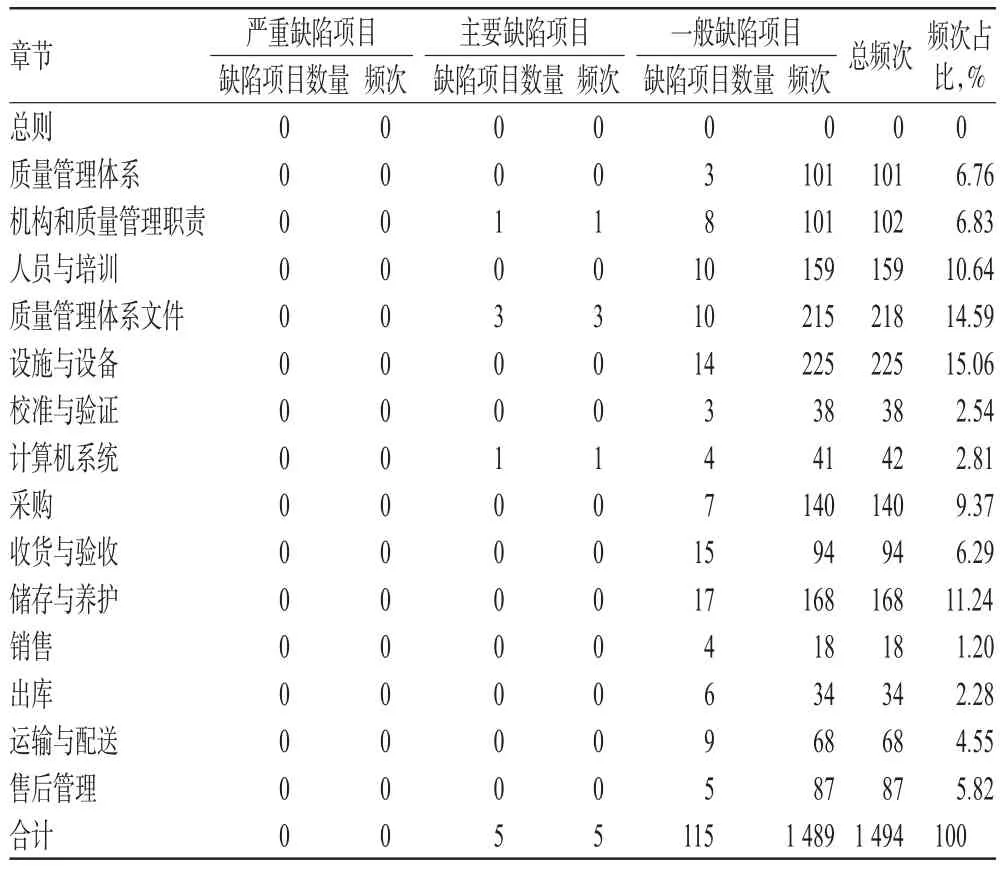
表1 缺陷项目的内容与频次统计Tab 1 Contents and frequencies of defective items
由表2可知,5项主要缺陷项目分别出现过1次,且均由主观条件造成;高频缺陷项目共有29项、999频次,其中由客观条件造成的有5项、146频次,由主观因素造成的有29项、853频次。
3 讨论
新版GSP认证全面提升了药品批发企业的软、硬件标准。在硬件方面,要求企业全面实施计算机管理、仓储温湿度全程实时监控、全方位配备冷链物流设施设备等;在软件方面,强调人员培训、质量管理体系的建立和完善、质量管理文件的建立等。经调查表明,山东省药品批发企业在硬件方面存在的问题不多,但也偶有不足,如库房支持系统正常运行的服务器和终端机数量不足(表2中的05801条款)。出现的缺陷项目多集中在人员、制度、文件、记录等软件方面,表明质量管理人员对新版GSP的理解不全面,因此将其归入主观因素。如表2中的01001条款,企业未对药品流通过程中的质量风险进行评估。又如01101条款,按照条款中的规定,企业应当对药品供货单位、购货单位的质量管理体系进行评价,确认其质量保证能力和质量信誉,必要时进行实地考察。在检查中发现,多数企业都能够提供供货单位、购货单位的资质证明文件、质量保证协议,但没有对其供货单位、购货单位进行定期的回顾性评审和动态管理。如表2中的03001条款,规定直接接触药品岗位的人员应当进行岗前及年度健康检查,并建立健康档案。但在检查中发现,有的企业员工的健康档案不全,究其原因,多数为企业行政人员对于健康档案归档不及时导致。又如表2中的05201条款,没有定期维护设施设备和建立记录,虽然此项是设施与设备章节的条款,但究其原因是设备管理员的失职,故应归于主观因素造成的缺陷。下面具体对造成主要缺陷项目和高频缺陷项目的原因进行分析。

表2 主要缺陷项目和高频缺陷项目的内容与频次统计Tab 2 Contents and frequencies of important items and high-frequency items
3.1 针对客观条件造成的缺陷及防范措施
针对表2中因客观条件出现的缺陷,如储运岗位着装不符合劳动保护的要求(02902条款);库房内墙渗水、地面不平整、门窗结构不严密(04603条款);库房未配备避光、通风、防潮、防虫、防鼠设备(04702条款);库房未配有零货拣选、拼箱发货、复核作业区和设备(04706条款);库房支持系统正常运行的服务器和终端机数量不足(05801条款)等。笔者认为,结合GSP的具体规定,所有药品批发企业应当采取以下防范措施:首先,企业应组织公司各岗位人员尤其是库房工作人员深入学习《指导原则》中的258项条款,掌握每项条款的细节,内审时逐条进行排查,对涉及本人工作岗位的条款内容必须清楚明确;其次,各岗位人员应尽职尽责,采取自查的方式,对自己岗位上发现的问题、缺少的设施设备及时反映给企业管理层,并尽早解决。
3.2 针对主观因素造成的缺陷及防范措施
3.2.1 因企业主要负责人质量意识淡薄造成的缺陷 目前,我国药品批发企业的法人、负责人大多为非药学专业出身,笔者认为存在“外行领导内行”的情况。不少企业将GSP认证看成是一种负担,抱着“1次检查通过,5年垄断市场”的心态,应付认证检查工作。企业领导层的质量责任缺位,由销售人员来指挥质量,质量管理部门形同虚设,GSP执行不到位,导致药品质量管理存在安全隐患[4]。
在目前的形势下,各省级食品药品监督管理局对药品批发企业的“飞行检查”逐渐常态化。笔者认为,药品批发企业的负责人必须及时转变思想,将实施GSP看作是促进企业发展的良好契机,通过强化质量管理推动企业持续、稳定地发展。企业应该知晓,通过实施新版GSP,有很多未按照GSP的要求经营与整改的企业已被淘汰[5]。如果企业负责人的眼光依旧短浅,只关注短期的经济效益,那么下一个被淘汰的有可能是自己。药品监管部门应逐步推进以企业负责人为药品质量第一责任人的制度,让企业负责人深刻意识到药品质量的重要性,将药品安全意识贯穿到药品经营活动的各个环节。企业和药品监管部门应共同努力,规范我国药品经营市场环境,为我国民众用药安全提供强有力的保障。
3.2.2 因企业质量管理人员认识上的不足造成的缺陷 调查发现,部分质量管理人员对相关法律法规理解不到位,导致GSP落不到实处。如01703条款,对供货单位、购货单位、品种、人员资质的审核。在检查中发现,山东省不少企业未对审核内容的变化进行动态管理。如发生业务往来的人员已发生变化,但企业尚未索要新的业务人员授权书以及资质证明等。某些质量管理人员工作态度消极,在制定企业文件时用类似的文件进行复制、修改,使用内容未经仔细审查与校对的文件。在实际的企业经营中无法按照相关规范进行操作,管理与文件内容脱节而不能得到正确的实施或完善[6]。如01702条款,质量管理部门应当组织制定质量管理体系文件,并指导、监督文件的执行。但在检查中发现,某些企业的质量管理体系文件与实际并不相符。企业经营范围不包括中药材、中药饮片,但在各岗位的操作规程中均体现了这方面的相关操作规程。如01704条款,质量管理部门对于质量信息的收集不全面,导致药品质量档案建立不完善。
作为质量管理人员,应不断提升自己的专业水平和质量意识,摆正自己在企业质量管理工作中的位置,对企业、民众安全用药负责。首先,质量管理人员应认识到药品质量工作的重要性,意识到租赁执业药师证的风险,坚决杜绝挂靠行为,不给企业租证的机会。当然,政府也应从法律层面明确执业药师的社会地位、责任和权利[7]。其次,企业之间要相互交流与学习,多参加行业协会、高校、药监系统举办的从业人员培训教育。再次,质量管理人员应努力提高自身素质,深入学习法律法规,提高主观能动性,充分意识到质量管理工作的重要性,增强责任感和事业心。最后,监管部门进行监督、检查时,应重点检查质量管理部门行使职能和履行管理职责情况、管理制度执行情况、内审情况[8],促使企业重视质量管理工作,使质量管理人员在每次的监督检查中发现不足,从而提升业务水平。
3.2.3 因企业工作人员专业水平偏低造成的缺陷 药品是与人生命安全息息相关的特殊商品,具有较强的专业技术性[9]。而药品经营企业中有很多非药学专业人员,缺乏药学相关知识,企业制定的培训计划与内容未涵盖必要的知识;或企业制定的管理制度、操作规程与实际工作割裂开来;日常培训多为应付,员工不理解相关规定中的内容;员工自身工作不负责任,未按规定开展工作。如03501条款,各岗位应获得与其工作内容相对应的必要文件,并严格按照规定开展工作。但在实际检查中发现,质量管理部门已将操作规程下发至个人,但员工并未好好保管,甚至将其丢失;或者为图省事,根本不按照操作规程开展工作。
对于企业工作人员专业水平偏低这一事实,笔者认为可采取以下措施:首先企业应加强培训,培训内容应涵盖相关法律法规、药品专业知识及技能、质量管理制度、职责及岗位操作规程[10]。同时,也要强化一般岗位工作人员的责任意识,可采取追责等制度,将责任落实到个人。另外,在新版GSP中引入国际标准化组织ISO9000系列标准,以防质量管理体系文件与执行完全分割开来[11]。在监管层面,监管人员在检查时不要拘泥于查看培训记录、笔记等,可要求企业人员进行实地操作,检查培训的实际效果,以敦促各岗位人员认真学习该岗位的工作内容。
4 结语
新版GSP修订伊始,就明确了“全面推进一项管理手段(实施企业计算机管理信息系统)、强化两个重点环节(药品购销渠道和仓储温湿度控制)、突破三个难点问题(票据管理、冷链管理和药品运输)”的修订目标[12]。从实际检查情况来看,山东省各药品批发企业基本能够满足新版GSP修订目标中关于硬件的要求,但在质量管理体系建设等软件方面还存在不足。为了使企业更加符合GSP的要求,更长远地发展,管理者还需提高自觉、自律意识,诚信经营,加强员工培训,培养其工作积极性,充分发挥每个岗位人员对药品质量的把控,全员参与质量管理工作。
[1] 国家食品药品监督管理局.新修订《药品经营质量管理规范》发布会[EB/OL].(2013-02-19)[2016-01-18].http:// www.sda.gov.cn/WS01/CL0849/78468.html.
[2] 国家食品药品监督管理总局.关于印发药品经营质量管理规范现场检查指导原则的通知[S].2014-02-25.
[3] 国家食品药品监督管理总局.关于贯彻实施新修订《药品经营质量管理规范》的通知[S].2013-06-25.
[4] 洪钢.后GSP时代药品经营企业质量体系缺陷与监管对策[J].中国药事,2010,24(11):1 043.
[5] 冯变玲,彭丽蓉,傅斌烽.GSP认证后药品经营企业发展趋势探讨[J].中国药房,2006,17(10):797.
[6] 董凤欣.《药品经营质量管理规范》认证后药品经营企业管理中存在的问题[J].中国药物经济学,2014(9):188.
[7] 宋丽丽,李阳杰.浅谈我国政府推动执业药师制度改革的举措与效果[J].中国药事,2014,28(11):1 196.
[8] 苏永梅,涂敏,吴雪龙,等.药品批发及零售连锁企业GSP认证跟踪检查结果的统计分析与对策[J].今日药学,2010,20(2):51.
[9] 孙桂杰.加强药品经营企业GSP认证后监管的问题与对策[J].中国药物经济学,2014(6):19.
[10] 国家食品药品监督管理总局.药品经营质量管理规范[S]. 2015-07-01.
[11] 郑洋洋,董志,夏永鹏.重庆市药品经营企业新版GSP实施情况调查[J].中国药房,2014,25(41):3 857.
[12] 国家食品药品监督管理总局高级研修学院.药品经营质量管理规范(2012年修订)实战教程[M].北京:中国人口出版社,2014:2.
(编辑:杨小军)
Defective Item Analysis in the Implementation of the New-version Good Supply Practice Certification in Pharmaceutical Wholesale Enterprises in Shandong Province
WANG Fang,RAN Daqiang,LIN Xiaoming(Center for Evaluation and Certification,Shandong Food and Drug Administration,Jinan 250014,China)
OBJECTIVE:To provide reference in the adaptation of the new-version Good Supply Practice(GSP)in pharmaceutical wholesale enterprises in Shandong province.METHODS:The research sample was got by 160(total 177 times)pharmaceutical wholesale enterprises which completed for the GSP certification in Shandong Province from Mar.to Dec.in 2015.According to the 15 chapters,258 items were classified serious items(6 items),important items(107 items),general items(145 items)in GSP Site Inspection Guidelines(hereinafter referred to as Guidelines),a summary was conducted for the contents and the frequencies of the items in each chapter,and one defective item(high-frequency item)in more than 10%enterprises;the reasons of important defective items and high-frequency items were analyzed in aspects of objective conditions and subjective factors,then preventative measures were presented.RESULTS&CONCLUSIONS:Totally 120 defective items were found,involving 1 494 times,including 0 serious item(0 times),5 important items(5 times),115 general items(1 489 times),mostly concentrated in facility and equipment(225 times),quality management system document(218 times),storage and conversation(168 times)and staff training(159 times),and 29 high-frequency items(999 times),which were general items.In the 5 important and 29 high-frequency items,there were 5(146 times)caused by objective conditions(such as lack of hardware);and 29(853 times)caused by subjective factors.To solve the defective items caused by objective conditions(such as staff insufficient understanding for GSP),it is suggested that staff in pharmaceutical wholesale enterprises should find the problems,and give their feedback to management in time;to solve the defective items caused by subjective factors,it is suggested that enterprises’leaders should increase their quality awareness,emphasize talents of quality management,and upgrade employees’attainment.
Shandong province;Good Supply Practice;Defective items;Preventative measure
R95
A
1001-0408(2016)34-4760-04
2016-02-17
2016-06-02)
*主管中药师。研究方向:药品经营质量管理。电话:0531-88592834。E-mail:wangfang_051@163.com
#通信作者:主管药师。研究方向:药品经营质量管理。电话:0531-88562363。E-mail:linxiaoming@sdfda.gov.cn
DOI 10.6039/j.issn.1001-0408.2016.34.03
——山东省济宁市老年大学之歌

