植物鲜样中游离氨基酸提取方法的比较
李 梅, 刘金华, 楼兵干, 高其康,
(浙江大学 a.农生环分析测试中心; b.昆虫科学研究所; c.生物技术研究所,浙江 杭州 310058)
植物鲜样中游离氨基酸提取方法的比较
李 梅a, 刘金华b, 楼兵干c, 高其康a,b
(浙江大学 a.农生环分析测试中心; b.昆虫科学研究所; c.生物技术研究所,浙江 杭州 310058)

为了对比不同提取液、温度、时间和纯化试剂对植物鲜样中各游离氨基酸提取效率的影响,以油菜鲜叶为例进行加标回收试验方法,通过氨基酸分析仪PF柱进行标准方法分析测定。结果表明:4种不同提取剂提取油菜鲜叶中游离氨基酸,水、0.1 mol/L盐酸和5%磺基水杨酸的提取效果都优于80%乙醇,以水提取后的颜色最为清亮,适于氨基酸分析仪直接分析;4 ℃时17种氨基酸平均回收率94.23%,高于80 ℃和100 ℃时的88.4%和87.4%,17种氨基酸平均回收率除缬氨酸外,其余氨基酸从1~24 h没有显著变化;80%乙醇优于5%磺基水杨酸,但两者整体回收率都较未纯化前有所下降。采用优化后的提取方法测定油菜幼苗的游离氨基酸含量,发现能有效筛选出抗逆品种。
植物鲜样; 游离氨基酸; 提取; 纯化
0 引 言
植物中氨基酸主要有两种存在形式,一种以游离态形式存在;另一种以结合态存在于肽和蛋白质中[1]。关注植物中游离氨基酸含量变化,主要有以下两个方面:①对食用口感影响重大的呈味氨基酸和有营养保健、药用价值的非蛋白氨基酸,如牛磺酸、γ-氨基丁酸、茶氨酸等只以游离形式存在;②由于一般植物体内游离氨基酸含量很低,在各种胁迫条件下,如干旱[2]、水分[3]、盐分[4]及重金属[5]等逆境时,游离氨基酸含量尤其脯氨酸会有显著增加,故植物游离氨基酸含量变化是植物抗逆重要生理指标[6]。
现今对植物游离氨基酸提取方法的研究中以干样较多和较为成熟,而在科研实践中植物抗逆生理指标游离氨基酸的测定时,常选用鲜样,这样可避免因干燥过程所带来的干扰,尤其一些在干燥过程中游离氨基酸会有很大变化的植物,如烟草[7-8]、茶叶[9]和菌菇类[10]。干样通常经高温杀青、烘干和粉碎而成,高温过程中蛋白质变性,其蛋白酶的生物活性也丧失,鲜样在研磨成匀浆过程中蛋白质和一些酶类等极易被提出,易造成蛋白质降解导致游离氨基酸含量增加而产生误差。由此可见,鲜样和干样在提取方法上应有所区别。
影响植物中游离氨基酸的提取因素主要由提取剂,提取温度、时间和纯化试剂(主要去除蛋白质)构成。Arnaiz[11]对比不同提取剂(70%甲醇和水)提取花椰菜叶片中游离氨基酸,发现在总量及个别氨基酸表现不一致。对青天葵[12]和鹿药[13]等中草药植物不同提取剂提取试验表明,水提取效果优于不同浓度乙醇。Carpenaruiz[14]对蕃茄叶片总游离氨基酸提取和测定,发现40 ℃时高于100 ℃。提取后以不同纯化方法的试验也表明纯化效果也有所差别,路苹[15]证实用5%磺基水杨酸优于阳离子树脂柱。以上均是植物干样的方法研究,对于植物鲜样其影响游离氨基酸各提取因素的方法鲜有报道,王均鉴等[16]以鲜样为材料做了不同提取剂的对比研究,但对于其他影响因素尚未探讨。本研究利用氨基酸分析仪,选取常用提取剂水、低浓度的盐酸、磺基水杨酸和80%乙醇,及常用去除蛋白质等分析杂质的纯化试剂磺基水杨酸和乙醇[17],通过加标回收试验对比不同提取液、温度、时间和纯化试剂对植物鲜样中各游离氨基酸提取的影响,探讨适于植物鲜样游离氨基酸的样本提取方法。
1 实验部分
1.1 仪器、试剂与材料
日立L- 8900型氨基酸分析仪(日本日立公司) ;天平(德国赛多利斯BS 323S);恒温水浴锅(嘉兴市中新医疗仪器有限公司,DKS-12);高通量组织研磨器(宁波新芝生物科技股份有限公司, SCIENTZ-48);离心机(艾本德5424R);光照培养箱(上海博讯实业有限公司医疗设备厂);纯水仪(上海优普UPR超纯水系统)。
柠檬酸、柠檬酸锂、氯化锂、氢氧化锂(日本和光公司);无水乙醇(优级纯,上海国药);丙二醇甲醚(进口分装,上海国药) ;醋酸钠;茚三酮;苯甲醇;冰醋酸;磺基水杨酸(分析纯、上海国药) 。标样:Type H、Type B、Type AN-Ⅱ氨基酸混标( 日本和光纯)。
缓冲液和反应液的配制:按照L-8900型氨基酸分析仪操作手册上的配方进行配制。
印度梨形孢培养和油菜幼苗的印度梨形孢定殖参照陈佑源等的方法[18]。实验选取经病原菌侵染的印度梨形孢定殖和对照油菜苗叶片,用研磨仪打成匀浆,选择不同游离氨基酸的提取方法进行提取。
1.2 色谱条件
色谱条件:柱子(#2522SCPF,4.6 mm×60 mm),梯度洗脱,分离柱柱温57 ℃,反应柱柱温135 ℃,缓冲液流速0.35 mL/min,茚三酮流速0.35 mL/min。分析方法:L89-PF4.6*60-2622.met,通道1: 检测波长570 nm;通道2: 检测波长440 nm,进样量20 μL。
1.3 实验步骤
(1) 提取剂对游离氨基酸回收率的影响。选取常用的游离氨基酸提取剂水,0.1 mol/L盐酸,5%磺基水杨酸和80%乙醇。以4种提取剂对标准氨基酸的回收率选择出较佳提取剂。
油菜叶片匀浆若干份,每份0.15 g,一份直接用无离子水定容至1.5 mL,一份加入60 μL标样后再用水定容至1.5 mL,80 ℃水浴30 min后,9 000 r/min离心15 min,取上清液,0.45 μm的水相膜过滤待测。分别用0.1 mol/L的盐酸,5%磺基水杨酸和80%乙醇代替上述中的水进行样品制备。
(2) 提取温度对游离氨基酸回收率的影响。根据上述实验所选出的提取剂,进行不同温度的提取实验,依据回收率选出较佳处理剂。分别用4 ℃,24 h;80 ℃,30 min和100 ℃,30 min进行处理,步骤同上。
(3) 提取时间对游离氨基酸回收率的影响。根据上述实验所选出的提取剂和温度等参数,进行不同时间的提取实验,依据回收率选出较佳处理剂。分别用1、3、6、12和24 h进行处理,步骤同上。
(4) 不同纯化试剂对游离氨基酸回收率的影响。根据上述较佳提取剂、温度和时间等因素,进行提取液纯化试验。选取两种常用除蛋白试剂,磺基水杨酸和乙醇,纯化试剂∶提取液= 1∶1(体积比),经4 ℃过夜后9 000 r/min离心15 min, 取上清液过0.45 μm的水相膜待测。
2 结果与讨论
2.1 提取剂对各游离氨基酸的回收率影响
本研究以4种常见的提取剂对植物鲜样中游离氨基酸的提取效果进行了比较,在仪器线性范围内通过添加标准品,以回收率为指标所测结果如图1所示。由图1可见,①4种不同提取剂的整体回收率:酸性氨基酸>中性氨基酸>碱性氨基酸。②80%乙醇与其他3种提取剂相比,提取效果较差。丝氨酸、脯氨酸、胱氨酸和组氨酸回收率显著低于其他3种提取剂,其中胱氨酸回收率不到40%,精氨酸的回收率偏高。③水、0.1 mol/L盐酸和5%磺基水杨酸对各氨基酸的提取效果整体相当,除了碱性氨基酸(赖氨酸、组氨酸和精氨酸)的回收率偏低外,其余氨基酸回收率均在80%以上。0.1 mol/L盐酸对天冬氨酸回收率低于其他两种提取剂,5%磺基水杨酸对缬氨酸回收率低于其他两种提取剂,同时对胱氨酸回收率高于水和0.1 mol/L盐酸。④4种提取液只有水提取的颜色清亮,适于氨基酸分析仪直接分析。80%乙醇提取液呈现绿色,这是由于乙醇将植物中的叶绿素溶解出来;0.1 mol/L盐酸和5%磺基水杨酸提取液偏粉红色,这是由于在酸性环境下叶绿素又转化为花青素而呈红色。色素[17]的存在一方面影响氨基酸含量的测定,另一方面使分析柱压力升高;用活性炭脱色会吸附芳香族氨基酸而影响其测定。鉴于植物鲜样组织中的色素比较容易被提出,故在此选择水作为提取剂。同时有研究认为,用化学溶剂提取法会在一定程度上诱导植物中有生物活性的成分发生热降解[19-20],而本方法中用水提取则可以很好地避免这一问题。

图1 不同提取剂测定游离氨基酸的回收率(n=5)
2.2 提取温度对游离氨基酸回收率的影响
以水作为提取剂,3个不同温度提取效果回收率测定结果见图2。从图2可以看出:①用80 ℃和100 ℃提取时,其回收率除了赖氨酸、组氨酸和精氨酸回收率较低外,其余氨基酸回收率均在80%以上;谷氨酸的回收率100 ℃时低于80 ℃,胱氨酸的回收率100 ℃高于80 ℃,其余氨基酸两种温度提取回收率无显著差异,可见温度增加到一定程度后对氨基酸提取回收率提高没有明显作用。②4 ℃提取回收率,各氨基酸均在80%以上,与80 ℃和100 ℃相比,3种碱性氨基酸回收率增加显著;酪氨酸回收率4 ℃时显著高于80 ℃和100 ℃;说明低温长时间浸提对于碱性和含苯环的氨基酸回收率的提高是有效的。③17种氨基酸按照出峰顺序(酸性氨基酸-中性氨基酸-碱性氨基酸),前8种氨基酸回收率除了谷氨酸和缬氨酸4 ℃与80 ℃和100 ℃有显著性差异偏低外,其余6种氨基酸无明显差异,且4 ℃除了丙氨酸和缬氨酸,其余6种氨基酸回收率均在90%以上;后9种氨基酸平均回收率除亮氨酸和苯丙氨酸各温度无显著差异,余下7种4 ℃时均显著高于80 ℃和100 ℃。④4 ℃、80 ℃和100 ℃时,17种氨基酸平均回收率分别为94.23%、88.4%和87.4%。结果显示,较低的温度已经能够充分提取样本中的游离氨基酸,而温度过高反而不利于游离氨基酸的提取,这与Carpenaruiz[14]以植物干样所测结果一致。
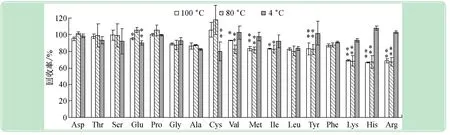
图2 不同提取温度测定游离氨基酸的回收率(n=5)
2.3 提取时间对游离氨基酸回收率的影响
以水为提取剂,在4 ℃时不同提取时间回收率测定结果如图3所示。从图3可以看出:①不同提取时间(1~24 h)下,除了1 h丙氨酸的回收率低于80%,其余均高于80%。不同提取时间下各氨基酸回收率几乎没有显著变化,除了缬氨酸回收率在提取24 h比其他几种处理偏低外。②提取时间为1、3、6、12和24 h时,17种氨基酸平均回收率分别为92.04%、91.35%、94.19%、91.95%和94.23%。不同提取时间结果表明,在4 ℃下1 h就可以比较充分地提取了其中的游离氨基酸,延长时间没有发现游离氨基酸的量明显增加,这与多数游离氨基酸易溶于水的性质相关,而延长时间也没有发现游离氨基酸的量下降的情况,这与氨基酸在4 ℃低温下相对比较稳定不会降解有关。可见对于植物鲜样来说,用水提取游离氨基酸1~24 h都是可以的。
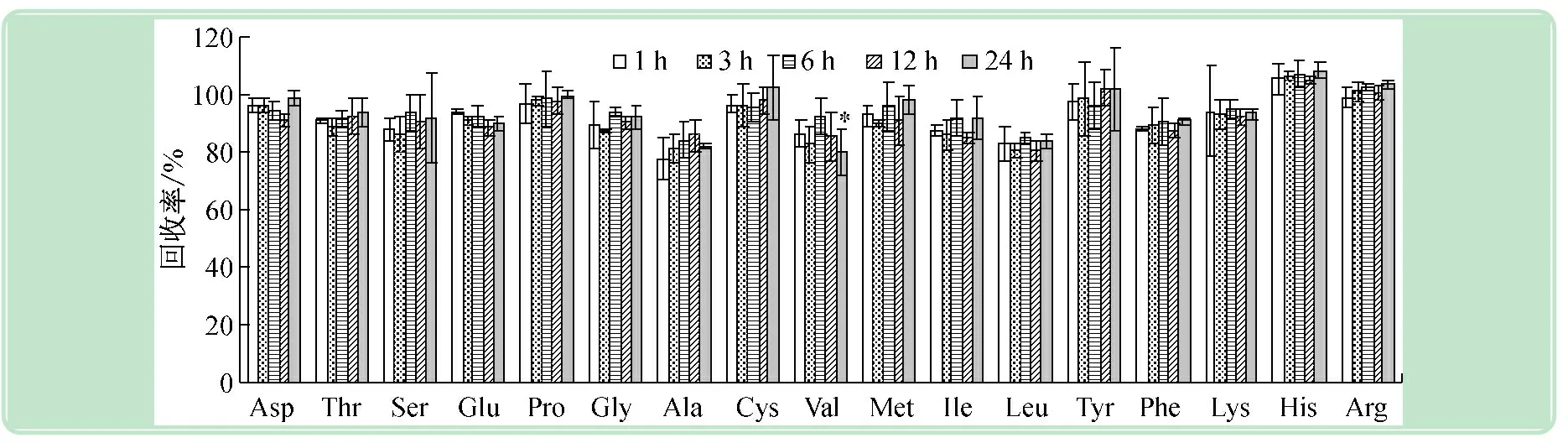
图3 不同提取时间测定游离氨基酸的回收率(n=5)
2.4 不同纯化试剂对游离氨基酸回收率的影响
用4 ℃水浸提后,分别用80%乙醇和5%磺基水杨酸纯化,其添加标样回收率见图4。由图可见:①两种纯化方法与未纯化相比,除谷氨酸和甘氨酸外,其余氨基酸平均回收率均有不同程度下降,这与一般纯化过程对各氨基酸有不同程度的损失相关。在此分析主要由于有机溶剂,酸和碱常会使氨基酸发生脱氨作用或脱羧形成胺类,不是所有的胺类都能和茚三酮发生显色反应,故回收率下降。②纯化过程对17种氨基酸的影响如下:对脯氨酸影响最小;其中谷氨酸和甘氨酸未纯化的回收率比5%磺基水杨酸要高,同时低于80%乙醇,其原因有待进一步查证;对余下14种氨基酸回收率都有显著影响,以丙氨酸、缬氨酸、异亮氨酸和精氨酸的回收率影响最大,其回收率极差值30%~47.5%。③两种纯化试剂以80%乙醇的纯化损失较小。如80%乙醇纯化时,胱氨酸和蛋氨酸的回收率高于5%磺基水杨酸纯化。④17种氨基酸未纯化的平均回收率94.23%,80%乙醇和5%磺基水杨酸纯化后平均回收率分别为81.18% 和75.36%。分析未纯化样品时其分析柱压未见明显上升,对于含蛋白不多的植物鲜样经低温研磨和低温提取后,其蛋白杂质对氨基酸分析影响有限,鉴于纯化过程会造成游离氨基酸的损失,故植物鲜样在无其他影响分析测定的因素外,可用水低温提取后直接上样分析测定结果更准确。
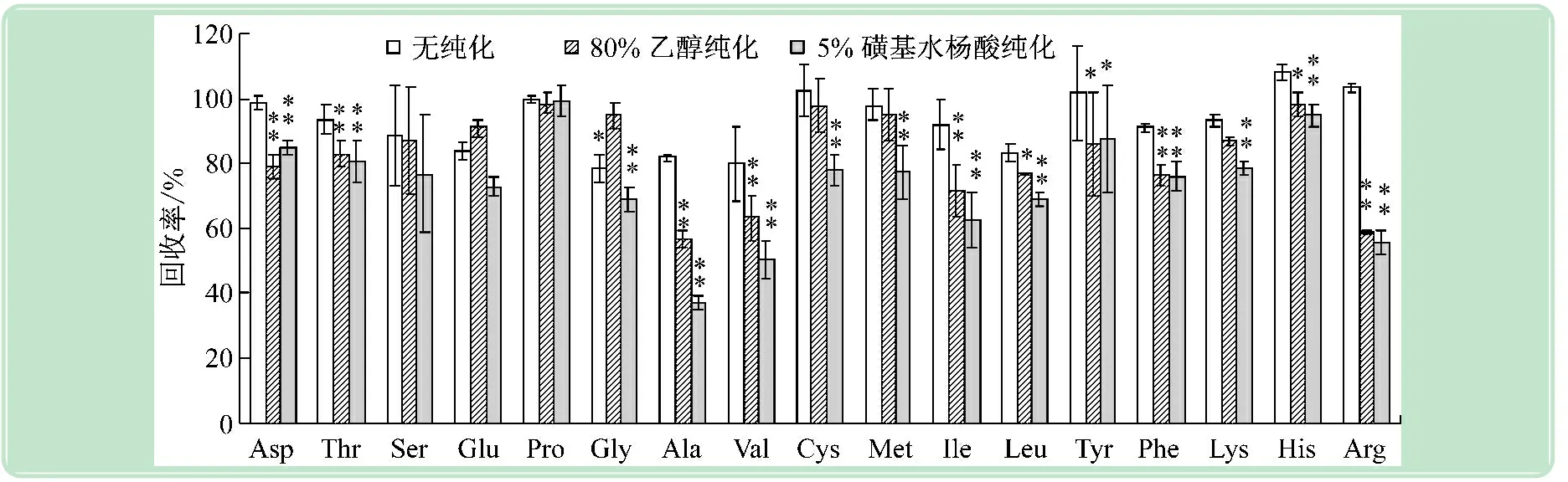
图4 不同纯化方法测定游离氨基酸的回收率(n=5)
2.5 油菜鲜样中游离氨基酸的测定
根据上述分析,选用4 ℃水提取24 h对印度梨形孢定殖处理和对照油菜鲜样中的游离氨基酸分析和测定,对比38种氨基酸标样图谱如图5所示(在此显示第一通道图谱,pro在第二通道检测)。发现油菜中除了含有常见的蛋白氨基酸,还有5种非蛋白氨基酸,另检出3种(图5中1~3)因标样中没有而未知的氨基酸,共定量检出22种游离氨基酸。
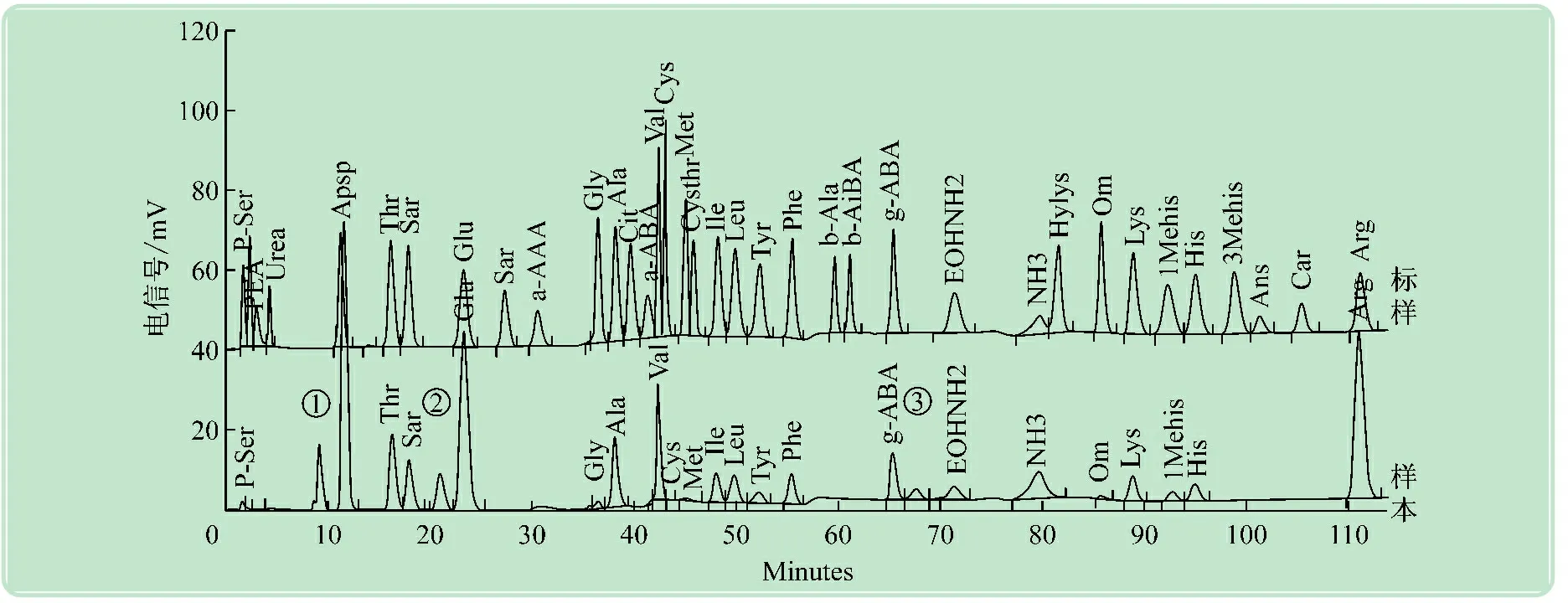
图5 油菜鲜样游离氨基酸和38种标样图谱
对处理和对照油菜鲜样中游离氨基酸含量分析(见表1)表明。经印度梨形孢定殖处理的油菜中脯氨酸含量明显高于对照,是对照的12.7倍。用此方法制备的样品,仪器运行期间压力平稳,峰形及分离度均较好,证实是一个切实可行的适于植物鲜样中游离氨基酸的提取方法。
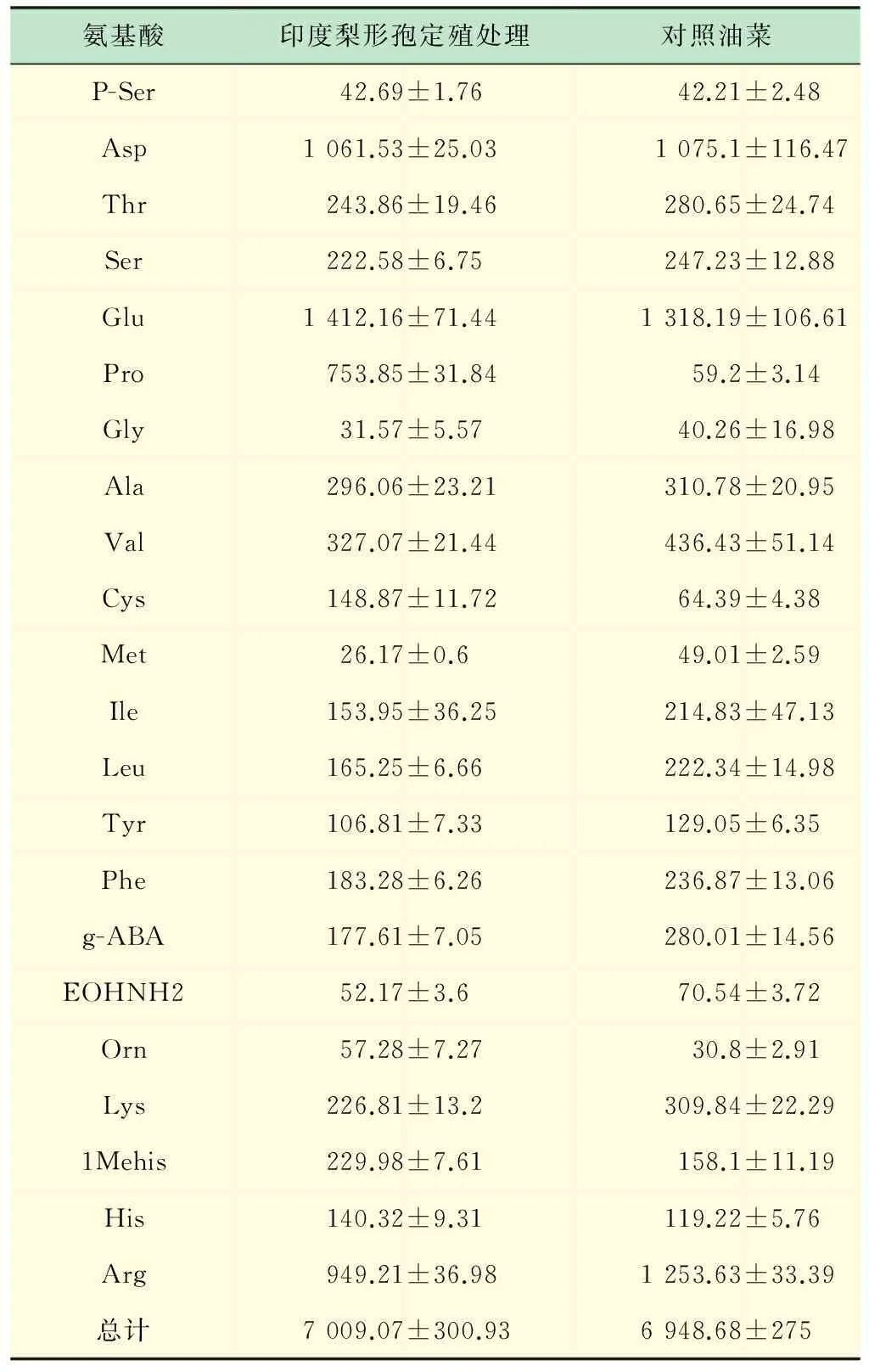
表1 油菜鲜样游离氨基酸含量测定 μg/g
(1) 通过4种不同提取剂对油菜鲜叶中游离氨基酸的提取和测定,发现水、0.1 mol/L盐酸和5%磺基水杨酸的提取效果都优于80%乙醇, 其中80%乙醇、0.1 mol/L盐酸和5%磺基水杨酸3种提取剂提取后的溶液会有色素干扰,只有用水提取后颜色最为清亮,适于氨基酸分析仪直接分析。
(2) 对水提取比较了不同温度的提取效果,4 ℃时17种氨基酸平均回收率94.23%,高于80 ℃和100 ℃时的88.4%和87.4%,同时低温提取能显著提高碱性氨基酸的回收率。故用水提取采用4 ℃是较为合适的。
(3) 用4 ℃水提取不同时间,结果显示除了缬氨酸在24 h的回收率有所下降,其余氨基酸平均回收率从1~24 h没有显著变化。
(4) 对比两种不同纯化试剂(除蛋白)纯化效果,80%乙醇优于5%磺基水杨酸,但两者整体回收率都较未纯化前有所下降。植物鲜样经低温研磨和提取后,其蛋白杂质对氨基酸分析影响有限,可用水4 ℃提取1~24 h后直接上样分析。
(5) 经印度梨形孢定殖的油菜叶片中脯氨酸的含量明显高于对照,为印度梨形孢定殖的油菜为何能提高对病原菌的抗病性提供了科学依据。
[1] 于 泓, 牟世芬. 氨基酸分析方法的研究进展[J]. 分析化学, 2005(3):398-404.
[2] Ahmed I M, Cao F B, Han Y,etal. Differential changes in grain ultrastructure, amylase, protein and amino acid profiles between Tibetan wild and cultivated barleys under drought and salinity alone and combined stress[J]. Food Chemistry,2013,141(3): 2743-2750.
[3] Chung I M, Kim J J, Lim J D,etal. Comparison of resveratrol, SOD activity, phenolic compounds and free amino acids in Rehmannia glutinosa under temperature and water stress[J]. Environmental and Experimental Botany,2006,56(1):44-53.
[4] Yan H, Hu X T, Li F S. Leaf photosynthesis, chlorophyll fluorescence, ion content and free amino acids in Caragana korshinskii Kom exposed to NaCl stress[J]. Acta Physiologiae Plantarum, 2012,34(6):2285-2295.
[5] Wen J F, Gong M, Liu Y,etal. Effect of hydrogen peroxide on growth and activity of some enzymes involved in proline metabolism of sweet corn seedlings under copper stress[J]. Scientia Horticulturae, 2013,164:366-371.
[6] Ashraf M, Foolad M R. Roles of glycine betaine and proline in improving plant abiotic stress resistance[J]. Environmental and Experimental Botany, 2007,59(2):206-216.
[7] Hwang I G, Kim H Y, Woo K S,etal. Biological activities of Maillard reaction products (MRPs) in a sugar-amino acid model system[J]. Food Chemistry, 2011,126(1):221-227.
[8] Yoshida S, Kobayashi K. Role of amino acids in the formation of polycyclic aromatic amines during pyrolysis of tobacco[J]. Journal of Analytical and Applied Pyrolysis, 2013,104:508-513.
[9] Kausar T, Akram K, Kwon J H. Comparative effects of irradiation, fumigation, and storage on the free amino acids and sugar contents of green, black and oolong teas[J]. Radiation Physics and Chemistry, 2013,86:96-101.
[10] Li X B, Feng T, Zhou F,etal. Effects of drying methods on the tasty compounds of Pleurotus eryngii[J]. Food Chemistry, 2015, 166(1):358-364.
[11] Arnaiz E, Bernal J, Martin M T,etal. Supercritical fluid extraction of free amino acids from broccoli leaves[J]. Jouranal of Chromatography A, 2012,1250:49-53.
[12] 吴月娜, 黄 松, 刘 梅, 等. 青天葵中总游离氨基酸的提取工艺研究[J]. 中国中医药信息杂志, 2011(1):53-55.
[13] 朱玉婷, 刘俊渤, 唐珊珊, 等. 鹿药游离氨基酸提取工艺[J]. 吉林农业大学学报, 2013,35(6):679-683.
[14] Carpenaruiz R, Sopena A, Ramon A M. Extraction of Free Amino-Acids from Tomato Leaves[J]. Plant and Soil, 1989, 119(2): 251-254.
[15] 路 苹, 张林生, 曹 让, 等. 植物游离氨基酸测定中提取剂和纯化方法的研究[J]. 氨基酸杂志, 1991(2):7-11.
[16] 王均鉴, 方建颖. 不同提取介质对植物材料游离氨基酸测定的影响[J]. 植物生理学通讯, 1987(4):50-53.
[17] 刘荣森, 杨虹琦, 黄郁维, 等. 植物中游离氨基酸的提取、纯化及分析方法[J]. 河南科技大学学报(自然科学版), 2007(3):76-79.
[18] 陈佑源, 楼兵干, 高其康, 等. 印度梨形孢诱导油菜抗旱性机理的初步研究[J]. 农业生物技术学报, 2013,21(3):272-281.
[19] Saunders J A, Rosentrater K A. Properties of solvent extracted low-oil corn distillers dried grains with solubles[J]. Biomass & Bioenergy, 2009,33(10):1486-1490.
[20] Vrhovsek U, Rigo A, Tonon D,etal. Quantitation of polyphenols in different apple varieties[J]. Journal of Agricultural and Food Chemistry, 2004,52(21):6532-6538.
·名人名言·
大学的荣誉,不在它的校舍与人数,而在于它一代一代人的质量。
——柯南特
Comparison of Methods for Free Amino Acid Extracted from Fresh Plant Samples
LIMeia,LIUJin-huab,LOUBing-ganc,GAOQi-kanga,b
(a. Analysis Center of Agrobiology and Environmental Sciences; b. Institute of Insect Sciences;c. Institute of Biotechnology, Zhejiang University, Hangzhou 310058, China)
To study the influence of different extraction solvents, temperatures, treatment times and purification reagents on extraction efficiency of the free amino acid from fresh samples, taking rape fresh leaves as samples for standard recovery test, the contents of free amino acid from rape fresh leaves were measured. The test showed that the extraction efficiencies of water, 0.1 mol/L hydrochloric acid and 5% sulfosalicylic acid were all better than that of 80% ethanol. Especially, the color of the plant extract that extracted by water was most clean and suitable for the detection of free amino acids directly. The results of the extraction efficiency of water at different temperatures showed that the average recovery of 17 kinds of amino acid at 4 °C (94.23%) was higher than that at 80 °C (88.4%) and at 100 °C (87.4%). It indicated extraction at low temperature could significantly increase the recovery of basic amino acid. No significant changes in the average recoveries of 17 kinds of amino acid except valine were observed when extracted for different treatment times from 1 h to 24 h at 4 °C. The purification test for the plant extract that was extracted by water showed that the purification efficiency of 80% ethanol was better than that of 5% sulfosalicylic acid, but the recoveries were lower than that before purification. Therefore, the free amino acid extracted by water at 4 °C for 1 h to 24 h should be the optimized extraction method. Especially, using the optimized extraction method for determining free amino acid content, the disease-resistant rape varieties were efficiently selected from different rape varieties. The optimized extraction method was proved to be a simple, convenient and effective method for the detection of free amino acids from fresh plant sample.
fresh plant samples; free amino acids; extraction; purification
2015-06-05
贵州中烟工业有限责任公司科技项目(201216)
李 梅(1984-),女,安徽六安人,实验师,从事色谱类仪器分析测试。Tel.: 0571-88982237; E-mail:limei7251314@zju.edu.cn
高其康(1962-),男, 浙江萧山人,研究员,从事昆虫生理生化与分子生物学研究。
Tel.: 0571-88982237; E-mail: qkgao@zju.edu.cn
Q 331
A
1006-7167(2016)04-0034-05

