糖痹康对糖尿病大鼠坐骨神经p38丝裂素活化蛋白激酶及血浆肿瘤坏死因子-α表达的影响
吕翠岩,张胜容,徐暾海,孙文,赵文景,张竹华,郑桂敏,孟元,王晖,刘铜华
1.首都医科大学附属北京中医医院,北京 100010;2.北京中医药大学,北京 100029
糖痹康对糖尿病大鼠坐骨神经p38丝裂素活化蛋白激酶及血浆肿瘤坏死因子-α表达的影响
吕翠岩1,2,张胜容1,徐暾海2,孙文2,赵文景1,张竹华1,郑桂敏1,孟元1,王晖1,刘铜华2
1.首都医科大学附属北京中医医院,北京 100010;2.北京中医药大学,北京 100029
目的 观察中药复方糖痹康对糖尿病大鼠坐骨神经p38丝裂素活化蛋白激酶(p38 MAPK)及血浆肿瘤坏死因子-α(TNF-α)表达的影响,探讨其神经保护及镇痛机制。方法 SD雄性大鼠60只,随机选取10只为正常组,其余大鼠采用高脂饲料和小剂量链脲佐菌素诱发2型糖尿病大鼠模型。成模后随机分为模型组、甲钴胺组和糖痹康低、中、高剂量组,每组10只。各给药组给予相应药物干预。16周后取大鼠一侧坐骨神经,放免法检测大鼠血浆TNF-α含量;Western blot检测大鼠坐骨神经p38、p-p38 MAPK蛋白表达。结果 与正常组比较,模型组大鼠坐骨神经p38、p-p38蛋白表达及血浆TNF-α含量升高(P<0.05,P<0.01);与模型组比较,各给药组大鼠血浆TNF-α含量和坐骨神经p-p38蛋白表达显著降低(P<0.05,P<0.01),各给药组p38蛋白表达降低,但只有糖痹康高剂量组差异有统计学意义(P<0.05)。结论 糖痹康下调大鼠坐骨神经p38、p-p38 MAPK蛋白表达和血浆TNF-α含量,可能是其糖尿病周围神经病变神经保护及镇痛作用靶点之一。
糖痹康;糖尿病周围神经病变;p38丝裂原活化蛋白激酶;肿瘤坏死因子-α;大鼠
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是由糖尿病导致的周围神经系统病变,特点是由于对称的远端周围神经组织退化,导致其感觉的痛苦和缺失。本实验在前期研究基础上,采用高脂饲料和小剂量链脲佐菌素(STZ)诱发2型糖尿病大鼠模型,观察中药复方糖痹康对模型大鼠坐骨神经p38丝裂素活化蛋白激酶(mitogen activated protein kinase,p38 MAPK)及血浆肿瘤坏死因子-α(TNF-α)表达的影响,探讨其神经保护及镇痛机制。
1 实验材料
1.1 动物
6周龄SPF级SD雄性大鼠60只,体质量(160± 10)g。许可证号SCXK(京)2004-0009,北京维通利华动物实验中心。北京中医药大学实验动物中心饲养,温度(23±2)℃,湿度(55±10)%,光照12 h,噪音<60 dB,自由摄食饮水,分笼喂养。
1.2 药物与饲料
糖痹康由黄芪、女贞子、桂枝、黄芩、黄连等组成,饮片由北京中医药大学中药学院提供;甲钴胺片,卫材(中国)药业有限公司制造,批号111109A。高脂饲料,北京华阜康生物科技有限公司。
1.3 主要试剂与仪器
TNF-α放射免疫试剂盒(北京华力特生物技术研究所),p38、p-p38为兔来源的单克隆抗体(美国CST公司),辣根过氧化物酶标记山羊抗兔IgG、山羊抗小鼠IgG(北京中杉金桥生物技术有限公司)。硝酸纤维素膜(德国Millipore),稳压稳流电泳仪、垂直电泳槽、半干转电转印仪(美国Bio-Rad),电子天平Sartouris(德国BS224S),紫外分光光度计eppendorf(德国Biophotometer)。
2 实验方法
2.1 造模与分组
大鼠适应性喂养1周,随机选取10只为正常组,普通饲料喂养。其余喂高脂饲料,8周后参考文献[1]造模,予STZ 35 μg/g腹腔内注射。72 h后检测尾尖血血糖,血糖水平≥16.7 mmol/L为造模成功。成模大鼠随机分为模型组、甲钴胺组和糖痹康低、中、高剂量组,每组10只。
2.2 给药
血糖稳定3 d后开始灌胃给药。糖痹康低、中、高剂量组分别按成人剂量5、10、20倍给药,分别为4.175、8.35、16.7 g原药材/(g·d),均换算成糖痹康为3 mL灌胃;甲钴胺组按成人剂量10倍给药,即1.97 mg/(g·d), 用蒸馏水配成混悬液3 mL灌胃;空白组和模型组给予等量生理盐水。实验期间大鼠自由饮食饮水,连续16周。
2.3 指标检测
2.3.1 肿瘤坏死因子-α含量检测 给药16周后,大鼠10%水合氯醛0.4 mL/100 g腹腔注射麻醉,腹主动脉采血2 mL,置于预冷的含7.5% EDTA 30 μL和抑肽酶40 μL无菌采血管中混匀,-4 ℃、3000 r/min离心10 min,分离血浆,放入-80 ℃冰箱备用。采用放免法检测血浆TNF-α含量,按试剂盒说明书操作。
2.3.2 p38丝裂素活化蛋白激酶蛋白表达检测 给药16周后,按350 mg/100 g剂量10%水合氯醛腹腔注射麻醉,取4 cm左右大鼠坐骨神经置于冻存管,迅速投入液氮中保存。Western-blot检测p38 MAPK蛋白表达。从液氮中取出部分组织研磨,经组织裂解液裂解后上样电泳,初始电压80 V,待溴酚蓝染料前缘进入分离胶上缘后提高电压至100 V,直至溴酚蓝泳出分离胶下缘结束电泳。采用半干电转移仪在PVDF膜上进行蛋白质电转移,恒流30 mA,持续90 min。取出PVDF膜用5%TBST脱脂奶粉封闭,室温振荡60 min。封闭结束后,用TBS-T漂洗液洗10 min×3次,将膜移入杂交袋中,加用漂洗液稀释的抗体(p38、p-p38均为1∶1000),封口,4 ℃孵育过夜;再用TBST漂洗液洗10 min×3次,加漂洗液稀释的辣根过氧化物酶标记二抗(p38、p-p38均为1∶1000),37 ℃振荡60 min。将PVDF膜置ECL显色液中于室温下振荡温育5 min,于暗室中曝光、显影、定影。清水冲洗后,晾干保存,扫描,使用IPP软件对扫描图像的目的条带进行灰度分析。
3 统计学方法
采用SPSS16.0统计软件进行分析。实验数据以—x±s表示,组间比较采用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 糖痹康对模型大鼠血浆肿瘤坏死因子-α的影响
与正常组比较,模型组大鼠血浆TNF-α含量显著升高(P<0.01);与模型组比较,各给药组大鼠血浆TNF-α含量显著降低(P<0.01)。结果见表1。
4.2 糖痹康对模型大鼠坐骨神经p38丝裂素活化蛋白激酶表达的影响
与正常组比较,模型组大鼠坐骨神经p38、p-p38蛋白表达升高(P<0.05,P<0.01);与模型组比较,各给药组p-p38蛋白表达降低(P<0.05,P<0.01),各给药组p38蛋白表达降低,但只有糖痹康高剂量组差异有统计学意义(P<0.05)。结果见表2、图1。
表1 各组大鼠血浆TNF-α含量比较(±s,ng/mL)
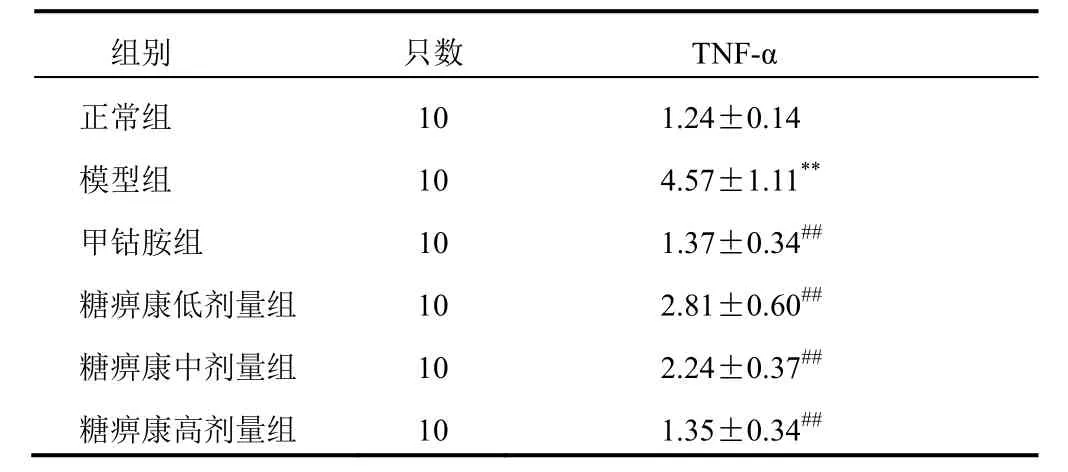
表1 各组大鼠血浆TNF-α含量比较(±s,ng/mL)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01
组别 只数 TNF-α正常组 10 1.24±0.14模型组 10 4.57±1.11**甲钴胺组 10 1.37±0.34##糖痹康低剂量组 10 2.81±0.60##糖痹康中剂量组 10 2.24±0.37##糖痹康高剂量组 10 1.35±0.34##
表2 各组大鼠坐骨神经p38和p-p38 MAPK蛋白表达比较(±s)

表2 各组大鼠坐骨神经p38和p-p38 MAPK蛋白表达比较(±s)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别 n p38 p-p38正常组 3 0.34±0.15 0.22±0.80模型组 3 0.86±0.30*0.76±0.13**甲钴胺组 3 0.76±0.31 0.56±0.64#糖痹康低剂量组 3 0.87±0.21 0.57±0.18#糖痹康中剂量组 3 0.60±0.10 0.39±0.05##糖痹康高剂量组 3 0.46±0.10#0.47±0.10##
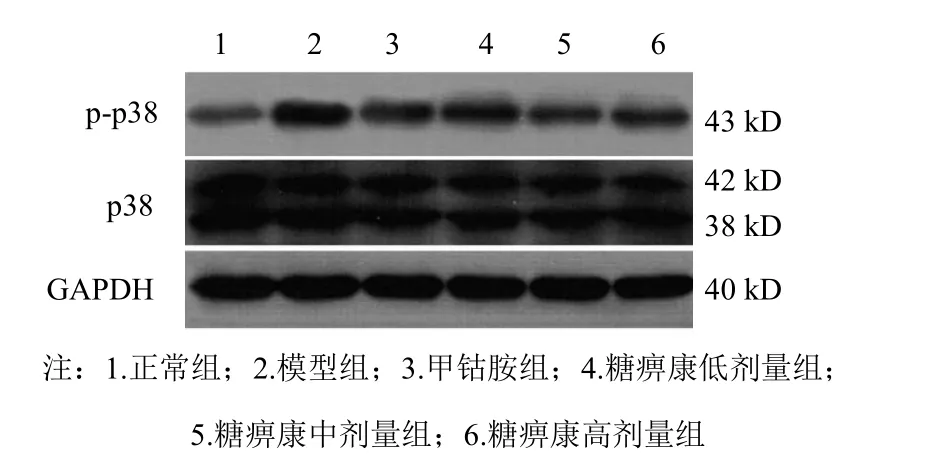
图1 各组大鼠坐骨神经p38和p-p38 MAPK蛋白免疫印迹图
5 讨论
糖痹康组方源自黄芪桂枝五物汤(《金匮要略•血痹虚劳病脉证并治》)。既往实验研究表明,糖痹康可提高STZ诱导的DPN大鼠周围神经传导速度,改善神经病理,提高坐骨神经Na+-K+-ATP酶活性和cAMP、cGMP含量,且存在剂量依赖关系,对DPN有一定的保护作用;改善STZ诱导的DPN大鼠脂质代谢,升高血清超氧化物歧化酶、一氧化氮合成酶、一氧化氮含量,降低丙二醛含量,减轻氧化应激造成的周围神经损害,具有抗氧化应激作用,显著上调DPN大鼠血浆β-内啡肽的表达,具有神经保护作用及镇痛作用[2-6]。
p38 MAPK是MAPK超家族重要成员之一,与DPN关系最密切的成员,是目前研究最多的氧化应激信号转导通路。激活后的MAPK可停留在胞质中,激活其他蛋白酶,使细胞骨架结合蛋白磷酸化;也可经核转位进入细胞核,磷酸化核转录因子,调控基因表达,促进相关蛋白质的合成和通道改变。DPN患者腓肠神经中p38总体水平升高[7]。糖尿病神经病理痛是DPN患者最常见、严重影响患者生活质量的症状之一,同时其发生的信号转导机制目前尚不清楚。研究表明,p38 MAPK在糖尿病神经病理性疼痛中起关键作用[8],同时炎性通路的激活是造成DPN的重要途径之一。TNF-α是一种重要的炎症因子,与DPN的发生发展关系密切。越来越多的资料表明,免疫和炎前介质,尤其TNF-α在外周神经病理性疼痛的发生及维持中起着重要作用[9],其与p38 MAPK之间错综复杂的关系更成为研究的热点之一。实验结果表明,模型组大鼠坐骨神经组织p38、p-p38 MAPK蛋白表达和血浆TNF-α含量较正常组显著升高;糖痹康各剂量组p38、p-p38 MAPK蛋白表达和TNF-α含量较模型组显著降低。由此,我们推测糖痹康可下调糖尿病大鼠坐骨神经p38、p-p38 MAPK蛋白表达和血浆TNF-α含量,可能是其DPN神经保护及镇痛作用靶点之一。
[1]吴晏,韩静,黄黎明,等.高脂喂养合并小剂量链脲佐菌素建立2型糖尿病大鼠模型[J].中国实验动物学报,2012,20(2):11-15.
[2]王佳,刘铜华.糖痹康对糖尿病周围神经病变大鼠坐骨神经传导速度的影响[J].中国中医基础医学杂志,2010,16(3):209-211.
[3]王佳,刘铜华.糖痹康对大鼠糖尿病周围神经病变氧化应激影响的实验研究[J].国际中医中药杂志,2010,32(4):296-298.
[4]吕翠岩,张胜容,赵文景,等.中药复方糖痹康对糖尿病大鼠坐骨神经BDNF蛋白及BDNF mRNA表达的影响[J].中国中医基础医学杂志,2015, 21(2):168-171.
[5]吕翠岩,张胜容,赵文景,等.中药复方糖痹康对糖尿病大鼠坐骨神经NGF、BDNF及NT-3蛋白表达的影响[J].中华中医药杂志,2014,29(12):3946-3949.
[6]吕翠岩,李秋明,毛颖秋,等.糖痹康对糖尿病周围神经病变大鼠血浆β-内啡肽的影响[J].中国中医药信息杂志,2014,21(4):49-52.
[7]PURVES T, MIDDLEMAS A, AGTHONG S, et al. A role form itogen activated protein kinases in the etiology of diabetic neuropathy[J]. FASEB J,2001,15(13):2508-2514.
[8]柯昌斌,黄晓霞,许先成,等.P38MAPK和PI3K/Akt信号通路在大鼠糖尿病神经病理性疼痛中的交互作用[J].中华麻醉学杂志,2010,9(26):701-703.
[9]MOALEM G, TRACEY D J. Immune and inflammatory mechanisms in neuropathic pain[J]. Brain Res Rev,2006,51:240-264.
Effects of Tangbikang on the Expressions of p38 MAPK of Sciatic Nerve and Plasma TNF-α
in Diabetic Rats
LV Cui-yan1,2, ZHANG Sheng-rong1, XU Tun-hai2, SUN Wen2, ZHAO Wen-jing1,
ZHANG Zhu-hua1, ZHENG Gui-min1, MENG Yuan1, WANG Hui1,LIU Tong-hua2(1. Beijing Hospital of Traditional Chinese Medicine, Capital Medical University, Beijing 100010, China; 2. Beijing University of Chinese Medicine, Beijing 100029, China)
Objective To explore the effects of Chinese herbal compound Tangbikang on the expressions of p38 MAPK of sciatic nerve and plasma TNF-α in diabetic rats. Methods Ten of the sixty male SD rats were selected randomly as normal group, and the rest were fed with high-fat diet and low-dosage STZ was used to induce type Ⅱdiabetic rat models. Model rats were randomly divided into model group, mecobalamine group and Tangbikang low-, medium-, and high-dosage groups, 10 rats in each group. Each medication group was intervened with relevant medicine. Rat unilaterals sciatic nerves were taken after 16 weeks. The content of TNF-α in plasma was determined by radioimmunoassay. Western blot method was used to detect the expressions of p38 and p-p38 MAPK protein of sciatic nerve. Results Compared with normal group, the expressions of p38 and p-p38 protein and content of TNF-α in model group significantly increase (P<0.05, P<0.01). Compared with the model group, the expressions of p-p38 protein and the content of TNF-α significantly decreased after medicine intervention in different doses Tangbikang groups and mecobalamin group (P<0.05, P<0.01). The expression of p38 protein in Tangbikang high-dose group significantly decreased (P<0.05), with statistical significance (P<0.05). Conclusion Tangbikang can reduce the expression of p38 and p-p38 MAPK protein of the rat sciatic nerve, and reduce the content of TNF-α protein in rat plasma, which may be one of the effective targets of neuroprotection and abirritation of diabetic peripheral neuropathy.
Tangbikang; diabetic peripheral neuropathy; p38 MAPK; TNF-α; rats
10.3969/j.issn.1005-5304.2016.03.018
R285.5
A
1005-5304(2016)03-0067-03
国家科技重大专项-重大新药创制(2012ZX09102201-001);教育部博士点基金立项课题(20110013130001);北京中医药科技发展资金项目(JJ2015-06);北京中医药大学创新团队项目(2011-CXTD-19)
刘铜华,E-mail:thliu@tom.com
(2015-04-21)
(2015-06-30;编辑:华强)

