木门百合试管鳞茎培养体系的建立
蔡宣梅, 郭文杰, 张 洁, 方少忠
(福建省农科院生物技术研究所, 福建 福州 350003)
木门百合试管鳞茎培养体系的建立
蔡宣梅, 郭文杰*, 张 洁, 方少忠
(福建省农科院生物技术研究所, 福建 福州 350003)
以百合新品种木门(Conca D′or)的种球鳞片为外植体,进行百合试管鳞茎培养体系研究。结果表明:鳞片诱导的最适培养基为MS+0.5 mg·L-1BA+0.1 mg·L-1NAA+0.1 mg·L-12,4-D,其诱导率达到95%;膨大培养最适蔗糖浓度为50-70 g·L-1;采用分切膨大后的试管鳞茎的鳞片进行增殖培养,平均增殖倍数为7.2;移栽成活率达98%以上。
木门百合; 试管鳞茎; 膨大培养
百合(Liliumspp.)是世界著名的五大切花之一,也是一种应用广泛的球根花卉,它的花形花色各异,清雅脱俗,芳香宜人,在国内外市场上需求量很大。近年来OT型百合(东方百合与喇叭百合杂交型)由于花色艳丽,花朵大,抗性好,种植面积迅速扩大,木门是其中备受消费者青睐的品种之一,又称“绝代双骄”,英文名为Conca D′or,其容易栽种,花色金黄,叶片健壮,呈深绿色。目前木门百合种球全部依赖进口,市场价格高。
据报道,利用组织培养的方法进行快速繁殖,具有去病毒、迅速更新品种等优点,在百合组培苗应用上已有许多成功的报道(崔徵,1985;徐文兴,1988)。 木门百合是近年刚流行的鲜切花品种,至今鲜见其相关组织培养的报道(潘正波等,2007)。本研究在离体培养条件下,对木门百合鳞片诱导培养、增殖培养及试管鳞茎的膨大、生根等进行了较系统的研究,旨在为木门百合的快速工厂化繁殖奠定基础。
1 材料与方法
1.1 材料
供试材料选用荷兰进口的OT百合木门种球。
1.2 培养条件
本试验采用的基本培养基是MS培养基,其中琼脂为0.65%,蔗糖为3%,pH为5.8-6.0,培养条件为20-25 ℃,试管鳞茎膨大及生根为暗培养。并添加不同浓度的激素6-BA、NAA 和2,4-D来配制诱导培养基(表1)。
1.3 无菌外植体的获得
选择健康的鳞茎,剪根,剥除外部2-3层鳞片。留下部分用流水冲洗干净,分切鳞片,尽量不损伤鳞茎基盘,挑选无病虫斑的鳞片,用洗衣粉浸泡5-10 min,用刷子轻刷2遍,然后用自来水冲洗干净。在超净工作台上用75%的酒精浸泡30 s,用无菌水洗1次,再用0.1%的升汞消毒13 min,无菌水洗3-4次,将消毒后的鳞片接种在诱导培养基上,以靠近鳞茎基盘部分接触培养基。
1.4 试管鳞茎膨大
小心切下小鳞茎,置于添加不同蔗糖浓度的膨大培养基上,配方为MS+0.4 mg·L-1BA+ 0.04 mg·L-1NAA,蔗糖浓度分别为30、50、70、90 g·L-1。
1.5 测量项目
(1)
(2)
(3)
鳞茎的鲜重:从培养基中取出诱导的小鳞茎,剪去叶片和根,称鲜重。
1.6 统计分析
试验数据采用DPS v14.10软件进行统计分析。
2 结果与分析
2.1 鳞片诱导培养
在暗培养条件下,接种15 d后鳞片下部靠近鳞茎基盘处开始膨大出现白色的突起,然后突起慢慢长大,形成小鳞茎,每个鳞片长1-6个小鳞茎,接种约30 d,逐渐形成完整的小鳞茎(图1)。每个处理接种30个外植体,重复3次。
不同种类、不同浓度激素组合对鳞片诱导的影响见表1,从处理1-4可以看出,当NAA浓度不变时,随着BA浓度的增加,诱导率变化不大,当BA浓度为0.5 mg·L-1时诱导率高于其它浓度,平均每个外植体诱导的再生鳞茎数高于其它浓度;从处理3及5-7可以看出,当BA浓度为0.5 mg·L-1时,随着NAA浓度的增加,诱导率先升高再下降,平均每个外植体诱导的再生鳞茎数变化规律同诱导率;从处理8-11可以看出,当BA浓度为0.5 mg·L-1、NAA浓度为0.1 mg·L-1时,随着2,4-D浓度的增加,诱导率先升高再下降,平均每个外植体诱导的再生鳞茎数变化规律同诱导率。从表1还可以看出,在适当的BA与NAA组合中,有添加2,4-D的诱导率和平均每个外植体诱导的再生鳞茎数都比没添加的组合高。其中处理10诱导率最高,达到95%,平均每个外植体诱导的再生鳞茎数也最多,达到4.5个。
表1 不同种类和浓度激素对鳞片诱导的影响
Table 1 Effect of different kinds and concentrations of plant hormones on induction of bulblet scales
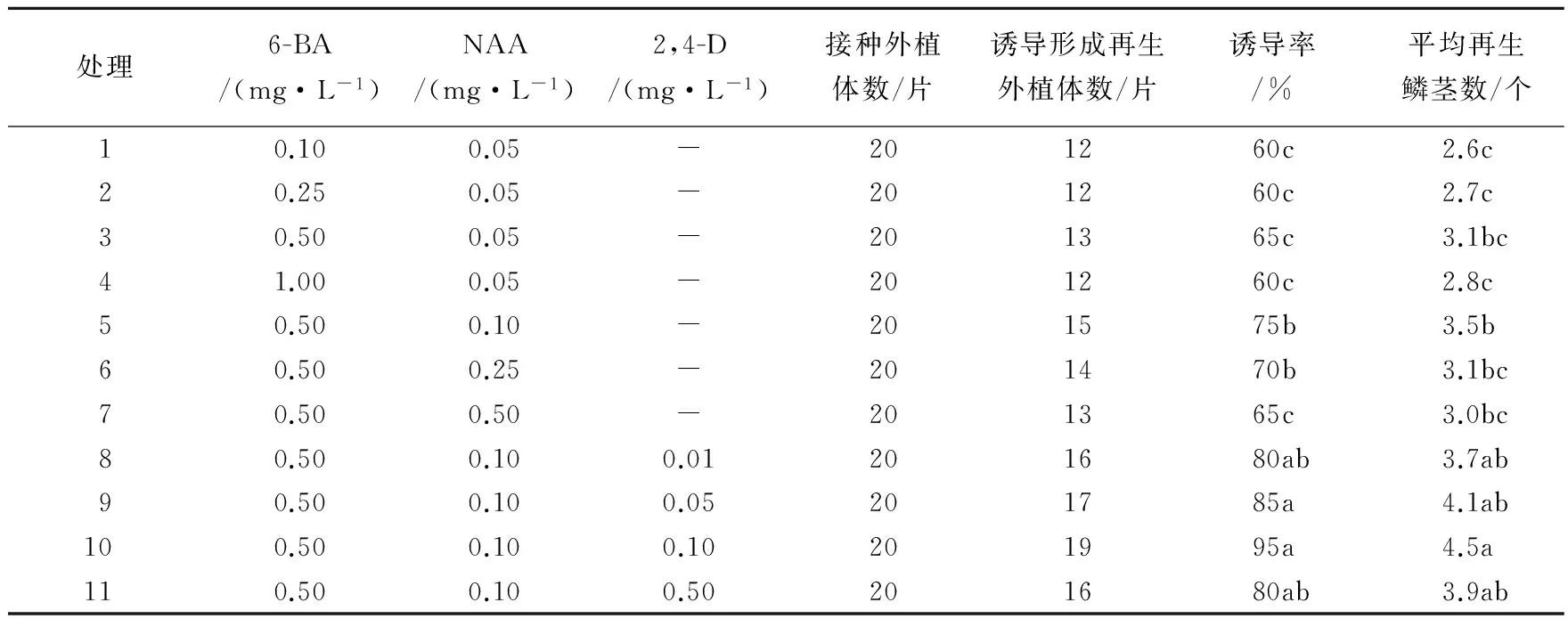
处理6-BA/(mg·L-1)NAA/(mg·L-1)2,4-D/(mg·L-1)接种外植体数/片诱导形成再生外植体数/片诱导率/%平均再生鳞茎数/个10.100.05-201260c2.6c20.250.05-201260c2.7c30.500.05-201365c3.1bc41.000.05-201260c2.8c50.500.10-201575b3.5b60.500.25-201470b3.1bc70.500.50-201365c3.0bc80.500.100.01201680ab3.7ab90.500.100.05201785a4.1ab100.500.100.10201995a4.5a110.500.100.50201680ab3.9ab
2.2 试管鳞茎的膨大
将诱导出来的小鳞茎从母鳞片上切下,接入含有不同蔗糖浓度的膨大培养基中(图2),每个处理接种50瓶,重复3次。由表2可看出,随蔗糖浓度的增加,百合试管鳞茎的鲜重均增加;当蔗糖浓度为90g·L-1时,形成的鳞茎鲜重最大,平均鲜重为1.29 g,是对照的1.68倍,是初始小鳞茎的4.30倍,但是鳞茎会畸形;而当蔗糖浓度为70 g·L-1时,平均鲜重为1.13g,是CK的1.47倍,是初始小鳞茎的3.65倍,鳞茎有轻微畸形;而当蔗糖浓度为50 g·L-1时,试管鳞茎长势正常,平均鲜重是CK的1.27倍。当蔗糖浓度为90g·L-1时,形成的鳞茎鲜重显著高于在蔗糖浓度为50 g·L-1和 CK(30 g·L-1)时形成的鳞茎鲜重,当蔗糖浓度为50 g·L-1时,形成的鳞茎鲜重显著高于CK。
试验结果表明,当培养基中蔗糖的浓度为50-70 g·L-1时,有利于百合试管鳞茎膨大。
表2 蔗糖浓度对百合鳞茎膨大的影响
Table 2 Effect of sucrose concentration on expanding of Lily bulblets

蔗糖浓度/(g·L-1)初始小鳞茎鲜重/g鳞茎培养90d鳞茎鲜重/g膨大倍数30(CK)0.310.77c2.48500.300.98b3.27700.311.13ab3.65900.301.29a4.30


图1 试管鳞茎诱导培养 图2 试管鳞茎膨大培养
Figure 1 Inductive culture of bulblets in tube Figure 2 Expanding culture of bulblets in tube
2.3 增殖培养
把膨大后的试管鳞茎的鳞片切下,转入增殖培养基中进行培养,增殖培养基用最佳的诱导培养基,即0.5 mg·L-1BA+0.1 mg·L-1NAA+0.1 mg·L-12,4-D。培养一个月后,统计增殖倍数。经统计,平均增殖倍数为7.2(图3)。
2.4 生根培养
当试管鳞茎膨大到围径约1 cm时,从膨大培养基中转入到生根培养基中进行生根培养(图4),培养20 d后观察发现,木门百合容易诱导生根,一般的MS培养基添加低浓度的NAA(低于0.2 mg·L-1)即可诱导生根,生根率达到98%以上。
2.5 移栽
待试管鳞茎的根尖冒出时,取出鳞茎,洗去根部的培养基(图5),移栽到草炭和珍珠岩体积比为1∶1混合的基质中,成活率可达98%以上。

图3 试管鳞茎增殖培养 图4 试管鳞茎生根培养 图5 试管鳞茎洗苗Figure 3 Proliferation culture of Figure 4 Rooting culture of Figure 5 Sprout washing of bulblets in tubebulblets in tube bulblets in tube
3 小结与讨论
本研究用木门百合种球的鳞片作外植体,成功地诱导出再生小鳞茎,通过膨大培养,促使再生小鳞茎膨大,再通过分切膨大培养后的再生小鳞茎的鳞片来增殖,增殖倍数可达到7.2,远高于分生鳞茎的数量。
百合组培苗具有去病毒、迅速更新品种等优点,但组培苗在炼苗过程中存活率低,容易重新感染病毒,而通过试管内培养鳞茎,可以克服上述缺点(王爱勤等,1999),但是百合试管鳞茎存在膨大慢、增重率低,新增小球数较少的问题,采用本模式生产百合种苗不仅增殖率高,膨大快,而且炼苗容易,受环境因子影响小,成活率高。
崔徵,桂耀林,1985.经济植物的组织培养与快速繁殖[M].北京:农业出版社.
潘正波,陈丽梅,李昆志,等,2007.木门百合子房组织培养研究[J].广西农业生物科学,26(2):168-170.
王爱勤,何龙飞,周琼,等,1999.百合试管苗的移栽对比试验[J].广西农业生物科学,(3):187-189.
徐文兴,金国良,潘荷娟,1988.百合组织培养两次成苗[J].植物生理学通讯,(3):57-59.
(责任编辑:陈晓雯)
Establishment of tissue culture system of bulblets in tube of Lily Conca D′or
CAI Xuan-Mei, GUO Wen-Jie*, ZHANG Jie, FANG Shao-Zhong
(InstituteofBiotechnology,FujianAcademyofAgriculturalSciences,Fuzhou,Fujian350003,China)
The bulb scales of Lily "Conca D′or" were used as explants to establish the tissue culture system of bulblets in tube. The results showed that the appropriate inductive medium of bulb scales was MS+0.5 mg·L-1BA+0.1 mg·L-1NAA+0.1 mg·L-12,4-D, with 95% induction rate, and 50-70 g·L-1sucrose concentration was appropriate for expanding culture. The bulb scales in tube after split expansion were used to proliferation culture by using the proliferation medium, with 7.2 average multiplication coefficient and 98% transplanting survival rate.
Conca D′or; bulblet in tube; expanding culture
2016-06-14; 发表日期: 2016-10-31
福建省科技厅省属公益类科研院所科研专项“食用百合的引种与利用”(2015R1019-5); 福建省农科院科技创新团队建设项目(CXTD-2-17)。
蔡宣梅(1969-),女,硕士,副研究员。研究方向:园艺植物组织培养及栽培生理。Email:879895274@qq.com。*
S682.2
A
1001-4276-(2016)01-0110-05
蔡宣梅,郭文杰,张洁,等,2016.木门百合试管鳞茎培养体系的建立[J].武夷科学,32:110-114.

