不同热处理对甘蔗蔗茎脱毒效果的影响
武媛丽,王俊刚,蔡文伟,张树珍,杨本鹏
(中国热带农业科学院甘蔗研究中心/中国热带农业科学院热带生物技术研究所/农业部热带作物生物学与遗传资源利用重点实验室,海南 海口 571101)
不同热处理对甘蔗蔗茎脱毒效果的影响
武媛丽,王俊刚,蔡文伟,张树珍,杨本鹏
(中国热带农业科学院甘蔗研究中心/中国热带农业科学院热带生物技术研究所/农业部热带作物生物学与遗传资源利用重点实验室,海南 海口 571101)
为确定甘蔗脱毒的最佳方式,以期为甘蔗脱毒健康种苗的生产提供一条切实可行的途径,将甘蔗蔗茎分别置于不同温度的恒温水浴中进行不同时间的恒温热处理。结果表明:不同热处理对蔗茎处理7 d后,低于52℃的各处理萌芽率均在90%以上,52℃处理30 min以内萌芽率均为60%以上,其余处理蔗茎萌芽率低于30%;当热处理温度高于55℃、58℃和61℃时可以分别获得脱去宿根矮化病(RSD)、花叶病毒(ScMV)和黄叶病毒(ScYLV)的腋芽,但是蔗茎萌芽率低于20%;而在52℃恒温热处理30 min后经过38℃恒温气候箱中培养1周后,蔗芽生长点均未检测出以上3种病原微生物。以此最佳条件,研究了心叶诱导愈伤组织培养、腋芽培养、温水处理种植和恒温热处理结合腋芽分生组织培养4种脱毒方式的脱毒效果,发现心叶诱导愈伤组织培养和恒温热处理结合腋芽分生组织培养脱毒效果最佳,但是继代培养过程中发现,经诱导愈伤组织培养产生的无性系后代中变异个体较多。因此,恒温热处理结合腋芽分生组织培养为甘蔗的最有效的脱毒途径,可以培养出脱毒健康种苗。
热处理;脱毒健康种苗;甘蔗种茎;分生组织培养
甘蔗(Saccharum officinarum L.)是热带、亚热带地区的重要经济作物和糖料作物,同时也是生产乙醇、葡萄糖等原料的能源作物[1]。中国是世界主要产糖国之一,对保障国内食糖供给、促进国民经济发展以及提高人们生活质量都具有重要作用[2]。甘蔗是无性繁殖作物,经过多年宿根栽培后会受到多种病原物的反复侵染,使种性退化,造成甘蔗产量和蔗糖分含量下降。花叶病、黄叶病和宿根矮化病是造成甘蔗品种退化的主要原因,采用普通物理化学方法难以根除,成为甘蔗单产及蔗糖分含量提高的主要制约因素[3]。已有研究表明,顶端分生组织培养对甘蔗波条病、嵌纹病、宿根矮化病、花叶病和白叶病的脱毒效果明显[4];愈伤组织培养对霜霉病、嵌纹病、宿根矮化病和白叶病具有脱除效果[4]。目前,已报道的采用愈伤组织茎尖培养、温水处理、恒温热处理结合分生组织培养对感花叶病和宿根矮化病的植株进行脱毒,均有一定效果[5-6],但仍然缺乏关于甘蔗种茎最佳脱毒方式的系统研究。本研究比较研究了不同热处理温度、热处理时间及不同的新生代植株获取方式对种苗脱毒效果的影响以期找出甘蔗综合脱毒的有效方法,为甘蔗脱毒健康种苗的培育及其产业化繁育提供技术支撑。
1 材料与方法
1.1 试验材料
供试材料选用中国热带农业科学院热带生物技术研究所临高试验基地繁育的新台糖22号常规蔗种。试验处理前检测蔗种是否携带宿根矮化病病原菌(Leifsonia xyli subsp. xyli)、花叶病毒(ScMV、SrMV、ScSMV)和黄叶病毒(ScYLV),并选择带病蔗种进行试验。
1.2 试验方法
1.2.1 甘蔗种茎恒温热处理 将蔗茎粗细大小一致的供试材料砍成单芽茎段,置于46℃、49℃、52℃、55℃、58℃、61℃的恒温水浴中分别浸泡24、27、30、33、36 min(表1),然后将以上材料置于38℃人工气候箱恒温恒湿培养[6],每个处理50个单芽茎段。培养3、7 d后分别观察每个处理蔗芽的生长状态,同时检测蔗芽的病原携带情况。

表1 甘蔗种茎恒温热处理设计
1.2.2 甘蔗新生代植株获取方式 (1)愈伤组织培养。将供试植株的梢部砍下消毒,在无菌条件下继续剥去外叶,留下直径为0.4~0.6 cm的心叶,切成0.5~1 mm厚的薄片,接种于MS+2,4-D 1.5 mg/L+蔗糖30 g/L(pH 5.8)的固体培养基中培养,诱导出愈伤组织,将具有分化能力的愈伤组织(淡黄色、松散)接种于MS+6-BA 2 mg/L+3%蔗糖(pH 5.8)的固体培养基中分化成苗,进行继代培养。选取30个芽段进行试验。
(2)腋芽培养。将直径大小一致的供试植株砍成3~4 cm长的单芽茎段,置于52℃蒸馏水恒温水浴浸泡30 min,期间不断搅拌。取出对外表皮消毒后,接种于起始培养基(MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+PVP 200 mg/L+蔗糖30 g/L)中,于28℃自然散射光下培养10~15 d,待芽萌动长至2~3 cm时,剥取腋芽进行继代培养。选取30个芽段进行试验。
(3)温水处理种植。将直径大小一致的供试植株砍成7~8 cm长的单芽茎段,置于52℃蒸馏水恒温水浴浸泡30 min,期间不断搅拌。热处理后,直接种植于室外花盆中(土壤采自大田)。选取30个芽段进行试验。
(4)热处理结合腋芽分生组织培养(简称“综合脱毒培养”)。将5~6 cm长的单芽茎段置于52℃蒸馏水恒温水浴中,经过30 min热处理后置于38℃人工气候箱中恒温恒湿培养。1周后当芽长至7~8 cm时取出,剥取芽尖1 cm左右,外表皮杀菌消毒后,在超净工作台上剥取生长点0.1~0.2 cm,接种于起始培养基(MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+PVP 200 mg/L+蔗糖30 g/L,pH 5.8)中,于28℃自然散射光下培养40~50 d,期间每隔1~2周更换1次培养基[6],培养成苗后进行继代培养。选取30个芽段进行试验。
1.2.3 甘蔗新生代植株病原检测 使用E. Z. A. N Plant RNA Kit(Omega Biotech Limited,India)试剂盒,按照试剂盒方法提取以上各处理的新生代植株总核酸,提取的总核酸用Revert Aid First Strand cDNA Synthesis Kit(Thermo scientific,USA)试剂盒,按照试剂盒说明书进行反转录,得到cDNA,作为PCR反应的模板。
应用宿根矮化病(Ratoon stunting disease,RSD)病原菌的特异性引物进行常规PCR扩增,应用甘蔗花叶病毒(Sugarcane mosaic virus,ScMV)、高粱花叶病毒(Sorghum mosaic virus,SrMV)、甘蔗线条花叶病毒(Sugarcane streak mosaic virus,ScSMV)和甘蔗黄叶病毒(Sugarcane yellow leaf virus,ScYLV)的特异性引物对反转录产物进行PCR扩增(表2)。PCR结束后,取5 μL产物进行l%琼脂糖凝胶电泳检测。

表2 聚合酶链式反应中的引物及反应条件
2 结果与分析
2.1 不同热处理方式对蔗茎腋芽生长的影响
经过不同恒温热处理后,将蔗茎沿腋芽进行纵切后,其腋芽剖面无明显差异(图1,封二)。处理后3 d,46℃、49℃各处理蔗茎萌芽率在83.3%~100%,52℃各处理蔗茎的发芽率与49℃各处理相比明显下降;52℃热处理27 min和30 min后蔗茎萌芽率达到63.3%,随着热处理时间的增加萌芽率急剧下降,在热处理36 min后萌芽率仅13.3%(表3);55℃及以上各处理的蔗茎萌芽率为0。
从图1(封二)可以看出,处理后3 d,46℃、49℃的全部处理以及52℃热处理27、30、33 min处理萌发的芽经纵剖后发现生长形态与对照无明显差异,但随着处理时间及温度的增加(52℃处理36 min以及55℃、58℃、61℃各处理),与对照形成了明显差异,表现为腋芽不萌发甚至死亡(图1,封二)。
在处理后7 d,46℃各处理蔗芽生长良好,成活率达到100%,芽高在7~8 cm之间;49℃处理24、27、30 min均无死亡个体,而当处理时间达到33 min时开始有个别蔗芽死亡,该温度下蔗茎总体萌芽率达98%、芽高7~8 cm;当处理温度升至52℃时,随着浸种时间的延长,蔗茎萌芽率逐渐降低(表3),当处理时间在27、 30 min时蔗茎萌芽率达66.7%,处理时间超过30 min时萌芽率为26.7%~30.0%,蔗芽生长受到抑制;当处理温度上升至55℃时,萌芽率低于6.7%,所萌生的蔗芽生长停滞;随着处理温度升高至58℃、61℃时,蔗芽全部死亡。
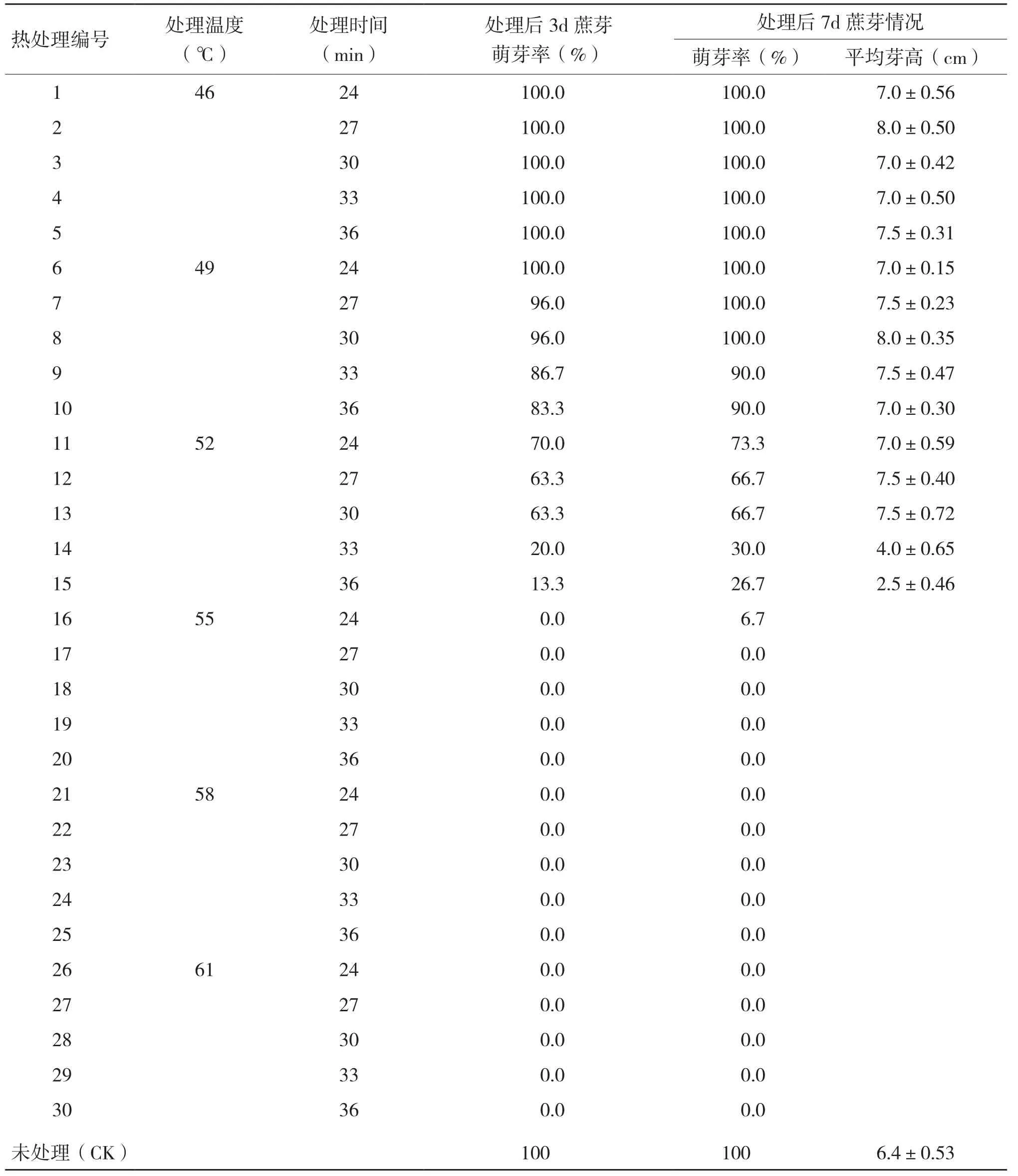
表3 不同热处理方式对蔗茎腋芽生长情况的影响
由图1(封二)可知,处理后7 d,46℃、49℃各处理蔗茎以及52℃处理27、30 min所萌发的蔗芽继续伸长,经纵剖后发现其生长形态与对照无明显差异。52℃33 min处理所萌发的蔗芽再无明显伸长,且与对照的生长形态有明显差异,说明在此条件下蔗芽生长已受到抑制。随着处理时间的延长以及处理温度的提高(52℃36 min以及55℃、58℃、61℃各处理),蔗芽表现为发黑死亡(图1,封二)。
2.2 不同热处理方式对蔗茎腋芽脱毒效果的影响
当热处理温度分别高于55℃、58℃和61℃时,RSD、SrMV和ScYLV在蔗茎腋芽中未检测出(图2)。但是,以上结果表明55℃以上的蔗茎发芽率低于30%。而在热处理后再经1周38℃恒温培养(组合标号为13’~15’),剥离蔗芽的生长点进行检测均未检测出RSD、ScMV和ScYLV,说明在52℃恒温热处理30~36 min后经过38℃恒温气候箱中培养1周后,蔗芽生长点已经达到较好的脱毒效果,而蔗茎萌芽率在52℃恒温热处理33和36min后不足30%,因此,30min为最佳热处理时间。
2.3 不同培养途径获得的新生代蔗苗携带病原菌检测比较
从病原菌检测情况来看,通过心叶愈伤组织诱导培养和综合脱毒培养两种途径获得的新生代植株均未检测出宿根矮化病、高粱花叶病和甘蔗黄叶病病原菌,达到了脱毒目的;而经过腋芽培养和温水处理种植两种途径获得的新生代植株,仍携带有病原菌(图3)。从继代培养情况来看,经愈伤组织诱导培养途径产生的新生代植株存在很大程度的变异(主要表现为白化、继代培养后逐渐死亡),而综合脱毒培养所产生的新生代植株中没有发现变异株(图4,封二)。
3 结论与讨论
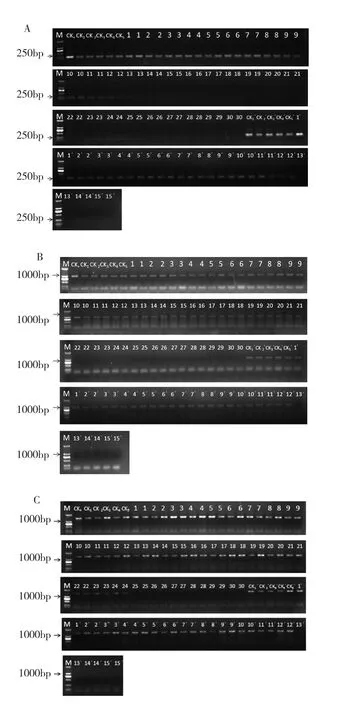
图2 不同热处理方式对蔗茎腋芽脱毒效果的影响
3.1 恒温热处理对甘蔗花叶病有显著的钝化作用
甘蔗花叶病是发生在甘蔗上最普遍、为害最严重的一类病毒[7],其病原至少有甘蔗花叶病毒(ScMV)、高粱花叶病毒(SrMV)、甘蔗线条花叶病毒(ScSMV)[8]3种。本试验对不同热处理温度和时间下蔗茎的脱毒效果进行了比较,同时研究了4种生产上常用的脱毒方法对花叶病病原的脱毒效果,结果发现,在所有供试材料中均检测到SrMV,而未检测出ScMV和ScSMV,因此供试材料感染花叶病的病原为SrMV,这与熊国如等[7]对海南蔗区甘蔗样品的毒源检测和分子鉴定所得到的结果一致。供试材料经4种不同途径获得了新生代植株,发现经愈伤组织诱导培养和综合脱毒培养途径方法所得到的新生代植株中均未检出有SrMV,而通过腋芽培养和温水处理种植两种途径获得的新生代植株均未达到脱毒效果,这可能是因为:经过52℃、30 min的恒温热处理后,并未经过38℃恒温培养使芽快速抽高,而使腋芽在常温下缓慢伸长,导致茎秆中未能脱除的病原由维管束作为介质重新分布于生长的芽中,因此经恒温热处理后直接接种或种植的带芽茎段出芽后检测均为带毒芽;而综合脱毒培养途径可能是由于存在芽中的病毒经恒温热处理后已经钝化[9],通过胞间连丝移动速度相对缓慢,病毒传播的速度远远低于植物细胞的复制速度;茎尖分生组织的维管束尚未形成,无法通过此途径传播病毒[3]。因此,由综合培养脱毒获得的新生代植株可以脱除花叶病毒,SrMV能经多种蚜虫以非持久性方式传播,但田间再侵染不明显,田间发病率主要取决于种苗带毒率[10-11]。
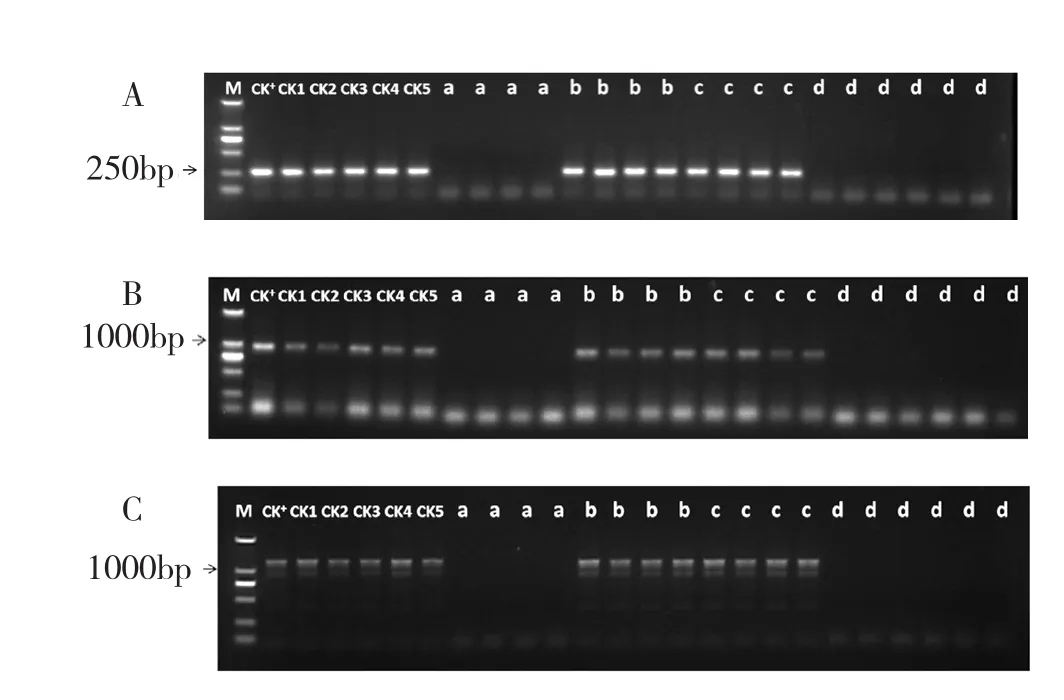
图3 不同培养途径获得的新生代蔗苗携带病原菌检测结果
3.2 快速催芽能获得不带宿根矮化病、黄叶病的甘蔗植株
甘蔗宿根矮化病(Ratoon stunting disease,RSD)由寄居于维管束木质部的革兰氏阳性细菌Leifsonia xyli subsp. xyli(Lxx)引起[12],是造成甘蔗减产的主要病害之一,在全球广泛发生[13]。本研究结果表明,该病菌在经恒温热处理后不能完全脱除,而综合脱毒培养途径能使其快速抽芽,取出茎尖生长点进行无菌培养所得新生代植株检测不到RSD,因此可通过恒温热培养快速催芽来获得不带宿根矮化病的甘蔗新生代植株。
我国于2001年在广西南宁首次发现甘蔗黄叶病(Sugarcane yellow leaf virus,ScYLV)[14],此后广东、云南、福建、贵州、海南以及广西大部分地区都发现甘蔗黄叶病[7,15-21],可见其传播范围广、速度快。黄叶病已成为影响甘蔗产量的一个主要病毒病害[7],甘蔗的整个生育期均可受到黄叶病毒的侵染,尤其是在甘蔗生产后期黄叶病毒大多表现出典型症状。从经过本试验中4种途径获得的新生代植株的检测结果可以看出,愈伤组织诱导培养和综合脱毒培养两种途径均可以很好地脱除甘蔗黄叶病病毒,而腋芽培养和温水处理种植两种途径所得到的新生代植株均携带病毒。
3.3 蔗茎综合脱毒培养方式可以获得脱毒健康种苗
甘蔗抗性品种缺乏与种性退化是制约甘蔗发展的主要瓶颈,由宿根矮化病和甘蔗病毒病等病害引起的危害是导致种性退化的主要因素之一,但目前尚无有效的防除技术,所以采用脱毒甘蔗种苗是最有效的防治措施。然而,在脱毒效果理想的两种方法(即愈伤组织诱导培养和综合脱毒培养)中,愈伤组织诱导培养由于其无性系后代产生变异程度较高,不适合用于生产,这与许莉萍等[22]研究结论一致,愈伤组织培养能达到较好脱毒效果的原因可能是愈伤组织中病毒的复制速度赶不上细胞增殖速度。
本试验结果表明,热处理程度低于52℃、30 min(1’~12’处理),虽然种芽生长良好、成活率较高,但脱毒效果不理想;热处理程度高于52℃、30 min(14’~30’处理),虽然其茎尖分生组织区域的脱毒效果十分理想,但成活率非常低,芽生长严重受阻甚至大量死亡。在实际生产中,要综合考虑种芽生长情况和脱毒效果,我们认为52℃处理30 min(13’处理)效果最佳,不仅蔗芽生长情况良好,且脱毒效果优,可以满足实际生产需要。经过52℃30 min的热处理后38℃恒温培养1周使其抽芽,取茎尖分生组织培养可以有效脱除病原菌,这可能是因为:(1)病原菌的传播是通过维管束组织在植物体内进行传输,而茎尖分生组织区域内无维管束组织,病原菌通过胞间连丝的传播速度慢于细胞的分裂和生长速度,因此茎尖分生组织所含病原菌数量微少,不在检出范围[3];(2)高温热处理可有效去除大部分甘蔗宿根矮化病病原并使部分甘蔗花叶病病毒失活,之后再用38~40℃恒温进行连续处理,使蔗芽快速伸长的同时抑制病毒、病菌的生长和传播,使茎尖分生组织离病原更远些,有利于切取到不携带病原的茎尖分生组织,从而达到彻底脱毒的效果[23-24]。而经过腋芽培养和温水处理种植两种途径,可能是由于部分病原菌仍然存活于茎尖分生组织以外的其他有维管束的组织中,但是此部分组织未经切除,因此仍会携带病原菌。
综上所述,虽然愈伤组织诱导培养的脱毒方法效果显著,但因其在继代培养过程中变异率较高,存在操作不便和成本增加等问题,无法满足生产需要,因此不适合应用于实际生产。经热处理后不进行茎尖分生组织培养(腋芽培养途径和温水处理种植途径),则无法将病原菌彻底清除,植株仍携带有病原菌。通过52℃恒温热处理30 min结合腋芽分生组织培养途径是应用细胞生物学、分子生物学、作物栽培与耕作学等原理,通过蔗茎综合脱毒、无突变快繁、病原快速检测等环节获得[6]。本试验通过对甘蔗茎段进行52℃热处理30 min、38℃恒温培养结合腋芽分生组织培养,有效去除了甘蔗携带的宿根矮化病、花叶病和黄叶病等病原菌,实现了脱毒与快繁的统一,可见蔗茎综合脱毒方式是获取甘蔗脱毒健康种苗的有效途径。
[1]滕峥,李鸣,崔永祯,等. 农杆菌介导冷调节基因(Cbcor15a)遗传转化甘蔗体系的建立[J].南方农业学报,2014,45(8):1333-1339.
[2]吕静. 国际糖业保护政策对中国食糖产业的影响[D]. 大连:东北财经大学,2010.
[3]杨本鹏,张树珍,蔡文伟,等. 甘蔗健康种苗田间栽培主要农艺性状比较[J]. 热带作物学报,2010,31(2):171-175.
[4]Irvine J E,Benda G T A. Sugarcane mosaic virus in plantlets regenerated from discased leaf tissue[J]. Plant Cell,Tissne and Organ Cultuer,1985,5(2):101-106.
[5]Dacn J L. Failure of sugarcane mosaic virus to survive in cultured sugarcane tissue[J]. Plant Disease,1982,66(11):1060-1061.
[6]杨本鹏,张树珍,杨学,等. 甘蔗健康种苗培育体系的建立[J]. 热带作物学报,2006,27(4):74-77.
[7]熊国如,张雨良,赵婷婷,等. 海南蔗区甘蔗黄叶病与花叶病发生情况的分子鉴定[J]. 热带作物学报,2011,32(12):2307-2311.
[8]周娅. 云南甘蔗花叶病病原分子鉴定及遗传多样性分析[D]. 北京:中国农业科学院研究生院,2014.
[9]黄应昆,李文凤,何文志,等. 甘蔗温水处理脱毒种苗生产技术研究[J]. 西南农业学报,2013,26(5):2153-2157.
[10]Comstock J C,Lentini R S. Sugarcane mosaic virus disease[R]. Florida:IFAS Extesion,University of Flirida,2009.
[11]唐红琴,淡明,李松,等黑皮果蔗花叶病茎尖脱毒技术研究[J]. 安徽农业科学,2011,39(25):15345-15346.
[12]Davis M J,Gillaspie J A G,Harris R W,et al. Ratoon stunting disease of sugarcane:isolation of the causal bacterium[J]. Science,1980,210:1365-1367.
[13]谢晓娜,张小秋,梁永检,等. 宿根矮化病军侵染后甘蔗防御酶活性变化[J]. 南方农业学报,2014,45(9):1551-1557.
[14]徐正银,吕榜丽,李璞,等. 广西甘蔗病毒病害调查及病原病毒鉴定[J]. 南方农业学报,2014,45(11):1957-1962.
[15]许东林,周国辉,任小平,等. 广东甘蔗引种基地甘蔗黄叶病毒分子鉴定[J]. 植物病理学报,2005,35(5):466-468.
[16]王中康,殷幼平,Comstock J C. 甘蔗黄叶病毒病早期快速RT-PCR诊断和鉴定[J]. 西南农业大学学报,2001,23(4):301-303.
[17]陈利平. 甘蔗花叶病与黄叶病RNAi双价抗病毒表达载体构建与遗传转化研究[D]. 福州:福建农林大学,2013.
[18]付瑜华,周玉飞,张正学,等. 贵州蔗区甘蔗黄叶病发生情况的分子鉴定[J]. 贵州农业科学,2015,43(4):85-87.
[19]颜梅新,黄伟华,黄诚华,等. 广西北部蔗区甘蔗黄叶病调查[J]. 南方农业学报,2011,42(5):509-511.
[20]黄伟华,颜梅新,黄诚华,等. 广西南部地区甘蔗黄叶病毒病的研究[J]. 安徽农业科学,2011,39(22):13425-13426.
[21]颜梅新,黄伟华,林珊宇,等. 广西甘蔗黄叶病调查及3种病毒基因型在广西的分布[J]. 南方农业学报,2014(5):769-775.
[22]许莉萍,陈如凯,李跃平. 利用愈伤组织培养和茎尖培养去除甘蔗花叶病毒[J]. 福建农业大学学报(白然科学版),1994,23(3):253-256.
[23]Flynn J L,Anderlini T A. Disease incidence and yield performance of tissue culture generated seedcane over the crop cycle in Louisiana[J]. Sugar Azucar,1989,80:20.
[24]Lee T S G. Micropropagation of sugarcane(Saccharum spp.)[J]. Plant Cell,Tissue and Organ Culture,1991,10:47-55.
(责任编辑 张辉玲)
Effects of different treatments on efficiency of virus-free seed-stems of sugarcane
WU Yuan-li,WANG Jun-gang,CAI Wen-wei,ZHANG Shu-zhen,YANG Ben-peng
(Sugarcane Research Center of Chinese Academy of Tropical Agricultural Sciences / Institute of Tropical Bioscience and Biotechnology of Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Biology and Genetic Resources of Tropical Crops,Ministry of Agriculture,Haikou 571101,China)
In order to find out the most efficient pattern to get virus-free sugarcane,and provide a viable way to produce healthy sugarcane seedlings. We put seed-stems of sugarcane into different thermostat water baths. The results revealed that the percentage of germination was higher than 90% when the temperature was lower than 52℃ after 7 days of different hot water baths,and was higher than 60% when the temperature was 52℃ and the time was 30 minutes,and was lower than 30% in other treatments. When the temperature was above 55℃,58℃and 61℃,we could get sprouts without ratoon stunting disease,sugarcane mosaic virus and sugarcane yellow leaf virus respectively,but percentage of germination was lower than 20%. However,if we put the seed-stems in 52℃thermostat water bath for 30 minutes then cultivated in 38℃ thermostat for one week,we cann’t detect pathogenic microorganisms in growing points of sugarcane. Then under the best condition,we compared the efficiencies of four virus-free ways: callus induced from heart leaves,axillary bud cultivated,putting into warm water before planting and hot water bath combined with meristems of axillary bud cultivated. The first and the forth method were better thanothers. However,after several times transfers of culture,there were more mutants when the callus induced from heart leaves. Thus,hot water bath combined with meristems of axillary bud cultivated was the best treatment,which could cultivate healthy sugarcane seedlings.
thermal treatment;virus-free seedlings;seed-stems of sugarcane;meristems culture
S432.1;S566.1
A
1004-874X(2016)11-0014-08
2016-08-23
国家现代农业产业技术体系建设专项资金(CARS-20-6-11);海南省重大科技项目(ZDZX 2013023-3-01);中央级公益性科研院所基本科研业务费专项资金(1630052015036)
武媛丽(1982-),女,硕士,助理研究员,E-mail:21csyh@163.com
杨本鹏(1964-),男,研究员,E-mail:y-bp@163.com
武媛丽,王俊刚,蔡文伟,等.不同热处理对甘蔗蔗茎脱毒效果的影响[J].广东农业科学,2016,43(11):14-21.

