硫酸新霉素控制肠型嗜水气单胞菌性草鱼肠炎病的给药方案
孙朋辉,吕利群
( 上海海洋大学 水产与生命学院,上海 201306 )
硫酸新霉素控制肠型嗜水气单胞菌性草鱼肠炎病的给药方案
孙朋辉,吕利群
( 上海海洋大学 水产与生命学院,上海 201306 )
水温(25 ± 2) ℃时,给体质量150~200 g的草鱼分别口灌4种剂量(10、20、30、40 mg/kg)的硫酸新霉素,采用柱前衍生化高效液相色谱法测定血液、肠道和肌肉内的实时药物质量浓度,结合硫酸新霉素对肠型嗜水气单胞菌的体外药效学和草鱼单次口灌不同剂量的硫酸新霉素的体内药代动力学以及硫酸新霉素在肠道内的代谢规律进行研究。结果显示,硫酸新霉素对肠型嗜水气单胞菌的最小抑菌质量浓度为6 μg/mL,抗菌后效应为1 h;按不同剂量口灌草鱼后,草鱼肠道内0~24 h用药曲线面积/最小抑菌质量浓度分别为52.467、72.963、109.907、136.489;肠道内药物的最大质量浓度/最小抑菌质量浓度分别为10.93、15.24、23.20、28.98;口灌剂量为40 mg/kg的硫酸新霉素时,血药质量浓度达峰时间为2 h,达峰质量浓度为3.833 μg/mL。综合肠道0~24 h用药曲线面积/最小抑菌质量浓度和肠道达峰质量浓度/最小抑菌质量浓度2个指标,确定硫酸新霉素对由肠型嗜水气单胞菌引起的草鱼肠炎病的给药方案为:每日给药1次,每次40 mg/kg,连续给药3~5 d,休药期为8 d。
硫酸新霉素;草鱼;嗜水气单胞菌;药代动力学;药效学
嗜水气单胞菌(Aeromonashydrophila)为革兰氏阴性菌,是水产动物的常见致病菌之一,能够产生很强的外毒素,通过感染水产动物肠道致病,如草鱼(Ctenopharyngodonidellus)的肠炎病[1];感染鲤科鱼类肠道并在肠道内大量增殖引起出血病,导致大批死亡[2-3]。
目前国内对于水产动物细菌性疾病主要以抗生素及中草药对其进行治疗。硫酸新霉素是一种广泛使用的氨基糖苷类抗生素,对革兰氏阴性菌有良好的抑制作用,主要用于治疗细菌性肠炎[4-5]。有研究表明,嗜水气单胞菌对硫酸新霉素具有高度敏感性[1],因此本试验采用硫酸新霉素对由肠型嗜水气单胞菌引起的草鱼肠炎病进行用药方案研究。该药在水产动物上的应用有少量报道,其中大部分都是关于硫酸新霉素在水产动物体内药代动力学研究[6-7],关于硫酸新霉素对水产疾病的用药方案尚未见报道。
水产药物的使用方面大部分是参考药物在机体药代动学,依据药物质量浓度高于最小抑菌质量浓度的时间给出用药方案[8-9],未参考药代药效联合参数,缺乏科学性。药代学参数24 h用药曲线面积(与细菌清除率有良好相关性)、最大药物质量浓度(与细菌清除率和预防耐药性的产生成相关性)。抗生素又分为三大类:质量浓度依赖性、时间依赖性、质量浓度—时间依赖性。质量浓度依赖性药物用于评价其杀菌作用的药代药效参数主要有最大药质量物浓度与最小抑菌质量浓度的比值;药—时曲线下面积与最小抑菌质量浓度的比值,例如,氨基糖苷类药物0~24 h用药曲线面积/最小抑菌质量浓度>125、达峰质量浓度/最小抑菌质量浓度>8时不仅起效快,且能有效地杀灭细菌和抑制耐药菌株产生,临床有效率可大于90%;时间依赖性药,评价该类药物杀菌作用的药代药效参数主要有血药质量浓度大于最小抑菌质量浓度的时间和最小抑菌质量浓度值以上的用药曲线面积部分[10]。因此仅参考药物在机体药代动学的药物质量浓度高于最小抑菌质量浓度的时间给出用药方案不够准确。
硫酸新霉素属于浓度依赖性抗生素,评价其杀菌作用的药代药效参数主要是达峰质量浓度/最小抑菌质量浓度、0~24 h用药曲线面积/最小抑菌质量浓度;本文结合这两个指标进行了硫酸新霉素对嗜水气单胞菌相关体外药效学及硫酸新霉素在草鱼体内的药代动力学和肠道药物代谢规律研究,为治疗草鱼肠炎病提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验鱼
健康草鱼200尾,体质量(150~200) g,购于上海浦东新区果园养殖场,暂养于水族箱内,水温(25 ± 2) ℃,停食两周。
肠型嗜水气单胞菌,来源于国家水生动物病原库(上海),自患病草鱼体内分离纯化。
1.1.2 药品和试剂
硫酸新霉素标准品(纯度≥98.0%),购于生工生物工程(上海)股份有限公司;硫酸新霉素原料药(纯度≥95.5%),购于生工生物工程(上海)股份有限公司;肉汤培养基,购于上海杉君医药科技有限公司;甲醇(色谱纯)、乙腈(色谱纯)、氯甲酸芴甲酯(分析纯)、甘氨酸(分析纯)、三氟乙酸(分析纯)、磷酸二氢钠(分析纯)均购于国药集团化学试剂有限公司。
1.1.3 试验仪器
LC-100高效液相色谱仪(上海伍丰科学仪器有限公司);高压灭菌锅(杭州艾普仪器设备有限公司);漩涡震荡器(无锡安耐斯电子科技有限公司);高速离心机;超纯水仪等。
1.2 方法
1.2.1 最小抑菌质量浓度的测定
采用试管两倍稀释法[11],嗜水气单胞菌悬液密度为106cfu/mL,混合后放置30 ℃恒温摇床培养24 h,目测将未发生浑浊的试管的最低药物质量浓度作为最小抑菌质量浓度。重复5次,取平均值为最小抑菌质量浓度。
1.2.2 抗菌后效应的测定
[12]的方法,配制质量浓度为60、120、240 μg/mL的硫酸新霉素溶液,吸取不同质量浓度的药液200 μL分别加入到3支含有1.8 mL、密度为106~108cfu/mL嗜水气单胞菌悬液的15 mL的塑料离心管中,作为试验组T1、T2、T3;分别吸取无菌生理盐水200 μL加入2支含有1.8 mL、密度为106~108cfu/mL嗜水气单胞菌悬液15 mL的塑料离心管中,作为对照组C1、C2;将T1、T2、T3、C1、C2放置于30 ℃恒温摇床培养1~2 h。采用400倍除药法,自T1、T2、T3、C1、C2中吸取菌液100 μL,分别加入5支含1.9 mL液体培养基的15 mL塑料离心管中,涡旋30 s,同样方法再稀释一次。在C2中加入一定量的硫酸新霉素,使其质量浓度为0.06 μg/mL,作为药残产生的抗菌后效应。将T1、T2、T3、C1、C2置于30 ℃恒温摇床中培养,此时为测定抗菌后效应的零时。于0、1、2、3、4、5、6 h进行细菌计数,绘制出细菌的恢复生长曲线,按公式抗菌后效应/h=T-C1计算(T和C1分别表示试验组与对照组单位体积中的活菌个数增长1 lg的时间)。
1.2.3 给药及样品采集
将44尾体质量相同的草鱼分成4组;配制10、20、30、40 mg/kg剂量的试验药物分别口灌入4组草鱼前肠。灌后将鱼身体朝上直立片刻,无回吐药物的鱼用于试验。在给药0.25、0.5、1、2、3、4、6、8、10、12、24 h时自尾静脉取血1.5 mL,加入100 μL 2%的草酸钾溶液(抗凝剂)混匀[13];分别取少量背部肌肉、整条肠道置于不同的15 mL塑料离心管中,置于-20 ℃冰箱中。各个时间点取5个平行样品,同时取对照组组织、血液作为对照。
1.2.4 样品前处理
准确称取匀浆肌肉、肠道各1.0 g、血浆1 mL,移至不同的50 mL离心管,分别加入20 mL提取液 (pH 6.5的磷酸盐缓冲液+ 5%三氟乙酸;体积比1∶1), 水平摇床室温振荡12 h ,8500 r/min离心10 min,取上清液,上清液中加入2 mL (0.2 mol/L)三氟乙酸水溶液,涡旋5 min,过0.22 μm有机滤膜,待衍生化[7]。
1.2.5 色谱条件
LC-100高效液相色谱仪,C18色谱柱(150 mm ×4.6 mm,5 μm),流动相:乙腈-水(95∶5,体积比),流速0.8 mL/min,柱温25 ℃,紫外检测波长265 nm,进样量20 μL[14]。
1.2.6 柱前衍生
取硫酸新霉素溶液1 mL,加入乙腈1 mL,加入硼砂溶液(pH=8.0,0.2 mol/L)1 mL,加氯甲酸芴甲酯溶液(8 mmol/L乙腈溶液)1 mL,旋涡混匀30 s,置于暗处反应20 min,加甘氨酸(0.1 mol/L)200 μL,终止反应,旋涡30 s,10 000 r/min离心3 min,取上清液,0.22 μm有机滤膜过滤,进样20 μL[14]。
1.2.7 标准曲线的建立
配制10 mg/mL的硫酸新霉素标准溶液,临用时将标准液用超纯水分别稀释成质量浓度为200、100、50、10、5 μg/mL的标准液,经0.22 μm有机滤膜过滤后,进行柱前衍生,然后通过高效液相色谱仪进行检测。以色谱面积为纵坐标(y),以质量浓度为横坐标(x)做回归方程[15]。
1.2.8 回收率
分别取硫酸新霉素质量浓度为200、100、50 μg/mL溶液各1 mL,分别加入到1 g空白草鱼肠道、肌肉匀浆、1 mL血浆中,涡旋5 min静置6 h;使混合物的理论质量浓度分别为100、50、25 μg /mL,按照1.2.4处理,然后进行柱前衍生,高效液相色谱仪进行检测,重复3次,以平均值为实际质量浓度。求得实际质量浓度与理论质量浓度之比即为回收率。将同一样品在不同时间点进样检测,计算肠道、肌肉、血浆内药物的日内、日间的变异系数[16]。
1.2.9 数据处理
将LC-100高效液相色谱仪测出的数据用Excel 绘出标准曲线及实时药物—质量浓度曲线,应用 Kinetic 4.4 药代动力学软件,计算药代动力参数。
2 结 果
2.1 硫酸新霉素对嗜水气单胞菌体外药效学研究
经测定硫酸新霉素对嗜水气单胞菌的最小抑菌质量浓度为6 μg/mL。
2.2 硫酸新霉素对嗜水气单胞菌的抗菌后效应
以1倍最小抑菌质量浓度、2倍最小抑菌质量浓度、4倍最小抑菌质量浓度的硫酸新霉素溶液与嗜水气单胞菌接触1 h后,去除药物后细菌的生长曲线见图1。对照组C1与药残组C2中的细菌生长基本一致,表明400倍稀释可以去除药物,试验各管中的细菌生长抑制因抗菌后效应所致,非残留药物的作用。抗菌后效应分别为0.284 ± 0.169、0.44 ± 0.25、1.15 ± 0.55。试验表明硫酸新霉素质量浓度对抗菌后效应有一定的影响,在一定范围内,随着质量浓度的升高,抗菌后效应逐渐升高,在制定给药间隔时抗菌后效应可以延长约1 h。
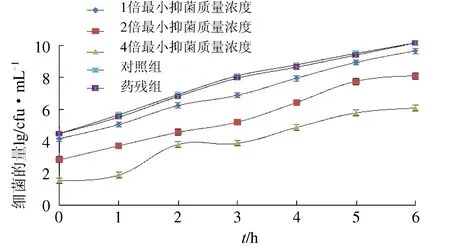
图1 嗜水气单胞菌与硫酸新霉素接触1 h后,去除药物后细菌的生长曲线
2.3 硫酸新霉素的标准工作曲线
以硫酸新霉素标准品溶液质量浓度为横坐标(x),以硫酸新霉素的色谱面积为纵坐标(y),绘制出标准工作曲线(图2)。线性回归方程为y=6.043x+0.321(r=0.999) 。在5~200 μg/mL 的范围内,硫酸新霉素的色谱面积与质量浓度呈线性相关,检测限为0.02 μg/mL。
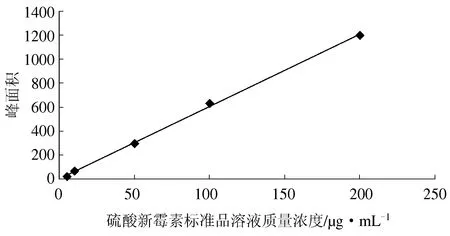
图2 硫酸新霉素标准品溶液工作曲线
2.4 回收率和精密度
草鱼的肌肉、肠道及血浆中硫酸新霉素的回收率及变异系数见表1。由表1可知,硫酸新霉素在肌肉中的回收率约为75.3%,日内变异系数为1.61%,日间变异系数1.89%;在肠道内的回收率约为87.4%,日内变异系数为2.62%,日间变异系数2.91%;血浆的回收率约为89.9%,日内变异系数为1.93%,日间变异系数2.32% 。
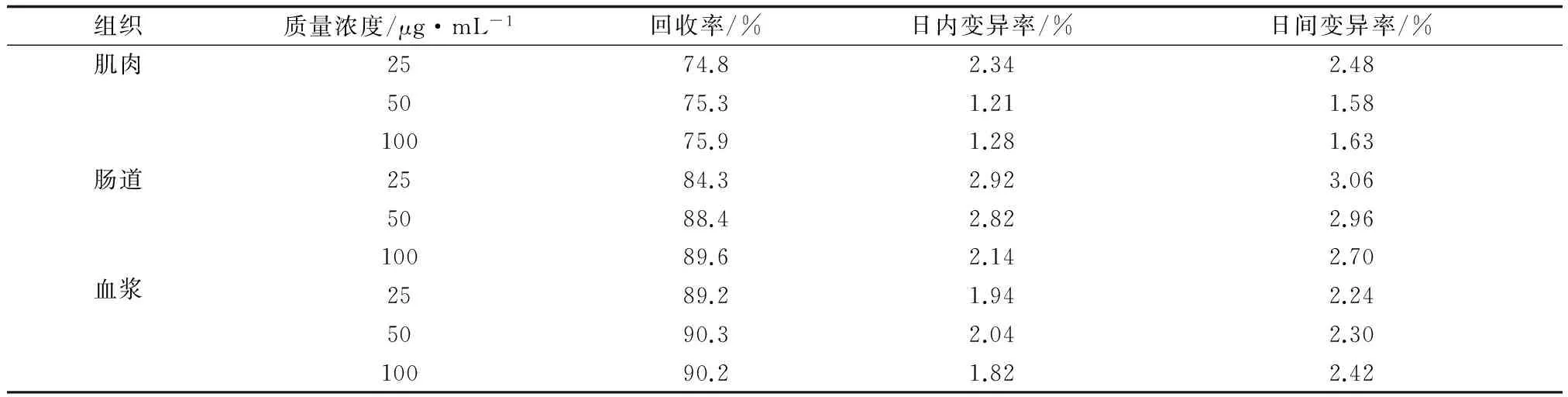
表1 草鱼肌肉、肠道和血浆中硫酸新霉素的回收率和变异系数
2.5 硫酸新霉素在草鱼血浆中的代谢规律及其相关药代参数
本试验以40 mg/kg体质量剂量的硫酸新霉素溶液口灌草鱼后,对草鱼各个时间点的血液药物质量浓度通过LC-100高效液相色谱仪进行检测,绘制出血液中硫酸新霉素的实时质量浓度曲线(图3)。结果发现,血药质量浓度在2 h后达到最大值,为3.833 μg/mL;24 h后血药质量浓度为1.167 μg/mL。血液中实时药质量浓度经Kinetica 4.4软件房室模型拟合,发现血药质量浓度时间数据符合一级吸收二室模型,硫酸新霉素在草鱼血液中的药动学参数见表2。
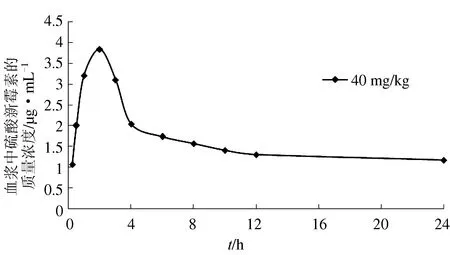
图3 草鱼血浆中的时时药物质量浓度曲线
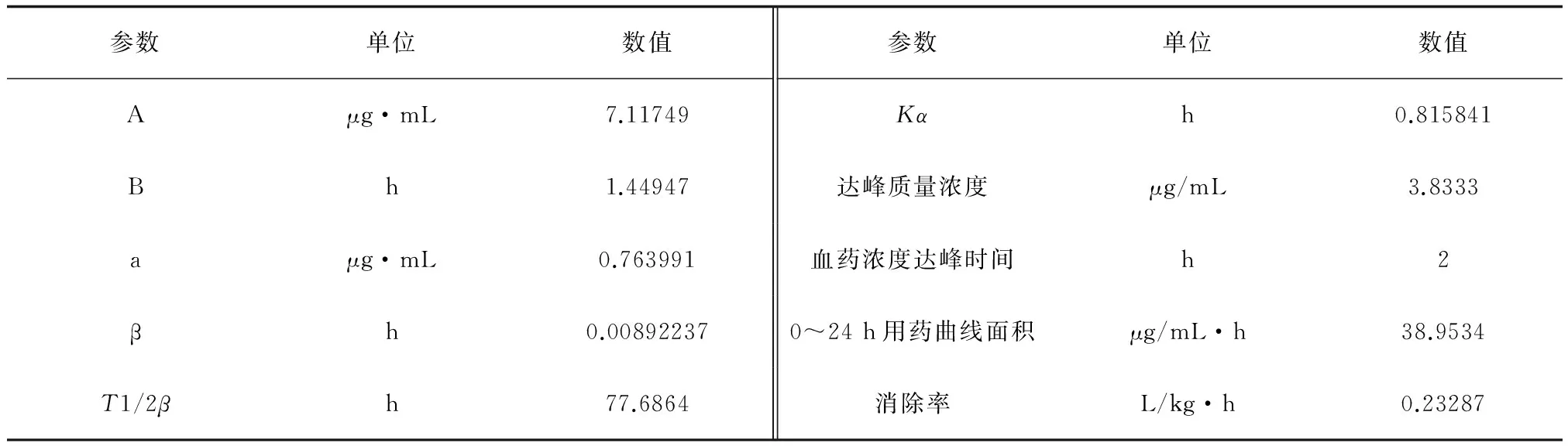
参数单位数值参数单位数值Aμg·mL7.11749Kαh0.815841Bh1.44947达峰质量浓度μg/mL3.8333aμg·mL0.763991血药浓度达峰时间h2βh0.008922370~24h用药曲线面积μg/mL·h38.9534T1/2βh77.6864消除率L/kg·h0.23287
2.6 硫酸新霉素在草鱼肠道内的代谢规律
以10、20、30、40 mg/kg体质量剂量的硫酸新霉素溶液分别口灌草鱼,对口灌不同剂量硫酸新霉素的草鱼各个时间点的肠道药物质量浓度通过LC-100高效液相色谱仪进行检测,最大质量浓度分别为65.89、91.45、139.22、173.90 μg/g;24 h后的药物浓度分别为4.96、8.78、16.32、20.27 μg/g(图4)。
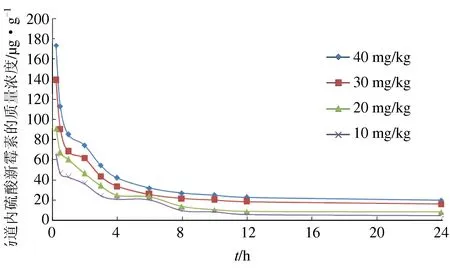
图4 草鱼肠道内时间—药物质量浓度曲线
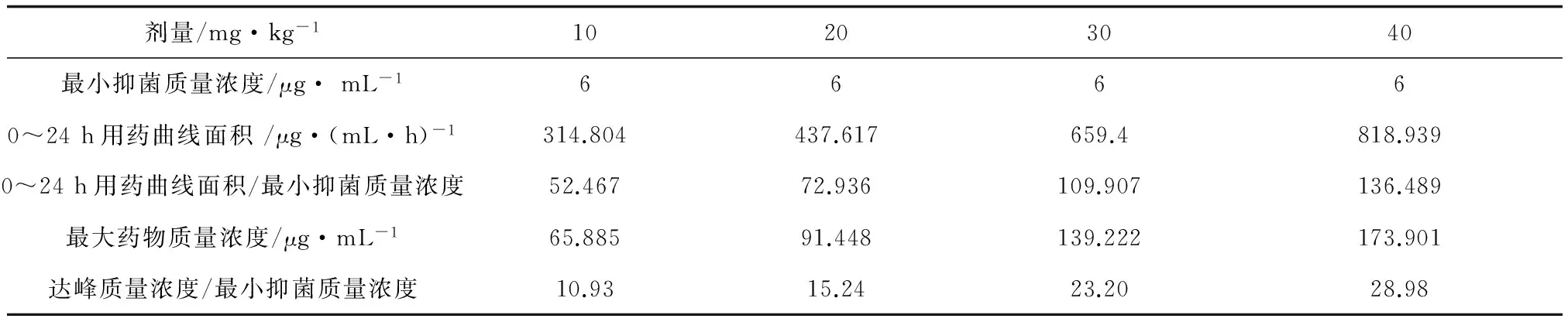
剂量/mg·kg-110203040最小抑菌质量浓度/μg·mL-166660~24h用药曲线面积/μg·(mL·h)-1314.804437.617659.4818.9390~24h用药曲线面积/最小抑菌质量浓度52.46772.936109.907136.489最大药物质量浓度/μg·mL-165.88591.448139.222173.901达峰质量浓度/最小抑菌质量浓度10.9315.2423.2028.98
2.7 休药期
在口灌40 mg/kg体质量剂量下草鱼肌肉中硫酸新霉素的达峰时间为3 h,最高质量浓度为24.89 μg/g(图5);在给药24 h时药物质量浓度为8.97 μg/g。欧盟对硫酸新霉素在食用动物肌肉中的药物残留量最大限度为500 μg/kg。硫酸新霉素是按照一级动力学从体内消除的,消除后期符合指数消除:C=C0e-kelt;通过计算得出药物残留理论休药期为8 d。
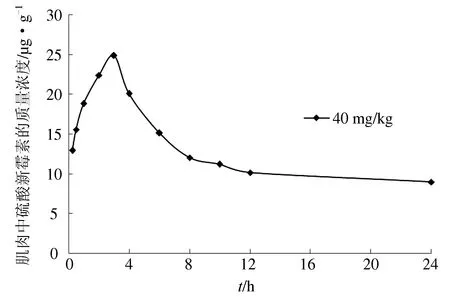
图5 草鱼肌肉中硫酸新霉素的实时质量浓度曲线
3 结 论
3.1 硫酸新霉素在草鱼体内的药代动力学特征
水温(25 ± 2) ℃时,以40 mg/kg体质量的硫酸新霉素单次口灌于草鱼前肠,血药质量浓度2 h达到最大值,最大药物质量浓度为3.833 μg/mL,24 h药—时曲线下面积为38.9534 μg/(mL·h);而肠道内的药物质量浓度在灌药后立刻达到最大值,最低药物质量浓度为20.27 μg/mL,24 h药时曲线下面积为818.939 μg/(mL·h);结果表明硫酸新霉素口服时吸收很少,血药质量浓度较低,肠道内药物质量浓度较高。廖碧钗等[6]在水温(25 ± 2) ℃时,以150 mg/kg的剂量给奥尼罗非鱼(O.niloticus♀×O.aureus♂)单次口灌硫酸新霉素,血药质量浓度2.856 h达到最大值,最大血药质量浓度为7.013 μg/mL,24 h药—时曲线下面积为101.22 μg/(mL·h);宋洁等[7]在水温(28±2) ℃条件下,按25 mg/kg的剂量对吉富罗非鱼(GIFT,O.niloticus)单次口灌硫酸新霉素,血药质量浓度1.299 h达到最大值,最大血药质量浓度为16.138 μg/mL,24 h药—时曲线下面积为456.225 μg/(mL·h)。可见不同的温度、给药剂量和受试动物对药物的吸收量有明显差异。
由此比较看出,硫酸新霉素在不同温度、给药剂量、水产动物体内药动学特征存在显著差异,因此在制定给药方案时需慎重分析其差异。由于硫酸新霉素口灌于草鱼前肠后吸收量很少,肠道内的药物质量浓度很高,血浆中药物质量浓度较低,通过血液的药代动力学研究不能真实的反映肠道内的药物质量浓度及其变化规律,所以本次对于草鱼肠炎病的用药方案并未采用通过草鱼血液的药代动力学给出用药方案,采用崔俊昌等[17]对组织内药物质量浓度变化的研究方法,从而得到最大药物质量浓度及药时曲线下面积。
3.2 给药方案的制定
本试验结合硫酸新霉素对嗜水气单胞菌的体外药效学和草鱼体内的药代动力学及肠道内药物代谢规律研究,发现口灌剂量10、20、30、40 mg/kg体质量的硫酸新霉素时,肠道内达峰质量浓度/最小抑菌质量浓度分别为10.93、15.24、23.20、28.98;肠道内0~24 h用药曲线面积/最小抑菌质量浓度分别为52.467、72.936、109.907、136.489。当氨基糖苷类药物0~24 h用药曲线面积/最小抑菌质量浓度>125、达峰质量浓度/最小抑菌质量浓度>8时不但起效快,且能有效地杀灭细菌和抑制耐药菌株产生,临床有效率可大于90%;0~24 h用药曲线面积/最小抑菌质量浓度>100时,细菌不能完全被清除,但能杀死90%以上的敏感菌;0~24 h用药曲线面积/最小抑菌质量浓度<100时,耐药菌会逐日增加,最终细菌几乎全部耐药,导致治疗失败[18]。
氨基糖苷类药物作为浓度依赖性药物,单次大剂量用药,不仅可以减少耐药,而且能产生较大的抗菌后效应,增加用药间隔,降低因多次用药产生的耳肾毒性,宜每日给药一次[19]。参照文献[20]的方法对于浓度依赖性抗生素药给药次数为3~5次。因此硫酸新霉素在治疗由肠型嗜水气单胞菌引起的草鱼肠炎病时应连续给药3~5 d,每日给药一次,每次剂量40 mg/kg。
参考文献:
[1]张晓君,陈翠珍,房海.草鱼肠炎嗜水气单胞菌分离株的主要特性及系统发育学分析[J].中国人兽共患病学报,2006,22(4):334-337.
[2]张翠娟,于宙亮,赵宝华,等.嗜水气单胞菌研究进展[J].中国兽药杂志,2008,42(7):46-50.
[3]杨本升,刘玉斌,苟仕金,等.动物微生物学[M].长春:吉林科学技术出版社,1995:677-684.
[4]陈玉楼.硫酸新霉素治疗鸡大肠杆菌病的疗效观察[J].山东家禽,1993(3):22-23.
[5]路景明,阎继业,李有长,等.硫酸新霉素治疗犬、猪肠炎和仔猪白痢的临床观察[J].兽医大学学报,1993,13(1):19-20.
[6]廖碧钗,樊海平,林丽聪,等.硫酸新霉素在奥尼罗非鱼体内的药代动力学及残留研究[J]. 福建农林大学学报,2011,40(1):64-68.
[7]宋洁,王贤玉,王伟利,等.硫酸新霉素在吉富罗非鱼体内的药代动力学及休药期[J].中国水产科学,2010,17(6):1358-1363.
[8]张雅斌,张祚新,郑伟,等.诺氟沙星在鱼类细菌性疾病中的应用研究[J].大连水产学院学报,2000,15(2):79-85.
[9]刘玉林,王翔凌,杨先乐,等.诺氟沙星在大黄鱼体内的药代动力学及残留研究[J].水产学报,2007,31(5):655-660.
[10]杨亚军,李剑勇,李冰.药动学-药效学结合模型及其在兽用抗菌药物中的应用[J].湖北农业科学,2011,50(1):114-117.
[11]戴自英.临床抗菌药物学[M].北京:人民卫生出版社,1985:6-8.
[12]刘远飞.氟喹诺酮类抗菌药后效应及其机制的研究[D].哈尔滨:东北农业大学,2002.
[13]钟明康,Xuan D,Nicolau D P,等.感染模型家兔体内莫西沙星的药动力学[J].中国医药学杂志,2001,21(1):15-17.
[14]杨美成,刘振,严小蕾,等.柱前衍生化I-IPLC法测定硫酸庆大霉素和硫酸新霉素的含量[J].中国临床药杂志,2004,13(5):288-291.
[15]丁俊仁,艾晓辉,汪开毓.强力霉素在斑点叉尾鮰体内药物动力学及残留消除规律研究[J].水生生物学报,2012,36(1):126-132.
[16]艾晓辉,陈正望,张春光.喹乙醇在鲤体内的药物代谢动力学及组织浓度[J].水生生物学报,2012,27(3):273-277.
[17]崔俊昌,刘又宁,王睿,等.左氧氟沙星药代动力学/药效学研究参数与金黄色葡萄球菌耐药的相关性研究[J].中国临床药理学与治疗学,2007,12(9):989-992.
[18]石焕阶.根据浓度依赖型与时间依赖型抗菌药物的特点制定给药方案[J].医学导报,2009,28(9):1222-1223.
[19]李运景,邢洁,陈文娟.时间依赖性抗菌药物与浓度依赖性药物给药方案的优化[J].中国现代药物应用,2008,24(2):72-73.
[20]徐叔云,卞如廉,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:699-759.
MedicationRegimeofNeomycinSulphateagainstEsoenteritisCausedbyAeromonashydrophilainGrassCarp
SUN Penghui, LÜ Liqun
( College of Life and Fishery Sciences, Shanghai Ocean University, Shanghai 201306, China )
In vivo pharmacokinetics of neomycin sulphate againstAeromonashydrophilawere studied in grass carp (Ctenopharyngodonidellus) with body weight of 150—200 g with esoenteritis caused byA.hydrophilaand with single oral administration of neomycin sulphate at a dose of 10, 20, 30, and 40 mg per kg body weight at water temperature of (25±2) ℃. The residues of neomycin sulphate were detected in blood, intestine and muscle of grass carp at different time points by high performance liquid chromatography (HPLC). It was found that neomycin sulphate againstA.hydropliahad minimal inhibitory concentration (MIC) of 6 μg/mL, and post antibiotic effect (AUC24)of 1 h. There was AUC24/MIC of 52.467 at a dose of 10 mg per kg body weight, 72.963 at a dose of 20 mg per kg body weight, 109.907 at a dose of 30 mg per kg body weight and 136.489 at a dose of 40 mg per kg body weight in the intestine. Cmax /MIC was 10.93, 15.24, 23.20 and 28.98 in the intestine at various doses, respectively. The maximal drug residue concentration of 3.833 μg/mL was observed in the blood of the grass carp orally administrated at a neomycin sulphate dose of 40 mg per kg body weight. Considering AUC24/MIC and Cmax/MIC, the medication regime of neomycin sulphate is recommended as the following: 40 mg/kg body weight, once a day, continuous administration for 3 to 5 days, and drug holiday of 8 days.
neomycin sulphate; grass carp;Aeromonashydrophila; pharmacokinetics; pharmacodynamics
S965.112
A
1003-1111(2016)01-0054-06
10.16378/j.cnki.1003-1111.2016.01.010
2015-07-15;
2015-09-15.
国家现代农业产业技术体系建设专项(CARS-46-12).
孙朋辉(1990-),男,硕士研究生;研究方向:水产疾病防控.E-mail:13052398178@163.com.通讯作者:吕利群(1971-),男,教授,博士生导师;研究方向:动物病毒学.E-mail:IqIv@shou.edu.cn.

