甘蔗糖蜜沉析率的影响因素研究
苏江滨,徐日益,尚红岩,黄向阳
(广州甘蔗糖业研究所,广东省生物工程研究所,广东 广州 510316)
甘蔗糖蜜沉析率的影响因素研究
苏江滨,徐日益,尚红岩,黄向阳
(广州甘蔗糖业研究所,广东省生物工程研究所,广东 广州 510316)
通过酒精聚沉并反复洗涤所得甘蔗糖蜜胶体凝聚物经电镜能谱分析表明,除了粘性蛋白复合物、多糖碳水化合物外,还含有大量的K+、Ca2+、Na+盐。由此可反映糖蜜自身所含无机盐可破坏胶粒水化层且中和胶粒电荷,胶粒随后克服分子间阻力并相互碰撞凝聚逐步析出,即表明糖蜜沉析是盐析过程。进一步研究表明,pH、温度、保温时间对糖蜜沉析率基本无影响。在46~66°Bx间,糖蜜沉析率和锤度成正向线性关系,以糖蜜锤度为横坐标(x)、沉析率为纵坐标(y),线性回归方程为y=0.000908x-0.020157,R2=0.9999,温度、保温时间、pH对糖蜜沉析率基本无影响,最佳沉析条件为66°Bx、温度和pH自然、静置半小时,沉析率达3.96%。该沉析法简单、节能、安全且能显著提高甘蔗糖蜜的沉析率。
甘蔗糖蜜;胶体凝聚物;盐析;沉析率
甘蔗糖蜜是制糖加工过程中产生的废品,锤度80~90°Bx,含糖量约50%,用途广泛,可作为碳源发酵制取酒精、单细胞蛋白、味精等[1-3],经过澄清处理可制作食用液体糖或牲畜饲料添加剂[4-5],亦可从中提取色素和抗氧化剂[6-7],甚至可作水泥缓凝减水剂[8-9]。糖蜜属于胶体分散体系,胶体粒径分布于1~100nm之间,大部分是由类果胶、糖和粘性蛋白构成的粘性复合物,每毫升糖蜜大概含有106个粒子[10]。糖蜜酒精发酵工业中,胶体是发酵罐、蒸馏塔结垢的主要诱因,胶粒还可以附着在酵母细胞表面,严重时甚至会促使细胞絮凝结团,从而大大降低发酵率,因此去除糖蜜胶体是提高糖蜜酒精发酵效率的有效途径。纵观国内外文献,蔗汁或糖蜜胶体含量评价方法一般有两种:一是添加酒精聚沉胶体后用滤纸过滤并用酒精脱糖后称胶体干重[11];二是间接采用胶体沉淀厚度、湿沉质量或上清液含糖量做为参考指标[12-13]。现阶段研究者普遍采用磷酸-石灰法、高温-硫酸法、聚丙烯酰胺法来去除糖蜜胶体[14-15],但是残留的添加助剂会给后期处理或食品安全带来隐患[16]。其实糖蜜本身含有大量的钾钙金属无机盐,只需进行适当的预处理,便可使胶体盐析,过程简单、安全。本文首先改进了胶体凝聚物检测方法,提高其准确性和重复性,初步分析胶体凝聚物的成份,并在此基础上研究糖蜜锤度、温度、加热时间及pH对糖蜜沉析率的影响,建立最优沉析工艺。
1 材料与方法
1.1 试剂与仪器
主要试剂:糖蜜83.27°Bx,广东三和酒精厂,去离子水,蒸馏水,无水酒精,浓盐酸,α-萘酚。
主要仪器:恒温干燥箱,恒温水浴锅,超声波清洗仪,漩涡振荡器,PAL-α迷你数显折射仪,pH计,BS201S电子分析天平,TDL-5A离心机,扫描电镜,能谱分析仪。
1.2 方法
1.2.1 糖蜜胶体凝聚物提取及检测
酒精聚沉法[17-18],稍作改进,笔者用4000rpm离心代替滤纸过滤,用超声波振荡代替玻璃棒搅拌,具体步骤如下:取烘干的15mL塑胶离心管1和2,取重量为0.9~1g糖蜜于离心管1,加去离子水约4.4~4.6g,加稀盐酸调pH4.3~4.4,振荡均匀,取2mL稀释液4000rpm离心3min(此可除去不溶悬浮物),取上清液1.5mL糖蜜稀释液于离心管2,于管2中慢慢加入无水酒精至11mL(边加边摇匀以免胶体和糖分结块聚沉),振荡10min,4000rpm离心3min,弃上清液,沉淀加10mL 90%酒精置于超声波清洗仪中50℃振散5min,4000rpm离心3min,如此洗涤5遍以上,直至上清液不与萘酚-浓硫酸发生紫色反应,证明沉淀糖分洗脱完全,将沉淀置于50℃过夜干燥,制片后扫描电镜观察结构,能谱仪分析其元素组成。
1.2.2 糖蜜沉析率的测定
取重量为M的原糖蜜,经过预处理(稀释、酸化、加热等)后置于离心管中2000rpm离心5min,弃上清液,沉淀加10mL90%酒精置于超声波清洗仪中50℃振散10min,2000rpm离心5min,如此洗涤4遍以上,直至上清液不与萘酚-浓硫酸发生紫色反应,证明沉淀糖分洗脱完全,将含有沉淀物的离心管置于50℃过夜干燥至恒重,称得干燥物重m,预处理糖蜜沉析率(g/g原蜜)=m/M。
1.2.3 锤度、温度、保温时间、pH影响因素实验设计
将等量糖蜜分别用去离子水稀释成70°Bx、67°Bx、66°Bx、60°Bx、53°Bx、46°Bx,pH自然于室温25~30℃静置半小时,测各组沉析率。
将等量糖蜜用去离子水稀释成60°Bx,pH自然分别置于40℃、50℃、60℃水浴保温半小时,对照组为自然温度31℃,测各组沉析率。
将等量糖蜜用去离子水稀释成60°Bx,pH自然置于60℃分别水浴0.5h、1h、1.5h、2h后,测各组沉析率。
为了避免因添加硫酸而析出硫酸钙,采用盐酸将等量60°Bx糖蜜稀释液分别调 pH至4.0、3.62、3.13、2.85,对照组为自然pH5.21,于室温静置0.5~1h,测各组沉析率。
分析上述单因素实验结果,建立最优沉析工艺。
2 结果与分析
2.1 糖蜜胶体凝聚物成份初步分析
如图1、2所示,胶体凝聚物呈现复杂的不规则状态,由片状物、晶状物和不规则的小颗粒组成,通过表1、2可推断其中除了含有蛋白复合物、类果胶等成份,还含大量K+、Ca2+、Na+等金属盐,也说明了金属无机盐无法通过90%酒精洗脱完全,侧面反映了糖蜜沉析是盐析的过程。
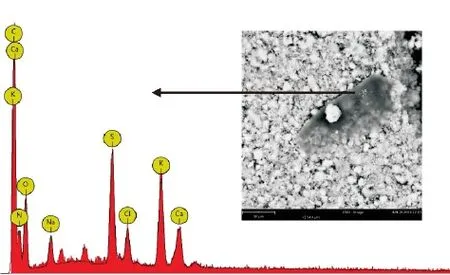
图1 糖蜜胶体凝聚物样品A的SEM/EDS分析

表1 样品A的EDS分析
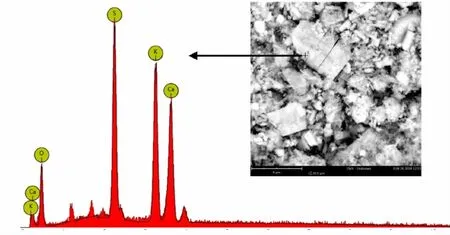
图2 糖蜜胶体凝聚物样品B的SEM/EDS分析

表2 样品B的EDS分析
2.2 糖蜜锤度对沉析率的影响
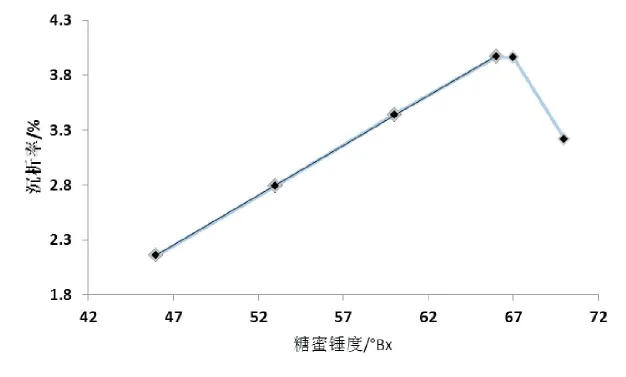
图3 糖蜜锤度对沉析率的影响
研究发现在46~66°Bx范围内,沉析率和锤度呈正向线性关系,以糖蜜锤度为横坐标(x)、沉析率为纵坐标(y),线性回归方程为y=0.000908x-0.020157,R2=0.9999,推测随着糖蜜锤度的增加,无机盐浓度亦增加,在66°Bx时达到盐析最佳浓度,沉析率达3.96%,当大于67°Bx时,沉析率开始下降,这是由于粘度太大,胶粒布朗运动被分子阻力所抑制,胶粒互相碰撞机会随之减少。
2.3 温度对糖蜜沉析率的影响
如表3所示,随着温度从自然31℃升至60℃,沉析率从3.63%略降至3.56%,推测是由于随胶体析出的金属盐呈高温溶解的趋势,根据SPSS方差分析表4可知P>0.05,说明温度对沉析率的影响不显著。糖蜜储存于大型储罐内,伴随着耐高渗微生物释放的生物热和内部生化反应热,温度可达40℃以上,稀释后通常都在30℃以上。因此选择自然温度既沉析率高又节能。
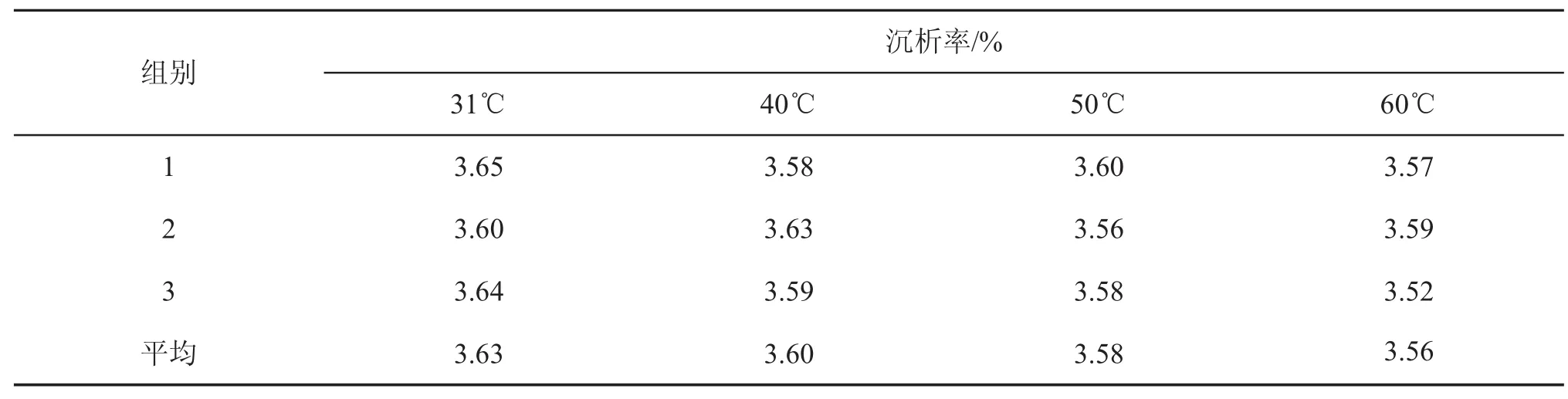
表3 温度对糖蜜沉析率的影响
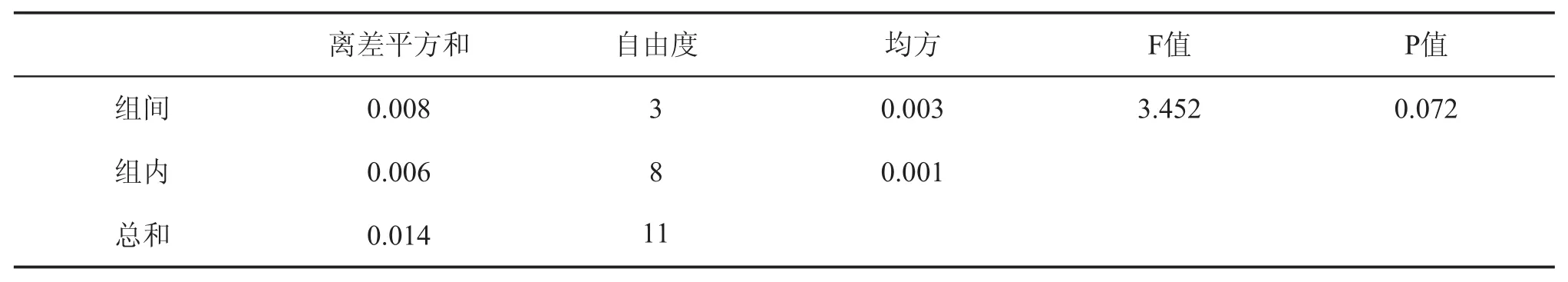
表4 温度对沉析率的影响显著性分析
2.4 保温时间对糖蜜沉析率的影响
如表5所示,4种保温时间对应的沉析率都在3.49%~3.50%,根据SPSS方差分析表6可知P>0.05,说明保温时间对沉析率的影响不显著。工业生产中使用100m3左右的酸化罐,体积大保温效果好,一般一小时降温的幅度很小,所以基本可以不考虑持续加热保温,只要初始温度达到便可。
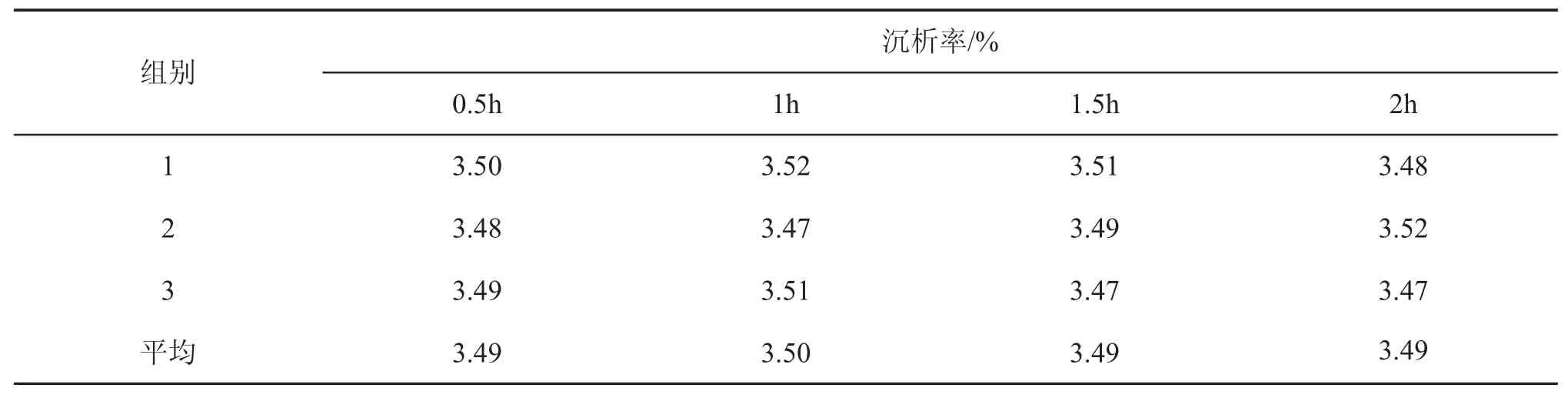
表5 保温时间对沉析率的影响
2.5 pH对糖蜜沉析率的影响
pH即等电点普遍被认为是影响胶体聚沉的重要因素,但本研究结果却相反,如表7所示:当pH2. 85~5.21时,沉析率处于3.48%~3.50%,工业中糖蜜用于发酵生产酒精时pH调至3~5,推测糖蜜等电点不在此pH范围内,根据SPSS方差分析表8可知P>0.05,说明pH对沉析率的影响不显著。目前糖蜜酒精无酸发酵技术倍受青睐,因此选择pH自然既可以节省硫酸又环保。
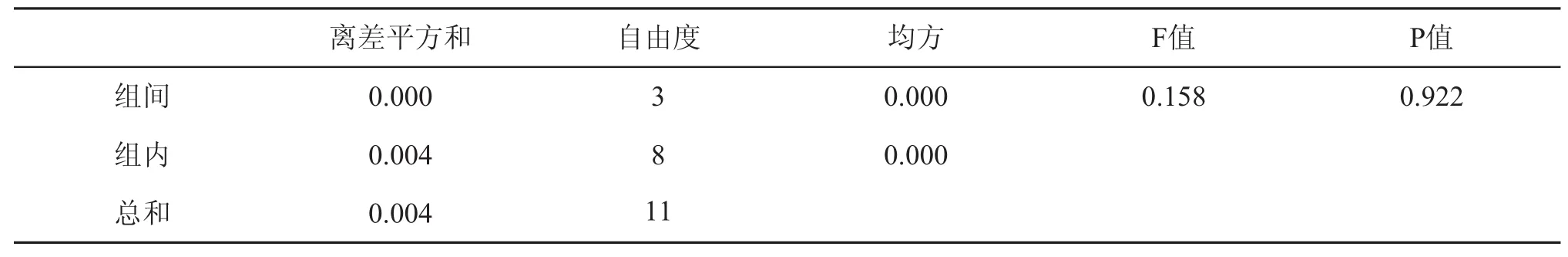
表6 保温时间对沉析率的影响显著性分析
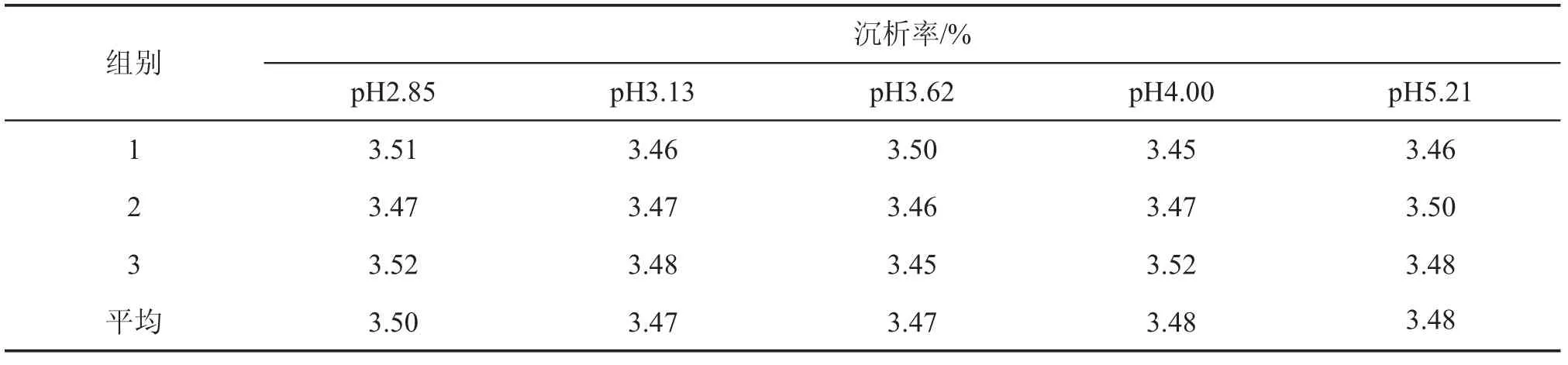
表7 pH对沉析率的影响
表8 pH对沉析率的影响显著性分析
3 结论与探讨
传统酒精聚沉法是添加酒精聚沉胶体后用滤纸过滤并用酒精洗净烘干后称干重,但胶体沉淀物是粘性物质,过滤时会强力粘附于滤纸,以至于难以搅匀并洗脱掺杂于沉淀物内部的糖分,搅拌的同时还伴有物料损失,导致实验数据的准确性和重现性很差;笔者用4000rpm离心代替滤纸过滤、用超声波振荡代替玻璃棒搅拌洗脱糖分,从表3、5、7的三次重复实验数据可知准确性和重现性大大提高。甘蔗糖蜜胶体凝聚物经电镜能谱分析得知,不但含有粘性蛋白、果胶多糖类等有机物,而且含有大量的钾、钙、钠金属无机盐,反映了糖蜜沉析是盐析的过程。因此传统的酒精聚沉法所得糖蜜胶体凝聚物是胶体和金属盐的混合物,并不能表征纯胶体总量,只能作为不同类别糖蜜的胶体含量的横向对比指标。想要测纯胶体含量,须用透析技术将金属盐除去,分析糖蜜内胶体分子量分布范围和含量也是下一步研究计划内容。
相比热酸法、聚丙烯酰胺法等,该沉析法简单、节能、安全。在46~66°Bx范围内糖蜜沉析率和锤度有正向线性关系,以糖蜜锤度为横坐标(x)、沉析率为纵坐标(y),线性回归方程为y=0.000908x-0.020157,R2=0.9999;当温度处于31~60℃之间,温度和保温时间对沉析率基本无影响;当pH处于2.85~5.21时,pH对沉析率基本无影响。最佳沉析条件是66°Bx,温度和pH自然,静止半小时,沉析率可显著提高至3.96%。本研究为糖蜜脱胶和除灰工艺工业应用提供了重要依据。
[1]韩冰,范桂芳,李十中,等.不同糖质原料和菌株固态发酵制取乙醇的特性比较[J].农业工程学报,2012,28(5): 201-206.
[2] 何海燕,覃拥灵,李楠,等.利用甘蔗糖蜜发酵生产酵母单细胞蛋白的菌种选育[J].粮食与饲料工业,2006,(12):28-30.
[3] 杨芳,陈宁,张克旭.甘蔗糖蜜发酵生产谷氨酸的研究[J].现代食品科技,2006,22(3):45-47.
[4] Bojana Filip ev,Oliveraimu rina,Tamara Dap eviHadnaev,et al.Effect of Liquid(Native)and Dry Molasses Originating from Sugar Beet on Physical and Textural Properties of Gluten-Free Biscuit and Biscuit Dough[J]. Journal of Texture Studies,2015,46(5):1-12.
[5]MF Montano,LR Flores,JF Calderon,et al.Influence of Level of Addition on the Feeding Value of Cane Molasses in Growing-Finishing Diets for Feedlot Cattle[J].Journal of Animal&Veterinary Advances,2009,8(1):190-194.
[6]Hatano K,Kikuchi S,Miyakawa T,et al.Sep aration and characterization of the colored material from sugarcane molasses[J].Chemosphere,2008,71:1730-1737.
[7]Yonathan Asikin,Makoto Takahashi,Takashi Mishima,et al.Antioxidant activity of sugarcane molasses against 2,2'-azobis(2-amidinopropane)dihydrochloride-induced peroxyl radicals[J].Food Chemistry,2013,141(141): 466-72.
[8]Hulusi Ozkul M.The utilization of beet molasses as a re-tarding and water-reducing admixture for concrete[J]. Cement and Concrete Research,2005,35(5):874-882.
[9]刘金芝,冉千平,张建纲,等.甘蔗糖蜜对水泥缓凝和减水的性能研究[J].新型建筑材料,2012,(2):38-41.
[10]Hubert OLBRICH.THE MOLASSES[M].Biotechnologie-Kempe GmbH(2006):26.
[11]毛瑞丰.甘蔗糖蜜酒精生产污垢发生机理及污垢控制[D].南宁:广西大学,2011:47.
[12]秦祖赠,刘自力.甘蔗糖蜜制取液体糖工艺的研究[J].食品研究与开发,2006,27(2):69-71.
[13]汤兴俊,卢林海,杨明智.利用甘蔗糖蜜生产焦糖色素的研究[J].中国酿造,2003,(5):11-13.
[14]王湘茹,于淑娟.甘蔗糖蜜澄清处理及处理前后组分分析[J].中国调味品,2010,35(2):64-68.
[15]王强,李秀霞,林常旭,等.甘蔗糖蜜净化处理工艺探究[J].广西民族师范学院学报,2014,31(3):4-6.
[16]李朝晖.注意选择饮用水处理用聚丙烯酰胺[J].给水排水,2004,30(10):42-43.
[17]梁秉华,程群卿,吴季良,等.甘蔗糖蜜酒精生产检验方法[M].轻工业部甘蔗糖业研究所(1986):27-28.
[18]李墉,郑长庚.甘蔗制糖化学管理分析方法[M].中国轻工总会甘蔗糖业质量监督检测中心,1995.
Study on the influence factors of precipitation rate of sugarcane molasses
Su Jiang-bin,Xu Ri-yi,Shang Hong-yan,Huang Xiang-yang
(Guangzhou Sugarcane Industry Research Institute,Guangzhou 510316,China)
As little as 0.008%of molasses colloids have an unfavorable effect to the yeast cells,therefore it is a useful approach in increasing the alcohol productivity by removing the molasses colloids.SEMEDS analysis showed that the precipitate formed by alcohol addition consisting of potassium、calcium、sodium salts and colloidal particles.It revealed that precipitation was a complex process mixed with?colloids and metal saults aggregation.In other words,the precipitation process is salting out.Further study showed that pH、temperature and soaking time had few effect on the colloidal precipitation rate.In a range from 46 to 66°Bx,the colloidal precipitation rate rose in step with the molasses brix,the equation was y=0.000908x-0.020157,R2=0.9999.The optimum conditions for precipitation were leaving the 66° Bx molasses with natural pH for half an hour at the natural temperature,and the colloidal precipitation rate was amount to 3.96%.This method was simple、energy-saving and safe,which also increased the precipitation rate significantly.
sugarcane molasses,colloidal agglomerate,salting out,precipitation rate
TS244
B
2016-08-12
广东省省级科技计划项目(2013B010102002;2014A010107017;2016B070701005),广东省科学院科研平台环境与能力建设专项资金项目(2016GDASPT-0208)。
苏江滨(1982-),男,福建人,工程师,研究方向:发酵工程。
徐日益(1984-),男,江西人,工学硕士,高级工程师,研究方向:发酵工程。Email:scutriyal@163.com

