我院单抗类抗肿瘤药致不良反应148例分析
徐 旭,黄新恩(1.泰州市第三人民医院,江苏泰州 5300;.江苏省肿瘤医院,南京 10009)
·不良反应与监测·
我院单抗类抗肿瘤药致不良反应148例分析
徐旭1*,黄新恩2(1.泰州市第三人民医院,江苏泰州225300;2.江苏省肿瘤医院,南京210009)
目的:分析单抗类抗肿瘤药致药品不良反应(ADR)发生的特点及规律,为临床安全用药提供参考。方法:收集我院2012年11月-2016年2月单抗类抗肿瘤药致ADR 148例,统计患者的性别、年龄、原患疾病、药品名称、ADR发生时间、临床表现、治疗及转归等信息。结果:148例ADR中,男性80例,女性68例,男女比例为1.176 5∶1;高发年龄为50~59岁(占32.43%);原患疾病中非霍奇金淋巴瘤的比例最高(占37.84%);共涉及到5种药物,其中利妥昔单抗注射液致ADR的比例最高(为47.97%);ADR发生时间<1 d的最多(占54.73%);主要累及消化系统(占41.89%),临床表现为慢性肝纤维化、食欲减退、便秘、恶心、呕吐等;严重的ADR 9例(占6.08%),新的一般的ADR 5例(占3.38%),新的严重的ADR 2例(占1.35%)。经对症处理后,总有效率为98.65%。结论:单抗类抗肿瘤药致ADR可出现在各个年龄阶段,原患疾病较广,且累及多个器官/系统,临床表现复杂,危害大,因此需给予高度重视,加强合理用药监护,做好应对措施,以提高患者用药的安全性。
单抗类抗肿瘤药;药品不良反应;分析;利妥昔单抗;非霍奇金淋巴瘤
恶性肿瘤是当今社会的一大危害,其对人们的身体健康及生命安全构成严重的威胁,传统的抗肿瘤药虽可取得一定的疗效,但其毒副作用明显,易损害患者的正常细胞,而且缺乏选择性[1]。单抗类抗肿瘤药是一种新型抗肿瘤药,与传统的抗肿瘤药相比,其治疗恶性肿瘤的疗效较高,有助于提高患者的生存率,但同样易出现多种药品不良反应(ADR)[2]。本研究对我院单抗类抗肿瘤药致ADR 148例进行回顾性分析,旨在总结此类药物ADR发生的特点及规律,为临床合理使用提供参考。
1 资料与方法
收集我院2012年11月-2016年2月上报的抗肿瘤药致ADR报告,通过手工归类及Excel表格整理,筛选单抗类抗肿瘤药致ADR 148例。统计患者的性别、年龄、原患疾病、药品名称、ADR发生时间、临床表现、治疗及转归等信息。
2 结果
2.1一般资料
148例ADR中,男性患者80例,女性患者68例,男女比例为1.176 5∶1;年龄8~88岁,平均年龄(53.82±13.56)岁,高发年龄为50~59岁,占32.43%,具体见表1。
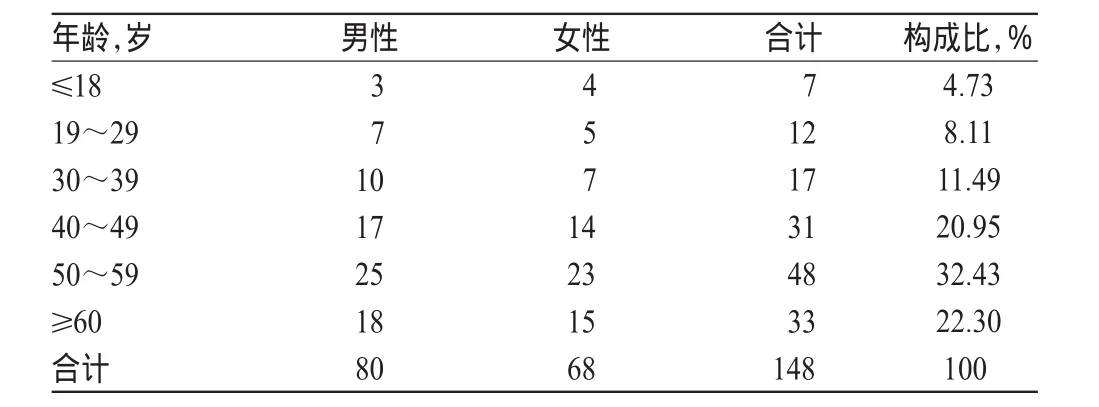
表1 单抗类抗肿瘤药致ADR患者的性别与年龄分布(例)Tab 1 Distribution of patients’gender and age in ADR cases induced by monoclonal antitumor drugs(case)
2.2原患疾病
148例ADR中,原患疾病为非霍奇金淋巴瘤的比例最高,为37.84%,其次为乳腺癌和结肠癌,两者分别为19.59%和8.11%,具体见表2。
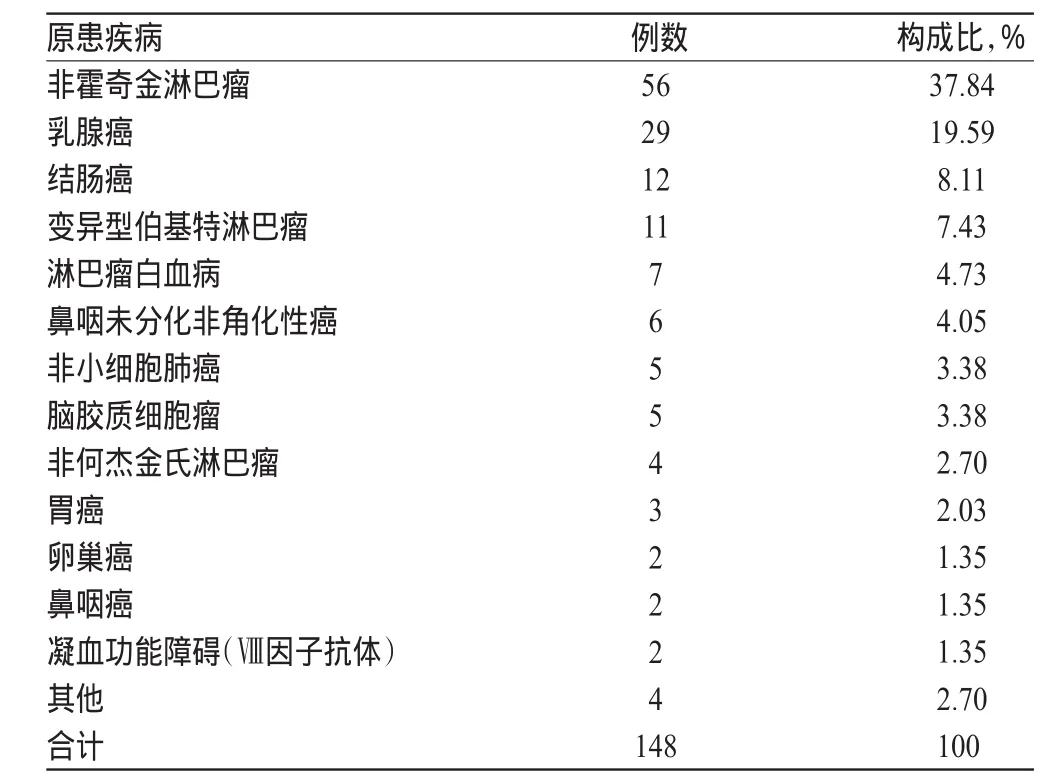
表2 单抗类抗肿瘤药致ADR患者原患疾病情况Tab 2 Primary diseases of patients with ADR induced by monoclonal antitumor drugs
2.3引发ADR的药物品种及构成比
本研究共涉及到5种单抗类抗肿瘤药,包括贝伐珠单抗注射液、注射用曲妥珠单抗、西妥昔单抗注射液、利妥昔单抗注射液和尼妥珠单抗注射液,其中利妥昔单抗注射液致ADR的比例最高,为47.97%,其次为注射用曲妥珠单抗和贝伐珠单抗注射液,分别占25.00%和10.81%,最后为尼妥珠单抗注射液和西妥昔单抗注射液,分别占9.46%和6.76%,具体见表3。

表3 引发ADR的单抗类抗肿瘤药品种及构成比Tab 3 Kind of ADR-inducing monoclonal antitumor drugs and constituent ratio
2.4ADR发生时间
148例ADR中,发生时间<1 d占54.73%,其次为2~7 d(29.73%)和8~30 d(13.51%),>30 d的最少,占2.03%,具体见表4。

表4 单抗类抗肿瘤药致ADR的发生时间Tab 4 Occurrence time of ADR induced by monoclonal antitumor drugs
2.5ADR累及器官/系统及临床表现
单抗类抗肿瘤药致ADR可累及多个器官/系统,其中累及消化系统最多,占41.89%,临床表现主要有慢性肝纤维化、食欲减退、便秘、恶心、呕吐、肝功能异常、腹泻、溃疡、腹痛、化学性肝炎等;其次为血液及造血系统,占10.81%,临床表现主要有粒细胞异常、白细胞异常、骨髓抑制、血红蛋白异常、血小板异常等,具体见表5。

表5 单抗类抗肿瘤药致ADR累及器官/系统及临床表现Tab 5 Systems/organs involved in ADR induced monoclonal by antitumor drugs and clinical manifestations
2.6ADR严重程度、治疗及转归
148例ADR中,一般的ADR 139例,占93.92%;严重的ADR 9例,占6.08%;新的一般的ADR 5例,占3.38%;新的严重的ADR 2例,占1.35%。
148例ADR均采取对症处理,其中痊愈47例,占31.76%;好转99例,占66.89%;无效2例,占1.35%。ADR治疗总有效率[(痊愈例数+好转例数)/总例数×100%]为98.65%,治疗效果较为明显。
3 讨论
3.1性别、年龄及原患疾病情况
据相关资料报道,肿瘤发病情况存在显著的性别差异,其中男性发病率远高于女性[3]。单抗类抗肿瘤药致ADR也存在显著的性别差异,男性ADR的发生率高于女性[4]。本研究男性比例高于女性,男女比例为1.176 5∶1,与肿瘤发病的性别差异一致。年龄方面,单抗类抗肿瘤药致ADR可出现在任何年龄阶段,但多见于中老年人群。本研究ADR高发年龄在50~59岁,其次为≥60岁。这可能与该年龄段肿瘤发生率高或中老年人的机体功能有关。
单抗类抗肿瘤药致ADR的原患疾病较多,包括结肠癌、乳腺癌、非霍奇金淋巴瘤、鼻咽未分化非角化性癌、胃癌、非何杰金氏淋巴瘤、脑胶质细胞瘤等。本研究原患疾病为非霍奇金淋巴瘤的比例最多,占37.84%,其次为乳腺癌和结肠癌,两者分别占19.59%和8.11%。近年来,非霍奇金淋巴瘤、乳腺癌、结肠癌等发病率出现逐年增长的趋势,其应用单抗类抗肿瘤药的几率逐年增加,因此所致ADR的比例也在增加[5]。
3.2单抗类抗肿瘤药
本研究共涉及到5种单抗类抗肿瘤药,即贝伐珠单抗注射液、注射用曲妥珠单抗、西妥昔单抗注射液、利妥昔单抗注射液和尼妥珠单抗注射液。贝伐珠单抗注射液是一种重组人源化单克隆抗体,其作用机制是中和血管内皮生长因子(VEGF),抑制其与内皮细胞上的受体结合,进而影响和抑制肿瘤细胞吸收养分和氧,以此起到抗肿瘤的功效,不良反应主要有栓塞性疾病、胃穿孔等[6]。注射用曲妥珠单抗是一种重组DNA衍生的人源化单克隆抗体,其可以影响人表皮生长因子受体2(Her-2)阳性肿瘤,阻断Her-2介导的信号传导途径,从而达到对Her-2活性的有效抑制,不良反应有头痛、恶心、呕吐、腹泻、发热、乏力和皮疹等[7]。西妥昔单抗注射液可与表皮生长因子受体(EGFR)选择性的结合,具有较强的抗瘤活性,不良反应有发热、呕吐、恶心、腹泻和黏膜炎等[8]。利妥昔单抗注射液主要通过杀伤B细胞,减少B细胞分泌的抗体,抑制T细胞功能,从而起到治疗肿瘤的作用,不良反应有腹胀、腹痛、颈痛、胸痛、背痛、腹泻和心律失常等[9]。尼妥珠单抗注射液是新型的肿瘤分子靶向治疗药物,主要通过阻断EGFR与其配体的结合,并对EGFR过度表达的肿瘤具有抗细胞增殖及促凋亡作用,不良反应有皮疹、轻度发热、恶心、头晕和血压下降等[10]。
5种单抗类抗肿瘤药均具有较强的抗瘤活性,在多种肿瘤疾病中发挥着重要的作用,取得较佳的疗效,但同时也存在不足之处,如价格昂贵、不良反应发生率高等。本研究利妥昔单抗注射液致ADR的比例最高,为47.97%,之后依次为注射用曲妥珠单抗、贝伐珠单抗注射液、尼妥珠单抗注射液和西妥昔单抗注射液。
3.3ADR发生时间、累及器官/系统及临床表现
单抗类抗肿瘤药致ADR多出现在用药后1 d内,由于症状较为明显,因此可通过对症处理,及时降低ADR对肿瘤患者造成的不利影响,但也有一些ADR属于迟发型,在停药后30 d甚至数月后才发现,对这些ADR应给予高度重视[11]。
单抗类抗肿瘤药致ADR涉及到多个器官/系统。肖若媚等[12]对310例单抗类抗肿瘤药致ADR进行分析,发现主要累及器官/系统有皮肤黏膜、血液系统、心脏毒性和消化系统等,临床表现有皮疹、咽炎、口腔黏膜炎、血小板减少、骨髓抑制、贫血、心肌损伤、心律失常、腹泻、腹痛、恶心和呕吐等。本研究ADR累及的器官/系统较肖若媚等报道多,主要包括呼吸系统、神经系统、内分泌系统、消化系统、皮肤及其附件、循环系统、五官、血液及造血系统、肌肉骨骼系统和泌尿生殖系统等,其中累及消化系统的比例最高,其次为血液及造血系统,临床表现以恶心、呕吐等消化道不适症状为主。
3.4ADR的防治措施
对于单抗类抗肿瘤药致ADR,通常选择对症处理。本研究148例ADR经过对症处理后,总有效率为98.65%,治疗效果较为明显。为了降低单抗类抗肿瘤药致ADR发生率,在临床中需做到几下几点:
(1)科学用药。不合理使用是单抗类抗肿瘤药致ADR产生的重要原因,在临床治疗中,只有依据病症科学用药,才能降低ADR的发生。(2)加强单抗类抗肿瘤药物的管理。医院应加强单抗类抗肿瘤药的管理,不断规范其进货渠道,定期进行质量检查,加强质量跟踪[11]。使用单抗类抗肿瘤药前,需观察药物是否出现沉淀现象,观察其色泽是否正常,若药物存在澄明度问题,则必须禁止使用[13]。(3)加强临床医师的教育。首先,要加强临床医师单抗类抗肿瘤药理论的教育,加强合理用药的宣传,使临床医师能够做到科学、合理地应用药物,减少单抗类抗肿瘤药的不合理使用[14]。其次,要建立健全单抗类抗肿瘤药的相关制度,通过制度约束临床医师的用药行为,同时要加大单抗类抗肿瘤药临床使用的考核力度,建立单抗类抗肿瘤药临床使用信息服务平台[15]。再次,临床医师在单抗类抗肿瘤药临床使用中,要严格参照说明书进行,不仅要确保所使用的药物符合相关的功能主治范围,而且要遵守说明书所规定的给药方式、剂量和疗程等[16]。(4)用药前,要警惕可能存在的ADR,提前做好各项应对措施,以降低ADR造成的后果[17]。
综上所述,单抗类抗肿瘤药致ADR多见于中老年人群,原发疾病以非霍奇金淋巴瘤、乳腺癌和结肠癌为主,且多发生在用药后1 d内,累及多个器官/系统,对患者危害大,应引起关注,加强临床用药管理,做好应对措施,以降低ADR发生率。
[1]李海蓉,董利红.抗肿瘤药致不良反应473例分析[J].中国药房,2014,25(10):926.
[2]蒙光义,韦银,庞家莲,等.我院215例抗肿瘤药致不良反应报告分析[J].中国药房,2014,25(34):3 233.
[3]李然,赵冰清,张艳华.贝伐珠单抗治疗恶性肿瘤的不良反应分析[J].中国新药杂志,2013,22(17):2 097.
[4]韩丹,储文功,代菲.125例贝伐珠单抗注射液的不良反应报告分析[J].中国医院药学杂志,2013,33(9):749.
[5]李蓉,董志,路晓钦,等.重庆市818例抗肿瘤药不良反应报告分析[J].中国药房,2013,24(34):3 225.
[6]钱锦,闫鹏,张凯.回顾性研究422例抗肿瘤类药物不良反应报告[J].中国医院药学杂志,2013,33(18):1 557.
[7]Garlipp B,Schwalenberg J,Adolf D,et al.Epidemiology,surgicalmanagement and early postoperative outcome in a cohort of gastriccancer patients of a tertiary referral center in relation to multi-center quality assurance studies[J].Pol Przegl Chir,2011,83(3):123.
[8]沈冬,茅卫东,刘少平,等.尼妥珠单抗联合顺铂同步放化疗中晚期鼻咽癌的效果[J].广东医学,2012,33(24):3 809.
[9]欧汝奋.85例抗肿瘤药物不良反应临床分析[J].北方药学,2012,9(3):14.
[10]邢放,许健,邢蓉.我院144例抗肿瘤药不良反应分析[J].安徽医药,2014,18(8):1 586.
[11]Han M,Diao YY,Jiang HL,et al.Molecular mechanism study ofchemosensitization of doxorubicin-resistant human myelogenousleukemia cells induced by a composite polymer micelle[J].Int J Pharm,2011,420(2):404.
[12]肖若媚,廖础欣,王桂凤.中山市某三甲医院单抗类抗肿瘤药应用分析[J].现代医院,2015,15(4):93.
[13]贾守薇,刘韬,黄红兵.分子靶向抗肿瘤药物的不良反应及其处理对策[J].肿瘤药学,2014,4(1):2.
[14]杨开宁.抗肿瘤药物不良反应298例临床分析[J].临床合理用药杂志,2014,7(1):56.
[15]刘韬,陈富钦,黄雪玲,等.贝伐珠单抗超说明书适应症用药情况调研[J].今日药学,2013,23(10):667.
[16]李小梅,郑咏池.2011年至2013年成都地区医院抗肿瘤药物使用状况分析[J].中国药业,2015,24(16):124.
[17]刘剑,徐韶东.常见铂类抗肿瘤药物不良反应的比较与防治[J].中国药房,2013,24(30):2 857.
(编辑:晏妮)
Analysis of 148Cases ofADR Induced by MonoclonalAnticancer Drugs in Our Hospital
XU Xu1,HUANG Xin’en2(1.Taizhou Third People’s Hospital,Jiangsu Taizhou 225300,China;2.Jiangsu Tumor Hospital,Nanjing 210009,China)
OBJECTIVE:To analyze the characteristics and laws of ADR induced by monoclonal antitumor drugs,and to provide reference for clinical medication safety.METHODS:148 cases of ADR induced by monoclonal antitumor drugs were selected from our hospital during Jan.2012-Feb.2016,and analyzed statistically in respects of patients’gender and age,primary disease,drug kind,the occurrence of ADR,clinical manifestations,treatment and outcome,etc.RESULTS:Among 148 ADR cases,there were 80 male and 68 female with ratio of 1.176 5∶1.High-risk aged 50 to 59 years old(32.43%);of primary disease,the proportion of non-Hodgkin lymphoma was the highest(37.84%);5 kinds of drugs were involved,among which ADR induced by Rituximab injection took up the highest proportion(47.97%);most of ADR occurred within 1 d after medication(54.73%);ADR mainly involved digestive system(41.89%);main clinical manifestations were chronic hepatic fibrosis,loss of appetite,constipation,nausea and vomiting;there were 9 severe ADR cases(6.08%),5 new general ADR cases(3.38%)and 2 new severe ADR cases(1.35%).After symptomatic treatment,the total effective rate was 98.65%.CONCLUSIONS:ADR induced by monoclonal antitumor drugs appear in all ages,the primary disease is wide;it causes multiple systems/orgars involved and complex clinical manifestations,great harm.Therefore,great importance should be attached to rational drug use monitoring and countermeasures in order to improve the safety of drug use.
Monoclonal anticancer drugs;ADR;Analysis;Rituximab;Non-Hodgkin lymphoma
R969.3;R979.1
A
1001-0408(2016)32-4512-03
10.6039/j.issn.1001-0408.2016.32.15
*副主任医师。研究方向:消化道肿瘤。电话:0523-86903089。E-mail:357345283@qq.com
(2016-03-18
;2016-07-18)

