尼古丁上调星形胶质细胞内源性Cryab抑制Aβ聚集的研究
任真奎, 杨 梅, 官志忠,2, 禹文峰
尼古丁上调星形胶质细胞内源性Cryab抑制Aβ聚集的研究
任真奎1, 杨 梅1, 官志忠1,2, 禹文峰1
目的 研究尼古丁激活星形胶质细胞α7胆碱能受体(α7 nicotinic receptors,7 nAChRs)上调内源性B-晶状体蛋白(αB-crystallin,Cryab)并抑制β淀粉样蛋白(Amyloid,Aβ)集聚的现象及其机制。方法 分离24 h内新生乳鼠大脑皮质培养原代星形胶质细胞并鉴定;体外制备Aβ1-42寡聚体;将细胞分为对照组、尼古丁组、α7 nAChRs阻断剂(methyllycaconitine,MLA)组、Aβ1-42组、尼古丁+Aβ1-42组、PI3K信号通路阻断剂LY294002+尼古丁+Aβ1-42组。用蛋白印迹法(Western blotting)检测细胞内Cryab、P-Akt(ser473)、Aβ寡聚体的表达水平。结果 尼古丁可以显著上调星形胶质细胞内源性Cryab蛋白(P<0.05);尼古丁能够显著上调磷酸化Akt蛋白水平(P<0.05);在细胞裂解液及培养基中,尼古丁显著增强星形胶质细胞对Aβ聚集的抑制作用(P<0.01)。结论 尼古丁通过激活星形胶质细胞α7 nAChRs上调内源性Cryab从而抑制Aβ集聚;PI3K/Akt信号通路可能参与尼古丁激活星形胶质细胞α7 nAChRs上调内源性Cryab蛋白抑制Aβ集聚的过程。为进一步研究尼古丁抑制Aβ集聚的可能机制提供了实验基础。
星形胶质细胞; 阿尔茨海默氏病; α7胆碱能受体; 尼古丁; B-晶状体蛋白; β淀粉样蛋白
阿尔茨海默病(Alzheimer’s disease,AD)是一种以进行性记忆和认知功能障碍为特征的中枢神经系统退行性疾病。由于缺乏早期预防意识,AD对老年人群的危害将日趋严重。Aβ聚集是AD核心发病机制,Aβ的聚集不仅可以导致神经细胞凋亡,也可以破坏突触结构和功能,从而导致记忆和认知功能障碍[1~3]。此外,Aβ的聚集能够激活星形胶质细胞释放细胞因子、炎性因子从而导致脑内的神经炎症[4]。因此,阻止Aβ的聚集及其发生和发展,对防治AD有重要意义。α7 nAChRs广泛分布于大脑皮质和海马的神经元、星形胶质细胞和小胶质细胞[5]。在AD的发病机制中,α7 nAChRs 通过与Aβ的相互作用而扮演了重要的病理角色[6]。近年来的研究表明,α7 nAChRs可能是拮抗Aβ神经毒性的一个重要靶点[7]。B-晶状体蛋白(αB-crystallin,Cryab)在大脑内具有许多重要的生理功能:抗炎、抗凋亡和神经保护等[8,9]。
我们前期研究结果证实,用尼古丁激活星形胶质细胞a7 nAChRs能够显著增强星形胶质细胞对 Aβ聚集的抑制,但具体调控机制不清楚。基于Cryab蛋白的特性,我们推测星形胶质细胞内源Cryab蛋白可能是尼古丁介导Aβ聚集的中间环节。
1 材料与方法
1.1 主要仪器和试剂 胎牛血清及DMEM培养基购于Gibco公司(美国);Aβ1-42肽、六氟异丙醇、DMSO、尼古丁、methyllycaconitine (MLA)购于Sigma公司(美国);青-链链霉素及胰蛋白酶购于Hyclone公司(美国);6E10抗体购自BioLegend公司(美国);鼠抗Cryab(αB-crystallin)单克隆抗体购自Abcam公司(美国);辣根过氧化物酶(HRP)标记的抗兔、抗鼠二抗;鼠抗-肌动蛋白(-actin)单克隆抗体;PI3K/Akt信号通路的抑制剂LY294002及相关位点的抗体购于CST公司(美国); 抗体稀释液、封闭液、聚丙烯酰胺凝胶购自碧云天公司;高效显影胶片、显影液、定影液购自柯达公司;ECL-Plus试剂及聚乙烯二氟(PVDF)膜购于Millipore公司(美国);BCA蛋白浓度测定试剂盒购自Thermo公司(美国);倒置显微镜(Olympus);-80 ℃冰箱(美国Thermo公司);高速离心机(德国eppendorf公司);ELX 800酶标仪(美国 Bio-tec公司); CO2培养箱(日本SANYO公司) 。
1.2 Aβ1-42寡聚体的制备 参照Klein等[10,11]体外制备Aβ1-42寡聚体的方法,将预冷的HFIP加入Aβ1-42粉末中,使其充分溶解后常温孵育60 min。随后为使HFIP挥发完全,将其放在常温下通风橱过夜。将干燥的肽膜于-80 ℃保存,使用时取出用DMSO溶解,再用含SDS的PBS稀释后,4 ℃存放2 w,冰冻高速离心机(10 min、14000 g)上清液即为寡聚体。
1.3 星形胶质细胞培养传代及鉴定 参照Mc Carthy[12]等的方法并改进,取24~48 h内新生SD(Sprague-Dawley)乳鼠的大脑皮质(由贵州医科大学动物实验中心提供),动物合格证号为SCXK(黔)2012-0001,将其大脑皮质剪成泥状,消化漂洗后,加入含1%双抗(青霉素100 U/ml,链霉素100 U/ml)、10%FBS的高糖DMEM培养基,吹打成细胞悬液,接种至培养瓶,5% CO2、37 ℃恒温培养。24 h后换液,之后每3 d换一次液直至细胞铺满瓶底。培养8~9 d,纯化并传3~4代。胶质纤维酸性蛋白(Glial fibrillary acidic protein,GFAP)细胞免疫荧光的方法对星形胶质细胞进行染色鉴定细胞纯度。
1.4 分组及细胞处理 将培养好的星形胶质细胞纯化、传代并鉴定后,以5×105的密度种入六孔板内。将细胞分为对照组、尼古丁组、尼古丁+MLA组、Aβ1-42组、尼古丁+Aβ1-42组、尼古丁+LY294002组、尼古丁+LY294002+Aβ1-42组。尼古丁+MLA组,预先加入MLA处理2 h,随后加入尼古丁;尼古丁+LY294002+Aβ1-42组,预先加入LY294002处理2 h,随后加入尼古丁孵育18 h,换液后,用DMEM培养基吹洗3次,加入终浓度为1 μmol/L的Aβ1-42寡聚体继续在37 ℃、5% CO2培养箱中培养24 h。
1.5 蛋白印迹法 从六孔版中收集细胞,加入细胞裂解液裂解(100 μl/孔),在4 ℃、12000转离心20 min后取上清,将提取的蛋白质用BCA蛋白定量试剂盒定量后分装保存(-80 ℃),用Western blotting方法检测Cryab、P-Akt(ser473)及Aβ蛋白表达水平。12%的梯度胶电泳,蛋白样品分离后转移至PVDF膜,5%BSA室温封闭1 h,TBS-T漂洗(3次×10 min),加入相应一抗,4 ℃孵育过夜,TBS-T漂洗(3次×10 min)后加入辣根过氧化物酶标记二抗室温孵育1 h,TBS-T漂洗(3次×10 min)后曝光。用ImageJ软件分析曝光结果,以β-肌动蛋白(β-actin)为内对照。
1.6 统计学分析 所有结果应用SPSS 22.0 软件进行统计学分析,两组间比较采用t检验,多组间采用one-way ANOVA分析,P<0.05表示差异有统计学意义。
2 结 果
2.1 尼古丁显著增强星形胶质细胞对Aβ聚集的抑制作用 在原代星形胶质细胞培养模型上,用α7 nAChRs激动剂尼古丁处理细胞,能够显著增加星形胶质细胞对细胞内和细胞培养液内Aβ聚集的抑制作用(见图1)。
2.2 尼古丁通过激活α7胆碱能受体而上调Cryab蛋白水平 尼古丁刺激星形胶质细胞后α7胆碱能受体(α7 nAChRs)的表达上调,为了探索尼古丁是否通过激活α7胆碱能受体而上调Cryab蛋白。本研究选取α7胆碱能受体的特异性阻断剂MLA,以100 nmol/L MLA预先处理星形胶质细胞2 h后,再加入尼古丁5 μmol/L共同孵育18 h。MLA刺激星形胶质细胞后尼古丁上调内源性Cryab的效应受到抑制(见图2)。
2.3 PI3K/Akt信号通路参与尼古丁激活α7 nAChRs上调星形胶质细胞内源性Cryab蛋白 以10 μmol/L LY294002或100 nmol/L MLA预先处理星形胶质细胞2 h后,再加入尼古丁5 μmol共同孵育20 min。尼古丁上调P-Akt(ser473)蛋白的效应受到抑制(见图3)。为进一步探索PI3K/Akt信号通路的抑制剂LY294002能否抑制星形胶质细胞内源性Cryab蛋白的上调。用LY294002预先处理星形胶质细胞2 h,再加入尼古丁共同孵育18 h。星形胶质细胞内源性Cryab的表达受到抑制(见图4)。
2.4 尼古丁显著增强星形胶质细胞对Aβ聚集的抑制作用与PI3K/Akt信号通路的激活相关 用LY294002预先处理星形胶质细胞2 h,再加入尼古丁孵育18 h,最后加入Aβ共同孵育24 h。分别收集细胞裂解液及培养基,对照组Aβ蛋白不表达。与Aβ1-42组相比,(尼古丁+Aβ1-42)组的Aβ蛋白显著下调(P<0.01);与(尼古丁+Aβ1-42)组相比,(尼古丁+Aβ1-42+LY294002)组的Aβ蛋白显著上调(P<0.01)(见图5)。说明尼古丁激活α7 nAChRs之后,通过PI3K/Akt信号通路上调Cryab,从而抑制Aβ的集聚。
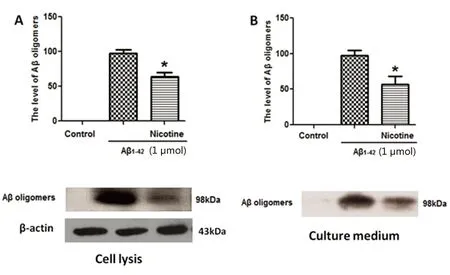
与Aβ组相比*P<0.01

与对照组相比*P<0.05;与尼古丁组相比#P<0.05
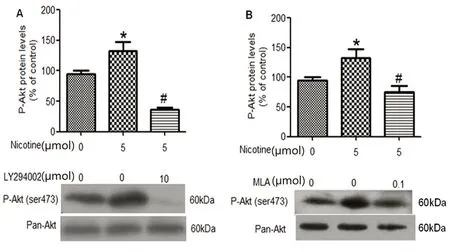
与对照组相比*P<0.05;与尼古丁组相比#P<0.01
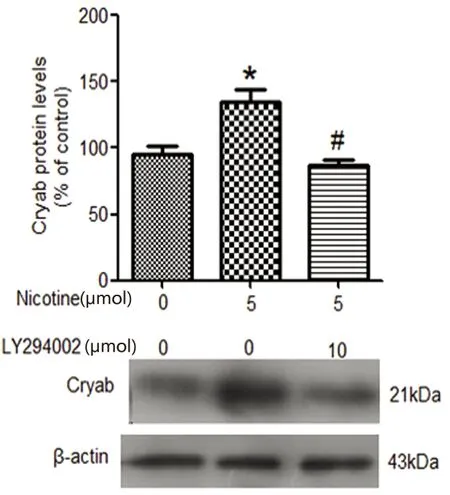
与对照组相比*P<0.05;与尼古丁组相比#P<0.01
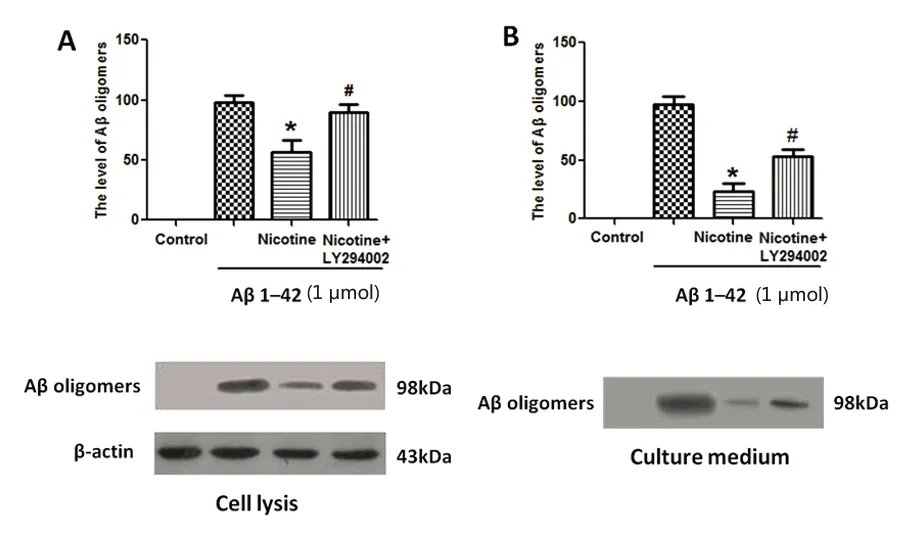
与Aβ1-42组相比*P<0.01;与(尼古丁+Aβ1-42)组相比#P<0.01
图5 尼古丁通过激活PI3K/Akt信号通路而抑制β-淀粉样蛋白的集聚
3 讨 论
Aβ的聚集是一个多因素参与的复杂过程,星形胶质细胞在Aβ的聚集和沉积过程中扮演重要病理角色。在中枢神经系统中星形胶质细胞数量最多而且参与重要的生理功能:防止神经元损伤、提供代谢、营养支持和调节突触活动[13]。星形胶质细胞在Aβ聚集和沉积过程中具有双重病理角色。一方面,激活的星形胶质细胞能够通过大量分泌细胞因子、炎性因子和一氧化氮等神经毒性物质而导致AD脑内的神经炎症发生[14];另一方面,活化的星形胶质细胞也能够表达与Aβ降解有关的酶,对Aβ进行有效的吞噬和降解[15,16]。基于以上事实,促进星形胶质细胞对Aβ聚集和沉积的抑制功能可能成为治疗AD的一个重要方向。α7胆碱能受体是配体门控离子通道家族中的成员。它由5个跨膜亚基组成,有一个大的胞外氨基端,4个跨膜结构域和一个胞浆域[17,18]。α7 nAChRs广泛分布于大脑皮质和海马的神经元、星形胶质细胞和小胶质细胞[5]。在 AD 的发病机制中,α7 nAChRs通过与Aβ的相互作用而扮演了重要的病理角色[6]。近年来的研究表明,α7 nAChRs可能是拮抗Aβ神经毒性的一个重要靶点。在神经元细胞中,α7 nAChRs能够通过激活多条细胞内信号通路而拮抗Aβ导致的神经细胞凋亡[19]。在我们的前期结果中,用尼古丁处理星形胶质细胞后发现α7 nAChRs的表达上调,并且能显著抑制Aβ聚集。本研究发现尼古丁通过激活α7胆碱能受体而上调Cryab蛋白水平,由此可推测尼古丁是通过激活星形胶质细胞的α7 nAChRs后上调内源性Cryab从而抑制Aβ的聚集。
有研究表明,PI3K/AKT信号通路参与了α7 nAChRs的神经保护功能,在阿尔茨海默病研究中发现,Akt在海马神经元中表达减少,继而导致神经元凋亡[19]。我们的实验结果发现,用尼古丁处理星形胶质细胞能显著上调Akt的磷酸化,该上调作用被PI3K/Akt信号通路的抑制剂LY294002或α7 nAChRs的阻断剂(MLA)所抑制。这说明尼古丁通过激活α7 nAChRs后,使PI3K/Akt信号通路激活引起细胞内相应的效应。进一步的研究发现LY294002能抑制尼古丁上调内源性Cryab蛋白表达。这些结果表明,尼古丁通过α7 nAChRs上调星形胶质细胞内源性Cryab蛋白与PI3K/Akt信号通路的激活相关。上调Akt能对抗Aβ诱导的神经元凋亡和tau蛋白磷酸化[20]。尼古丁处理星形胶质细胞后,能明显抑制Aβ的聚集,并且该作用能被LY294002阻断,说明尼古丁通过α7 nAChRs抑制Aβ的聚集与PI3K/Akt信号通路的激活相关,而且该过程可能有内源性Cryab蛋白的参与。因为在AD大脑中,星形胶质细胞表达的Cryab蛋白明显上调,并且这些上调的Cryab蛋白紧密地分布在Aβ蛋白沉积周围[21,22]。Cryab蛋白能够通过与Aβ蛋白直接结合等方式有效地阻止Aβ蛋白的聚集及其细胞毒性作用[23,24]。
综上所述,尼古丁通过激活星形胶质细胞α7 nAChRs上调内源性Cryab从而抑制Aβ集聚;PI3K/Akt信号通路很可能是尼古丁通过星形胶质细胞α7 nAChRs上调内源性Cryab蛋白从而抑制Aβ集聚过程的重要参与因素。为进一步研究Cryab蛋白可能是治疗AD的一个潜在靶点提供了一定的基础。
[1]Rijal UA,Capetillo-Zarate E,Kosterin I,et al.Dispersible amyloid beta-protein oligomers,protofibrils,and fibrils represent diffusible but not soluble aggregates:their role in neurodegeneration in amyloid precursor protein (APP) transgenic mice[J].Neurobiol Aging,2012,33(11):2641-2660.
[2]Walsh DM,Klyubin I,Fadeeva JV,et al.Naturally secreted oligomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo[J].Nature,2002,416(6880):535-539.
[3]Shankar GM,Li S,Mehta TH,et al.Amyloid-beta protein dimers isolated directly from Alzheimer’s brains impair synaptic plasticity and memory[J].Nat Med,2008,14(8):837-842.
[4]Heneka MT,O’Banion MK.Inflammatory processes in Alzheimer’s disease[J].J Neuroimmunol,2007,184(1~2):69-91.
[5]Bourdin CM,Lebreton J,Mathe-Allainmat M,et al.Pharmacological profile of zacopride and new quaternarized fluorobenzamide analogues on mammalian alpha7 nicotinic acetylcholine receptor[J].Bioorg Med Chem Lett,2015,25(16):3184-3188.
[6]Parri HR,Hernandez CM,Dineley KT.Research update:Alpha7 nicotinic acetylcholine receptor mechanisms in Alzheimer’s disease[J].Biochem Pharmacol,2011,82(8):931-942.
[7]Ni R,Marutle A,Nordberg A.Modulation of α7 nicotinic acetylcholine receptor and fibrillar amyloid-β interactions in Alzheimer’s disease brain[J].J Alzheimer’s Disease Jad,2013,33(3):1-4.
[8]Bhat R,Steinman L.Innate and adaptive autoimmunity directed to the central nervous system[J].Neuron,2009,64(1):123-132.
[9]Ousman SS,Tomooka BH,van Noort JM,et al.Protective and therapeutic role for alphaB-crystallin in autoimmune demyelination[J].Nature,2007,448(7152):474-479.
[10]Klein WL.Abeta toxicity in Alzheimer’s disease: globular oligomers (ADDLs) as new vaccine and drug targets[J].Neurochem Int,2002,41(5):345-352.
[11]Ryan DA,Narrow WC,Federoff HJ,et al.An improved method for generating consistent soluble amyloid-beta oligomer preparations for in vitro neurotoxicity studies[J].J Neurosci Methods,2010,190(2):171-179.
[12]Schildge S,Bohrer C,Beck K,et al.Isolation and culture of mouse cortical astrocytes[J].J Vis Exp,2013,71:5007-5008.
[13]Sidoryk-Wegrzynowicz M,Wegrzynowicz M,Lee E,et al.Role of astrocytes in brain function and disease[J].Toxicol Pathol,2011,39(1):115-123.
[14]Li C,Zhao R,Gao K,et al.Astrocytes: implications for neuroinflammatory pathogenesis of Alzheimer’s disease[J].Curr Alzheimer Res,2011,8(1):67-80.
[15]Pihlaja R,Koistinaho J,Malm T,et al.Transplanted astrocytes internalize deposited beta-amyloid peptides in a transgenic mouse model of Alzheimer’s disease[J].Glia,2008,56(2):154-163.
[16]Heurling K,Buckley C,Vandenberghe R,et al.Separation of beta-amyloid binding and white matter uptake of (18)F-flutemetamol using spectral analysis[J].Am J Nucl Med Mol Imaging,2015,5(5):515-526.
[17]Paterson D,Nordberg A.Neuronal nicotinic receptors in the human brain[J].Prog Neurobiol,2000,61(1):75-111.
[18]Lotfipour S,Mandelkern M,Brody AL.Quantitative molecular imaging of neuronal nicotinic acetylcholine receptors in the human brain with A-85380 radiotracers[J].Curr Med Imaging Rev,2011,7(2):107-112.
[19]Kawamata J,Shimohama S.Stimulating nicotinic receptors trigger multiple pathways attenuating cytotoxicity in models of Alzheimer’s and Parkinson’s diseases[J].J Alzheimers Dis,2011,24(Suppl 2):95-109.
[20]Xu J,Zhang R,Zuo P,et al.Aggravation effect of isoflurane on Abeta(25-35)-induced apoptosis and tau hyperphosphorylation in PC12 cells[J].Cell Mol Neurobiol,2012,32(8):1343-1351.
[21]Wilhelmus MM,Otte-Holler I,Wesseling P,et al.Specific association of small heat shock proteins with the pathological hallmarks of Alzheimer’s disease brains[J].Neuropathol Appl Neurobiol,2006,32(2):119-130.
[22]Wilhelmus MM,de Waal RM,Verbeek MM.Heat shock proteins and amateur chaperones in amyloid-Beta accumulation and clearance in Alzheimer's disease[J].Mol Neurobiol,2007,35(3):203-216.
[23]Raman B,Ban T,Sakai M,et al.AlphaB-crystallin,a small heat-shock protein,prevents the amyloid fibril growth of an amyloid beta-peptide and beta2-microglobulin[J].Biochem J,2005,392(3):573-581.
[24]Wilhelmus MM,Boelens WC,Otte-Holler I,et al.Small heat shock proteins inhibit amyloid-beta protein aggregation and cerebrovascular amyloid-beta protein toxicity[J].Brain Res,2006,1089(1):67-78.
Nicotine inhibit Aβ aggregation via upregulation endogenous Cryab in astrocytes
REN Zhenkui,YANG Mei,GUAN Zhizhong,et al.
(Key Lab of Medical Molecular Biology,Guizhou Medical University,Guiyang 550004,China)
Objective To investigate the possible mechanism of nicotine on amyloid β(Aβ) aggregation via activation α7 nAChRs as well as upregulation endogenous Cryab.Methods Primary astrocytes culture were separated from neonatal SD rat cerebral cortex;Aβ1-42oligomers were prepared in vitro.The astrocytes were divided into control group,nicotine group,MLA group,Aβ1-42group,nicotine+Aβ1-42group,nicotine+LY294002+Aβ1-42group.The protein levels of Cryab,phosphorylated-Akt (ser473) and Aβ oligomers in the cells was detected by Western blot.Results Nicotine significantly increased endogenous Cryab in astrocytes (P<0.05).Nicotine significantly increased phosphorylated-Akt in astrocytes.In cell lysis solution and medium,Nicotine significantly enhanced astrocyte to inhibit Aβ aggregation (P<0.01).Conclusions Nicotine can significantly inhibit Aβ aggregation via activated α7 nAChRs as well as upregulation endogenous Cryab in astrocytes.PI3K/Akt signaling pathway is likely to be involved in this process.This study provided experimental data on the possible mechanism of nicotine inhibit Aβ aggregation.
Astrocytes; Alzheimer’s disease; α7nAChRs; Nicotine; αB-crystallin; Amyloid
1003-2754(2016)10-0897-04
2016-06-13;
2016-09-28
国家自然科学基金(批准号:81360199),教育部科学技术研究项目(批准号:213032A),贵州省国际 科技合作计划项目[批准号:黔科合外G字(2013)7026 号],贵州省创新计划项目[黔教合协同创新中心(2014)06]
(1.贵州医科大学医学分子生物学重点实验室,贵州 贵阳 550004;2.贵州医科大学病理学教研室,贵州 贵阳 550004)
禹文峰,E-mail:wenfengyu2013@126.com
R749.1
A

