非高密度脂蛋白胆固醇(non-HDL-C)与颅内外动脉硬化狭窄的关系
刘 洋, 郭 阳
非高密度脂蛋白胆固醇(non-HDL-C)与颅内外动脉硬化狭窄的关系
刘 洋, 郭 阳
目的 探讨中国人群非高密度脂蛋白胆固醇(non-HDL-C)与颅内外动脉硬化狭窄的关系。方法 选急性脑梗死266例为实验组,同期入院无脑动脉硬化65例为对照组,比较组间一般临床特征,将P<0.05各变量纳入多元回归分析。据动脉硬化部位、程度及斑块类型将实验组分为不同亚组,比较组间non-HDL-C水平。结果 颅内外动脉硬化各组non-HDL-C与对照组比较P<0.05,差异具有统计学意义;多元Logistic回归分析,non-HDL-C在校正其它相关危险因素后(OR值=3.8,95%CI:2.21-6.54,P<0.001);不同动脉硬化部位、硬化程度组间non-HDL-C比较P>0.05,差异无统计学意义;颈动脉不同斑块类型组间non-HDL-C比较P<0.05,差异具有统计学意义。结论 non-HDL-C是颅内外动脉硬化的危险因素,可能成为颅内动脉硬化的独立危险因素;non-HDL-C与颅内外动脉硬化部位及程度无相关性;non-HDL-C与颈动脉硬化斑块稳定性有关。
非高密度脂蛋白胆固醇; 颅内动脉硬化; 颈动脉硬化
非高密度脂蛋白胆固醇(non-HDL-C)指除了高密度脂蛋白以外的所有脂蛋白中胆固醇含量的总和,既包含了富含胆固醇脂蛋白(如LDL)中的胆固醇,又包含了富含TG脂蛋白(如CM、VLDL等)中的胆固醇,大量研究证实LDL-C浓度与动脉硬化风险强烈相关[1],LDL-C升高已被证实是冠心病和缺血性脑卒中的独立危险因素之一。2013年国际动脉粥样硬化学会(IAS)将致动脉粥样硬化胆固醇定义为LDL-C和non-HDL-C,并提出non-HDL-C为致动脉硬化胆固醇的主要形式,更能代表致动脉硬化的脂蛋白,甚至可能取代LDL-C成为主要治疗目标。
中国缺血性卒中及短暂性脑缺血发作(TIA)中颅内动脉硬化狭窄或闭塞的发生率为46.6%(其中19.6%合并颈动脉颅外段狭窄)且1 y卒中复发率随狭窄程度增加而升高[2]。积极探讨颅内外动脉硬化的可控危险因素意义重大,以往研究表明,ICAS的主要独立危险因素有高脂血症、LDL-C、高血压、吸烟及糖尿病[3,4]。本研究回顾性收集我院近1 y内急性脑梗死及无脑动脉硬化患者的连续病例资料,探讨non-HDL-C与颅内外动脉硬化的关系。
1 资料与方法
1.1 入选及排除标准 实验组入选标准:(1)急性脑梗死,诊断符合第四届脑血管病会议修订标准[5],行头部MRI+MRA证实;(2)行双侧颈动脉彩超检查;(3)行血脂系列、肝肾功、血浆同型半胱氨酸等常规化验; 对照组入选标准:与实验组同期入院且满足:(1)行头部MRI+MRA及双侧颈动脉彩超检查,结果无梗死及动脉硬化证据;(2)行血脂系列、肝肾功、血浆同型半胱氨酸等; 常规生化指标正常值如下:空腹血糖(FBG,3.9~6.11 mmol/L)、总胆固醇(TC,3.36~5.69 mmol/L)、甘油三酯(TG,0.4~1.69 mmol/L)、高密度胆固醇(HDL-C,1.04~1.83 mmol/L)、低密度胆固醇(LDL-C,正常人群<3.37,高危<2.59,极高危<2.09 mmol/L)、载脂蛋白B(apoB,0.45~1.3 g/L)、载脂蛋白A1(apoA1,1~1.8 g/L)、血浆同型半胱氨酸(HCY,5-15 μmol/L)、尿酸(UA,142~420 μmmol/L)、胱抑素C(Cys-c,0.59~1.03 mg/L)。实验组及对照组排除标准:(1)病因明确的脑栓塞;(2)入院前服用他汀或贝特类降脂药;(3)脑严重器质性病变如脑炎、颅内占位等;(4)严重心脏病如近期急性冠脉综合征、心脏瓣膜病、严重心律失常等;(5)慢性肾功不全、严重肝病如肝硬化、肝癌等;(6)肿瘤、严重感染及血液系统疾病;(7)甲状腺低功行L-T4替代治疗;(8)病史资料不全。
1.2 一般资料 2014年1月-10月于我院神经内科住院且符合上述标准的急性脑梗死患者266例,即实验组,男167例(62.8%),女99例(37.2%),年龄34~90岁,平均(65.82±10.65)岁;对照组65例,男15例(23%),女50例(77%),年龄28~70岁,平均(55.32±9.64)岁。
1.3 检测方法 所有患者禁食12 h以上,次晨抽外周静脉血送至我院检验科,常规生化指标均用雅培C16000全自动生化分析仪测定。
1.4 脑动脉硬化评估及分类标准 (1)动脉狭窄评估手段:美国GE Signa Excite 3.0T超导磁共振扫描仪、彩色多普勒超声诊断仪;(2)观察动脉:颈内动脉及椎动脉颅内段、基底动脉,大脑前、大脑中动脉及大脑后动脉起始段及一级分支;双侧颈内动脉颅外段。正常人大脑前、大脑后动脉起始段和一侧椎动脉变异较多,其不显示或均匀细小,归为正常变异;(3)脑动脉狭窄标准:动脉狭窄处管径与相邻正常管径比较小于50%以上,即狭窄程度(%)=(1-最狭窄处直径/狭窄远端正常动脉管径)×100%;无脑动脉狭窄(NCAS)组:包括无颅内或颅外动脉狭窄及颅内或颅外动脉狭窄程度≤50%;明显狭窄定义为颅内或颅外动脉狭窄≥50%[6]。颈内动脉颅外段狭窄分类(参考2003年美国超声放射学会推荐):正常;轻度,狭窄<50;中度,狭窄为50~69;重度及闭塞,狭窄≥70。
1.5 高血压诊断标准 符合1998年世界卫生组织和世界高血压联盟重新修订的诊断标准:未服抗高血压药情况下,收缩压≥18.7 kPa(140 mmHg)和(或)舒张压≥12.0 kPa(90 mmHg)。
1.6 方法与分组 (1)将331例患者分单纯颅内动脉硬化组(单纯ICAS,139例)、单纯颅外动脉硬化组(单纯ECAS,11例)、颅内颅外均狭窄组(CAS,56例)、无狭窄组(NCAS,60例)以及对照组(65例),无狭窄组(NCAS,60例)包括无颅内或颅外动脉狭窄及颅内或颅外动脉狭窄程度≤50%,比较组间一般临床特征。将P<0.05的因素纳入多元Logistic回归分析;(2)据动脉硬化部位将实验组266例分单纯前循环组(46例)、单纯后循环组(45例)、前后循环组(104例)及无狭窄组(71例),无狭窄组(71例)包括NCAS组60例及单纯ECAS组11例,比较组间non-HDL-C有无统计学差异,分析non-HDL-C与ICAS部位的关系;(3)将单纯ICAS组与CAS组合并为颅内动脉硬化组(ICAS,195例),据狭窄血管条数分层(n为狭窄血管条数),分为ICAS(n=1,57例)、ICAS(n=2,57例)、ICAS(n≥3,81例)、ICAS(n=0,71例),分析non-HDL-C水平与颅内动脉硬化程度的关系;(4)据颈动脉狭窄程度将实验组分无狭窄组(70例)、轻度狭窄组(132例)、中度狭窄组(41例)及重度或闭塞组(23例),分析non-HDL-C与颈动脉狭窄程度的关系;(5)据颈动脉斑块类型将实验组分正常组(29例)、弱回声组(108例)、中回声组(89例)及强回声组(40例),分析non-HDL-C与斑块稳定性的关系。

2 结 果
2.1 组间一般临床特征的比较P值来自于单因素方差分析及校正后t检验,结果non-HDL-C、高血压、糖尿病、吸烟、性别、年龄、TC、LDL、apoB、apoB/apoA1、FBG、HCY的ANOVA检验组间P值<0.001且各组与对照组两两比较,上述各因素P值均<0.05,差异有统计学意义,结果(见表1)。
2.2 将P<0.05的各变量行多元Logistic回归分析 将单因素分析中P<0.05各变量纳入多元逐步Logistic回归分析,与ICAS明显相关的变量有non-HDL-C、吸烟史、高血压、糖尿病,校正其它相关危险因素后,non-HDL-C(OR值=3.8,95%CI:2.21~6.54,P<0.05)与ICAS明显相关,可能是ICAS的独立危险因素。
2.3 non-HDL-C水平与动脉硬化部位的关系
2.3.1 non-HDL-C与颅内外动脉硬化部位的关系 见1.6方法与分组(1), ANOVA检验组间P<0.05,单纯ICAS、单纯ECAS、CAS与NCAS比较P均<0.05,差异有统计学意义;单纯ICAS、单纯ECAS及CAS组间两两比较P>0.05,差异无统计学意义。
2.3.2 non-HDL-C与颅内动脉硬化部位的关系 见1.6方法与分组(2),颅内不同硬化部位组间采用ANOVA检验P>0.05,差异无统计学意义,结果示单纯前循环组(46例,3.93±0.86 mmol/L)、单纯后循环组(45例,3.85±1.16 mmol/L)、前后循环组(104例,3.99±0.99 mmol/L)及无狭窄组(71例,3.71±0.97 mmol/L),non-HDL-C水平与ICAS部位无关。
2.4 non-HDL-C水平与动脉硬化程度的关系
2.4.1 non-HDL-C与颅内动脉硬化程度的关系 见1.6方法与分组(3),ANOVA检验组间P>0.05,狭窄血管数目越多,non-HDL-C水平递增,但组间比较差异无统计学意义,其中ICAS(n=0,71例,3.71±0.99 mmol/L),ICAS(n=1,57例,3.88±0.87 mmol/L)、ICAS(n=2,57例,3.89±0.92 mmol/L)、ICAS(n≥3,81例,4.03±1.13 mmol/L)。
2.4.2 non-HDL-C水平与颈动脉硬化程度的关系 见1.6方法与分组(4),ANOVA检验组间P>0.05,差异无统计学意义,其中无狭窄组(70例,3.81±1.05 mmol/L),轻度(132例,3.86±1.03 mmol/L)中度(41例,3.88±0.90 mmol/L)重度及闭塞组(23例,4.21±0.73 mmol/L)。
2.5 non-HDL-C与颈动脉斑块稳定性的关系 见1.6方法与分组(5),ANOVA检验组间P<0.05,差异具有统计学意义;组间两两比较示P1、P2及P5<0.05 (P1正常-弱;P2正常-中;P5弱-强),差异有统计学意义,斑块稳定性越差,non-HDL-C水平越高;其中正常组(29例,3.37±1.08 mmol/L),强回声组(40例,3.66±0.80 mmol/L),中回声组(89例,3.93±0.95 mmol/L),弱回声组(108例,4.06±1.03 mmol/L)。
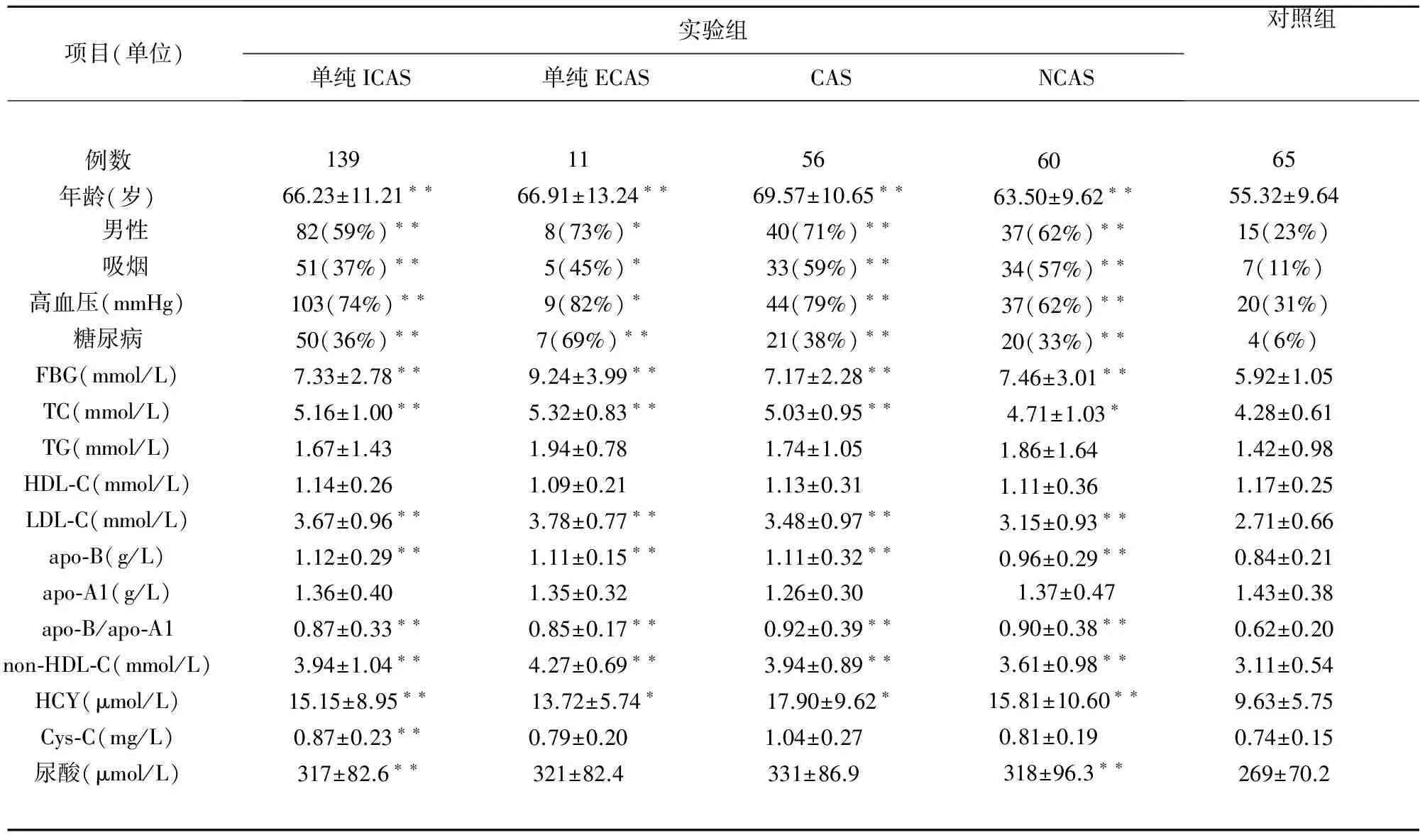
表1 一般临床特征的比较
注:P值为各动脉硬化组与对照组比较:与对照组比较*P<0.05,与对照组比较**P<0.01
3 讨 论
脑血管病是一类死亡率和致残率高且严重危害人类健康的疾病,其中约80%为脑梗死。颅内外动脉粥样硬化是缺血性卒中最重要的病因之一,积极探讨颅内外动脉硬化狭窄的可控危险因素对中国人群缺血性卒中的早期预防具有重要意义。
本研究得出non-HDL-C为颅内外动脉硬化的危险因素,non-HDL-C可能为颅内动脉硬化的独立危险因素,与吴建伟等研究示non-HDL-C会增加无症状性颅内动脉狭窄的发病风险[7]相符,同时得出高血压、糖尿病及吸烟也为ICAS的独立危险因素,与以往研究结果一致[3,4,8]。
我们进一步探究了non-HDL-C与动脉硬化部位的关系,比较颅内外之间以及颅内不同血管分布区之间non-HDL-C的情况,结果证实non-HDL-C与动脉硬化发生部位无关。动脉粥样硬化是一种全身性疾病,好发部位在大动脉分叉或转折处,但其发生发展是非常复杂的病理过程,为外在环境因素及内在多个因素调控异常共同作用的结果,故non-HDL-C水平与动脉硬化部位无关符合动脉硬化发生发展特点,查阅国内外相关文献也并未发现有学者提出non-HDL-C与动脉硬化部位有关的结论。
为探究non-HDL-C水平与动脉硬化程度的关系,分别比较颅内外动脉不同狭窄程度组间non-HDL-C情况,虽颅内外动脉硬化狭窄程度与non-HDL-C水平比较无统计学差异,但本研究结果示non-HDL-C水平随动脉硬化狭窄程度递增呈递增趋势,考虑无统计学差异可能与研究纳入样本量不足有关;既往有学者就non-HDL-C水平与颈动脉病变相关性进行研究,本研究结论与之相符[9]。
本研究还发现non-HDL-C与斑块稳定性有关,且稳定性越差,non-HDL-C水平越高。动脉粥样斑块由致密的结缔组织纤维帽和覆盖于其下的脂质核心和坏死碎片组成,脂质核心内富含胆固醇和胆固醇脂,脂质坏死核心在动脉粥样斑块中所占比例越大,斑块越容易破裂。与动脉狭窄比较,斑块本身成分及稳定性与缺血性脑血管事件密切相关[10],且发现不稳定的斑块与复发性脑梗死具有极大的相关性[11]。查阅近期相关文献并未发现non-HDL-C与不稳定斑块直接相关的研究,但已证实氧化修饰的低密度脂蛋白为不稳定斑块的危险因素之一[12]。non-HDL-C为致动脉粥样硬化主要形式,包含了LDL-C且本研究证实non-HDL-C与斑块稳定性有关,故积极监测和控制non-HDL-C水平可能对缺血性卒中发生及复发有重要意义。
近年来non-HDL-C备受关注,2013年ACC/AHA指南[1]中LDL-C与non-HDL-C作为降脂治疗的第一、二目标,同年IAS将non-HDL-C定义为致动脉粥样硬化胆固醇的主要形式,甚至可能取代LDL-C成为主要的治疗目标,2014年NICE血脂管理指南将non-HDL-C纳入血脂谱检测等。颅内外动脉硬化是缺血性卒中最重要的危险因素,而本研究证实non-HDL-C与颅内外动脉硬化狭窄相关,non-HDL-C作为动脉硬化的可控危险因素对于缺血性卒中的预防具有重要意义。最近有研究提出非高密度脂蛋白胆固醇会增加缺血性卒中的发病风险,而且其对缺血性卒中的预测价值要高于低密度脂蛋白胆固醇[13,14]。虽然non-HDL-C的临床应用价值受到越来越多的重视和认可,但LDL-C作为降脂治疗的首要目标仍不能被忽视,二者比较哪个更有优势或者在某些条件下哪个具有更好的应用价值需要更多更深入的研究。
本研究存在的不足:一是本研究纳入病例数相对不足,且实验组病例均为新发脑梗死,可能遗漏无症状性颅内外动脉硬化狭窄部分;二是本研究中采用MRA评估ICAS,虽然MRA对ICAS有重要的诊断的价值,但MRA反映更多的是血液流动的信息而非血管信息,对缓慢流动的血液不能显示,故一定程度上可能会夸大血管狭窄的程度。
4 结 论
non-HDL-C是颅内外动脉硬化狭窄的危险因素,可能成为ICAS的独立危险因素;non-HDL-C水平与颅内外动脉硬化狭窄部位及狭窄程度无相关性;non-HDL-C水平与颈动脉硬化斑块稳定性有关。
[1]Stone NJ,Robinson J,Lichtenstein AH,et al.2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atheroscler otic cardiovascular risk in adults:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J].J Am Coll Cardiol,2013,63:3024-3025.
[2]王拥军,徐安定,曾进胜,等.2013症状性颅内动脉粥样硬化性狭窄血管内治疗中国专家共识[J].中华内科杂志,2013,52(3):271-275.
[3]Wong KS,Ng PW,Tang A,et al.Prevalence of asymptomatic intracranial atherosclerosis in high-risk patients[J].Neurology,2007,68:2035-2038.
[4]Du YL,Chen SX,Hu YR,et al.Prevalence and risk factors of asymptomatic intracranial vascular stenosis in patients with essential hypertension[J].中华心血管病杂志,2007,35:893-896.
[5]中华医学会神经分会.各类脑血管病诊断要点[J].中华神经科杂志,1996,29:379-380.
[6]Samuels OB,Joseph GJ,Lynn MJ,et al.A standardized method for measuring intracranial arterial stenosis[J].AJNR Am J Neuroradiol,2000,21:643-646.
[7]Wu JW,Zhang Q,Yang HJ,et al.Association between non-high-density-lipoprotein-cholesterol levels and the prevalence of asymptomatic intracranial arterial stenosis[J].J Cholesterol and Intracrial Stenosis,2013,8(5):625-629.
[8]Liu M,Wu B,Wang WZ,et al.Stroke in China:epidemiology,prevention,and management strategies[J].J Lancet Neurol,2007,6:456-464.
[9]刘 影,帅 平,刘玉萍.非高密度脂蛋白胆固醇与颈动脉血管病变相关性分析[J].实用医学杂志,2013,29(15):2515-2516.
[10]刘国荣,姚 林,王大力.颈动脉粥样硬化易损斑块的临床研究进展[J].中华老年心脑血管病杂志,2012,17(4):112-114.
[11]张 媚,叶笃筠.复发性与初发性脑梗死患者颈动脉粥样硬化斑块的比较[J].中国现代医学杂志,2007,17:83-85.
[12]Pentikminen MO,Oumi K,Ala-Korpela M,et al.Modified LDL-trigger of atherosclerosis and inflammation in the arterial intima[J].J Inter Med,2000,247:359-370.
[13]Wu J,Chen S,Zhou Y,et al.Non-high-density lipoprotein cholesterol on the risks of stroke:a result from the Kailuan study[J].PLoS One,2013,8(9):736-742.
[14]Wu J,Chen S,Liu L,et al.Non-high-density lipoprotein cholesterol vs low-density lipoprotein cholesterol as a risk factor for ischemic stroke:a result from the Kailuan study[J].Neurol Res,2013,35(5):505-511.
Association between non-high-density-lipoprotein-cholesterol levels and intracranial and extracranial atherosclerosis
LIU Yang,GUO Yang.
(Department of Neurology,Shengjing Hospital,China Medical University,Shenyang 110000,China)
Objective To measure non-high-density-lipoprotein-cholesterol in acute cerebralinfarction patients to investigate possible correlations of non-HDL-C with cerebral atheros-clerosis.Methods 266 acute cerebral infarction act as experiment group and 65 subjects with no cerebral atherosclerosis as controls.The experiment group were divided into subgroups by atherosclerosis position,severity and stability.We analyze the association between the non-HDL-C level and cerebral atherosclerosis and its possible correlation with stability of carotis angiosclerosis.Results Compared with contrast,atherosclerotic groups have higer level of non-HDL-C and the difference is statistically significant (P<0.05).Multivariate analysis showed that non-HDL-C is an independent indicator for the presence of ICAS(OR=3.8,95%CI;2.21-6.54,P<0.001).Comparison of the non-HDL-C among groups with different atherosclerotic positions and extent showed no statistically significant difference(P>0.05).Higher level of non-HDL-C,more stable of carotis angiosclerosis(P<0.05).Conclusion Non-HDL-C is the risk factor of cerebral atherosclerosis and may be an independent predictor of ICAS prevalence.There is no correlation between non-HDL-C and the position and extent of atherosclerosis.Non-HDL-C is related to plaque stability.
Non-high-density-lipoprotein-cholesterol; Intracranial atherosclerosis; Carotis angiosclerosis
1003-2754(2016)10-0890-04
2016-06-29;
2016-09-29
(中国医科大学附属盛京医院神经内科,辽宁 沈阳 110000)
郭 阳,E-mail:guoy@sj-hospital.org
R743.4
A

