15d-PGJ2对神经元氧糖剥夺/复氧损伤的影响
李 键, 冯 江, 段 宇, 徐 锋, 毛仁玲
15d-PGJ2对神经元氧糖剥夺/复氧损伤的影响
李 键1, 冯 江1, 段 宇1, 徐 锋2, 毛仁玲1
目的 观察过氧化物酶体增殖物激活受体γ(PPAR-γ)激动剂15d-PGJ2对神经元氧糖剥夺/复氧(OGD/R)损伤的影响,并探讨其可能的作用机制。方法 采用原代培养的小鼠胎鼠大脑皮质神经元,建立OGD/R损伤模型。将培养的神经元细胞进行分组,Western blot检测各组神经元内LC3-1、LC3-Ⅱ、Bcl-2、Beclin1、AMPK、mTOR及p70S6K等蛋白的表达;MTT法检测细胞活性,乳酸脱氢酶(LDH)漏出率测定细胞毒性。结果 OGD/R损伤6 h、12 h及24 h后神经元LC3-Ⅱ、Beclin 1表达明显增高,而p62表达持续下降,神经元的生存率明显下降,LDH漏出率增加。15d-PGJ2可显著降低LC3-Ⅱ和Beclin 1表达水平,改善神经元的生存率及降低LDH的漏出率。OGD/R后Bcl-2的蛋白表达水平均明显减少,而Beclin 1表达则显着增加。15d-PGJ2预处理显著增加OGD/R 24 h的Bcl-2表达量。利用Bcl-2 siRNA或scRNA转染神经元细胞发现,Bcl-2 siRNA可消除15d-PGJ2对OGD/R后各时间点的抑制效应。结论 15d-PGJ2能够有效地对神经元OGD/R损伤起到保护作用,其机制可能是通过上调Bcl-2的表达进而抑制自噬的发生实现的。
缺血再灌注; 自噬; 过氧化物酶体增殖物激活受体γ; Bcl-2; Beclin1
缺血性脑卒中已成为严重威胁人类健康的临床常见病,在中国,缺血性脑卒中约占脑卒中的80%[1]。目前治疗手段仍以早期溶栓为主,但溶栓时间窗短及缺血再灌注损伤等因素影响溶栓疗效及预后。如何在脑组织缺血缺氧的耐受时间窗内,给予有效的神经细胞保护,已成为减轻脑缺血再灌注损伤的一个热门话题。
自噬是细胞的一种自我降解途径,可通过膜囊泡包裹的方式将蛋白质、RNA、老化受损细胞器等转运至溶酶体降解,从而维持内环境稳态[2]。目前已有研究表明,脑缺血后,能量感应、内质网缺氧及氧化应激等均可刺激神经元自噬[3],且在缺血再灌注过程中,细胞的自噬与Beclin 1的表达上调有关[4]。Beclin 1基因的表达可被Bcl-2家族的多域蛋白所抑制,过氧化物酶增殖物激活受体反应元件(perosisome proliferater-activated receptor response element,PPRE)激动剂可通过上调Bcl-2的表达,从而防止神经元的缺血再灌注损伤[5]。因此,本研究旨在观察过氧化物酶增殖物激活受体-γ(perosisome proliferater-activated receptor, PPAR-γ)激动剂15-Deoxy-Delta-12,14-prostaglandin J2(15d-PGJ2)对氧糖剥夺/复氧(oxygen-glucose deprivation/reperfusion,OGD/R)的影响,并探讨其可能的作用机制。
1 材料与方法
1.1 制备氧糖剥夺/复氧(OGD/R)的细胞模型及分组
1.1.1 制备氧糖剥夺/复氧(OGD/R)的细胞模型 妊娠15 d的C57BL/6J雌性小鼠(由南京医科大学动物实验中心提供),予10%水合氯醛1 ml腹腔注射麻醉后,切开孕鼠下腹取出子宫,剥离胎鼠并分离出胎鼠的大脑皮质组织,将皮质组织剪碎并加入胰蛋白酶,37 ℃条件下消化15 min后加入5 ml DMEM溶液终止消化,离心后弃去上清液,将细胞悬液置于培养板并放置在37 ℃ 5% CO2的培养箱内进行培养。原代神经元培养到第7天时,弃去培养基,并加入无糖的DMEM培养基,每孔加入1 ml,然后将培养板置于CO2培养箱(37 ℃,95%N2,5%CO2)进行缺氧缺糖培养120 min。OGD培养结束后,弃去无糖DMEM培养基,预温37 ℃PBS洗涤培养板一次,加入神经元专用培养基,每孔加入1 ml,置于5%CO2培养箱继续培养。对照组不作任何缺氧缺糖处理,复氧后24 h终止实验。
1.2 实验分组和设计
1.2.1 15d-PGJ2对神经元OGD/R后细胞存活率及自噬的影响 将原代神经元培养至7 d开始OGD处理,根据再复氧复糖的时间点不同,随机分为5组:对照组、OGD/R 2 h组、OGD/R 6h组、OGD/R 12 h组、OGD/R 24 h组;再根据OGD/R前加入15d-PGJ2剂量的不同,将OGD/R 24 h随机分为4组:对照组+15d-PGJ2(0 μmol)、OGD/R+15d-PGJ2(0.1 μmol)、OGD/R+15d-PGJ2(0.5 μmol)、OGD/R+15d-PGJ2(1.0 μmol),对上述各组进行MTT及LDH漏出率检测,采用Western blot法分析各组LC3-Ⅱ、Beclin 1、p62的表达。
1.2.2 15d-PGJ2对神经元细胞AMPK、mTOR、p70S6K表达的影响 将原代神经元发生OGD后,根据复糖复氧时间分为对照组、OGD/R 2 h组、OGD/R 6 h组、OGD/R 12 h组及OGD/R 24 h组;再根据OGD/R前有无15d-PGJ2,随机分为4组:对照组、OGD/R 24 h组、对照组+15d-PGJ2(1.0 μmol)组、OGD/R 24 h+15d-PGJ2(1.0 μmol)组,对照组不进行OGD/R处理。Western blot法分析各组p-AMPK、AMPK、p-mTOR、mTOR、p-p70S6K、p70S6K的表达。
1.2.3 15d-PGJ2对神经元细胞Bcl-2/Beclin 1表达的影响 将原代神经元发生OGD后,根据复糖复氧时间分为对照组、OGD/R 2 h组、OGD/R 6 h组、OGD/R 12 h组及OGD/R 24 h组;并将原代神经元发生OGD后24 h随机分为对照组、OGD/R 24 h组、对照组+15d-PGJ2(1.0 μmol)组、OGD/R 24 h+15 d-PGJ2(1.0 μmol)组;再将原代神经元OGD/R 24 h时,根据是否有Bcl-2 siRNA干扰,及OGD/R前是否加入15d-PGJ2(1.0 μmol)干预,随机分为6组:对照组+Bcl-2 scRNA组、OGD/R+Bcl-2 scRNA组、OGD/R+15d-PGJ2+Bcl-2 scRNA组、对照组+Bcl-2 siRNA组、OGD/R+Bcl-2 siRNA组、OGD/R+15d-PGJ2+Bcl-2 siRNA组。Western blot分析各组Bcl-2、LC3-II、Beclin-1、p62的蛋白表达情况。对照组不进行OGD/R处理,Western blot法分析以上各组Bcl-2、LC3-Ⅱ、Beclin-1、p62的蛋白表达情况。
1.3 细胞活力测定 神经元的活力测定则采用MTT比色法来确定。每孔加入20 μl MTT溶液,在细胞培养箱37 ℃下孵育4 h,吸出孔内培养液后再加入二甲基亚砜溶液,待颗粒完全溶解后以多孔分光光度计在570 nm测定吸光度,记录结果并绘制曲线图。以对照组细胞活力为100%,细胞死亡的百分比计算用下面的公式:细胞死亡(%)=(1-实验组OD值/对照组OD值)×100%。
1.4 细胞毒性测定 细胞毒性通过乳酸脱氢酶(LDH)测定法评估。OGD/R后各组细胞培养物的上清液保留,PBS漂洗后,用1%的Triton X-100在37 ℃下30 min指示,制备上清液和细胞裂解液的样品,进行LDH漏出率的测定。多孔分光光度计测定440 nm处光密度值(A),计算LDH漏出率(%)=(A+/A+空白)/(A-/A-空白)×100%。
1.5 Bcl-2 RNA干扰 使用Lipofectamine 2000转染试剂盒,待神经元细胞生长密度达到50%时实施转染。转染前用Opti-MEM I Medium的稀释液将其稀释为比例为1∶50,轻柔混合后在室温下孵育5 min,并将转染的质粒按照1∶25的比例进行稀释。将两者稀释的液体轻柔混合并放置在室温20 min,待其形成Bcl-2-siRNA-转染混合物。将Bcl-2-siRNA-转染混合物(500 μl)加入六孔板中,轻柔晃动,放置在孵箱中进行培养,对照组则以Bcl-2-scRNA替代Bcl-2-siRNA进行试验。
1.6 Western blot检测 将实验组细胞弃去培养液,用预冷的PBS清洗2~3遍,加入适量的细胞蛋白裂解液,冰上不停摇晃20 min以充分裂解细胞,用细胞刮顺序刮取细胞,移液器收集细胞至1.5 ml离心管中,4 ℃条件下12000 r/min离心10 min,收集上清即为各组蛋白,采用BCA法检测蛋白浓度。所用一抗为LC3(1∶1000)、Beclin1 (1∶500)、Bcl-2 (1∶500)、mTOR (1∶200)、p-mTOR (1∶200)、p70S6K(1∶200)及β-actin(1∶5000)。
2 结 果
2.1 15d-PGJ2对神经元OGD/R后细胞存活率的影响 随着再灌注时间的延长,与对照组相比,各组神经元细胞的生存率明显下降(P<0.05)(见图1A)。同时,与对照组相比,LDH的漏出率在再灌注2~24 h后逐步增加,差异有统计学意义(P<0.05) (见图1B)。在再灌注开始前,分别予不同浓度的15 d-PGJ2(0.1,0.5,1 μmol)加入到培养基中,我们发现,与OGD/R组相比,0.5~1.0 μmol的15 d-PGJ2能显著增加神经元细胞的存活率、抑制OGD/ R诱导的LDH释放,且差异均有统计学意义(P<0.05)(见图1C、1D)。
2.2 15d-PGJ2对神经元OGD/R后细胞自噬的影响 与对照组相比,LC3-Ⅱ/LC3-I的比值和Beclin 1的表达在再灌注后的6 h开始显著增加(P<0.05),而p62的表达在再灌注后的6 h明显降低,并持续至24 h(P<0.05) (见图2A、B)。在再灌注开始前,分别予不同浓度的15d-PGJ2(0.1~1 μmol)加入到培养基中,结果发现,与OGD/R组相比,15 d-PGJ2的浓度在0.5~1.0 μmol时, LC3-Ⅱ/LC3-I的比值和Beclin 1的表达均显著降低,而p62的表达则显著增加(P<0.05)(见图2C、D)。
2.3 15d-PGJ2对神经元细胞AMPK、mTOR、p70S6K表达的影响 与对照组相比,OGD/R后2 h、6 h及12 h,15d-PGJ2可诱导磷酸化的AMPK明显增加(P<0.05),随着OGD后再灌注时间的延长,其表达逐渐下降,至再灌注24 h回到正常水平(P>0.05)(图3A、B)。此外,与对照组相比,OGD/R后磷酸化的mTOR和p70S6K表达量在2 h及6 h均明显下降(P<0.05),在再灌注后24 h均恢复到正常水平(P>0.05)(见图3A、B)。在OGD/R后24 h时,予以15d-PGJ2干预,与对照组相比,磷酸化的AMPK、mTOR及p70S6K水平均无显著差异(P>0.05)(见图3C、D)。
2.4 15d-PGJ2对神经元细胞Bcl-2/Beclin 1表达的影响 与对照组相比,OGD/R后6 h、12 h及24 h时,Bcl-2的蛋白表达水平均明显减少,而Beclin 1表达则显着增加(P<0.05)(见图4A、B)。在OGD/R后24 h,15d-PGJ2(1 μmol)可显著上调Bcl-2的蛋白表达,降低Beclin 1表达量,差异具有统计学意义(P<0.05)(见图4C、D)。在OGD/R后24 h,在15d-PGJ2作用下,与给予Bcl-2 scRNA的对照组相比,转染Bcl-2 siRNA的神经元细胞内Bcl-2的蛋白表达水平明显下调,Beclin 1蛋白表达水平则明显增高,且LC3-Ⅱ/LC3-I比值明显升高(P<0.05)(见图4E、F)。
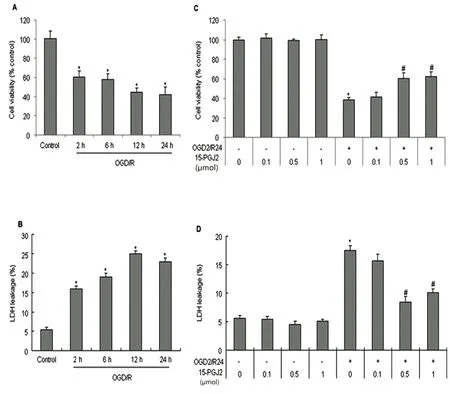
A:MTT测定法分析细胞活力;B:通过LDH漏出率分析细胞毒性;C、D:15d-PGJ2对神经元细胞存活率的影响。在再灌注开始前,在神经元培养基中给予不同浓度的15d-PGJ2(0.1、0.5、1 μmol),OGD/R后24 h,分析细胞活力和LDH漏出率。与对照组比较*P<0.05;与OGD/R组比#P<0.05
图1 15d-PGJ2对原代神经元细胞OGD/R后存活率的影响
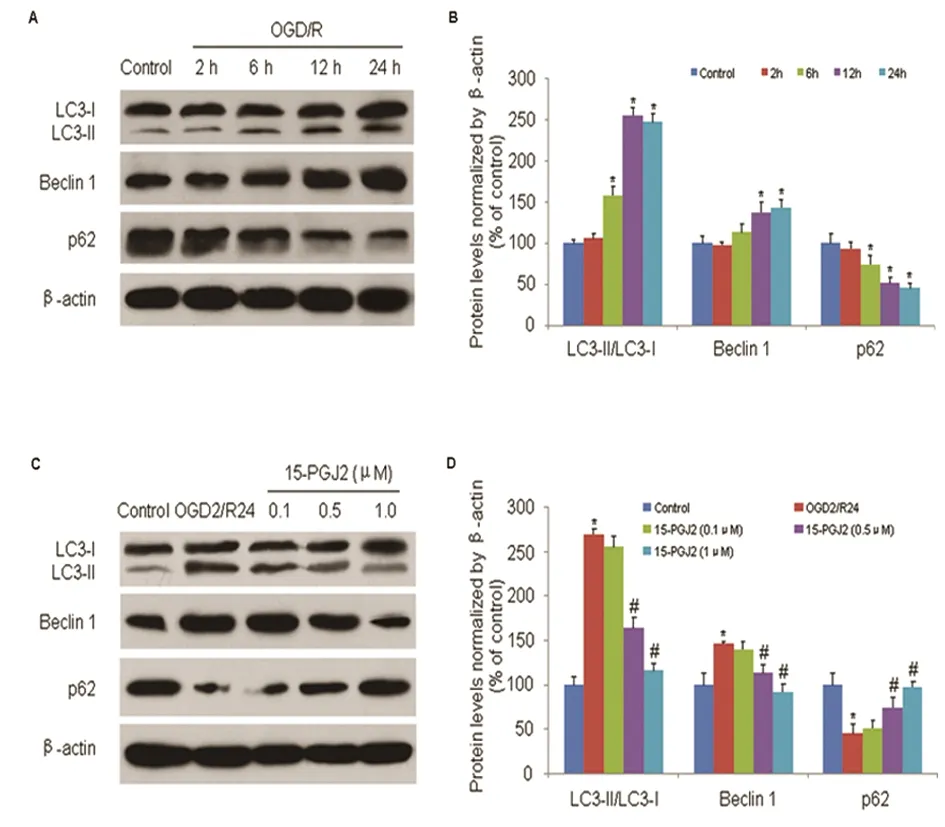
A、B:当原代神经元发生OGD/R损伤后,LC3-Ⅱ/LC3-I的比值、Beclin-1及p62表达的影响; C、D:15d-PGJ2对OGD/R后LC3-Ⅱ/LC3-I的比值、Beclin-1及p62表达的影响。与对照组比较*P<0.05;与OGD/R组比较#P<0.05
图2 15d-PGJ2对神经元OGD/R后细胞自噬的影响
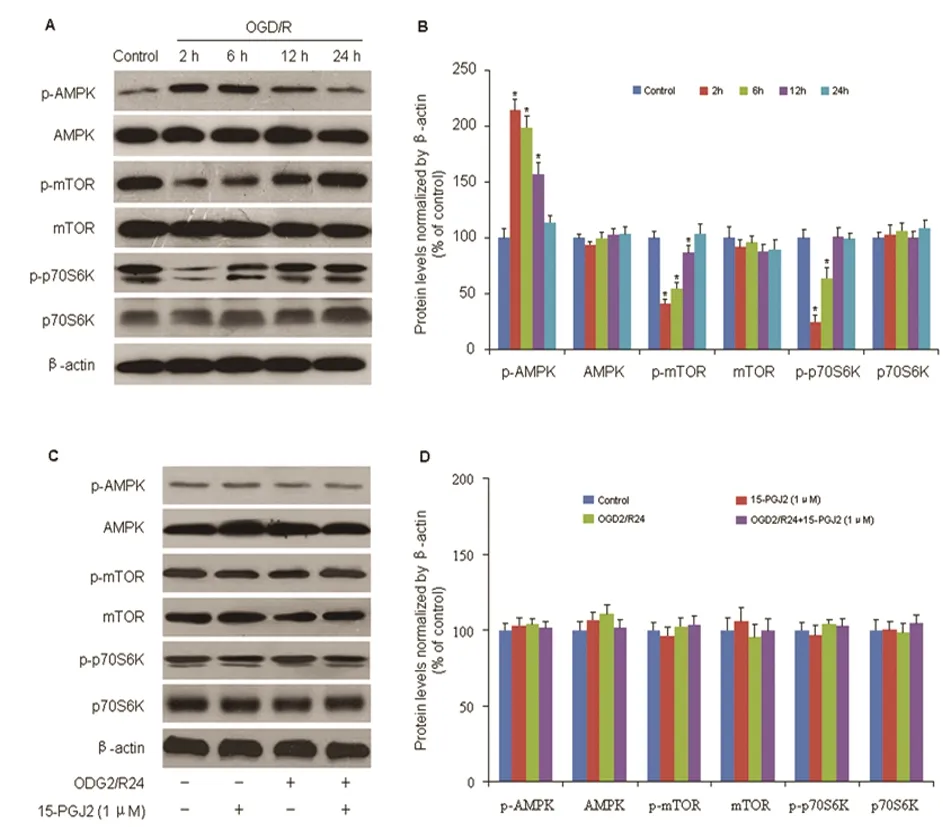
A、B:神经元细胞OGD/R后磷酸化的AMPK、mTOR及p70S6K表达量的变化;C、D:在OGD/R后24 h,15d-PGJ2(1 μmol)对磷酸化的AMPK、mTOR及p70S6K水平的影响。与对照组比较*P<0.05;与OGD/R组比较#P<0.05
图3 15d-PGJ2对神经元细胞AMPK、mTOR、p70S6K表达的影响
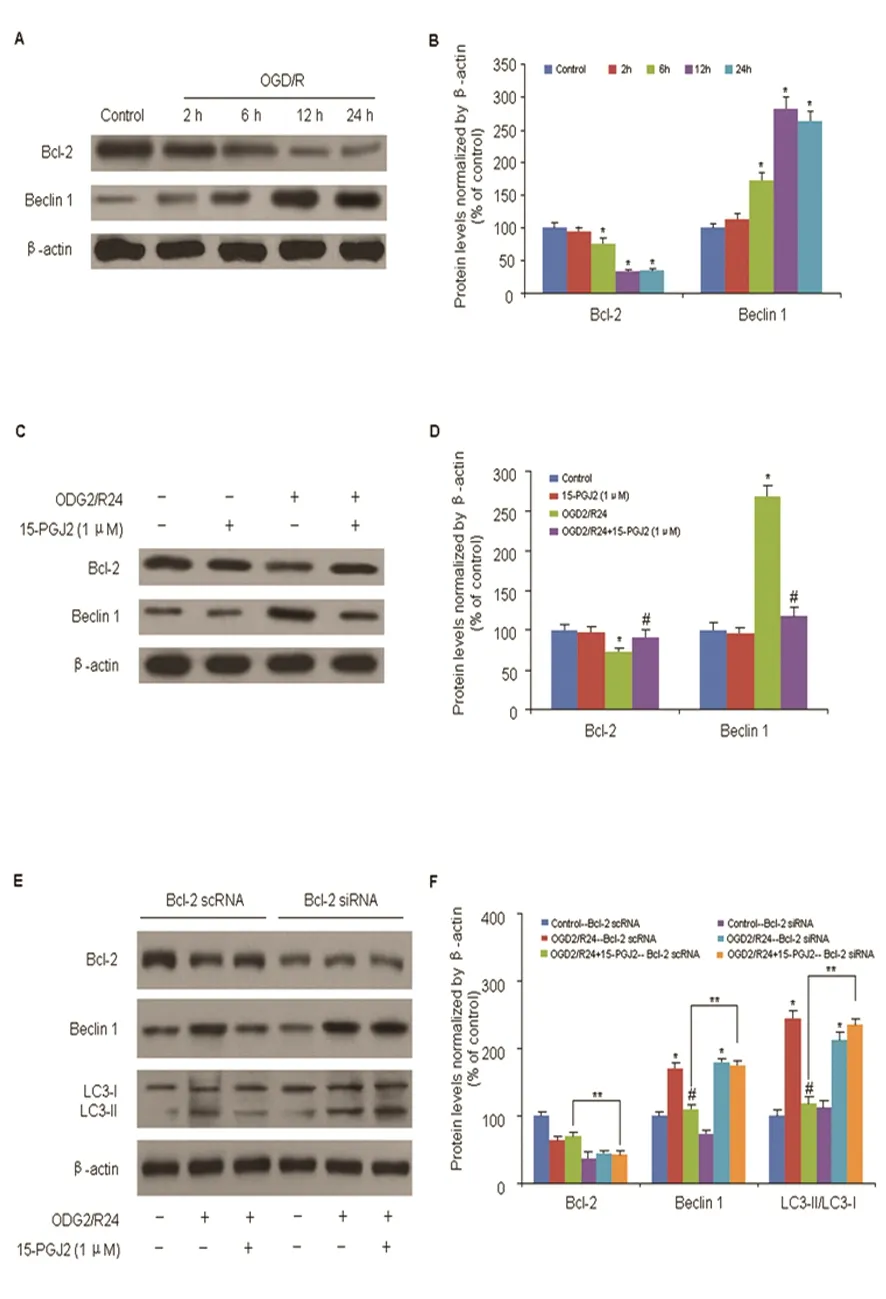
A、B:在OGD/R后,Bcl-2及Beclin 1的蛋白表达量的变化;C、D:OGD/R后24 h,15d-PGJ2(1 μmol)对Bcl-2及Beclin 1的蛋白表达的影响;E、F:在OGD/R后24 h,Bcl-2 siRNA对Beclin 1、Bcl-2及LC3-Ⅱ/LC3-I的表达量的影响。与对照组比较*P<0.05;与OGD/R组比较#P<0.05
图4 15d-PGJ2对神经元细胞Bcl-2/Beclin 1表达的影响
3 讨 论
目前普遍认为,在脑缺血再灌注过程中,细胞的自噬起关键作用。且研究发现,PPAR反应元件激动剂可通过调节Bcl-2,从而对神经元的缺血再灌注损伤起一定程度的保护作用[5]。但在缺血再灌注过程中,PPAR反应元件激动剂是否对自噬产生影响,国内外尚未见相关报道。
脑缺血的本质为缺氧缺糖,氧糖剥夺(OGD)模型可模拟脑缺血病理变化。参照文献[6],本实验成功复制神经元OGD/R损伤的细胞模型,选用PPAR反应元件激动剂15d-PGJ2,观察其对OGD/R损伤的影响。结果发现,OGD/R损伤后,神经元细胞的生存率明显下降,LDH的漏出率则显著升高。给予15d-PGJ2干预后,神经元细胞的生存率则明显升高,LDH的漏出率下降,提示15d-PGJ2可对原代神经元发生OGD/R损伤后起到显著保护作用。
自噬在哺乳动物正常脑组织内通常很难检测到,但在脑缺血的情况下,其表达则显著增强。Gabryel等[7]发现在脑缺血的不同阶段,自噬可能扮演着双重角色。当脑轻度缺氧或是局部缺血时,自噬的激活能起到保护效应[8]。然而,在严重缺氧缺血的情况下,过度激活的自噬过程则是有害的[9]。Mo等[10]在利用PC12细胞复制缺血性卒中细胞模型中发现,β-细辛脑可通过下调自噬所依赖的Beclin 1表达,对OGD/R后细胞产生保护效应。相反地,Shi等[11]在脑缺血的细胞模型中发现,自噬的过度表达则促进神经元的死亡。
LC3-Ⅱ是真核细胞自噬研究中应用最广泛的特异性蛋白,Beclin1 1是Ⅲ类磷脂酰肌醇-3-激酶(PI3K)复合物中的组成成分,该复合物可诱导自噬的发生。我们在本次研究中发现,在OGD/R发生后6~24 h,LC3-Ⅱ和Beclin 1的表达显著增加,这与文献报道[12,13]。加入15d-PGJ2后我们发现,LC3-Ⅱ和Beclin 1的表达水平则明显下降。此外,自噬抑制剂3-MA可明显降低LC3ⅡI的蛋白表达量、增加细胞的存活率及减少LDH的漏出率。这些研究结果提示,神经元细胞在OGD/R后自噬表达水平显著增强,从而促进OGD/R损伤后神经元的死亡。15d-PGJ2则可通过抑制自噬的表达,对神经元OGD/R损伤后起到一定程度的保护作用。
目前已有研究发现,在脑缺血所致的神经元细胞死亡中,自噬明显增强,但调节自噬激活的具体信号通路仍不明确。Wang等[14]研究证实,在脑缺血发生过程中,TSC2-mTOR-S6K1信号通路在自噬的表达过程中起重要作用。Matsui等[15]研究发现,心肌缺血时可通过AMPK-mTOR通路激活自噬的发生,而在再灌注时,自噬的激活却依赖于Beclin 1通路,而非AMPK途径。本实验将原代神经元进行2 h的OGD后再灌注2~24 h,发现在OGD的初始阶段,p-AMPK的蛋白表达水平明显增加,同时p-mTOR及p-p70S6K的表达量下降,但这3种蛋白的磷酸化水平均在再灌注24 h后恢复到正常水平,且在OGD/R后24 h时,15 d-PGJ2对p-AMPK、p-mTOR及p-p70S6K表达变化无显著影响。同时,我们还发现,OGD/R后6 h、12 h及24 h时,Bcl-2的蛋白表达水平均明显下降,而Beclin 1的蛋白表达量则显着增加,15d-PGJ2(1 μmol)可显著上调Bcl-2、降低Beclin 1的蛋白表达量。同时,本实验通过细胞转染技术进一步研究发现,Bcl-2 siRNA可阻止15d-PGJ2对Beclin 1、Bcl-2和LC3-Ⅱ/LC3-1的影响。以上研究结果提示我们,15d-PGJ2对神经元OGD/R损伤的保护作用可能是通过Bcl-2/Beclin 1信号通路实现的,而并非依赖于AMPK-mTOR- p70S6K途径,但是否还存在其他信号通路参与自噬过程的调节,还需要进一步研究。
综上所述, 15d-PGJ2能够有效的对神经元OGD/R损伤起到保护作用,其机制可能是通过上调Bcl-2的表达进而抑制自噬的发生实现的,从而为临床上缺血性脑卒中的治疗提供了新的思路。
[1]陈荣富,张 婷,谌雯琦,等.丁基苯酞通过调节自噬干预淀粉样蛋白前体β位剪切酶1的代谢[J].中国临床神经科学,2015,23(2):121-129.
[2]张瑞剑,陈谦学.自噬抑制剂3-MA对顺铂诱导的人胶质瘤U251细胞凋亡的影响[J].中华神经外科杂志,2015,31(4):406-411.
[3]Dai JP,Zhao XF,Zeng J.Drug screening for autophagy inhibitors based on the dissociation of Beclin1-Bcl-2 complex using BiFC technique and mechanism of eugenol on anti-influenza A virus activity[J].PLoS ONE,2013,8(4):e61026.
[4]Matsui Y,Takagi H,Qu X,et al.Distinct roles of autophagy in the heart during ischemia and reperfusion:roles of AMP-activated protein kinase and Beclin 1 in mediating autophagy[J].Circ Res,2007,100(6):914-922.
[5]Wu JS,Lin TN,Wu KK.Rosiglitazone and PPAR-gamma overexpression rotect mitochondrial membrane potential and prevent apoptosis by upregulating anti-apoptotic Bcl-2 family proteins[J].J Cell Physiol,2009,220(1):58-71.
[6]Wang Y,Li Y,Dalle Lucca SL,et al.Decay accelerating factor (CD55) protects neuronal cells from chemical hypoxia-induced injury[J].J Neuroinflammation,2010,9(7):24.
[7]Gabryel B,Kost A,Kasprowska D.Neuronal autophagy in cerebral ischemia-a potentialtarget for neuroprotective strategies[J].Pharmacol Rep,2012,64(1):1-15.
[8]Puyal J,Ginet V,Grishchuk Y,et al.Neuronal autophagy as a mediator of life and death:contrasting roles in chronic neurodegenerative and acute neural disorders[J],2012,18(3):224-236.
[9]Xu M,Zhang HL.Death and survival of neuronal and astrocytic cells in ischemic brain injury:a role of autophagy[J].Acta Pharmacol Sin,2011,32(9):1089-1099.
[10]Mo ZT,Fang YQ,He YP,et al.β-Asarone protects PC12 cells against OGD/R-induced injury via attenuating Beclin-1-dependent autophagy[J].Acta Pharmacol Sin,2012,33(6):737-742.
[11]Shi R,Weng J,Zhao L,et al.Excessive autophagy contributes to neuron death in cerebral ischemia[J].CNS Neurosci Ther,2012,18(3):250-260.
[12]张 坤,张宏义,王东春,等.亚低温对脑损伤大鼠海马神经元自噬相关蛋白表达的影响[J].中华创伤杂志,2016,32(2):166-170.
[13]Maiuri MC,Criollo A,Kroemer G.Crosstalk between apoptosis and autophagy within the Beclin 1 interactome[J].EMBO J,2010,29(3):515-516.
[14]Wang P,Guan YF,Du H,et al.Induction of autophagy contributes to the neuroprotection of nicotinamide phosphoribosyltransferase in cerebral ischemia[J].Autophagy,2012,8(1):77-87.
[15]Matsui Y,Takagi H,Qu X,et al.Distinct roles of autophagy in the heart during ischemia and reperfusion:roles of AMP-activated protein kinase and Beclin 1 in mediating autophagy[J].Circ Res,2007,100(6):914-922.
Effect of 15d-PGJ2on the neuron oxygen-glucose deprivation/reperfusion injury
LI Jian,FENG Jiang,DUAN Yu,et al.
(Department of Neurosurgery,Huadong Hospital,Fudan University,Shanghai 200040,China)
Objective To investigate the effect of PPAR-γ agonist 15d-PGJ2on the neuron oxygen-glucose deprivation/reperfusion injury and to clarify the underlying mechanism.Methods In this study,We established the cerebral ischemia-reperfusion models in vitro.Primary cortical neuron was exposed to a paradigm of ischemic insult by using an oxygen-glucose deprivation/reperfusion (OGD/R) device and were randomly divided into groups according to the experimental scheme.The expression of LC3、Bcl-2、Beclin1、AMPK、mTOR and p70S6K protein were deterined by Western blot.The neuronal cell viability was detected by MTT and the cytotoxicity was determined by lactate dehydrogenase (LDH) leakage.Results The expression of LC3-Ⅱ and Beclin 1 protein significantly increased,while the p62 protein expression decreased obviously.The neuronal cell viability was decreased and the LDH leakage was increased evidently.The LC3-Ⅱ and Beclin 1 protein expression were decreased significantly by the treatment of 15d-PGJ2,the neuronal cell viability was improved and the LDH leakage was decreased.The Bcl-2 protein expression decreased while the Beclin 1 protein expression increased obviously in the OGD/R injury model.And the pretreatment of 15d-PGJ2could upregulate Bcl-2 protein expression.Bcl-2 siRNA could abrogate the effect of 15d-PGJ2on OGD/R injury model.Conclusions Our study demonstrated that 15d-PGJ2could effectively protect the neuronal OGD/R injury,the underlying mechanism may involve in the upregulation of Bcl-2 protein expression and inhibit the process of autophagy.
Ischemia-reperfusion; Autophagy; Peroxisome proliferator-activated receptor-γ; Bcl-2; Beclin-1
1003-2754(2016)10-0873-05
2016-06-25;
2016-09-29
(1.复旦大学附属华东医院,上海 200040;2.复旦大学附属华山医院,上海 200040)
毛仁玲,E-mail:18939953717@189.cn
R741.02
A

