α-分泌酶在自主运动调节APP/PS1转基因小鼠海马APP与Aβ42中的作用研究
余 锋,徐 波,季 浏
α-分泌酶在自主运动调节APP/PS1转基因小鼠海马APP与Aβ42中的作用研究
余 锋1,徐 波2,季 浏2
目的:探讨α-分泌酶在16周自主跑轮运动调节APP/PS1转基因小鼠海马APP水解与Aβ42生成中的作用。方法:24只C57系APP/PS1转基因小鼠,随机分为自主跑轮运动组(TE,n=12)和对照组(TC,n=12);同时选取C57系野生型小鼠24只,随机分为自主跑轮运动组(E,n=12)和对照组(C,n=12)。TE组和E组小鼠从3月龄开始,除给予正常饮食、饮水外,给予16周的自主跑轮运动,TC组和C组小鼠给予正常饮食、饮水,不运动。采用实时荧光定量RT-PCR实验检测各组小鼠海马α-分泌酶家族的3种主要成员ADAM9、ADAM10和ADAM17 mRNA表达水平,采用Western Blot实验检测各组小鼠海马APP、ADAM10和Aβ42蛋白表达水平。结果:1)16周的自主跑轮运动极显著性上调了APP/PS1转基因小鼠海马ADAM10 mRNA表达水平(P<0.01),同时显著性上调了转基因小鼠海马ADAM10蛋白表达水平(P<0.05);2)16周的自主跑轮运动显著上调了APP/PS1转基因小鼠海马ADAM17 mRNA表达水平(P<0.05);3)16周的自主跑轮运动显著性下调了APP/PS1转基因小鼠海马APP(P<0.05)和Aβ42(P<0.05)的蛋白表达水平。结论:16周的自主跑轮运动可通过促进APP/PS1转基因小鼠海马α-分泌酶基因表达进而降低转基因小鼠海马APP的水平,并抑制APP水解产生Aβ42的水平。
自主跑轮运动;阿尔茨海默病;APP/PS1转基因小鼠;海马;α-分泌酶;β-淀粉样前体蛋白;β-淀粉样蛋白42
阿尔茨海默病(Alzheimer’s disease,AD)是一种进行性记忆受损和认知功能下降的神经退行性疾病。AD主要病理特征是脑内β-淀粉样蛋白(β-amyloid,Aβ)沉积、神经纤维缠结(neurofibrillary tangles,NTFs),以及神经细胞的减少和脑组织的萎缩等[7]。其中,神经细胞外Aβ异常沉积形成老年斑是导致AD的主要原因之一。
脑内Aβ多肽具有极其强烈的神经毒性,能诱导脑组织的免疫炎症反应、神经细胞的异常凋亡、氧化应激损伤以及诱导钙离子稳态。其机理可能是Aβ易于和神经细胞膜、小神经胶质细胞以及神经细胞的相关受体结合,阻碍细胞膜的物质运输[1]。有研究发现,外周血中的Aβ可穿越受损的血脑屏障,直接对神经细胞产生毒性作用[19]。Song等[32]的研究显示,纳摩尔浓度的Aβ即可结合于神经细胞膜上。Aβ的神经毒性还可诱导活性氧(Reactive oxygen species,ROS)的产生,研究发现,ROS可导致自由基增加,脂质过氧化反应加剧,增强神经细胞膜的通透性,导致钙离子的大量内流,激活钙依赖性酶的反应,这一系列反应导致了神经细胞物质转运相关代谢机制的紊乱,诱发神经细胞的功能损害[11,16]。此外,Aβ还可诱导神经细胞异常凋亡,诱导神经细胞的缺失,有研究发现,Aβ可通过诱导促凋亡蛋白Bax的表达,导致神经细胞的异常凋亡[28]。Aβ还可诱导神经细胞的能量代谢障碍,Aβ可直接损害细胞膜,导致钙离子内流和钙离子超载的发生,促使细胞内线粒体肿胀,导致线粒体的能量供应系统功能紊乱[35],致使神经细胞异常死亡和神经系统的退行性病变。
过去数十年中,研究者在AD的预防和治疗领域展开了大量的研究。在体育科学领域,运动干预被证明可有效预防和缓解AD的发病。动物实验证实,运动训练在改善AD病理机制方面非常有效,主要体现在以下几个方面:运动能够诱导脑内Aβ沉积水平的降低[5,20,25,26],运动可抑制脑内tau蛋白的异常磷酸化进程[6,23,24],运动能够促进神经细胞的抗氧化功能[14,24,37]、缓解神经细胞死亡的发生[18,33,34]和神经系统炎症反应的发生[17,26]等,这些均是降低AD风险的重要机制。因此,运动干预在AD病理调节中的作用值得进一步探讨。本研究拟探讨α-分泌酶在16周的自主跑轮运动调节APP/PS1转基因小鼠海马APP水解及Aβ42生成中的作用,阐释自主运动调节转基因小鼠海马Aβ沉积的可能分子机制。
1 研究对象与方法
1.1 研究对象
购自南京大学-南京生物医药研究院实验动物模式研究所的3 月龄C57系APPswe/ PSEN1dE9(APP/PS1)转基因雄性小鼠24 只(体重19.56±1.48 g)和正常野生型C57系小鼠24 只(体重20.24±1.02 g)。各组小鼠每笼1只,独立饲养。小鼠饲料购自上海斯莱康公司,给予其自由饮水和饮食饲养。环境温度控制在22℃~24℃,相对湿度控制在50%~60%,自然光照。本实验过程严格按照华东师范大学《实验动物管理委员会章程》和《实验动物伦理委员会章程》饲养和对待实验小鼠。
1.2 研究方法
1.2.1 动物分组与运动方案
丹参多酚酸盐联合地尔硫卓治疗不稳定型心绞痛的疗效及对血清基质蛋白酶-9和髓过氧化物酶水平的影响……………………… 魏晓娟 常荣 李卫 等(4)442
随机将APP/PS1转基因雄性小鼠24只分为自主跑轮运动组(TE,n=12)和对照组(TC,n=12),随机将野生型C57BL/6 小鼠24只也分为自主跑轮运动组(E,n=12)和对照组(C,n=12)。其中,TE 组和E 组小鼠除给予正常饮食和饮水之外,为其提供16周的自主跑轮运动,具体操作参考Adlard等[5]研究进行。通过安装在笼盖上的电子计数器记录小鼠每天的跑轮圈数,根据跑轮的直径计算跑轮的周长,再通过跑轮圈数与跑轮周长的乘积计算小鼠每天的跑动距离,作为小鼠每天的运动量参考值并统计运动组小鼠每4天的跑轮平均距离(图1)。
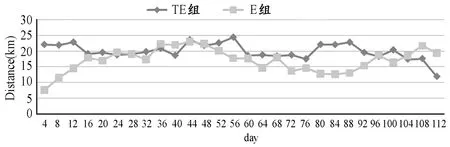
图1 本研究E组和TE组小鼠跑轮运动的平均距离折线图Figure 1. The Average Running Distance of Group E and Group TE
1.2.2 实时定量RT-PCR 实验
冰上取海马组织约20 mg,按照Invitrogen Trizol法提取总RNA,采用Toyobo Fsq101反转录试剂盒合成第一链cDNA(15℃,5 min; 37℃,15 min;85℃, 5 min),ABI Step One型实时荧光定量PCR仪检测相关基因相对含量,荧光染料为Toyobo QPK201 SYBR GREEN。具体实验操作步骤参照Yu等[37]研究进行。各目的基因和内参基因的引物序列见表1(引物设计与合成均由上海生工生物工程有限公司提供合成服务)。
1.2.3 Western blot实验
另取海马组织约20 mg,冰上剪碎放入研磨管中,按照Beyotime P0013 Western及RAP裂解液说明书加入0.5 ml裂解液(含1 mM PMSF),OMINI Bead Ruptor型磁珠匀浆机匀浆,14 000 g离心15 min,取上清转入离心管,BCA法测定蛋白浓度后进行蛋白变性。采用8%分离胶电泳,湿转法将蛋白转至PVDF膜;使用5%脱脂奶粉封闭,一抗于4℃环境孵育12 h,TBST缓冲液清洗后,HRP标记的二抗于室温孵育2 h,Millipore ECL超敏试剂盒显影,Alpha FC2型凝胶成像系统进行冷光扫膜。实验所用抗体购于CST和Abcam公司,使用Flour Chem FC2软件对所捕捉图像进行灰度值分析,具体实验步骤参照LEEM等[24]的研究。

表1 RT-PCR实验基因引物序列表(5’- 3’)一览表Table 1 Gene Primer Sequences for Real-time RT-PCR (5’- 3’)
1.3 数据统计
采用SPSS 18.0数据统计软件和GraphPad绘图分析软件以及Excel 2007办公软件分析实验数据。所有实验数据均以平均值±标准差表示,组间比较采用单因素方差分析,P<0.05为具有显著性差异,P<0.01 为具有极显著性差异。
2 实验结果
本研究通过RT-PCR法检测ADAMs(ADAM9、ADAM10和ADAM17) mRNA表达水平,通过Western blot法检测了APP、ADAM10和Aβ42的蛋白表达水平。
2.1 各组小鼠海马ADAMs mRNA表达水平的变化
实验结果显示,与C组小鼠相比,TC组小鼠海马ADAM10 mRNA表达水平极显著性上调(P<0.01),ADAM17和ADAM9 mRNA表达水平均无显著性差异;与TC组小鼠相比,TE组小鼠海马ADAM10 mRNA表达水平呈现极显著性上调(P<0.01),ADAM17 mRNA表达水平亦显著性上调(P<0.05),ADAM9 mRNA表达水平较有上调趋势,但不具有显著性差异;与E组小鼠相比,TE组小鼠海马ADAM10 mRNA表达水平显著性下调(P<0.05),ADAM17 mRNA表达水平呈现极显著性下调(P<0.01),ADAM9 mRNA表达水平不具有显著性差异;与C组小鼠相比,E组小鼠海马ADAM10 mRNA表达水平显著性上调(P<0.05),ADAM17 mRNA表达水平上调幅度具有极显著性差异(P<0.01),ADAM9 mRNA表达水平上调,但无显著性差异(表2,图2)。

表2 各组小鼠海马ADAMs相对于GAPDH的mRNA表达水平一览表Table 2 mRNA Expression of ADAMs to GAPDH in the Hippocampus of Four Groups
2.2 各组小鼠海马ADAM10、APP和Aβ42蛋白表达水平的变化
实验结果显示,与C组小鼠相比,TC组小鼠海马ADAM10蛋白表达水平显著性下调(P<0.05),APP蛋白、Aβ42蛋白表达水平极显著性上调(P<0.01);与TC组小鼠相比,TE组小鼠海马ADAM10的蛋白表达水平显著性上调(P<0.05),APP蛋白、Aβ42蛋白表达水平显著性下调(P<0.05);与E组小鼠相比,TE组小鼠海马的ADAM10的蛋白表达水平下调,但两组之间不具有显著性差异,而APP蛋白、Aβ42蛋白水平则极显著性上调(P<0.01);与C组小鼠相比,E组小鼠海马的ADAM10蛋白水平虽上调,但两组并无显著差异,APP和Aβ42蛋白表达水平均有下调趋势,但两组之间亦无显著性差异(表3,图3)。

表3 各组小鼠海马ADAM10、APP和Aβ42相对于GAPDH的蛋白表达水平一览表Table 3 Protein Expression of ADAM10,APP and Aβ42 to GAPDH in the Hippocampus of Four Groups
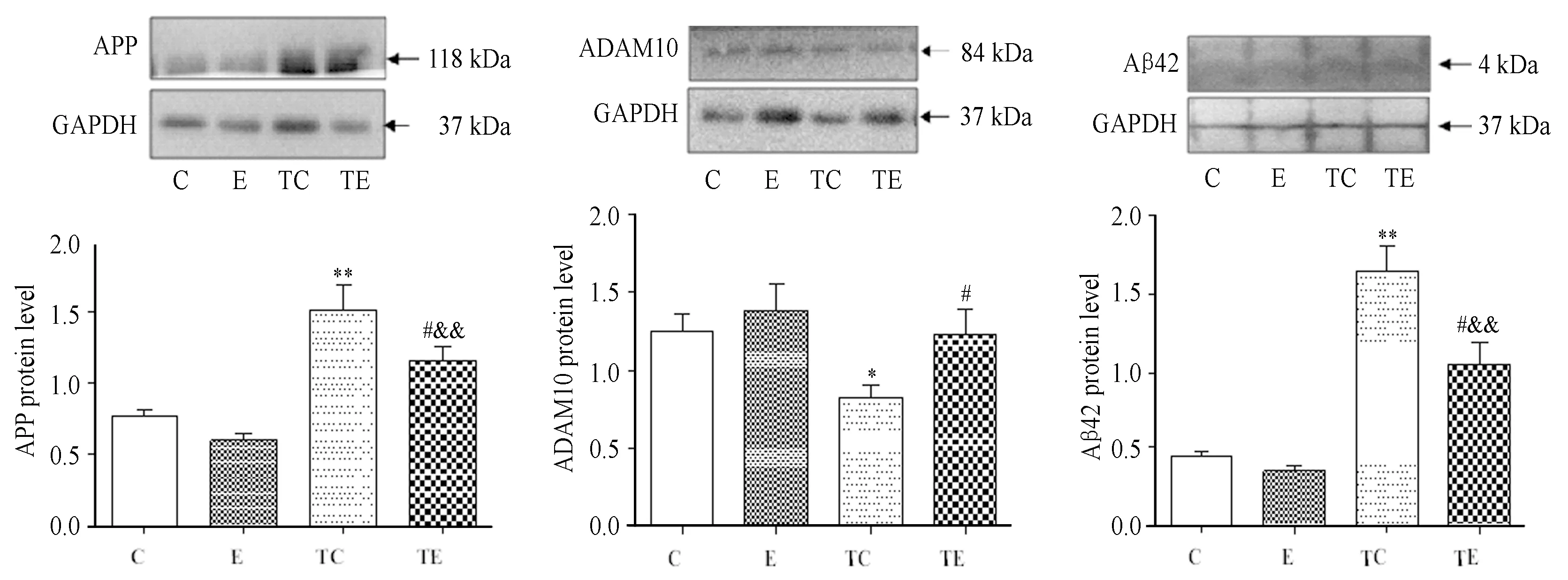
图3 各组小鼠海马ADAM10、APP和Aβ42相对于GAPDH的蛋白表达水平示意图Figure 3. Protein Expression of ADAM10,APP and Aβ42 to GAPDH in the Hippocampus of four Groups
3 讨论
本研究证实,APP/PS1转基因小鼠海马内APP和Aβ42的表达水平较野生型小鼠均显著增加,而抑制APP水解产生Aβ的α-分泌酶的表达水平显著降低,说明该转基因小鼠海马内α-分泌酶在APP非淀粉样蛋白水解途径中的作用可能被抑制,APP水解倾向于淀粉样蛋白产生途径,导致Aβ沉积的增加。而经过16周的自主跑轮运动,转基因运动组小鼠较转基因对照组小鼠,其海马内APP和Aβ42的表达水平均得到显著性下调,且α-分泌酶3种亚型中的2种(ADAM10和ADAM17)得到显著性上调。因此,自主跑轮运动可能通过上调α-分泌酶的表达进而促进APP的非淀粉蛋白水解途径,抑制APP的淀粉样蛋白水解途径,减少了海马Aβ的沉积。
3.1 自主跑轮运动对APP/PS1转基因小鼠海马APP蛋白表达的影响
本研究发现,转基因对照组小鼠海马APP的蛋白表达水平显著性高于野生型对照组小鼠,说明本研究所采用的转基因小鼠能够成功的模拟AD病理特征,即AD脑内APP基因的过表达特性。两组转基因小鼠相比较,则发现转基因运动组小鼠海马APP蛋白表达水平被显著性下调,说明本研究中所采用的16周的自主跑轮运动能够有效地调节转基因小鼠脑内过表达的APP水平。而通过对转基因运动组小鼠和野生型运动组小鼠的对比发现,两组小鼠在APP的蛋白表达水平上仍然存在极显著性的差异,说明16周的自主跑轮运动未能逆转APP基因的过表达状态,但在两个转基因组小鼠间,运动可下调转基因小鼠海马APP蛋白表达水平,说明运动干预可能在一定范围内抵御由于APP基因过表达而导致的APP的蛋白水平的上调。对两个野生型组小鼠的比较发现,运动组小鼠海马APP的蛋白水平较对照组低,但二者之间不具有显著性差异,说明野生型小鼠海马APP的基础蛋白表达水平较低,可经过正常的非淀粉样蛋白途径降解而使其维持在较低的水平,而自主跑轮运动对野生型小鼠海马正常水平APP表达的调节不如对转基因小鼠脑内过度表达的APP蛋白调节的敏感性高。
有研究发现,当脑内APP基因过度表达而超出其正常降解水平时,倾向于产生更多的Aβ沉积,同时可导致APP通过多个途径产生Aβ[10]。体外实验发现,APP的过表达可导致神经元的病变,如致使神经细胞的死亡,同时体内实验发现,实验动物脑认知功能的损害以及脑内出现大量淀粉样斑块物质的沉积[29]。还有研究发现,脑内APP的过度表达可能是其经异常途径水解和Aβ沉积产生,进而导致AD发病的重要因素[15]。
本研究所采用的实验动物是过度表达APP基因的小鼠,检测结果充分证实其脑内APP基因被过度表达。而本实验通过16周的自主跑轮运动干预能够有效地抑制其脑内的APP蛋白表达水平,比前也有类似的报道,如Wolf等[36]采用APP-23转基因AD小鼠的研究发现,与对照组小鼠相比,将该转基因小鼠置于带有跑轮的丰富环境干预实验中能够显著性降低其脑内APP的基因表达水平。徐波等[4]采用D-半乳糖造模AD大鼠的研究发现,8周的跑台运动能够显著抑制模型组大鼠海马APP的基因表达水平。Liu等[25]研究发现,5月的长期跑台运动虽然未能显著性降低APP/PS1转基因小鼠海马的APP蛋白表达水平,但运动却显著性抑制了APP的淀粉样途径的水解产物CTFs和sAPPβ的蛋白水平。以上研究均说明,运动能够抑制AD实验动物脑内的APP表达或其水解产物的表达水平。
3.2 自主跑轮运动对APP/PS1转基因小鼠海马ADAMs的影响
α-分泌酶是APP非淀粉样蛋白水解途径的重要水解酶,而APP的非淀粉样蛋白水解是脑内APP正常水解的主要途径。若α-分泌酶活动异常,脑内APP将不能正常水解,并可能激活其他的异常水解途径(如β-分泌酶发挥作用)导致Aβ产生。α-分泌酶的3个重要成员ADAM9、ADAM10和ADAM17在APP正常水解中发挥着不可或缺的作用,三者中,ADAM10可直接发挥着在APP的α-分泌酶位点降解APP的作用[22],而ADAM9[21]和ADAM17[31]在α-分泌酶对APP水解的过程中也发挥着重要的调节作用。
本研究发现,与野生型对照组小鼠相比,APP/PS1转基因小鼠海马ADAM10 mRNA表达水平和蛋白表达水平均显著性下调,说明APP/PS1转基因小鼠海马内ADAM10表达的减少是APP在脑内过度累积的重要原因之一。对转基因运动组小鼠和转基因对照组小鼠比较发现,运动组小鼠海马ADAM10 mRNA表达水平和蛋白水平均显著性上调,结合上文所述的自主运动下调了转基因小鼠海马APP的蛋白表达,说明自主运动可通过促进转基因小鼠海马ADAM10的表达进而促进APP向非淀粉样蛋白途径水解,促进了APP的正常代谢,减少其过度积累。对两个野生型组小鼠比较发现,与对照组小鼠相比,运动组小鼠海马ADAM10 mRNA和蛋白水平均有上调趋势,但均不具有显著性差异,其原因一方面可能与自主跑轮运动的强度有关,可以从野生型小鼠和转基因组小鼠在跑轮距离(图1)的差异上进行解释,总体上看,野生型小鼠的运动量显著小于转基因组小鼠;另一方面,ADAM10的表达水平可能与野生型小鼠脑内APP生成与水解的动态平衡有关,低水平的APP可能通过反馈性机制调节ADAM10的表达量。运动促进ADAM10的表达也得到了其他研究的证实,Liu等[25]研究发现,5个月的长期跑台运动能够有效上调APP/PS1转基因小鼠海马的ADAM10蛋白表达水平。孔繁军等[2]研究发现,6个月的跑台运动显著增强了APP/PS1转基因小鼠脑ADAM10的活性水平。
本研究发现,APP/PS1转基因小鼠海马ADAM9 和ADAM17 mRNA表达水平与野生型小鼠相比均无显著性差异;APP/PS1转基因运动组小鼠海马ADAM9和ADAM17 mRNA表达水平较APP/PS1转基因对照组小鼠均上调,但ADAM9 mRNA表达水平在两组间不具有显著性差异,而运动却显著上调了转基因小鼠海马ADAM17 mRNA的表达;两组野生型小鼠的比较发现,运动组小鼠海马ADAM9和ADAM17 mRNA表达水平较对照组小鼠均上调,但在ADAM9 mRNA表达上两组之间无显著性差异,而运动组小鼠的ADAM17 mRNA的表达水平极显著上调。这提示,自主运动对ADAM17的调节程度比对ADAM9的调节更显著,也暗示ADAM17在调节APP的非淀粉样蛋白水解途径中具有更显著的效果。本实验室的前期研究[37]发现,8周的有氧跑台运动能够在促进D-半乳糖造模AD大鼠海马ADAM17 mRNA表达水平显著上调的同时抑制海马Aβ42水平。由于本研究仅检测了各组小鼠海马ADAM9和ADAM17 mRNA表达情况,未进一步检测二者的蛋白表达情况,自主运动对二者mRNA表达水平的调节,可能只在一定程度上说明运动具有促进ADAM9和ADAM17在脑内表达的效果,不能完全成为证实运动干预对二者水平调节的确切依据,还需进一步深入研究。
3.3 自主跑轮运动对APP/PS1转基因小鼠海马Aβ42的影响
Aβ42是最重要的APP降解产物,它比其他的Aβ产物更加难溶,且较易聚积,一旦在神经细胞外沉积形成斑块,便难以清除,是神经细胞外老年斑的最主要成分,具有较强的神经毒性,可诱导神经细胞的功能紊乱,损害脑的认知功能,导致AD的神经病理学特征。
本研究采用的APP/PS1转基因小鼠是研究Aβ沉积诱发AD的最佳实验动物之一,有研究发现,该转基因小鼠在4月龄[27]或6月龄[30]时即可在海马内检测到Aβ沉积。而本研究运动干预时间在小鼠3~7月龄期间,因此,可验证16周运动对该转基因小鼠海马Aβ沉积的影响。本实验发现,与野生型小鼠相比,转基因小鼠海马Aβ42蛋白表达显著增加,说明两种小鼠在Aβ42表达水平上存在先天性差异,APP/PS1转基因小鼠已在分子水平上表现出AD病理特征。同时,本实验结果也可在一定程度上验证前人发现的该转基因小鼠在6月龄即出现海马Aβ沉积的结论。
对两组转基因小鼠比较发现,转基因运动组小鼠海马Aβ42蛋白表达水平较转基因对照组小鼠显著下调,提示,16周自主跑轮运动可有效促使转基因小鼠海马的Aβ蛋白水平的减少。此前研究发现,自主跑轮运动能够有效下调AD动物脑内的Aβ水平,如Adlard等[5]对TgCRND8转基因小鼠的研究,Nichol等[26]对Tg2576转基因小鼠的研究,Mesa等[12,13]对3xTg-AD三转基因小鼠的研究均证实,自主跑轮运动可促进转基因小鼠脑内Aβ水平的下调。
对转基因运动组小鼠和野生型运动组小鼠的对比发现,转基因小鼠与野生型小鼠海马Aβ42蛋白表达水平存在极显著性差异。基于先前的研究基础,Aβ42是AD脑内淀粉样蛋白沉积的主要组成部分,其在转基因小鼠脑内的基础水平可能较高,而运动干预能够在一定范围内抑制Aβ42的表达水平,但由于Aβ42难溶且易于聚积而沉积形成斑块的特性在一定程度上可能会抵消运动干预对其抑制性作用。提示,16周的跑轮运动能够在一定程度上下调转基因小鼠海马Aβ42的蛋白表达水平,但运动干预并不能使其水平降低至野生型小鼠的水平。
对两个野生型组小鼠的比较发现,Aβ42蛋白表达水平无显著性差异,提示,野生型小鼠脑内Aβ代谢处于产生和清除的动态平衡状态,脑内Aβ的基础水平较低,而运动干预对正常水平Aβ的调节作用较弱,说明运动对脑内正常水平的Aβ不具有明显的调节作用;也说明,野生型小鼠脑内APP可能主要是在α-分泌酶的作用下经非淀粉样蛋白途径水解,α-分泌酶竞争性抑制了β-分泌酶的功能,致使脑内Aβ蛋白处于较低的水平。
有不少研究发现,跑台运动也能够下调AD实验动物脑内的Aβ水平,如Cho等[8]对NSE/PS2m转基因AD小鼠的研究,Um等[33]对NSE/APPswe转基因小鼠的研究,Um等[34]对NSE/PS2m转基因AD小鼠的研究,Kang等[18]对PS2转基因小鼠的研究等均证实跑台运动可抑制转基因AD小鼠脑内Aβ水平。本实验室前期研究[37]也发现,8周的跑台运动抑制了D-半乳糖造模AD大鼠海马Aβ42的表达。综合本研究结果与先前研究结论可以发现,无论是自主跑轮运动还是跑台运动均能不同程度的抑制AD脑内的Aβ水平。
4 结论
APP/PS1转基因小鼠海马APP和Aβ42的蛋白表达水平较同月龄野生型小鼠显著性增加,其海马的α-分泌酶的mRNA和蛋白表达水平显著降低。16周的自主跑轮运动能够显著性下调转基因小鼠海马APP和Aβ42的蛋白表达水平,上调α-分泌酶主要家族成员的mRNA和蛋白表达水平。推测自主跑轮运动可能通过提高转基因小鼠海马α-分泌酶的表达,进而下调海马APP的表达,抑制海马Aβ的沉积。
[1]戴雪伶,姜招峰.阿尔茨海默氏病中β-淀粉样蛋白的神经毒性及其治疗策略[J].现代生物医学进展,2009,(8):1577-1579.
[2]孔繁军,周婷,王贺成,等.规律性运动对APP/PS1小鼠学习记忆能力的影响[J].神经疾病与精神卫生,2013,13(3):232-234.
[3]刘文娟,戴雪伶,姜招峰.β-淀粉样蛋白神经毒性及其防治策略[J].生命科学,2011,(10):1022-1026.
[4]徐波,余锋,张宪亮,等.跑台运动对D-半乳糖阿尔茨海默病大鼠海马β-淀粉样前体蛋白和Tau蛋白基因表达的影响[J].中国康复医学杂志,2014,(11):1010-1015.
[5]ADLARD P A,PERREAU V M,POP V,etal.Voluntary exercise decreases amyloid load in a transgenic model of Alzheimer's disease[J].J Neurosci,2005,25(17):4217-4221.
[6]BELARBI K,BURNOUF S,FERNANDEZ-GOMEZ F J,etal.Beneficial effects of exercise in a transgenic mouse model of Alzheimer's disease-like Tau pathology[J].Neurobiol Dis,2011,43(2):486-494.
[7]BLENNOW K,DE LEON M J,ZETTERBERG H.Alzheimer’s Disease[C].2006:387-403.
[8]CHO J Y,HWANG D Y,KANG T S,etal.Use of NSE/PS2m-transgenic mice in the study of the protective effect of exercise on Alzheimer's disease[J].J Sports Sci,2003,21(11):943-951.
[9]DEUSS M,REISS K,HARTMANN D.Part-time alpha-secretases:The functional biology of ADAM 9,10 and 17[J].Curr Alzheimer Res,2008,5(2):187-201.
[10]DU J T,YU C H,ZHOU L X,etal.Phosphorylation modulates the local conformation and self-aggregation ability of a peptide from the fourth tau microtubule-binding repeat[J].FEBS J,2007,274(19):5012-5020.
[11]ESCH F S,KEIM P S,BEATTIE E C,etal.Cleavage of amyloid beta peptide during constitutive processing of its precursor[J].Sci,1990,248(4959):1122-1124.
[12]GARCIA-MESA Y,GIMENEZ-LLORT L,LOPEZ L C,etal.Melatonin plus physical exercise are highly neuroprotective in the 3xTg-AD mouse[J].Neurobiol Aging,2012,33(6):1113-1124.
[13]GARCIA-MESA Y,LOPEZ-RAMOS J C,GIMENEZ-LLORT L,etal.Physical exercise protects against Alzheimer's disease in 3xTg-AD mice[J].J Alzheimers Dis,2011,24(3):421-454.
[14]GIMENEZ-LLORT L,GARCIA Y,BUCCIERI K,etal.Gender-specific neuroimmunoendocrine response to treadmill exercise in 3xTg-AD mice[J].Int J Alzheimers Dis,2010,(3):128354.
[15]GOTZ J,CHEN F,VAN DORPE J,etal.Formation of neurofibrillary tangles in P301l tau transgenic mice induced by Abeta 42 fibrils[J].Sci,2001,293(5534):1491-1495.
[16]HALLIWELL B,GUTTERIDGE J M.The importance of free radicals and catalytic metal ions in human diseases[J].Mol Aspects Med,1985,8(2):89-193.
[17]HERRING A,DONATH A,YARMOLENKO M,etal.Exercise during pregnancy mitigates Alzheimer-like pathology in mouse offspring[J].FASEB J,2012,26(1):117-128.
[18]KANG E B,KWON I S,KOO J H,etal.Treadmill exercise represses neuronal cell death and inflammation during Abeta-induced ER stress by regulating unfolded protein response in aged presenilin 2 mutant mice[J].Apoptosis,2013,18(11):1332-1347.
[19]KAZEMI K,MOGHADDAM H A,GREBE R,etal.A neonatal atlas template for spatial normalization of whole-brain magnetic resonance images of newborns:preliminary results[J].Neuroimage,2007,37(2):463-473.
[20]KE H C,HUANG H J,LIANG K C,etal.Selective improvement of cognitive function in adult and aged APP/PS1 transgenic mice by continuous non-shock treadmill exercise[J].Brain Res,2011,1403:1-11.
[21]KOIKE H,TOMIOKA S,SORIMACHI H,etal.Membrane-anchored metalloprotease MDC9 has an alpha-secretase activity responsible for processing the amyloid precursor protein[J].Biochem J,1999,343(2):371-375.
[22]LAMMICH S,KOJRO E,POSTINA R,etal.Constitutive and regulated alpha-secretase cleavage of Alzheimer's amyloid precursor protein by a disintegrin metalloprotease[J].Proc Natl Acad Sci U S A,1999,96(7):3922-3927.
[23]LEEM Y H,LIM H J,SHIM S B,etal.Repression of tau hyperphosphorylation by chronic endurance exercise in aged transgenic mouse model of tauopathies[J].J Neurosci Res,2009,87(11):2561-2570.
[24]LEEM Y H,LEE Y I,SON H J,etal.Chronic exercise ameliorates the neuroinflammation in mice carrying NSE/htau23[J].Biochem Biophys Res Commun,2011,406(3):359-365.
[25]LIU H L,ZHAO G,ZHANG H,etal.Long-term treadmill exercise inhibits the progression of Alzheimer's disease-like neuropathology in the hippocampus of APP/PS1 transgenic mice[J].Behav Brain Res,2013,256:261-272.
[26]NICHOL K E,POON W W,PARACHIKOVA A I,etal.Exercise alters the immune profile in Tg2576 Alzheimer mice toward a response coincident with improved cognitive performance and decreased amyloid[J].J Neuroinflamm,2008,5:13.
[27]PERIN E C,SILVA G V,VELA D C,etal.Human hepatocyte growth factor (VM202) gene therapy via transendocardial injection in a pig model of chronic myocardial ischemia[J].J Card Fail,2011,17(7):601-611.
[28]QIN W,PENG Y,KSIEZAK-REDING H,etal.Inhibition of cyclooxygenase as potential novel therapeutic strategy in N141I presenilin-2 familial Alzheimer's disease[J].Mol Psychiatry,2006,11(2):172-181.
[29]RAPOPORT M,FERREIRA A.PD98059 prevents neurite degeneration induced by fibrillar beta-amyloid in mature hippocampal neurons[J].J Neurochem,2000,74(1):125-133.
[30]SAVONENKO A,XU G M,MELNIKOVA T,etal.Episodic-like memory deficits in the APPswe/PS1dE9 mouse model of Alzheimer's disease:relationships to beta-amyloid deposition and neurotransmitter abnormalities[J].Neurobiol Dis,2005,18(3):602-617.
[31]SLACK B E,MA L K,SEAH C C.Constitutive shedding of the amyloid precursor protein ectodomain is up-regulated by tumour necrosis factor-alpha converting enzyme[J].Biochem J,2001,357(3):787-794.
[32]SONG Y,MULLER B,BURMAN C,etal.A model-aided segmentation in urethra identification based on an atlas human autopsy image for intensity modulated radiation therapy[J].Conf Proc IEEE Eng Med Biol Soc,2007:3532-3535.
[33]UM H S,KANG E B,LEEM Y H,etal.Exercise training acts as a therapeutic strategy for reduction of the pathogenic phenotypes for Alzheimer's disease in an NSE/APPsw-transgenic model[J].Int J Mol Med,2008,22(4):529-539.
[34]UM H S,KANG E B,KOO J H,etal.Treadmill exercise represses neuronal cell death in an aged transgenic mouse model of Alzheimer's disease[J].Neurosci Res,2011,69(2):161-173.
[35]VERRI M,PASTORIS O,DOSSENA M,etal.Mitochondrial alterations,oxidative stress and neuroinflammation in Alzheimer's disease[J].Int J Immunopathol Pharmacol,2012,25(2):345-353.
[36]WOLF S A,KRONENBERG G,LEHMANN K,etal.Cognitive and physical activity differently modulate disease progression in the amyloid precursor protein (APP)-23 model of Alzheimer's disease[J].Biol Psychiatry,2006,60(12):1314-1323.
[37]YU F,XU B,SONG C,etal.Treadmill exercise slows cognitive deficits in aging rats by antioxidation and inhibition of amyloid production[J].Neuroreport,2013,24(6):342-347.
Research on Effect of α-secretase on Regulating Hippocampal APP and Aβ42 in APP/PS1 Transgenic Mice of Alzheimer’s disease after Voluntary Wheel Running
YU Feng1,XU Bo2,JI Liu2
Objective:To observe the effect of α-secretase on the hippocampal APP cleaving and Aβ42 deposition in transgenic mice of Alzheimer’s disease (AD) after 16 weeks voluntary wheel running.Methods:24 male APP/PS1 transgenic mice of line C57 that expresses human mutant APP and PS1 in the brain were chosen and divided into wheel running group (TE,n=12) and control group (TC,n=12).Meanwhile,24 male wild-type mice in line C57 were chose and divided into wheel running group (E,n=12) and control group (C,n=12).Mice in group TE and group E were subjected to wheel running with ad libitum access to food and water for 16 weeks from 3 months of age.Mice in group TC and group C were subjected to food and water ad libitum,without exercise.Real-time RT-PCR was used to detect mRNA level of the main member of α-secretase,ADAM9,ADAM10 and ADAM17.Western blot was used to detect protein level of APP,ADAM10 and Aβ42.Results:(1)16 weeks wheel running significantly up-regulated the expression of ADAM10 mRNA (P<0.01) and ADAM10 protein (P<0.05) in the hippocampus of APP/PS1 transgenic mice.(2)16 weeks wheel running significantly up-regulated the expression of ADAM17 mRNA (P<0.05) in the hippocampus of APP/PS1 transgenic mice.(3) 16 weeks wheel running significantly decreased the protein expression of APP (P<0.05) and Aβ42 (P<0.05) in the hippocampus of APP/PS1 transgenic mice.Conclusion:16 weeks wheel running decreased the level of APP and its production Aβ42 by promoting the gene expression of α-secretase in the hippocampus of APP/PS1 transgenic mice.
voluntarywheelrunning;Alzheimer’sdisease;APP/PS1transgenicmice;hippocampus;α-secretase;APP;Aβ42
2015-10-21;
2016-06-05
青少年POWER工程协同创新中心项目(44801400/011);国家自然科学基金项目(31371204)。
余锋(1983-),男,河南信阳人,讲师,博士,主要研究方向为脑健康的运动干预,Tel:(0517)83525585,E-mail:yfyf005@163.com;徐波(1963-),男,山东莱阳人,教授,博士,博士研究生导师,主要研究方向为体育运动与身心健康、运动营养学,Tel:(021)54342612,E-mail:bxu@tyxx.ecnu.edu.cn;季浏(1961-),男,江苏泰兴人,教授,博士,博士研究生导师,主要研究方向为青少年体质健康评价、体育课程与教学、体育心理学,Tel:(021)54345131,E-mail:lji@tyxx.ecnu.edu.cn。
1.淮阴师范学院,江苏 淮安 223300;2.华东师范大学 “青少年健康评价与运动干预”教育部重点实验室,上海 200241 1.Huaiyin Normal University,Huaian,223300,China;2.East China Normal University,Shanghai 200241,China.
G804.2
A
10.16469/j.css.201607006

