60例人工耳蜗植入患者常见耳聋基因检测分析
张学梅,赵 宁,董 梅,刘 辉,毛轶楠,臧 雯
(1.河北省石家庄市第一医院耳鼻咽喉科,河北 石家庄 050011;2.河北医科大学第三医院手术室,河北 石家庄 050051;3.河北医科大学第二医院耳鼻咽喉科,河北 石家庄 050000)
·论 著·
60例人工耳蜗植入患者常见耳聋基因检测分析
张学梅1,赵 宁1,董 梅2,刘 辉1,毛轶楠3,臧 雯1
(1.河北省石家庄市第一医院耳鼻咽喉科,河北 石家庄 050011;2.河北医科大学第三医院手术室,河北 石家庄 050051;3.河北医科大学第二医院耳鼻咽喉科,河北 石家庄 050000)
目的分析人工耳蜗植入患者遗传性耳聋的发病情况。方法采用聚合酶链反应及限制性内切酶方法,检测60例人工耳蜗患者耳聋易感基因GJB2 235delC、PDS IVS7-2A>G及线粒体DAN 12sRNA A1555G位点的突变情况。结果60例人工耳蜗植入患者,共有33例患者携带常见致聋基因,总的突变率55.0%。包括235delC纯合突变6例(10.0%)、杂合突变7例(11.7%),PDS基因IVS7-2A>G纯合突变6例(10.0%)、杂合突变为12例(20.0%),线粒体12sRNA DNA A1555G阳性突变为2例(3.3%)。结论人工耳蜗植入患者主要致病原因为遗传因素,以PDS基因IVS7-2A>G为主,其次为GJB2基因235delC位点突变,部分患者为线粒体DAN 12sRNA A1555G位点突变。
聋;耳蜗植入术;基因;突变
研究已经发现遗传因素是导致感音神经性耳聋最重要的病因,人工耳蜗能有效解决由遗传导致的重度-极重度感音性耳聋[1]。河北省石家庄市第一医院耳鼻咽喉科自2006年开展人工耳蜗植入术,2011年开展耳聋基因检测,目前已完成了石家庄地区部分聋哑人群及部分耳聋患者耳聋基因检测。对于人工耳蜗植入患者术前常规进行常见耳聋基因检测,发现基因突变是导致人工耳蜗植入患者致聋的主要病因。现对60例人工耳蜗植入患者常见耳聋基因检测结果进行总结分析并报告如下。
1 资料与方法
1.1 一般资料 选择2012年5月—2014年3月在河北省石家庄市第一医院耳鼻咽喉科进行人工耳蜗植入术的耳聋患者60例,男性45例,女性15例,年龄1~50岁,中位年龄4.5岁。均为汉族。均无中耳炎、腮腺炎等病史,无母孕期异常和出生时乏氧及早产等病史,无智力障碍。所有患者除耳聋外,无其他遗传性疾病,均为非综合征耳聋(non-syndromic hearing impairment nSHI)患者。调查耳聋患者的基本信息、耳聋史、家族史、聋儿出生史、个人史(耳聋前传染病、耳毒性药物应用情况、头部是否受外伤等)。进行全身及专科查体。进行纯音测听(不能配合的儿童改为行为测听)、声导抗、听性脑干、40 Hz相关电位、多频稳态等检测。向患者或患儿家长解释聋病基因筛查的意义和目的,让家长了解耳聋基因检测的必要性,填写知情同意书。经患者或患儿家长同意后收集每位患者的基本资料和血样。
1.2 DNA提取 所有入选患者均经肘静脉抽取外周血5~6 mL,乙二胺四乙酸抗凝管保存,应用试剂盒提取DNA(山东三月三基因技术有限公司),提取步骤和方法参照试剂盒提供的使用说明进行。取适量提取DNA用紫外分光光度计进行定量和纯度检测,其余保存于-80 ℃备用。
1.3 检测方法 应用聚合酶链反应及限制性内切酶方法进行检测。
1.3.1 试剂 GJB2 235delc突变、PDS IVS7-2A>突变检测试验为:2×PCR反应液、阴性对照DNA、纯合突变阳性对照DNA、杂合突变对照DNA、酶切鉴定试剂。线粒体DNA12sRNA A1555G的酶切鉴定试剂为:HaeⅢ限制性内切酶缓冲液、HaeⅢ限制性内切酶,其他与GJB2突变检测试剂同(所有试剂均为山东三月三基因技术有限公司提供)。
1.3.2 扩增体系配制 2×PCR反应液10 μL,水7 μL,分别加入对照DNA及待检样本DNA 3 μL,空白对照组加水3 μL,总反应体系20 μL。
1.3.3 扩增条件 保温42 ℃,5 min;94 ℃,5 min;变性94 ℃,30 s;复性58 ℃,30 s;延伸72 ℃,30 s;30个循环;再延伸72 ℃,5 min;4 保存。
1.3.4 GJB2及PDS酶切体系配制 PCR扩增产物10 μL,酶切鉴定试剂10 μL,总量20 μL体系。酶切条件:37 ℃水浴15 min。线粒体酶切体系配制:PCR扩增产物10μL, HaeⅢ限制性内切酶缓冲液2μL,HaeⅢ限制性内切酶1 μL,水7 μL,总量20 μL体系。酶切条件:37 ℃水浴1 h。
1.3.5 琼脂糖凝胶电泳检测 2%琼脂糖凝胶,酶切产物上样量为8μL,以电场强度为85 V电压,进行恒压电泳,时间为45 min。
1.4 结果分析 应用凝胶电泳成像分析仪进行样本PCR产物酶切后图像扫描观察。GJB2 235delC纯合突变:出现940 bp条带,与阳性对照DNA酶切片段泳动距离一致。GJB2 235delC杂合突变:出现940 bp、580 bp和360 bp 3条带,与杂合对照DNA酶切片段泳动距离一致。GJB2 235delC野生阴性:出现580 bp和360 bp 2条带,与阴性对照组DNA酶切片段泳动距离一致(图1)。
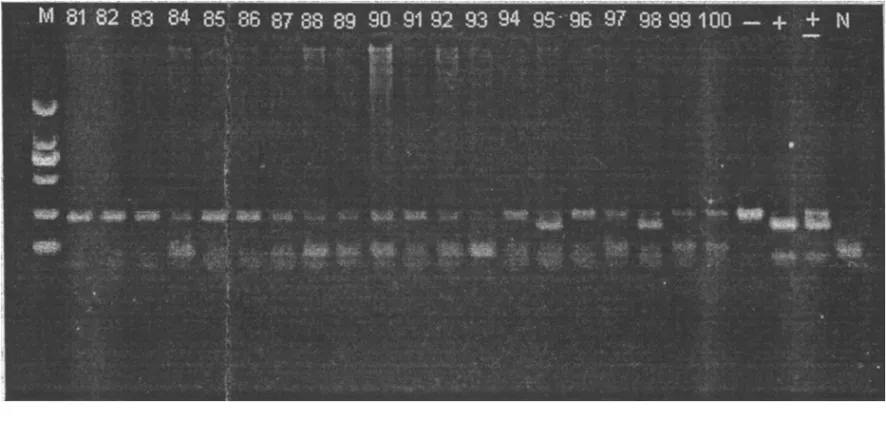
图1 部分GJB2 235delC突变检测结果
泳道M:DL2000DNA;泳道(+):纯合阳性对照;泳道(-):阴性对照;泳道(±):杂合对照;泳道(95、98):纯合阳性突变;泳道(94、96):杂合突变;其余:阴性
Figure 1 Detection results of the mutation of GJB2 235delC
PDSIVS7-2A>G纯合突变:出现190bp条带,与阳性对照DNA酶切片段泳动距离一致。PDSIVS7-2A>G杂合突变:出现190 bp和240 bp 2条带,与杂合对照DNA酶切片段泳动距离一致。PDSIVS7-2A>G野生阴性:出现40 bp条带,与阴性对照组DNA酶切片段泳动距离一致(图2)。

图2 部分PDS IVS7-2A>G检测结果
泳道M:DL2000DNA;泳道(+):纯合阳性对照;泳道(-):阴性对照;泳道(±):杂合对照;泳道(95):纯合阳性突变;泳道(98):杂合突变;其余:阴性
Figure 2 Detection results of the mutation of PDS IVS7-2A>G
线粒体DNA A1555G阳性突变:出现91 bp条带,与阳性对照DNA酶切片段泳动距离一致。线粒体DNA A1555G野生阴性:出现111 bp条带,与阴性对照组DNA酶切片段泳动距离一致(图3)。
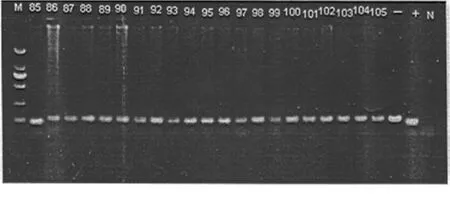
图3 部分线粒体DNA12srRNA A1555G检测结果
泳道M:DL2000DNA;泳道(+):纯合阳性对照;泳道(-):阴性对照;泳道(85):阳性突变;其余:阴性
Figure 3 Detection results of the mitochondrial DNA12srRNA A1555G
2 结 果
2.1 听力检测结果 全部患者由专业人员进行听力学检测,按WHO(1980)国际标准,60例患者均为双侧重度-极重度感音神经性耳聋(听力损失均在70 dB以上),除听力障碍无其他系统疾病及发育异常。
2.2 PCR扩增及限制性内切酶酶切结果 60例检测对象中共33例发生了基因突变,总突变率为55.0%。其中GJB2基因235delC双等位基因纯合突变6例(10.0%)、单等位基因杂合突变7例(11.7%),PDS基因IVS7-2A>G双等位基因纯合突变6例(10.0%)、单等位基因杂合突变为12例(20.0%),线粒体DNA A1555G阳性突变为2例(3.3%)。
13例GJB2 235delC突变患者均为先天耳聋。18例PDS IVS7-2A>G 突变患者,有3例有明确的外伤后出现听力下降,5例为先天性耳聋,10例后天性渐进性耳聋,逐渐达到重度耳聋;所有PDS IVS7-2A>G突变患者颞骨CT检测均发现前庭导水管扩大,5例患者并发Mondini畸形。2例线粒体DNA A1555G阳性突变患者,1例为患脑膜炎后肌内注射庆大霉素后出现重度感音性耳聋,1例因腹泻口服庆大霉素出现重度性耳聋。27例耳聋基因检测阴性患者,7例为先天性耳聋,15例为后天性耳聋,还有5例耳聋病史不明。
3 讨 论
耳聋是一类发病率高、病因复杂、给患者和社会家庭带来沉重负担的疾病。耳聋的影响因素主要分为环境因素和遗传因素。目前随着环境因素导致的耳聋发病率的降低和对耳聋诊断水平的提高,已经确定60%的耳聋是由遗传缺陷引起,遗传因素是导致耳聋的首要因素[2]。
遗传性耳聋分为NSHI和综合征性耳聋(syndromic hearing impairment,SHI)。其中70%为NSHI,临床表现为单纯的感音神经性聋,除听力受损外基本无其他异常;其余30%为SHI,临床表现多样,除听力损失外,常伴有全身其他器官的病变。遗传性NSHI根据遗传特征可分为4种:常染色体隐性遗传性耳聋、常染色显性遗传性耳聋、线粒体DNA相关遗传性耳聋、X-连锁相关性遗传性耳聋。其中以常染色体隐性遗传性耳聋最为常见,约占遗传性NSHI总发病率的80%,常染色体显性遗传约占20%,X-连锁及线粒体DNA相关占1~2%[3-4]。本研究的60例患者除耳聋外,无其他疾病,无其他系统发育不全,均为NSHI患者。
研究证实GJB2、PDS和线粒体mtDNA基因突变导致了大部分的遗传性耳聋[4-7];而且这部分基因突变引起的病变的部位均在耳蜗,听神经功能尚完好,人工耳蜗植入是唯一能有效帮助这类患者获得听觉的最有效途径[8]。
本研究应用基因检测技术,对60例人工耳蜗植入患者进行常见耳聋基因GJB2 235delC、PDS IVS7-2A>G及线粒体12sRNA A1555G位点的突变情况进行检测,发现60例患者中共有33例(55.0%)是由这3个基因突变所致,其中GJB2突变占21.7%。13例GJB2 delC突变患者均为先听性重度感音神经性耳聋,有6例为纯合突变,7例为杂合突变,纯合突变引起耳聋容易理解,推测杂合突变引起先天耳聋可能为复合杂合突变,等位基因上可能同时并发35delG、167delT、R143等突变,对于这一类患者需要进一步采取测序的方法明确其基因突变类型和方式,这样才能为患者及其家族提供较为明确的遗传资料,为下一步家族遗传资料收集和分析提供依据。GJB2 235delC突变占本研究耳聋耳蜗植入患者的21.7%,提示对先天性感音性耳聋患者进行GJB2 235delC突变检测,至少能为五分之一患者回答其致聋的病因,具有重要的临床指导意义[9-12]。
PDS (SLC26A4)基因位于7号染色体长臂,有21个外显子,编码pendrin蛋白在多种组织器官中表达,其中以内耳、甲状腺和肾脏表达最为明显。pendrin蛋白与氯离子、碘离子和碳酸氢离子转运有关。PDS基因突变导致耳聋表现为双侧、呈波动性或进行性加重的耳聋;可为先天性语前聋,也可为后天早期语后聋;颞骨CT检测可发现大前庭水管或Mondini畸形等。本研究结果显示60例重度耳聋患者中,有18例为PDS IVS7-2A>G,占总突变率的30.0%,是本研究患者最常见的致聋基因,其中纯合突变为6例(10.0%),单等位基因杂合突变为12例(20.0%),这18例PDS IVS7-2A>G突变患者,经颞骨CT检查均发现有前庭导水管有扩大,其中有5例并发Mondini畸形。这提示PDS基因检测对于大前庭导水管扩大综合征具有很高的特异性,是很重要的诊断依据[13]。18例PDS IVS7-2A>G突变患者,5例有明确的外伤后耳聋病史,这也是PDS突变致聋的一个临床特点,可为临床上头部外伤后出现耳聋的诊断提供一个新的思路和检验方法,同时对于检测阳性患者,告知其避免剧烈活动、头部外伤、颅压剧烈变化可预防耳聋发生或延缓耳聋的进程。另外,PDS基因基因有多种突变类型,最常见的为IVS7-2A>G,还包括2168A>G、1649T>A、IVS8+IG>A以及其他类型突变等[6]。这可以帮助理解为什么PDS IVS7-2A>G杂合突变也能导致耳聋提供了答案,分析可能是这部分患者为复合杂合突变,除IVS7-2A>G突变外,等位基因同时并发2168A>G、1649T>A、IVS8+IG>A等突变类型,笔者下一步计划采取测序的方法明确这一部分患者基因突变类型和方式。
线粒体12sRNA基因1555A>G突变为氨基糖甙类药物敏感性聋的遗传因素。由于12sRNA基因的1555位点核苷酸腺嘌呤A突变成鸟嘌呤G,导致线粒体12sRNA基因的一级结构发生改变,变得与大肠杆菌线粒体16sRNA基因结构类似,从而使得氨基糖苷类药物容易与之结合,从而影响线粒体呼吸链正常功能,导致患者对氨基糖甙类抗生素异常敏感,常表现为“一针致聋”[14-15]。本研究2例线粒体12sRNA 1555A>G 突变患者均为少量接触庆大霉素即出现重度感音性耳聋。虽然线粒体12sRNA 1555A>G基因突变导致的耳聋没有GJB2和PDS基因突变常见,但是对于这一突变类型,只要有了明确的基因诊断,通过避免使用氨基糖甙类药物就可以有效预防耳聋的发生,具有很大的经济和社会意义。
本研究总结了人工耳蜗植入耳聋患者常见致聋基因的发病特点,提示人工耳蜗植入患者耳聋的主要原因为PDS基因突变、其次为GJB2突变,线粒体突变也占小部分比例。以上数据可为人工耳蜗植入患者耳聋基因检测及诊断提供依据,更重要的是通过对突变基因的筛查,通过遗传分析可为其后代出现耳聋患者的风险系数作出预测,为患者家族内成员的婚育提供指导意见,同时结合婚前或产前检查可以避免耳聋患儿出生,从而为社会和家庭节省很大的医疗和经济资源。因此,建立全国和地方遗传性耳聋防治机构将是未来耳聋防治工作的关键。鉴于本研究病例数量有限,同时仅对最常见的3个耳聋基因的3个位点进行检测,故有一定的局限性,有待在今后的研究中进一步补充完善。
[1] Popov TM,Stancheva I,Kachakova DL,et al. Auditory outcome after cochlear implantation in patients with congenital nonsyndromic hearing loss:influence of the GJB2 status[J]. Otol Neurotol,2014,35(8):1361-1365.
[2] Zhu J,Cao Q,Zhang N,et al. A study of deafness-related genetic mutations as a basis for strategies to prevent hereditary hearing loss in Hebei,China[J]. Intractable Rare Dis Res,2015,4(3):131-138.
[3] 王秋菊,纵亮.遗传性耳聋的基本概念(2) [J].听力学及言语疾病杂志,2016,24(1):110-112.
[4] 刘启珍,陈丽鸿,张应龙,等.重庆市永川地区青少年耳聋患者耳聋基因热点突变筛查分析[J].中华耳科学杂志,2013,11(1) :126-130.
[5] 王继,张铁松.遗传性耳聋的基因研究进展[J].医学综述,2013,19(3):442-444.
[6] Ben Said M,Grati M,Ishimoto T,et al. A mutation in SLC22A4 encoding an organic cation transporter expressed in the cochlea strial endothelium causes human recessive non-syndromic hearing loss DFNB60[J]. Hum Genet,2016,135(5):513-524.
[7] 封纪珍,李素芳,李天洁,等.石家庄新生儿听力及耳聋基因联合筛查结果分析[J].河北医科大学学报,2015,36(11):1271-1275.
[8] 卿洁,彭安全,谢鼎华,等.耳蜗植入在常见类型遗传性耳聋中的应用效果[J].中华耳科学杂志,2013,11(2):175-180.
[9] 高儒真,陈晓巍,历东东,等 新生儿GJB2基因筛查及听力随访的意义[J].临床耳鼻咽喉头颈外科杂志,2015,29(4):314-318.
[10] 王辉兵,于飞,戴朴,等.GJB2单杂合突变非综合征型耳聋GJB2序列长度检测[J].中华耳科学杂志,2014,12(1) :54-56
[11] 陈默,王朝燕,张智雯,等.单侧人工耳蜗入学龄前耳聋儿童听觉言语康复效果影响因素分析[J].听力学及言语疾病杂志,2016,24 (2):171-175.
[12] 代志瑶,孙宝春,黄莎莎,等.GJB2基因听力学表型与基因型关系分析[J].中华耳科学杂志,2014,12(1):34-36.
[13] 孙宝春,代志瑶,黄莎莎,等.GJB2、SLC26A4基因致病性突变与内耳CT表型关系的研究[J].中华耳科学杂志,2014,12(1):30-33.
[14] 彭光华,郑斌娇,方芳,等.25个携带线粒体12S rRNA A1555G突变的中国汉族非综合征型耳聋家系[J].遗传,2013,35(1):62-72.
[15] 梁玲芝,伍越,阳娅玲,等.线粒体tRNAIle)A4317G突变可能影响12S rRNA A1555G突变相关的耳聋表型表达[J].遗传,2013,35(6):752-760.
(本文编辑:赵丽洁)
Analysis of common deafness genes in 60 patients with cochlear implantation
ZHANG Xue-mei1, ZHAO Ning1, DONG Mei2, LIU Hui1, MAO Yi-nan3, ZANG Wen1
(1.Department of Otolaryngology Head and Neck Surgery, the First Hospital of Shijiazhuang City, Hebei Province, Shijiazhuang 050011, China; 2.Department of Operating Room, the Thord Hospital of Hebei Medical University, Shijiazhuang 050051, China; 3.Department of Otolaryngology Head and Neck Surgery, the Second Hospital of Hebei Medical University,Shijiazhuang 050000, China)
Objective To analyze the incidence of hereditary hearing loss in patients with cochlear implantation. Methods Using polymerase chain reaction and restriction enzyme method, the mutations of 235delC GJB2, IVS7-2A>G PDS and mitochondrial 12sRNA A1555G DAN were detected in 60 patients with cochlear hearing loss. Results A total of 33 patients with genetic mutation were detected in 60 cochlear implantation patients, and the total mutation rate was 55.0%,including: 235delC homozygous mutation in 6 cases(10.0%), 7 cases with heterozygous mutation(11.7%); PDS gene homozygous IVS7-2A>G mutation in 6 cases(10.0%), heterozygous mutation in 12 cases(20.0%); DNA mitochondrial 12sRNA A1555G mutation positive for 2 cases(3.3%). Conclusion The main causes of the disease are genetic factors, IVS7-2A>G gene PDS, followed by the 235delC gene GJB2 site mutation. Some patients are mitochondrial 12sRNA A1555G DAN site mutation.
deafness; cochlear implantation; genes; mutation
2016-05-11;
2016-07-22
石家庄市科学技术研究与发展指导计划(141462573)
张学梅(1978-),女,湖北黄冈人,河北省石家庄市第一医院副主任医师,医学博士,从事耳鼻咽喉科疾病诊治研究。
R764.43
A
1007-3205(2016)11-1294-04
10.3969/j.issn.1007-3205.2016.11.014

