不同条件下核桃青皮腐解物对土壤肥力的影响
马红叶,潘学军,张文娥,彭 剑
(贵州大学 农学院/贵州省果树工程技术研究中心,贵州 贵阳 550025)
不同条件下核桃青皮腐解物对土壤肥力的影响
马红叶,潘学军,张文娥,彭 剑
(贵州大学 农学院/贵州省果树工程技术研究中心,贵州 贵阳 550025)
【目的】 研究不同腐解条件下核桃青皮腐解物对土壤化学和生物学性质的影响,探讨核桃青皮的还田效应,筛选最佳腐解条件,为有效利用核桃青皮提供科学依据。【方法】 以铁核桃青皮为试材,将核桃青皮与土壤混合进行腐解试验,研究不同腐解时间(0,10,20,30,40,50,60 d)、腐解温度(15,25,35 ℃)以及青皮与土壤不同配比(0∶100(CK),1∶100,5∶100,10∶100,质量比)条件下核桃青皮腐解对土壤化学特性、养分含量、酶活性和微生物数量的影响。【结果】 在不同腐解时间试验中,与0 d(未腐解)处理相比,核桃青皮腐解降低了土壤EC值和过氧化氢酶、纤维素酶活性,提高了蔗糖酶和碱性磷酸酶活性,土壤全氮、全磷、全钾、有机碳、有机质含量以及真菌、放线菌数量的最大值多出现在10~30 d,其中又以20 d居多。在不同腐解温度处理中,除全氮、全磷、全钾含量及过氧化氢酶活性和放线菌数量外,其他测定指标的峰值均出现在常温(25 ℃)处理中。青皮与土壤不同配比试验中,土壤pH、EC值、全氮、总有机碳、有机质、全钾含量,以及脲酶和碱性磷酸酶的活性、放线菌数量大体上随青皮添加比例的增加而增大,当青皮与土壤配比为10∶100时均达最大值。【结论】 核桃青皮腐解能有效提高土壤养分含量,增强土壤酶活性,增加微生物数量,可以改善和提高土壤肥力。就改善土壤肥力方面而言,核桃青皮的最佳腐解条件为:腐解时间20 d、常温(25 ℃)和青皮与土壤配比为10∶100。
核桃青皮;腐解条件;土壤肥力
残体是植物在生长发育过程中新陈代谢的产物,含有有机质和氮、磷、钾等营养元素,是生态系统养分循环的重要载体[1]。作为生态系统物质循环和能量转换的主要途径,植物残体通过分解逐步将养分归还给土壤,在维持土壤肥力、保持土壤生产力等方面发挥着重要作用[2]。研究表明,植物残体分解能够改善土壤营养状况、提高土壤生物活性及保持土壤物理稳定性[3]。郭鑫等[4]发现,毛乌素沙地人工固沙灌木林地(沙柳、杨柴、柠条)植物残体的分解可使土壤有机质、全氮、全磷含量提高,土壤体积质量降低,孔隙度增大,促进土壤改良。马尾松、槲栎凋落物分解后能使土壤脲酶、过氧化氢酶及碱性磷酸酶活性增强[5]。此外,植物残体分解也利于增加土壤动物、微生物数量,提高生物多样性[3]。具有化感作用的植物如桉树、大蒜、紫茎泽兰等的残体分解对土壤质量也有不同程度的改良作用[6-8]。而陈国平等[9]研究指出,具有化感作用的核桃林凋落物对土壤矿质营养元素积累总量的贡献小于栓皮栎林和槲栎林。近年来,关于植物残体分解的研究较多[10],其中有关化感植物残体分解也有一定报道[6-9,11-12],但具有强烈化感作用的核桃青皮的分解至今尚缺乏相应的关注,目前关于其分解物对土壤理化性质和生物活性的影响等问题的认识还不清楚。植物残体通过分解发挥其在养分循环、维持土壤肥力等方面的作用,但其分解受时间、环境因素(尤其是温度)、植物残体本身的数量和质量等诸多因素的影响[13]。基于此,本试验以我国西南地区核桃特有种铁核桃(JuglanssigillataDode)的青皮为试材,研究在不同分解条件下核桃青皮腐解物对土壤化学性质、养分含量、酶活性及微生物数量的影响,以期为筛选核桃青皮的最佳腐解条件提供理论参考。
1 材料与方法
1.1 试验地概况
试验在贵州大学果树工程技术研究中心盆栽场进行(26° 11′ N,106° 27′ E)。该地区属亚热带湿润温和型气候,年平均气温15.3 ℃,年极端最高温度35.1 ℃,年极端最低温度-7.3 ℃,年平均相对湿度78%,年平均总降水量为1 129.5 mm,夏季降雨量约500 mm,夜间降水量占全年降水量的70%。年平均阴天时间为235.1 d,年平均日照时数为1 148.3 h,年降雪仅为11.3 d。
1.2 试验材料
试验所用的铁核桃青皮和土壤(黑色石灰土)于2014年10月采集于贵州大学核桃栽培试验基地。采集的核桃青皮自然风干,用粉碎机粉碎成颗粒状,装入塑料袋在暗室中储藏备用。将取回的土壤于暗室中摊开、风干、敲碎、去除杂物、过1 cm筛,于暗室中保存备用。核桃青皮和土壤的基本化学性质见表1。
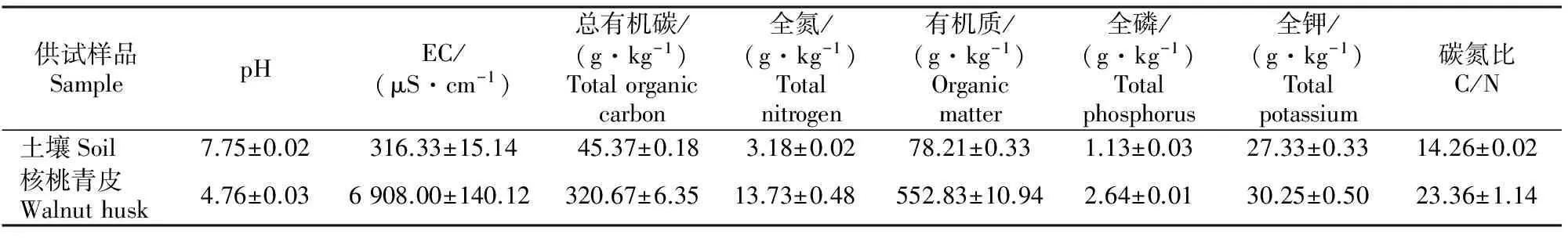
表 1 供试土壤和核桃青皮的基本化学性质
1.3 试验设计
从2014年11月开始共进行了3个核桃青皮分解试验,研究不同腐解时间、腐解温度以及青皮粉末与土壤不同配比(质量比,下同)下核桃青皮腐解物对土壤化学及生物学性质的影响。
1.3.1 腐解时间 将核桃青皮粉末与土壤以5∶100比例混合,装入具有透气孔的塑料盆(19 cm×19 cm×15 cm)内,浇透水,在自然条件下,分别于分解0,10,20,30,40,50和60 d时取样,测定土壤化学及生物学性质。
1.3.2 腐解温度 将核桃青皮粉末与土壤以5∶100比例混合,装入具有透气孔的塑料盆(19 cm×19 cm×15 cm)内浇透水,在恒温培养箱内分解,腐解温度分别为15,25和35℃,腐解30 d时取样,测定土壤化学及生物学性质。
1.3.3 青皮粉末与土壤配比 将核桃青皮粉末与土壤分别以0∶100(CK),1∶100,5∶100和10∶100的比例混合,装入具有透气孔的塑料盆(19 cm×19 cm×15 cm)内浇透水,自然条件下腐解30 d时取样,测定土壤化学及生物学性质。
所有处理均在盆的底部和顶部铺上塑料薄膜以防水分散失。培养过程中,水分控制采用质量控制法,保证腐解过程中土壤含水量不低于土壤田间最大持水量的70%。每处理15盆,3次重复。随机区组设计。1.3.1和1.3.3节试验在塑料大棚中进行。试验结束后,将每个重复各盆中的土壤混匀,一部分(约1 kg)室温下风干,过孔径1 mm或0.25 mm筛,暗室干燥保存,留待测定土壤化学性质、酶活性;一部分(约50 g)于4 ℃冰箱保存,用于测定土壤微生物数量。
1.4 测定项目与方法
1.4.1 土壤pH、EC值 土壤pH(水土体积质量比为2.5∶1),用酸度计(PHS-3CT,上海)测定;土壤EC值(水土体积质量比为5∶1),用电导仪(DDS-12DW,萧山)测定[14]。
1.4.2 土壤有机碳、有机质含量 土壤有机碳含量采用重铬酸钾-浓硫酸外加热法测定,土壤有机质含量=土壤有机碳含量×1.724。
1.4.3 土壤矿质养分含量 全氮含量采用半微量开氏法测定,全磷含量用NaOH熔融-钼锑抗比色法测定,全钾含量用NaOH熔融-原子吸收法测定[14]。
1.4.4 土壤酶活性 土壤蔗糖酶、纤维素酶活性采用3,5-二硝基水杨酸比色法测定,碱性磷酸酶活性采用磷酸苯二钠比色法测定,脲酶活性采用靛酚蓝比色法测定,过氧化氢酶活性采用紫外分光光度法测定(UV-1100,MAPAD,上海)[15]。
1.4.5 土壤微生物数量 土壤微生物数量采用稀释平板法测定[16],其中细菌用牛肉膏蛋白胨选择性培养基培养,真菌用马丁孟加拉红-链霉素选择性培养基培养,放线菌用改良高氏一号培养基培养。微生物总量为细菌、真菌和放线菌数量的总和。
1.5 数据处理与分析
利用Excel 2003软件对数据进行整理和做图,采用DPSv7. 05 分析软件进行单因素方差分析。方差分析时的多重比较采用Duncan’s新复极差法。
2 结果与分析
2.1 不同腐解时间下核桃青皮对土壤化学及生物学性质的影响
随着腐解时间的延长,土壤pH值变化表现为先增加后降低,而EC值呈现先降低而后波动上升再下降的趋势,pH、EC峰值分别出现在10 和0 d(图1)。

图中标不同小写字母表示差异显著(P<0.05)。下图同
图 1 不同腐解时间下核桃青皮腐解物对土壤pH和EC值的影响
Fig.1 Effects of duration of walnut husk decomposition on soil pH and EC
由表2可见,核桃青皮腐解期间,土壤全氮、总有机碳、有机质、全磷、全钾含量大体呈先增加后降低的变化趋势,以上指标的最大值多出现在10~30 d,表明核桃青皮在30 d内腐解较快,可释放出大量养分。腐解20,60 d时土壤C/N明显高于其他腐解时间处理,而其他处理之间差异不显著。
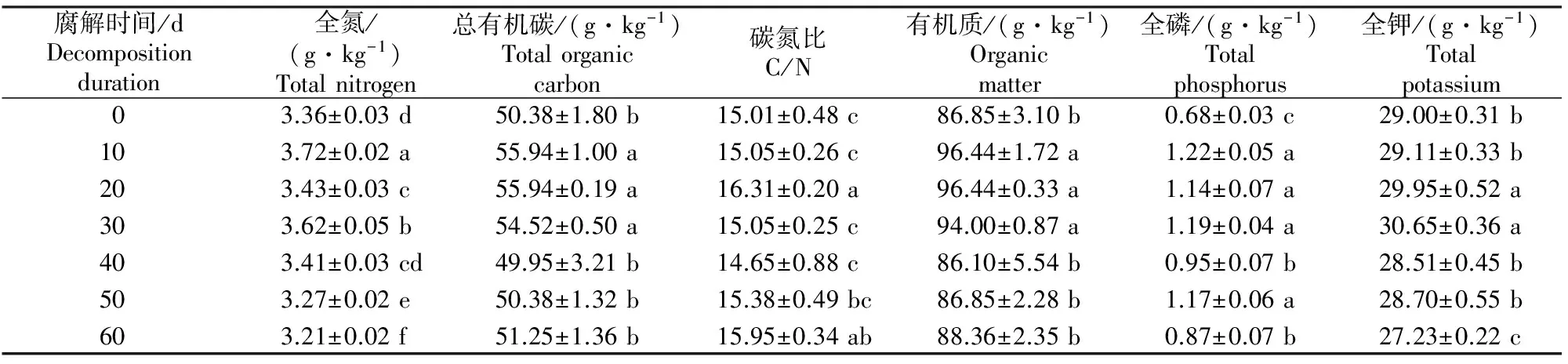
表 2 不同腐解时间下核桃青皮腐解物对土壤养分含量的影响
注:同列数据后标不同小写字母表示差异显著(P<0.05)。下表同。
Note:Different lowercase letters mean significant difference (P<0.05).The same below.
不同腐解时间下核桃青皮腐解物对土壤酶活性的影响见图2。
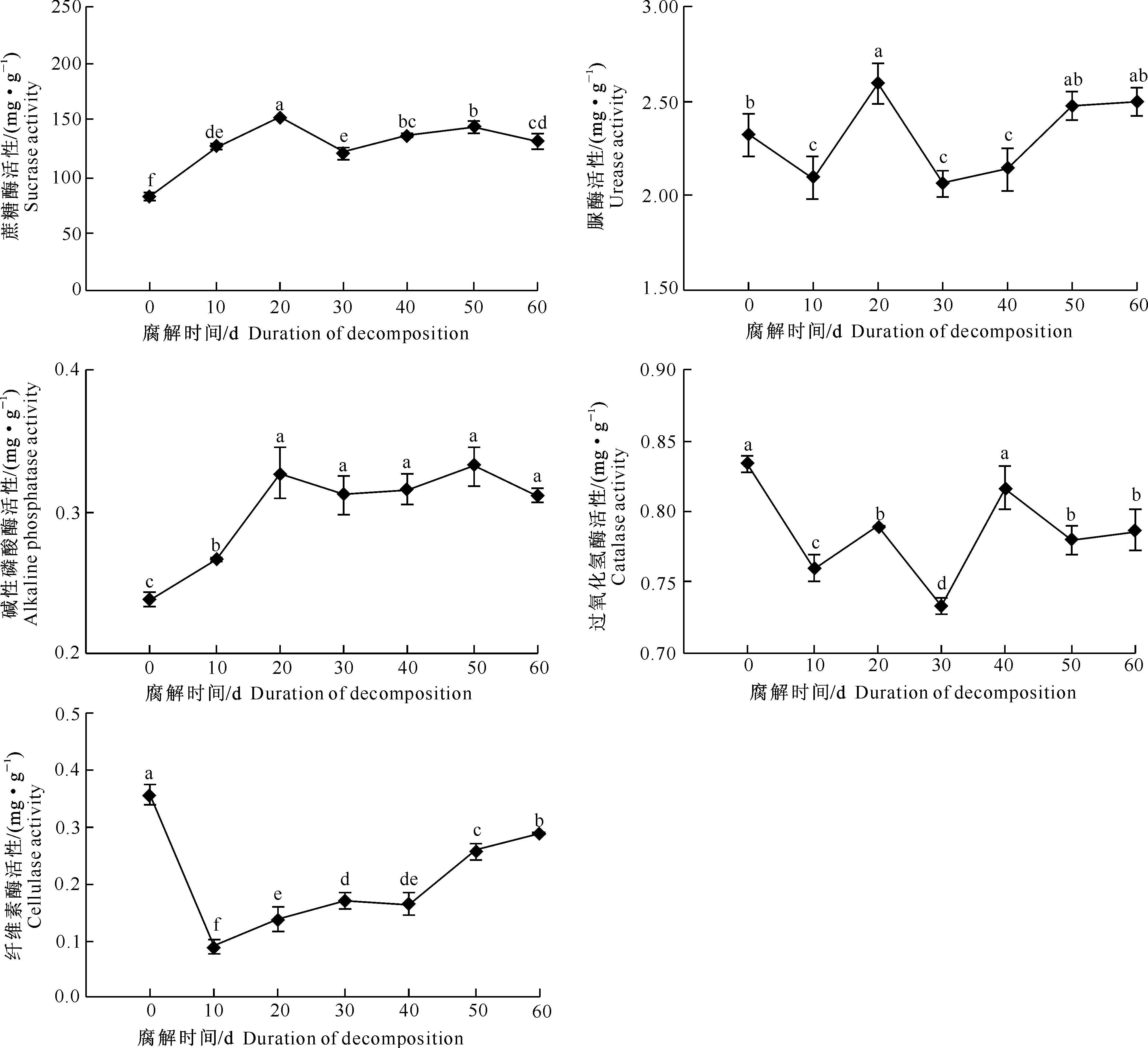
图 2 不同腐解时间下核桃青皮腐解物对土壤酶活性的影响
Fig.2 Effects of duration of walnut husk decomposition on soil enzyme activities
从图2可以看出,与0 d(未腐解)相比,随着腐解时间的延长,核桃青皮腐解显著提高了土壤蔗糖酶和碱性磷酸酶活性,显著降低了纤维素酶活性。在核桃青皮腐解期间,脲酶和过氧化氢酶活性均呈现波动性不规则变化趋势。
图3显示,土壤各类微生物数量在青皮腐解期间变化趋势多样,其中细菌、放线菌数量和微生物总量均呈单峰曲线变化,其最大值分别出现在40,20,40 d;而真菌数量呈双峰曲线变化,2个峰值分别出现在10 和40 d。在微生物总量中,细菌数量占绝对优势,这也是微生物总量与细菌数量变化趋势一致的原因。
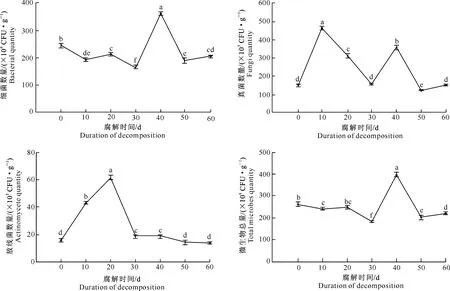
图 3 不同腐解时间下核桃青皮腐解物对土壤微生物数量的影响
2.2 不同腐解温度下核桃青皮对土壤化学及生物学性质的影响
在不同的腐解温度处理中,土壤pH值在低温(15 ℃)和常温(25 ℃)处理间无显著差异,但较高温处理(35 ℃)均显著增加,分别增加了0.06和0.07(图4)。各处理土壤EC值也表现出相似的趋势。与高温处理(35 ℃)相比,15和25 ℃ 处理土壤EC值分别增加了24.34和32.67 μS/cm。
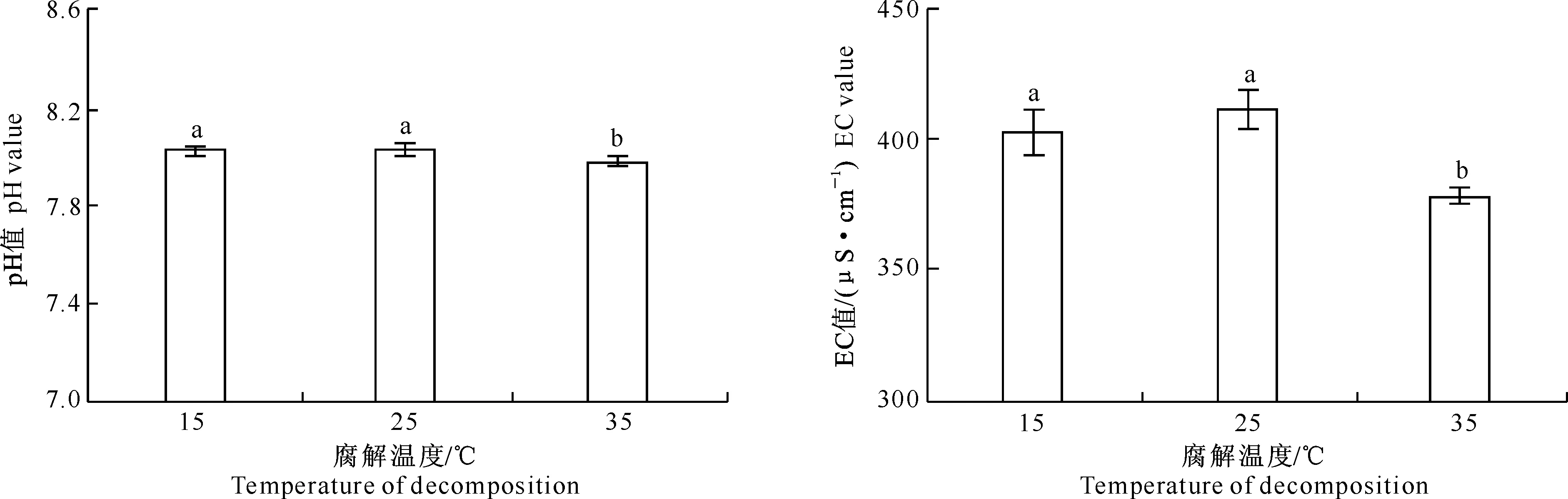
图 4 不同腐解温度下核桃青皮腐解物对土壤pH和EC值的影响
表3显示,随着温度的升高,土壤养分呈现不同的变化趋势。其中,土壤全氮含量随着温度的升高而升高,35 ℃下土壤全氮含量比15 ℃增加了11.58%。总有机碳含量在25 ℃下达到最大值。土壤有机质含量在高温(35 ℃)和常温(25 ℃)处理间无显著差异,但较低温(15 ℃)处理均显著增加。各温度处理对土壤全磷、全钾含量的影响不显著。C/N 在25 ℃下最高,15 ℃下次之,35 ℃下最低。

表 3 不同腐解温度下核桃青皮腐解物对土壤养分含量的影响
腐解温度对土壤酶活性的影响如图5所示。图5显示,在各温度处理中,土壤碱性磷酸酶和过氧化氢酶活性在低温(15 ℃)和常温(25 ℃)处理间无显著差异,但较高温(35 ℃)处理均显著增加,增幅分别为42.83%,46.47%和5.6%,4.22%。但土壤纤维素酶活性却表现出相反的趋势,在高温(35 ℃)和常温(25 ℃)处理间无显著差异,但较低温(15 ℃)处理均显著增加。此外,蔗糖酶和脲酶活性峰值均出现在常温处理(25 ℃)中,且与其他温度处理之间差异显著。
哦,东方人!希望你能再次登上“非洲之傲”!你一定会看到我,看到我美丽的衣服!珊德拉夫人独自举起酒杯,一饮而尽。
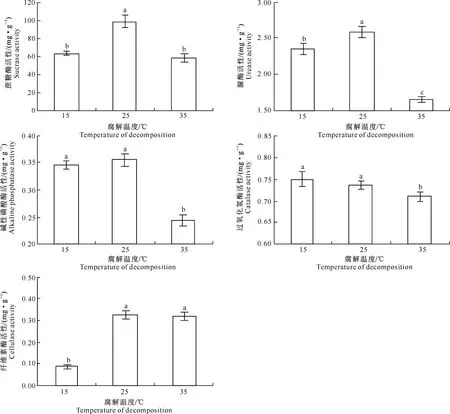
图 5 不同腐解温度下核桃青皮腐解物对土壤酶活性的影响
图6显示,在不同温度处理中,细菌、真菌数量及微生物总量表现出相同的变化趋势,均以25 ℃时最高,15 ℃时次之,35 ℃时最低。25 ℃处理的土壤细菌、真菌数量及微生物总量分别是35 ℃处理的4.05,55.36和4.01倍。放线菌数量随着腐解温度的升高而显著增加。说明在不同腐解温度下,核桃青皮腐解物对土壤微生物的数量产生了较大影响。在各温度处理中,微生物总量以细菌占绝对优势,微生物总量变化趋势与细菌数量相同。
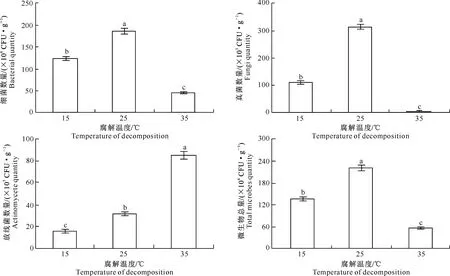
图 6 不同腐解温度下核桃青皮腐解物对土壤微生物数量的影响
Fig.6 Effects of temperature of walnut husk decomposition on soil microbial quantity
2.3 青皮与土壤不同配比下核桃青皮对土壤化学及生物学性质的影响
从土壤pH值对青皮不同添加量处理的响应(图7)可以看出,土壤pH值随核桃青皮添加比例的增加而呈显著增大的趋势。土壤EC值最高值出现在青皮与土壤配比为10∶100处理中,青皮与土壤配比为5∶100处理次之,青皮与土壤配比为1∶100处理最低,且显著低于CK。
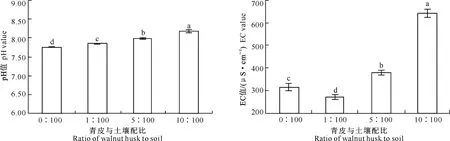
图 7 青皮与土壤不同配比下核桃青皮腐解物对土壤pH和EC值的影响
Fig.7 Effects of different husk to soil ratios of decomposed walnut husk on soil pH and EC
表4显示,土壤全氮、总有机碳、有机质、全钾含量均随核桃青皮添加比例的增加而增大。与CK相比,青皮与土壤配比为1∶100~10∶100时土壤全氮、总有机碳、有机质、全钾含量分别提高了9.12%~31.13%,9.61%~36.76%,9.62%~36.76%,5.56%~17.31%。除核桃青皮与土壤配比为10∶100处理土壤全磷含量显著高于CK外,其余处理全磷含量与CK差异不显著。C/N随核桃青皮添加比例的增加而呈先增长后降低的趋势,但核桃青皮与土壤配比为1∶100和10∶100处理的C/N与CK之间差异不显著。

表 4 青皮与土壤不同配比下核桃青皮腐解物对土壤养分含量的影响
图8表明,不同核桃青皮添加比例对土壤酶活性的影响不同。除纤维素酶活性在青皮与土壤配比为5∶100的处理中达到最大值外,蔗糖酶、脲酶、碱性磷酸酶和过氧化氢酶活性均在青皮与土壤配比为10∶100的处理中达到最大值,且与其他处理差异达到显著水平,与CK相比,以上4种酶活性最大值的增幅分别为69.04%,117.02%,94.16%,13.52%。此外,脲酶和碱性磷酸酶活性均与核桃青皮添加比例呈正相关关系,即以上2种酶活性随核桃青皮添加比例的增加而增大。
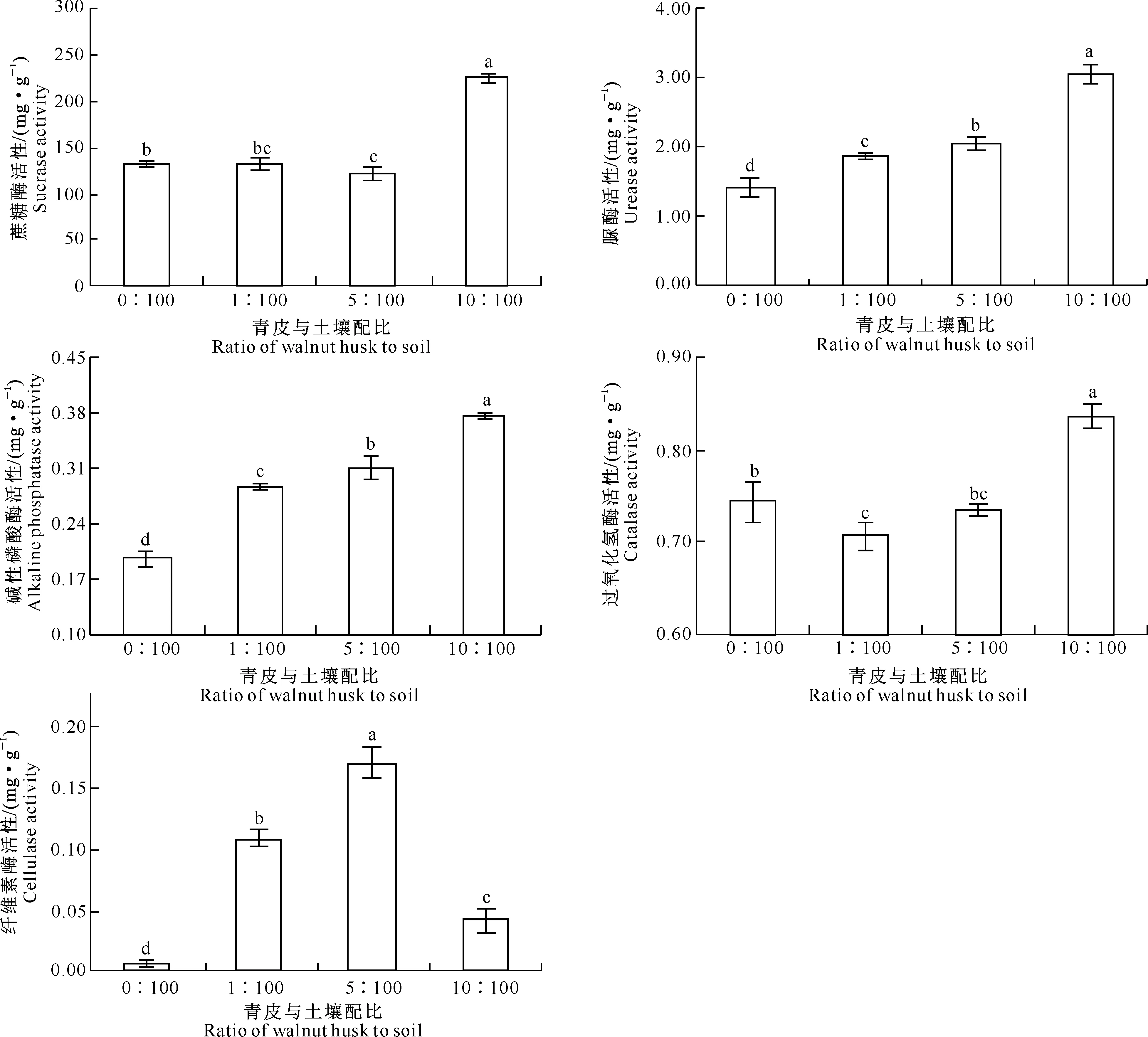
图 8 青皮与土壤不同配比下核桃青皮腐解物对土壤酶活性的影响
Fig.8 Effects of different husk to soil ratios of decomposed walnut husk on soil enzyme activities
图9显示,核桃青皮腐解对土壤微生物数量的增加有显著的促进作用。细菌、真菌、放线菌数量和土壤微生物总量均在青皮与土壤配比为10∶100的处理中最高,青皮与土壤配比为1∶100和5∶100处理次之,CK最低。青皮与土壤不同配比为10∶100处理土壤细菌、真菌、放线菌数量和土壤微生物总量分别较CK提高了105.6%,3 316.73%,922%,245.68%。
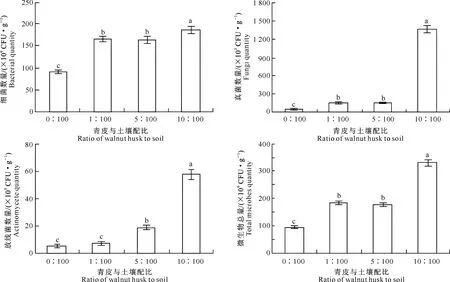
图 9 青皮与土壤不同配比下核桃青皮腐解物对土壤微生物数量的影响
3 讨 论
3.1 不同腐解条件下核桃青皮腐解物对土壤化学性质的影响
土壤pH和EC值是揭示土壤化学特性的重要指标,通常用来反映土壤酸化和盐渍化的程度[8]。在本研究中,腐解10 d时核桃青皮腐解物显著提高了土壤pH值,这是由凋落物中有机阴离子的去羧基过程造成的[17]。前人研究发现,添加的凋落物对土壤pH的升高作用具有一定的时间限度,即前期添加凋落物后土壤pH会上升,而培养一段时间后土壤的pH会下降[18-19],这与本研究不同腐解时间处理中土壤pH值呈现先增加后降低的变化趋势相符。本试验中,不同腐解条件下各处理中的土壤pH值(7.75~8.17)虽高,但大体处在利于大多数林木和苗木生长的土壤pH变化范围内(4.5~8.5),对土壤营养利用率的影响不大,反而添加核桃青皮后能缓解由植物残体焚烧和作物连作以及长期过多施用氮肥或生理酸性化肥造成的土壤酸化[20]。
在本研究的不同配比核桃青皮腐解试验中,除了青皮与土壤配比1∶100处理的EC值低于CK外,其他处理EC值均高于CK。且在青皮与土壤配比10∶100的处理中,土壤EC值达到了642.67 μS/cm,这与添加的青皮EC值较高有关。有研究认为,土壤EC较低(120 μS/cm以下)时,不足以维持植物的生长;EC值为130~350 μS/cm,适宜育苗及种植不耐盐植物;EC值为360~650 μS/cm,土壤适宜大多数植物生长;EC值>650 μS/cm,抑制植物生长,易使植物遭受盐害[20-21]。因此,在还田的过程中应注意核桃青皮的用量。
3.2 不同腐解条件下核桃青皮腐解物对土壤养分含量的影响
植物残体含有丰富的养分,其腐解也是土壤碳素循环和营养再生的有效途径[3-4,22]。前人研究表明,当植物残体回归土壤并立即腐解能够快速释放残体中的多种元素[23]。Musvoto等[24]也发现,土壤全氮含量的最高值出现在腐解的早期。本研究中,在核桃青皮不同腐解时间的处理中,各养分含量的最大值出现在10~30 d,这与上述结论相似。在25和35 ℃条件下,核桃青皮腐解物显著提高了土壤全氮、总有机碳和有机质含量,这与较高温度通常伴随着营养的快速循环,从而能够增强腐解程度有关[23]。在不同配比核桃青皮的腐解试验中,各养分含量均在青皮与土壤配比为10∶100时达到最大值,说明核桃青皮作为植物残体的一种,与其他植物残体一样含有丰富的营养元素。与CK相比,添加核桃青皮的处理均提高了土壤C/N,这与植物残体本身具有较高的C/N及腐解时间较短、残体腐解不彻底有关[25]。在一定范围内,C/N越高,表明土壤中有机物质的活性越大,可供给微生物的能源也越多,进而可增强土壤活性[25]。一些研究指出,农业生产过程中大量施用氮肥和不合理施用有机肥,导致土壤C/N下降,土壤环境恶化[26]。而增施含纤维素较多的植物残体、有机粪肥能更好协调土壤养分与能量间(土壤C/N)的平衡,改善土壤质量,保持土壤的高效生产和持续利用[27]。
3.3 不同腐解条件下核桃青皮腐解物对土壤酶活性的影响
Dilly等[28]研究指出,土壤脲酶的最大活性出现在腐解的最后阶段。但在本研究中,脲酶的最大活性在腐解早期(20 d)和腐解后期(50~60 d)均有出现,这与腐解前期核桃青皮增加了土壤透气性,适当提高了土壤温度,且前期青皮腐解速率较快,腐解产物中含氮化合物较多有关[26]。与腐解0 d 相比,随着腐解时间延长,土壤蔗糖酶活性总体呈升高趋势。相对于其他酶活性而言,过氧化氢酶活性变幅较小,这可能与青皮中的有机碳释放有关[28]。本研究中,土壤纤维素酶活性在前期迅速下降,到腐解后期才明显地升高,这主要归因于腐解前期和中期,土壤中微生物群落主要针对青皮中容易腐解的物质先进行分解,到了后期才主要针对残体中的纤维素进行降解,土壤纤维素降解菌开始活跃,纤维素酶活性才不断增加[28],而纤维素酶活性在0 d之后急剧下降可能与青皮腐解期间土壤微生物优势群体的改变和土壤有机质的含量有关[26,28]。
有研究认为,温度升高引起的蛋白质降解作用(如脱酰胺和肽键断裂等)是土壤酶活性降低的重要原因,作为蛋白质的土壤酶会因热变性,影响自身的活性[26]。在本试验中,除纤维素酶外,其他酶活性均在高温处理(35 ℃)时达到最小值,这与赵彬等[29]得出的火后许多土壤酶的活性迅速降低的结论是一致的。
本研究发现,在一定添加范围内,蔗糖酶、脲酶、碱性磷酸酶、过氧化氢酶、纤维素酶5种酶活性大体随核桃青皮添加比例的增加而增大。核桃青皮腐解提高土壤酶活性的原因在于青皮的腐解提供了大量的有机营养,可加快微生物繁殖速度、增强微生物活性,进而促进了土壤酶活性的提高。
3.4 不同腐解条件下核桃青皮腐解物对土壤微生物数量的影响
土壤微生物是土壤中微生态环境的重要组成部分[29]。作为土壤的三大类微生物,细菌、真菌和放线菌对土壤中植物残体的分解以及土壤中营养元素的转化具有重要的作用[5]。本研究中,细菌数量及微生物总量均在分解的中后期(40 d)出现峰值,主要是因为随着腐解时间的延长,核桃青皮中复杂的有机物进一步分解,土壤中营养物质和能源增加,从而使土壤细菌及微生物总量增加[25,30]。本研究中,土壤微生物总量大体上随青皮添加比例的增加而增大,这主要归因于植物残体是土壤微生物的重要碳源,残体腐解能够为微生物提供充足的有机营养,促进土壤微生物的大量繁殖,使微生物数量显著增加[25]。本试验中,各腐解时间及不同配比核桃青皮处理土壤微生物数量变化趋势多样,这与土壤微生物对土壤质量的变化敏感有关,即凡是影响土壤质量的因素都会影响到土壤微生物数量[31]。
土壤微生物多属于中温型,适宜温度一般为25~37 ℃,当温度不适宜土壤微生物生存时,它们的数量和活性将发生变化[31]。本研究中,在不同温度处理中,细菌、真菌数量及微生物总量表现出相同的变化趋势,即随着温度升高而先升后降,且在25 ℃时达最大,这与前人的研究结果相似[31]。本研究中,土壤放线菌数量随温度升高而增加,最大值出现在35 ℃。
鉴于本研究是在室内模拟条件下进行,与田间实际环境存在一定的差异,且在腐解过程中未种植作物,因此还需要在田间试验中进一步对试验结果进行验证,分析外界环境及作物吸收养分情况下青皮腐解物对土壤理化及生物学状况的影响。
4 结 论
核桃青皮腐解可以有效提高土壤养分含量,增强土壤酶活性,增加微生物数量,具有改善和维持土壤肥力的作用。通过对青皮腐解化感效应的综合评价得出,在腐解时间为20 d、常温(25 ℃)和青皮与土壤配比为10∶100条件下,腐解的核桃青皮对土壤的化学性质、酶活性及微生物数量表现出较强的促进作用,就提高土壤肥力方面而言,该条件可作为核桃青皮的有效腐解条件。
[1]Jacobson T K B,Bustamante M M C,Kozovits A R.Diversity of shrub tree layer,leaf litter decomposition and N release in a Brazilian Cerrado under N,P and N plus P additions [J].Environmental Pollution,2011,159:2236-2242.
[2]曲 浩,赵学勇,赵哈林,等.陆地生态系统凋落物分解研究进展 [J].草业科学,2010,27(8):44-51.
Qu H,Zhao X Y,Zhao H L,et al.A reviewe of terrestrial ecosystems litter decomposition [J].Pratacultural Science,2010,27(8):44-51.
[3]Merilä P,Malmivaara-Lämsä M,Spetz P,et al.Soil organic ma-tter quality as a link between microbial community structure and vegetation composition along a successional gradient in a boreal forest [J].Applied Soil Ecology,2010,46(2):259-267.
[4]郭 鑫,卢立娜,贺晓辉,等.毛乌素沙地人工固沙灌木林凋落物分解及改良土壤的研究 [J].林业资源管理,2014,10(5):74-78.
Guo X,Lu L N,He X H,et al.Study on litter decomposition and soil improvement in artificial shrub forest in Maowusu sandy land [J].Forest Resources Management,2014,10(5):74-78.
[5]宋 影,辜夕容,严海元,等.万宇轩中亚热带马尾松林凋落物分解过程中的微生物与酶活性动态 [J].环境科学,2014,35(3):1151-1158.
Song Y,Gu X R,Yan H Y,et al.Dynamics of microbes and enzyme activities during litter decomposition ofPinusmassonianaforest in mid-subtropical area [J].Environmental Science,2014,35(3):1151-1158.
[6]时伟伟,彭晚霞,宋同清,等.不同林龄尾巨桉人工林土壤养分与微生物的耦合关系 [J].西北植物学报,2013,33(7):1452-1458.
Shi W W,Peng W X,Song T Q,et al.Coupling relationships between soil microbe and soil nutrient inEucalyptusurophylla×E.grandisplantation at different stand ages [J].Acta Bot Boreal-Occident Sin,2013,33(7):1452-1458.
[7]Han X,Cheng Z H,Meng H W.Soil properties,nutrient dynamics,and soil enzyme activities associated with garlic stalk decomposition under various conditions [J].Plos One,2012,7:1-9.
[8]李会娜,刘万学,戴 莲,等.紫茎泽兰入侵对土壤微生物、酶活性及肥力的影响 [J].中国农业科学,2009,42(11):3964-3971.
Li H N,Liu W X,Dai L,et al.Invasive impacts ofAgeratinaadenophora(Asteraceae) on the changes of microbial community structure,enzyme activity and fertility in soil ecosystem [J].Scientia Aericultura Sinica,2009,42(11):3964-3971.
[9]陈国平,程珊珊,丛明旸,等.三种阔叶林凋落物对下层土壤养分的影响 [J].生态学杂志,2014,33(4):874-879.
Chen G P,Cheng S S,Cong M Y,et al.Effects of litter decomposition on soil nutrients in three broad-leaved forests [J].Chinese Journal of Ecology,2014,33(4):874-879.
[10]刘 强,彭少麟.植物凋落物生态学 [M].北京:科学出版社,2010:3-56.
Liu Q,Peng S L.Plant litter ecology [M].Beijing:Sciences Press,2010:3-56.
[11]Jose S,Gillespie A R.Allelopathy in black walnut (JuglansnigraL.) alley cropping:Ⅱ.effects of juglone on hydroponically grown corn (ZeamaysL.) and soybean (GlycinemaxL.Merr.) growth and physiology [J].Plant Soil,1998,203:199-205.
[12]Rice E.Allelopathy [M].Orlando:Academic Press,1984:1-300.
[13]Wetterstedt J M,Persson T,Aagren G.Temperature sensitivity and substrate quality in soil organic matter decomposition:results of an incubation study with three substrates [J].Global Change Biology,2010,16(16):1806-1819.
[14]鲍士旦.土壤农化分析 [M].北京:中国农业出版社,2000:1-214.
Bao S D.Soil and agricultural chemistry analysis [M].Beijing:China Agriculture Press,2000:1-214.
[15]关松荫.土壤酶及其研究法 [M].北京:农业出版社,1986:1-338.
Guan S Y.Soil enzyme and its research methods [M].Beijing:Agriculture Press,1986:1-338.
[16]程丽娟,薛泉宏.微生物学实验技术 [M].西安:世界图书出版公司,2000:80-83.
Cheng L J,Xue Q H.Experimental technique in microbiology [M].Xi’an:Book World Publications,2000:80-83.
[17]Marschner B,Noble A D.Chemical and biological processes leading to the neutralisation of acidity in soil incubated with litter materials [J].Soil Biology and Biochemistry,2000,32:805-813.
[18]Yan F,Hütsch B W,Schubert S.Soil pH dynamics after incorporation of fresh and oven-dried plant shoot materials of faba bean and wheat [J].Journal of Plant Nutrition and Soil Science,2006,169:506-508.
[19]Tang G Y,Li K,Zhang C H,et al.Accelerated nutrient cycling via leaf litter,and not root interaction,increases growth of Eucalyptus in mixed-species plantations withLeucaena[J].Forest Ecology and Management,2013,310:45-53.
[20]何文寿.设施农业中存在的土壤障碍及其对策研究进展 [J].土壤,2004,36(3):235-242.
He W S.Soil problems and countern easure in facility agriculture in China [J].Soi1s,2004,36(3):235-242.[21]李谦盛,郭世荣,李式军.基质EC值与作物生长的关系及其测定方法的比较 [J].中国蔬菜,2004(1):70-71.
Li Q S,Guo S R,Li S J.The relationship between crop growth and substrate EC value and the comparison of its measuring method [J].China Vegetables,2004(1):70-71.
[22]Zhang C F,Trofymow J A,Jamieson R C,et al.Litter decomposition and nitrogen mineralization from an annual to a monthly model [J].Ecological modelling,2010,221:1944-1953.
[23]Prescott C E.Litter decomposition:what controls it and how can we alter it to sequester more carbon in forest soils [J].Biogeochemistry,2010,101:133-149.
[24]Musvoto C,Campbell B M,Kirchmann H.Decomposition and nutrient release from mango and miombo woodland litter in Zimbabwe [J].Soil Biology & Biochemistry,2000,32:1111-1119.
[25]王 芳,张金水,高鹏程,等.不同有机物料培肥对渭北旱塬土壤微生物学特性及土壤肥力的影响 [J].植物营养与肥料学报,2011,17(3):702-709.
Wang F,Zhang J S,Gao P C,et al.Effects of application of different organic materials on soil microbiological properties and soil fertility in Weibei rainfed highland [J].Plant Nutrition and Fertilizer Science,2011,17(3):702-709.
[26]王树起,韩晓增,乔云发,等.不同土地利用和施肥方式对土壤酶活性及相关肥力因子的影响 [J].植物营养与肥料学报,2009,15(6):1311-1316.
Wang S Q,Han X Z,Qiao Y F,et al.Effects of land uses and fertilization systems on soil enzyme activities and nutrients [J].Plant Nutrition and Fertilizer Science,2009,15(6):1311-1316.
[27]Qiu S J,Ju X T,Ingwersen J.Changes in soil carbon and nitrogen pools after shifting from conventional cereal to greenhouse vegetable production [J].Soil & Tillage Research,2010,107(2):80-87.
[28]Dilly O,Munch J C,Pfeiffer E M.Enzyme activities and litter decomposition in agricultural soils in northern,central,and southern Germany [J].Journal of Plant Nutrition and Soil Science,2007,70:197-204.
[29]赵 彬,孙 龙,胡海清,等.兴安落叶松林火后对土壤养分和土壤微生物生物量的影响 [J].自然资源学报,2011,26(3):450-459.
Zhao B,Sun L,Hu H Q,et al.Post-fire soil microbial biomass and nutrient content ofLarixgmeliniiforest in autumn [J].Journal of Natural Resources,2011,26(3):450-459.
[30]Smyth C E,Macey D,Trofymow J A.Long-term litter decay in Canadian forests and the influence of soil microbial community and soil chemistry [J].Soil Biology & Biochemistry,2015,80:251-259.
[31]Pascault N,Cécillon L,Mathieu O,et al.In situ dynamics of microbial communities during decomposition of wheat,rape,and alfalfa residues [J].Microbial Ecology,2010,60(4):816-828.
Effects of walnut (Juglans sigillata) husk decomposition on soil fertility under various conditions
MA Hongye,PAN Xuejun,ZHANG Wene,PENG Jian
(Agricultural College,Guizhou University/Guizhou Engineering Research Center for Fruit Crops,Guiyang,Guizhou 550025,China)
【Objective】 The effects of walnut (Juglanssigillata) husk decomposition under various conditions on soil chemical and biological properties were analyzed to determine the feasibility to return walnut husk to soil and the reasonable decomposition conditions.【Method】 Walnut husk was decomposed with soil,and the chemical properties,nutrient content,enzymes activity and microbial quantity of soil under different durations (0,10,20,30,40,50,and 60 d),temperatures (15,25,and 35 ℃) and ratios of walnut husk to soil (0∶100(CK),1∶100,5∶100,and 10∶100) were analyzed.【Result】 Under different decomposition durations,decay of walnut husk improved soil sucrase and alkaline phosphatase activity and reduced activities of soil catalase and cellulase and EC value comparing with 0 d (not decay).The maximum value of soil nutrition indicators (total nitrogen,phosphorus,potassium and total organic carbon,organic matter) and fungi and actinomycetes quantity appeared in 10-30 d treatments,especially in 20 d.Under different decomposition temperatures,in addition to total nitrogen,phosphorus,potassium,catalase,and actinomycetes,the peak values of other measurement indexes were found at 25 ℃.Under different concentrations of decomposed walnut husk,soil pH,EC value,contents of total nitrogen,total organic carbon,organic matter and total potassium,activities urease and alkaline phosphatase,and quantity of soil actinomycetes increased with the increase of walnut husk ratio,and the highest values were all observed when the ratio was 10∶100.【Conclusion】 Walnut husk decomposition effectively improved the soil nutrients,soil enzyme activity,and quantity of microorganism.The optimal decomposition conditions were shorter durations 20 d,normal temperature (25 ℃),and high husk concentration (10∶100).
walnut husk;decomposition conditions;soil fertility
时间:2016-10-20 16:36
10.13207/j.cnki.jnwafu.2016.12.013
2016-02-14
国家科技支撑计划项目(2014BAD23B03);贵州省科技重大专项([2011]6011号)
马红叶(1989-),女,河北邢台人,在读硕士,主要从事果树生理生态与栽培研究。E-mail:653751327@qq.com
潘学军(1977-),男,山东临沂人,教授,博士,硕士生导师,主要从事果树种质资源与生物技术育种研究。 E-mail:pxjun2050@aliyun.com
S664.109.9
A
1671-9387(2016)12-0088-11
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20161020.1636.026.html

