不同Ca2+浓度养殖环境下三角帆蚌外套膜和内脏团组织钙调蛋白基因的表达
尚朝施杨李文娟周子睿施志仪
(1. 上海海洋大学水产与生命学院 农业部淡水水产种质资源重点实验室,上海 201306;2. 上海市食品研究所,上海 200235)
不同Ca2+浓度养殖环境下三角帆蚌外套膜和内脏团组织钙调蛋白基因的表达
尚朝1施杨2李文娟1周子睿1施志仪1
(1. 上海海洋大学水产与生命学院 农业部淡水水产种质资源重点实验室,上海 201306;2. 上海市食品研究所,上海 200235)
为了探索钙调蛋白基因(CaM)在淡水贝类珍珠形成中的作用,研究0、0.5、1.25、2和3 mmol/L 5个不同Ca2+浓度水环境下养殖三角帆蚌,并在插核后的0、20、50、90和120 d对外套膜和内脏团组织采样,采用荧光定量方法检测组织CaM表达量。结果表明:(1)在不同Ca2+浓度中,CaM基因外套膜和内脏团组织在0 mmol/L Ca2+浓度下始终处于过低表达水平;0.5 mmol/L浓度下先降低后升高并维持稳定;1.25 mmol/L浓度下在20 d内脏团出现降低,之后升高至0 d水平并保持稳定;在2 mmol/L浓度下表达量在20 d时显著上升达到各浓度中最高后保持高表达量状态;3 mmol/L浓度下在插核后20 d表达量升高,之后时期表达量开始不断降低(P<0.05)。(2)在插核后不同天数中,0 d各浓度表达差异不明显;之后各天数的表达出现明显差异。(3)相同条件养殖下,内脏团CaM基因表达量高于外套膜。研究发现,0.5 mmol/L和2 mmol/L Ca2+浓度会促进CaM基因的表达,但0 mmol/L和3 mmol/L的浓度则会抑制CaM基因的表达。内脏团部位更有利于珍珠的形成。
三角帆蚌;钙调蛋白;钙浓度;内脏团;外套膜
钙调蛋白(Calmodulin protein,CaM)是生物体中的多功能调节蛋白,广泛存在于所有的真核细胞中,是生物体最丰富的Ca2+结合蛋白,参与调节离子转运、细胞钙代谢、防御反应等重要的生理过程[1]。珍珠由CaCO3和基质蛋白等有机质组成,其中绝大多数成分为CaCO3。珍珠的形成是贝类Ca2+吸收、转运、贮存和分泌等代谢活动的过程[2,3],受到CaM等多个调节因子调控[4,5]。CaM被广泛认为是涉及到珍珠形成的关键蛋白。在合浦珠母贝(Pinctada fucata)中,CaM可以通过和16 kD珍珠层基质蛋白的结合诱导CaM文石晶体的成核,又可以调节棱柱层方解石晶体的的生长,参与贝壳损伤的修复[6,7]。
三角帆蚌(Hyriopsis cumingii)作为我国重要的淡水育珠蚌,具有生长速度快,育珠质量好的特点[8]。研究表明,三角帆蚌的外套膜和内脏团均可作为插核手术部位进行珍珠培育[9]。两个部位各具优势,外套膜培育出的珍珠光泽度和圆润度好,而内脏团分布空间大,更适宜培育大颗粒的珍珠[10]。但是,珍珠形成过程中重要的钙代谢相关基因在育珠部位的表达差异鲜有报道。有研究表明,在淡水贝类中,适当增加钙的供应能够提高贝类CaCO3的沉积[11],然而其调节机制仍不清楚。本研究对三角帆蚌外套膜和内脏团部位分别进行插核手术后,饲养于不同钙离子浓度水环境下,在不同养殖时期进行采样,探究CaM基因在不同插核部位及不同钙离子浓度下的表达变化,旨在探索CaM在淡水贝类珍珠形成中的作用。
1 材料与方法
1.1 材料
三角帆蚌取自上海海洋大学滨海养殖基地,选取体长均一,个体差异较小的2龄三角帆蚌75只。在实验室中暂养两周后,对三角帆蚌外套膜和内脏团部位进行插核手术。
插核手术使用的珠核经贝壳打磨而成,手术之前将珠核进行高压灭菌干燥。清洗实验蚌外壳泥土和藻类,插核前将其离水放置30-60 min,减弱实验蚌的活力,降低应激反应。手术器械经75%酒精消毒后,将蚌置于手术架上,腹缘朝上。在蚌的偏后端腹缘部位,用开壳器将蚌开口,并用U型架支撑。在每只实验蚌的外套膜和内脏团靠近性腺前端部位分别插入直径为2.5 mm的珠核,并将制作好的外套膜小片贴在珠核上。取下U型架,插核手术完成。
将插核后的75只实验组三角帆蚌随机分成5组,每组15只。本校公共实验楼取的去离子水作为水源,使用CaCl2·2H2O作为外源钙源,采用EDTA滴定法分别将5个水缸中的Ca2+浓度调节至0、0.5、1.25、2和3 mmol/L,其余实验条件相同。将5组三角帆蚌养于5个不同浓度的水缸中。每周定期用豆浆进行投喂,定期调节水缸中Ca2+浓度。
三角帆蚌插核后养殖5 h,从每个浓度中取出3只三角帆蚌,对其进行外套膜和内脏团插核部位采样,作为插核后0 d样品组织。之后在插核后第20、50、90和120天分别取出3只三角帆蚌进行外套膜和内脏团采样。采样前将实验所需器材进行灭菌除酶。首先切断其闭壳肌,快速取出三角帆蚌插核位点处的外套膜和内脏团组织置于装有Trizol(Invitrogen,美国)的除酶离心管中,供后续继续进行总RNA提取实验。
1.2 方法
1.2.1 RNA提取、检测与反转 将Trizol(Invitrogen,美国)中的各个时期不同Ca2+浓度的外套膜和内脏团组织,按照试剂说明书的方法进行总RNA提取。提取完毕后,用Nanodrop 2000C(Thermo Fisher Scientific,美国)分光光度仪检测其纯度和浓度,用 1% 琼脂糖凝胶电泳检测其完整性。
按照M-MLV Reverse Transcriptase(Promega,北京)的操作要求进行反转录实验实验,反转录成cDNA。
1.2.2 基因mRNA水平测定 根据NCBI上公布的三角帆蚌β-actin基因(HM045420)序列设计定量引物:β-actin F(TCAACCCTAAAGCCAACA)β-actin R(TCTCTACCTGCCAAGTCAA)。CaM基因(HM-483521.1)定量引物:CaM F(TTCAAGGAGGCATTCAGC)和CaM R(TTACCATCGGCATCCACT)。
荧光定量采用CFX96 TouchTMReal-Time PCR Detection System(Bio-Rad,美国)平台进行实验。首先进行目的基因和内参基因(β-actin)的标准曲线实验,然后进行目的基因的定量实验。反应
体系为20 μL,包括10 μL 的 2×iQTMSYBR Green Supermix(Bio-Rad,美国)、1.0 μL cDNA、上下游引物各0.5 μL和8.0 μL dH2O。反应条件为 95℃预变性 1 min;95℃ 10 s,60℃ 15 s和72℃ 20 s,采集荧光40次,72℃ 7 min,反应终止,添加溶解曲线生成程序:95℃ 到 60℃ 每降 0.5℃(5 s)采集一次荧光。实验结束后,用溶解曲线分析产物专一性,结果用2-ΔΔCt法进行初步数据统计分析。实验结果中R值均大于0.9,相应的扩增效率(E)均在 95%-100%之间。
然后数据采用 SPSS 16.0软件中的One-Way 方差分析(ANOVA),使用Dunnett's T multiple comparisons 进行相对表达分析,P<0.05 表示存在显著性差异。
2 结果
2.1 不同Ca2+浓度养殖下外套膜和内脏团组织CaM基因的表达
观察插核后0、20、50、90和120 d在不同Ca2+浓度养殖下CaM基因表达的变化,结果如图1、图2和图3所示。
由图1可以看出,插核0 d在外套膜中CaM基因表达量没有显著差异,内脏团中CaM基因表达量也没有显著差异(P>0.05)。而内脏团表达量明显高于外套膜表达量(P<0.05)。插核后20 d,各浓度培养下的表达量差异明显。0 mmol/L Ca2+浓度在外套膜和内脏团中CaM基因表达量明显低于其他浓度(P<0.05)。外套膜中,0.5 mmol/L Ca2+浓度与0 mmol/L浓度情况下表达量无显著差异(P>0.05);浓度升高后,在1.25 mmol/L Ca2+浓度时表达量明显高于0.5 mmol/L;2 mmol/L、3 mmol/L Ca2+浓度时表达量都高于1.25 mmol/L(P<0.05),但2 mmol/L和3 mmol/L并无差异(P>0.05)。内脏团中,0.5 mmol/L Ca2+浓度相比0 mmol/L表达量已经表现出显著升高;2 mmol/L Ca2+浓度时CaM基因表达量高于1.25 mmol/L浓度;而3 mmol/L Ca2+浓度表达量较2 mmol/L出现明显下降的情况(P<0.05)。
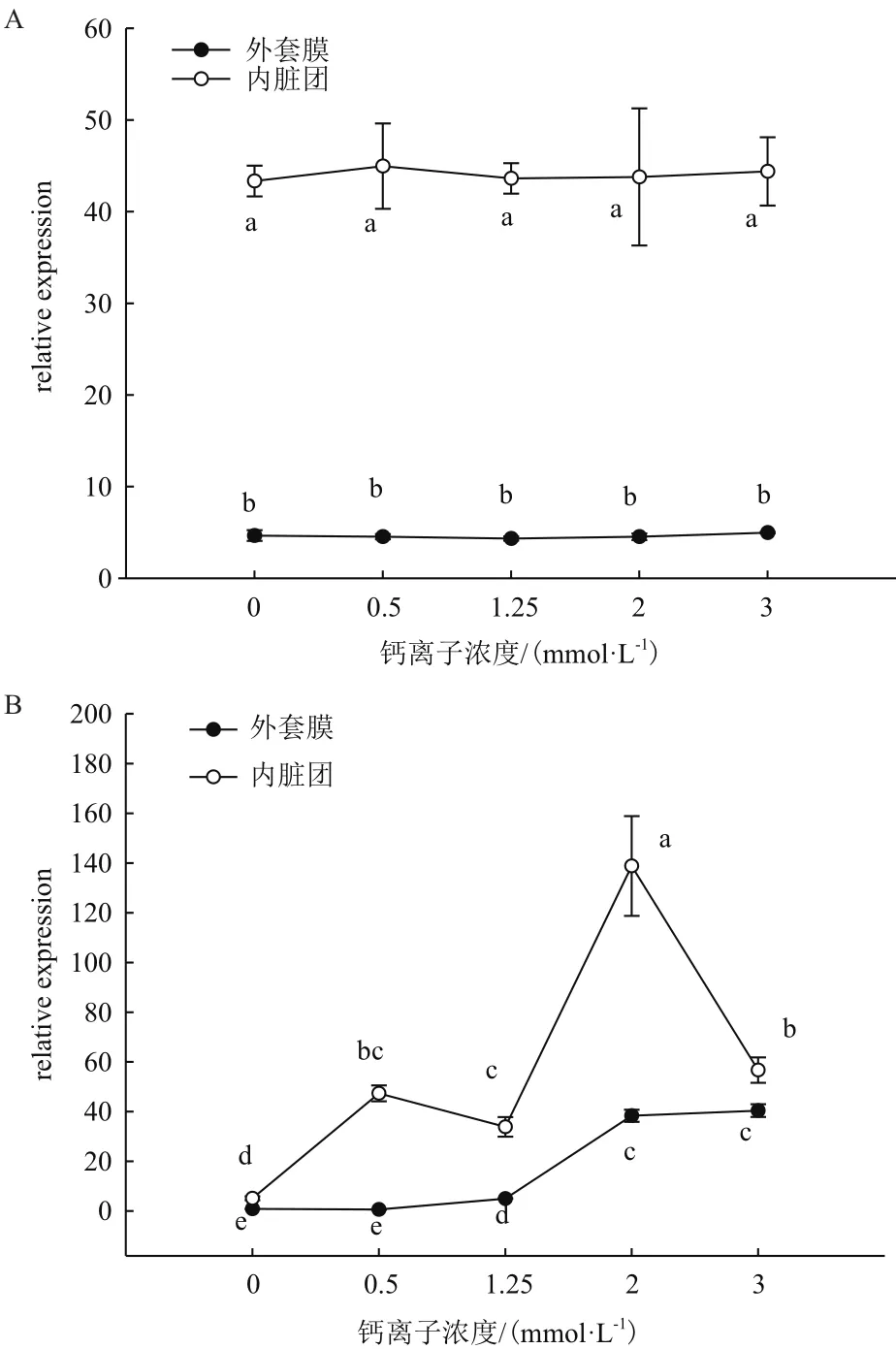
图1 插核后0 d(A图)、20 d(B图)不同Ca2+浓度对三角帆蚌外套膜和内脏团中CaM基因表达的影响
图2中,在插核后50 d,0 mmol/L Ca2+浓度时相较其他浓度CaM基因表达量明显最低;而2 mmol/L Ca2+浓度时相较其他浓度CaM基因表达量明显最高(P<0.05)。在外套膜中,0.5 mmol/L、1.25 mmol/L和3 mmol/L Ca2+浓度表达量互相之间没有明显变化(P>0.05)。而内脏团中,0.5 mmol/L和3 mmol/L Ca2+浓度时表达明显相差不大,但是明显低于1.25 mmol/L时的表达量(P<0.05)。插核后90 d,在外套膜中表达趋势和插核后50 d相似。在内脏团中,0.5 mmol/L Ca2+浓度明显高于0 mmol/L、1.25 mmol/L和3 mmol/L时的表达量;而2 mmol/L时表达量还是明显高于其他浓度表达量(P<0.05)。
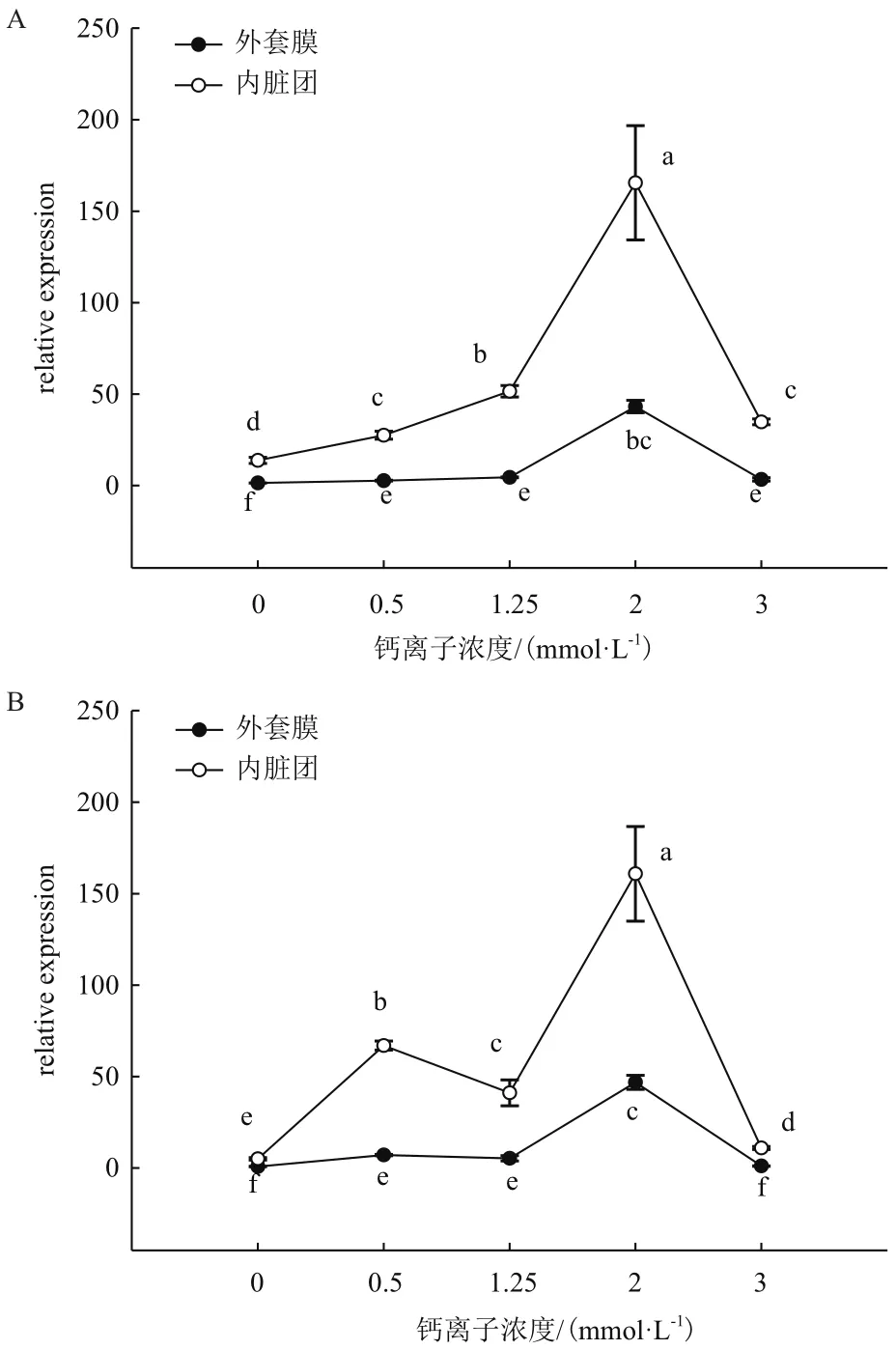
图2 插核后50 d(A)、90 d(B)不同Ca2+浓度对三角帆蚌外套膜和内脏团中CaM基因表达的影响
在图3中,插核后120 d在外套膜和内脏团中,0 mmol/L和3 mmol/L Ca2+浓度较1.25 mmol/L CaM基因显著降低;而2 mmol/L Ca2+浓度表达量较1.25 mmol/L时表达量显著升高(P<0.05)。在外套膜中,0.5 mmol/L Ca2+浓度表达量明显升高(P<0.05),而内脏团中,0.5 mmol/L Ca2+浓度时表达没有显著变化(P>0.05)。
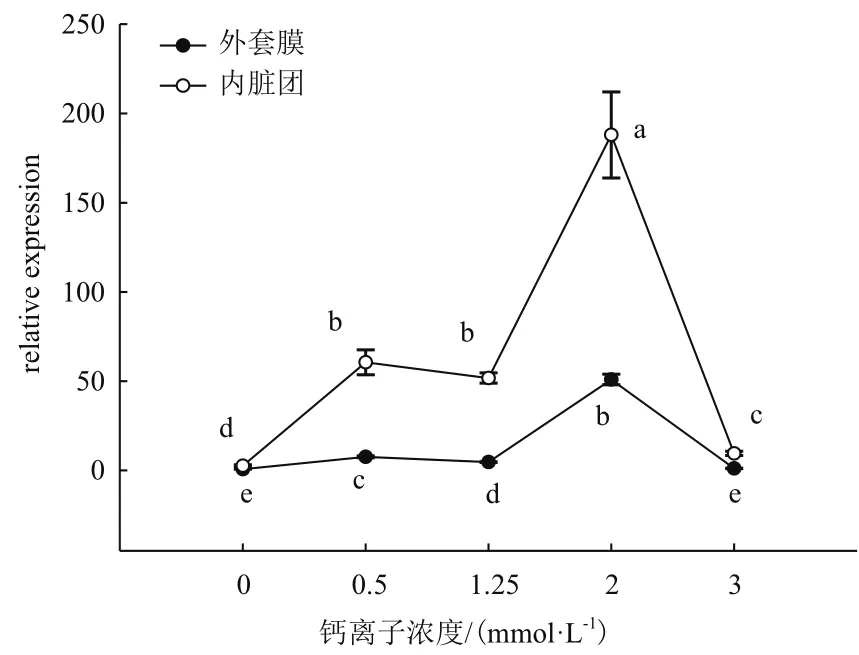
图3 插核后120 d不同Ca2+浓度对三角帆蚌外套膜和内脏团中CaM基因表达的影响
2.2 不同插核天数外套膜和内脏团组织CaM基因的表达
分析三角帆蚌0、0.5、1.25、2和3 mmol/L Ca2+浓度下培养下,每个浓度中不同插核后天数的CaM基因表达变化,结果如图4、图5和图6所示。
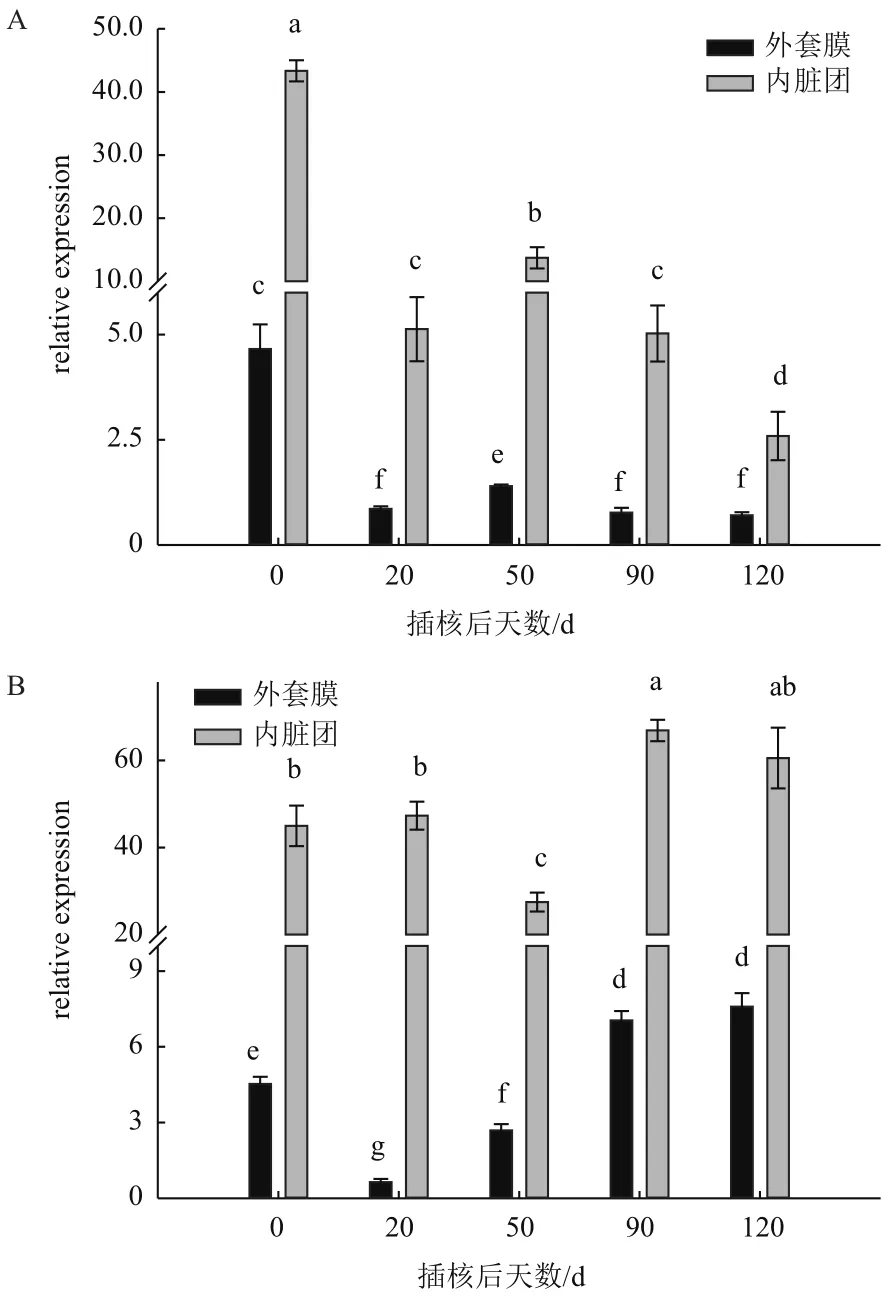
图4 0 mmol/L Ca2+浓度(A)、0.5 mmol/L Ca2+浓度(B)在不同插核天数后三角帆蚌外套膜和内脏团中CaM基因表达
如图4所示,在0 mmol/L Ca2+浓度下培养,外套膜和内脏团中CaM基因表达量在插核后20 d出现显著降低,50 d时相较于20 d表达量明显升高,但仍低于0 d时表达量(P<0.05);90 d时相比于50 d有显著降低,120 d时继续降低,出现最低表达量。在0.5 mmol/L Ca2+浓度下培养,外套膜中CaM基因表达量在插核后20 d出现显著降低,50 d时相较于20 d表达量明显升高,但仍低于0 d时期表达量,在之后时间继续升高,90 d时明显高于0 d表达量(P<0.05),120 d时相比90 d无显著变化(P>0.05)。在内脏团中,CaM基因表达量在插核后20 d时并无显著变化(P>0.05),在第50 d时相比之前时期显著降低,在插核后90 d较0 d时期显著升高(P<0.05),
120 d时与90 d表达量无显著差异(P>0.05)。
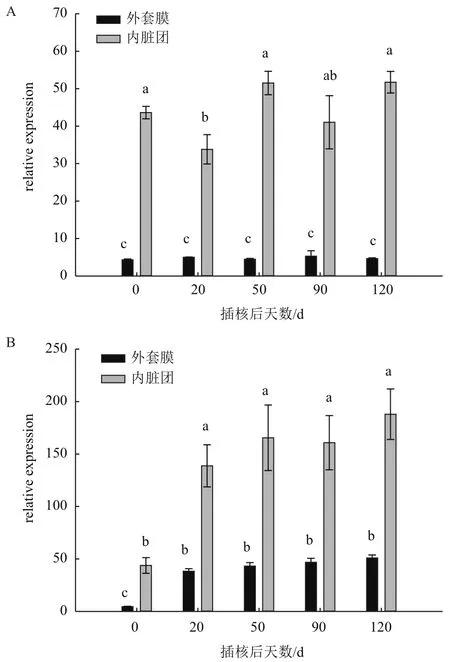
图5 1.25 mmol/L Ca2+浓度(A)、2 mmol/L Ca2+浓度(B)在不同插核天数后三角帆蚌外套膜和内脏团中CaM基因表达
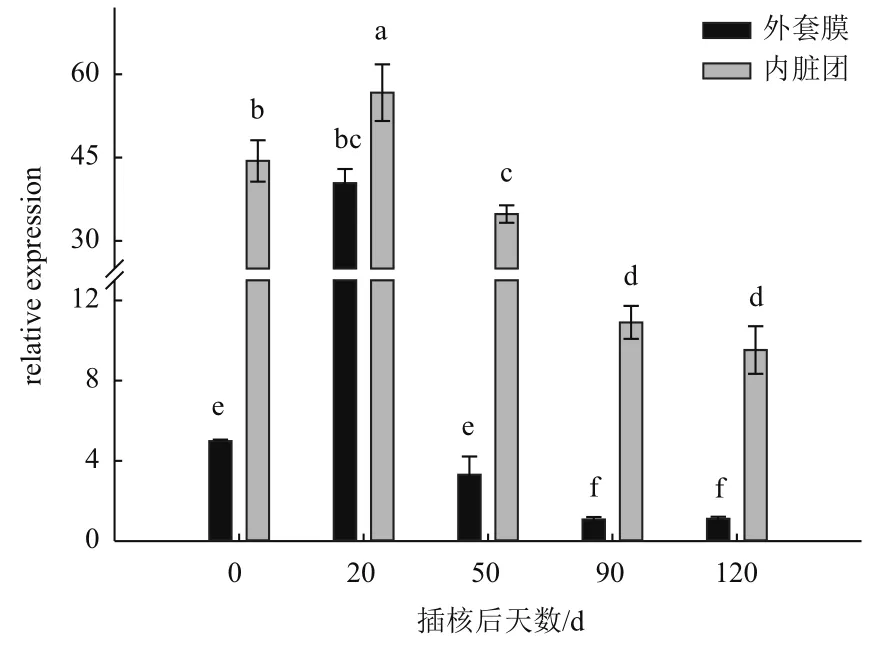
图6 3 mmol/L Ca2+浓度在不同插核天数后三角帆蚌外套膜和内脏团中CaM基因表达
从图5中可以看出,在1.25 mmol/L Ca2+浓度下培养,外套膜中CaM基因表达量在各时期无显著变化(P>0.05)。内脏团在插核后20 d表达量出现降低情况(P<0.05),之后时期又上升至与0 d无显著差异(P>0.05)。在2 mmol/L Ca2+浓度下培养,外套膜和内脏团都在插核后20 d时CaM基因表达量显著增加(P<0.05),之后各时期保持高表达量并且无显著差异(P>0.05)。
根据图6可以看出,在外套膜中CaM基因表达量在插核后20 d显著增高;在50 d时表达量下降到与0 d无显著差异;插核后90 d,继续下降,较50 d显著降低(P<0.05);120 d与90 d无显著变化(P>0.05)。在内脏团中CaM基因表达量在插核后20 d出现明显升高,之后时间内表达量不断下降,50 d比20 d显著降低,90 d比50 d显著降低(P<0.05),直到插核120 d时,表达量与90 d无显著差异(P>0.05)。
3 讨论
Ca2+作为第二信使参与动物的各种生理活动,不同浓度Ca2+对淡水贝类的生长率、繁殖能力、珍珠沉积率都有影响,密切关系着贝类的生理状态[12]。贝类体内Ca2+的一系列生理活动,如吸收、贮存、转运、分泌等都受到机体复杂并严格的调控,参与调控的蛋白众多并发挥着不同的作用[13]。
分析GenBank中已有的三角帆蚌CaM基因的全长序列(HM483521)[14]可以得到,CaM基因中含有的4个EF-hand结构域。EF-hand结构域是常见的Ca2+结合结构域高度保守,在生物矿化过程,如Ca的运输、肌肉收缩、信号转导等过程中起着重要的作用[15,16]。贝类的EFhand蛋白能通过调控Ca代谢,从而调节珍珠质的形成,是CaCO3晶体形成珍珠质的有机成分之一[17]。有研究表明该基因可能是珍珠形成过程中一个重要的调节因子[18],贝类的EFhand蛋白也具有与脊椎动物EF-hand蛋白类似的功能[19]。
3.1 不同Ca2+浓度养殖下外套膜和内脏团组织CaM基因的表达
有研究表明,三角帆蚌育珠过程中,Ca2+的代谢具有明显的变化波动[20]。0 mmol/L Ca2+浓度各个时期表达量较其他Ca2+浓度都表现出显著降低,CaM基因在0 mmol/L Ca2+浓度下,外套膜和内脏团
由于Ca2+缺乏严重而都表现出显著下降趋势,之后时期因为钙代谢无法正常进行而保持着极低的表达量[21]。2 mmol/L Ca2+浓度各个时期表达量较其他Ca2+浓度都表现出显著升高,在Ca2+含量适当高于自然淡水水体(1.0 mmol/L-1.3 mmol/L)的情况下,Ca2+起到了促进了的作用[22,23],此时CaM基因表达量最高。3 mmol/L Ca2+浓度时相较于2 mmol/L Ca2+浓度CaM基因表达量明显降低,这说明CaM基因表达量不会随着Ca2+浓度不断升高而一直升高,Ca2+浓度超过一定程度不仅不会增加表达量,反而会降低。由此可以看出,Ca2+浓度影响着CaM基因的表达。
图1中,由于插核后在不同Ca2+浓度下养殖5 h就对其采样,以作为0 d样品与其他时期比较。此时,CaM基因受Ca2+浓度影响较小,所以表达量几乎无差异。0.5 mmol/L Ca2+浓度在低于1.25 mmol/L Ca2+浓度情况下,CaM基因表达量依然出明显增加,推测CaM基因需要更多表达来促进较低Ca2+浓度下Ca的吸收。
3.2 不同插核天数外套膜和内脏团组织CaM基因的表达
由图4可以看出,0 mmol/L Ca2+浓度养殖下,整体呈明显下降趋势。在0.5 mmol/L Ca2+浓度培养下,外套膜和内脏团都出现了CaM基因表达量先降低再显著升高的趋势,在插核后90 d和120 d表达水平明显高于0 d时期。0.5 mmol/L Ca2+浓度低于正常淡水水体中Ca2+浓度[23],而插核后期的表达量升高,推测在长期Ca2+缺乏的情况下,为了调节机体的钙离子的平衡,以稳定机体的正常Ca代谢,机体内需要补充更多的Ca2+,此时会促进CaM基因的表达来适应低浓度Ca2+的生活,以稳定机体的正常Ca代谢[24],证明了CaM基因在Ca2+的重要作用。在1.25 mmol/L Ca2+浓度培养下,可以看出,外套膜表现比较稳定,各时期没有显著差异。
0 mmol/L、1.25 mmol/L Ca2+浓度下,对比插核后20 d和50 d发现内脏团都出现了短期内的表达量升高情况,有研究表明,研究表明三角帆蚌进行内脏团插核手术后,伤口需要20 d左右时间进行修复愈合[25]。推测三角帆蚌在插核后20 d还处于机体修复期,三角帆蚌尚未恢复活力,且免疫活力较高,CaM基因表达受到抑制[26,27],后期机体修复完成后机体为获取所缺失的钙,CaM基因较平时表达量增加。但在0 mmol/L Ca2+浓度养殖下短期增加后由于长期处于缺乏Ca而完全得不到补充,CaM基因无法正常表达而不断降低。
在图5中可以发现,2 mmol/L Ca2+浓度培养下,插核后CaM基因的表达量在插核后20 d已经显著升高。但是,在插核20之后的各个时期表达没有显著变化。由此可见,在适当的高Ca2+浓度下,会刺激钙的代谢使CaM基因的表达量迅速升高[14],但是促进作用到达一定程度后CaM基因会在一个高表达量状态保持稳定,并没有出现持续性的增长。
在3 mmol/L Ca2+浓度下(图6),外套膜和内脏团表达量都出现先升高再降低的趋势,在插核后90 d和120 d,表达量甚至低于0 d。可以看出,Ca2+浓度在超过一定范围后,机体内Ca2+浓度过饱和钙代谢出现紊乱[28],出现抑制CaM基因表达的情况。
通过上述分析可以看出,CaM基因在一定Ca2+浓度范围内,低浓度表达量升高,过高浓度表达量降低,通过自身基因表达水平的改变来维持体内Ca代谢的稳定。
3.3 外套膜和内脏团组织CaM基因表达分析
总结所有CaM基因表达水平变化可以看出,外套膜中CaM基因表达量都显著低于相应时期和浓度下内脏团表达量(P<0.05)。这与内脏团插核部位有关,本实验内脏团插核所在位置为靠近性腺部前端,珠核紧贴性腺。推测因为三角帆蚌性腺中含有大量的Ca2+[29],组织之间进行比较,Ca含量更为丰富的内脏团比外套膜部位更具优势。此外,内脏团组织相比外套膜,结构更加复杂,功能更加完善,Ca2+浓度发生改变时,对内脏团的影响较小[30]。
综上所述,本研究针对三角帆蚌珍珠形成过程中的关键蛋白钙调蛋白进行不同Ca2+浓度养殖,检测不同时期外套膜和内脏团的表达量进行研究。研究发现Ca2+浓度和CaM之间相互作用,在不同Ca2+浓度下CaM基因表达会有不同的变化,适当升高Ca2+浓度对CaM基因表达起促进作用,浓度过高和过低都会造成表达量降低,引发机体的钙代谢紊乱。
内脏团表达量整体高于外套膜,钙代谢水平升高,更有利于珍珠沉积[31],但其在珍珠质沉积的作用还有待进一步深入研究。
4 结论
本实验研究了不同Ca2+浓度养殖环境下,检测了三角帆蚌CaM在外套膜和内脏团中的表达变化。研究发现,适当升高(2 mmol/L)和降低(0.5 mmol/L)Ca2+浓度都会促进CaM基因的表达,但过低(0 mmol/L)和过高(3 mmol/L)的浓度则会抑制CaM基因的表达。相同条件下,内脏团CaM基因表达量高于外套膜,更有利于珍珠的形成。
[1]Hoeflich KP, Mitsuhiko I. Calmodulin in action:diversity in target recognition and activation mechanisms[J]. Cell, 2002, 108(6):739-742.
[2]Machado J, Lopes-Lima M. Calcification mechanism in freshwater mussels:Potential targets for cadmium[J]. Toxicological & Environmental Chemistry, 2011, 93(9):1778-1787.
[3]Jing H, Cen Z, Ma Z, et al. A novel extracellular EF-hand protein involved in the shell formation of pearl oyster[J]. Biochimica et Biophysica Acta, 2007, 1770(7):1037-1044.
[4]Li S, Xie LZ, Zhang R. cDNA cloning and characterization of a novel calmodulin-like protein from pearl oyster Pinctada fucata[J]. Febs Journal, 2005, 272(19):4899–910.
[5]Li S, Xie L, Cen Z, et al. Cloning and expression of a pivotal calcium metabolism regulator:calmodulin involved in shell formation from pearl oyster(Pinctada fucata)[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2004, 138(3):235-243.
[6] Fang Z, Cao W, Li S, et al. Significance of the C-terminal globular domain and the extra tail of the calmodulin-like protein(Pinctada fucata)in subcellular localization and protein—protein interaction[J]. Cell Biology International, 2008, 32(8):920-927.
[7] Yan Z, Fang Z, Ma Z, et al. Biomineralization:functions of calmodulin-like protein in the shell formation of pearl oyster[J]. Biochimica et Biophysica Acta(BBA)- General Subjects, 2007, 1770(9):1338-1344.
[8]Fu LL, Bai ZY, Jin W, et al. Evaluation of laser labeling on growth and survival of the freshwater pearl mussel, Hyriopsis cumingii[J]. Aquacult Int, 2012, 20(3):431-441.
[9] 黄惟灏, 沈智华, 童建民, 王卓锋. 三角帆蚌内脏团培育圆形有核珍珠的试验[J]. 淡水渔业, 2009(4):72-74.
[10] 施志仪, 谢先中, 何秀娟. 三角帆蚌内脏团珍珠培育部位的生物性状研究[J]. 生物技术通报, 2008(3):178-181.
[11]Dalesman S, Lukowiak K. Effect of acute exposure to low environmental calcium on respiration and locomotion in Lymnaea stagnalis(L.)[J]. Journal of Experimental Biology, 2010, 213(Pt9):1471-1476.
[12]Zalizniak L, Kefford BJ, Nugegoda D. Effects of different ionic compositions on survival and growth of Physa acuta[J]. Aquatic Ecology, 2009, 43(1):145-156.
[13]Chamilani N, Mahanama DZ, Ilson W, et al. Characterization and expression analysis of EF hand domain-containing calciumregulatory gene from disk abalone:calcium homeostasis and its role in immunity[J]. Fish & Shellfish Immunology, 2010, 29(2):334-342.
[14]李文娟, 李倩, 祁晓翔, 等. 三角帆蚌钙调蛋白(CaM)基因的cDNA序列克隆与表达分析[J]. 安徽农业科学, 2014(22):7310-7314.
[15]Li W, Halling D, Hall A, Aldrich R. EF hands at the N-lobe of calmodulin are required for both SK channel gating and stable SK-calmodulin interaction[J]. Journal of General Physiology, 2009, 134(4):281-293.
[16]Feinstein PG, Schrader KA, Bakalyar HA, et al. Molecular cloning and characterization of a Ca2+/calmodulin-insensitive adenylyl cyclase from rat brain[J]. Proceedings of the National Academy of Sciences of the United States of America, 1991, 88(22):10173-10177.
[17]Huang J, Zhang C, Ma Z, et al. A novel extracellular EF-hand protein involved in the shell formation of pearl oyster[J]. Biochimica et Biophysica Acta, 2007, 1770(7):1037-1044.
[18]祁晓翔, 李文娟, 尚朝, 等. 三角帆蚌EFCB1基因cDNA序列克隆及表达研究[J]. 水产学报, 2015, 39(7):962-970.
[19]Ni B, Rush S, Gurd JW, Brown IR. Molecular cloning of calmodulin mRNA species which are preferentially expressed in neurons in the rat brain[J]. Brain Research Molecular Brain Research, 1992, 13(1-2):7-17.
[20]罗文, 杨受保, 丁盈, 等 . 三角帆蚌(Hyriopsis cumingii)珍珠
形成初期钙代谢的特征分析[J]. 海洋与湖沼, 2010, 41(6):895-900.
[21] Paul JH, Sharpe JS. Studies in calcium metabolism:I. The deposition of lime salts in the integument of decapod crustacea[J]. Journal of Physiology, 1916, 50(3):183-192.
[22]Borght OVD, Puymbroeck SV. Calcium metabolism in a freshwater mollusc:quantitative importance of water and food as supply for calcium during growth[J]. Nature, 1966, 210(5038):791-793.
[23]唐敏, 石安静. 环境钙浓度对淡水育珠蚌外套膜及珍珠囊钙代谢的影响[J]. 四川大学学报:自然科学版, 2000, 37(5):741-747.
[24]Robertson JD. The function and metabolism of calcium in the invertebrata[J]. Biological Reviews, 1941, 16(2):106-133.
[25]施志仪, 杨显祥. 三角帆蚌alpha-2巨球蛋白活性测定及不同组织的表达[J]. 生物技术通报, 2006(4):115-120.
[26]何秀娟, 施志仪, 陈晓武, 程千千. 内脏团插核术刺激对三角帆蚌血细胞的影响[J]. 水生生物学报, 2010, 34(2):410-417.
[27]何秀娟, 施志仪, 李文娟. 插核手术对三角帆蚌血淋巴中3种免疫防御因子的影响[J]. 中国水产科学, 2009, 16(6):859-867.
[28]Li S, Xie L, Cen Z, et al. Cloning and expression of a pivotal calcium metabolism regulator:calmodulin involved in shell formation from pearl oyster(Pinctada fucata)[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2004, 138(3):235-243.
[29] 李文娟, 施志仪, 郝莹莹, 叶显峰. 应用激光共聚焦显微技术研究Ca2+在三角帆蚌组织内的积累与分布[J]. 水产学报, 2011, 35(2):214-220.
[30]邵晓阳, 黄惟灏. 三角帆蚌内脏团与外套膜钙盐分布的组织化学研究[J]. 青岛海洋大学学报:自然科学版, 1999(3):483-488.
[31]钱伟平, 林国星, 许梓荣. Ca2+在三角帆蚌体内沉积效应的研究[J]. 水利渔业, 2005, 25(1):6-8.
(责任编辑 狄艳红)
Expressions of Calmodulin Gene in Hyriopsis cumingii Mantle and Visceral Tissues Under the Culture Environment with Different Ca2+Concentrations
SHANG Chao1SHI Yang2LI Wen-juan1ZHOU Zi-rui1SHI Zhi-yi1
(1. Key Laboratory of Freshwater Aquatic Genetic Resources of Ministry of Agriculture,College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306;2. Shanghai Institute of Food Research,Shanghai 200235)
In order to explore the role of calmodulin(CaM)gene in the formation of freshwater mussel,Hyriopsis cumingii was cultured in water environment at 5 different Ca2+concentrations of 0 mmol/L,0.5 mmol/L,1.25 mmol/L,2 mmol/L,and 3 mmol/L. At 0 d,20 d,50 d,90 d,and 120 d after nucleus inserted,mantle and visceral were sampled,then the CaM expressions in the tissues were detected using fluorescent quantitative PCR. The results showed that:1)The expression level of CaM gene in mantle and visceral mass were always low at 0 mmol/L Ca2+concentration,decreased and then increased and remained stable at 0.5 mmol/L,decreased at the 20 d in visceral mass,then rose to level at 0 d and remain stable at 1.25 mmol/L,significantly increased at 20 d,reached the highest which was maintained at 2 mmol/L among all 5concentrations,increased at 20 d after nucleus inserted,and decreased in the later period(P < 0.05)at 3 mmol/ L. 2)There was no obvious difference among different concentrations at 0 d,and the expressions differentiated along different days after 0 d. 3)Under the same culture conditions,the expression of CaM gene in visceral mass was higher than that in mantle. It was found that the concentration of 0.5 mmol/L and 2 mmol/L promoted the expression of CaM gene,but the concentration of 0 mmol/L and 3 mmol/L inhibited the expression of CaM gene. Visceral mass was more conducive to the formation of pearl.
Hyriopsis cumingii;calmodulin;calcium concentration;visceral mass;mantle
10.13560/j.cnki.biotech.bull.1985.2016.12.024
2016-04-05
国家自然科学基金项目(31201991),教育部博士点基金(20123104120003),上海市优青项目(ssc11004)
尚朝,男,硕士研究生,研究方向:生物学;E-mail:shangchao1120@126.com
施志仪,男,教授,研究方向:生物学;E-mail:zyshi@shou.edu.cn

