微藻营养价值及其在水产生物营养强化中的应用
张继红,任丹丹,姜玉声,任先见,郭晓茜
(1.大连海洋大学食品科学与工程学院,辽宁大连116023;2.大连海洋大学水产与生命学院,辽宁大连116023)
微藻营养价值及其在水产生物营养强化中的应用
张继红,任丹丹,姜玉声,任先见,郭晓茜
(1.大连海洋大学食品科学与工程学院,辽宁大连116023;2.大连海洋大学水产与生命学院,辽宁大连116023)
微藻营养丰富,易于大规模培养,生产成本低,投喂方便,而且能够净化调节养殖水体,作为鱼、虾、蟹、贝类等水产生物的饵料,具有无可替代的作用。本文就微藻中蛋白质、碳水化合物、脂类、色素、维生素和矿物质等主要营养成分的研究进展,以及微藻作为生物饵料在水产生物营养强化中的应用进行综述,以期为水产生物营养学研究与生物饵料的应用提供参考。
微藻,营养价值,生物饵料,轮虫,营养强化
微藻的研究与应用广泛,涉及生物能源、制药、食品、水处理、染料和饲料等领域[1]。随着世界水产养殖业的发展,其在此领域的应用价值更备受关注。微藻是食物链的基础环节,作为初级生产力,维持着整个生态系统的运转。其不仅营养丰富,易于大规模培养,生产成本低,投喂方便,而且能够调节水质,作为鱼、虾、蟹、贝类等水产动物苗种的饵料,具有无可替代的作用[2]。多数水产经济种类仅在幼体初期时少量摄食微藻,随着幼体生长,即转为摄食轮虫、桡足类、枝角类等浮游动物。实际生产中,微藻更多用作浮游动物的营养强化饵料,其营养学及相应的应用研究具有重要意义。本文就微藻的营养价值及在水产生物营养强化中的应用进行综述,以期为水产生物营养学研究与生物饵料的应用提供参考。
1 微藻的主要营养成分
微藻的营养组成受其自身的大小、形状、生化成分、生长环境、生理状态及消化率的影响,在不同种类或不同批次的相同种类间差异较大。实际生产中通常根据水产动物的营养需要,培养不同种类的微藻,进行组合投喂,以达到营养平衡的目的。为了更好地利用微藻饵料的营养,需要掌握不同藻类的营养组成。目前,有关微藻营养组成的研究多集中于蛋白质、碳水化合物和脂类三大类物质,其在常见种类中的含量见表1[2]。
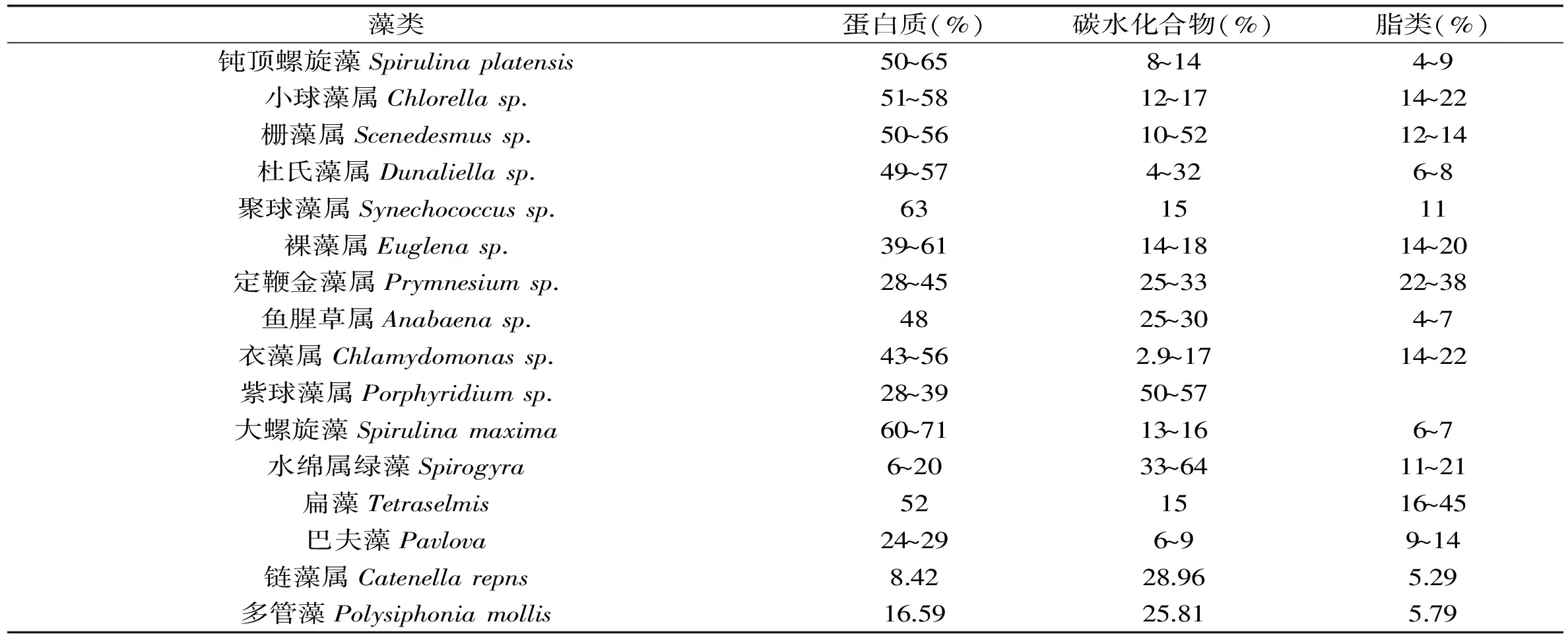
表1 部分微藻的蛋白质、碳水化合物和脂类的含量
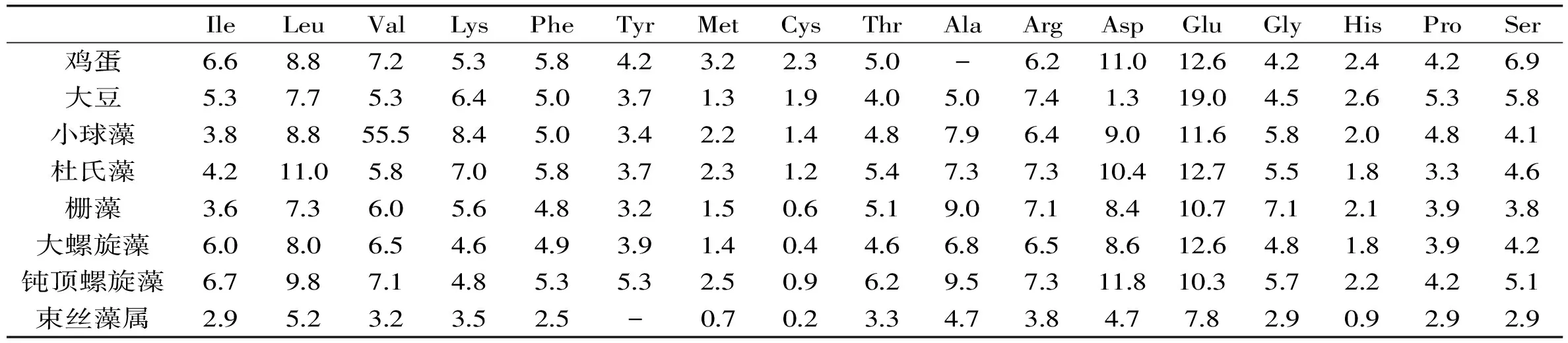
表2 几种常见微藻的氨基酸组成及与常规蛋白源的比较(克/每百克蛋白)[9-11]
注:异亮氨酸(Ile),亮氨酸(Leu),缬氨酸(Val),赖氨酸(Lys),苯丙氨酸(Phe),酪氨酸(Tyr),甲硫氨酸(Met),半胱氨酸(Cys),苏氨酸(Thr),丙氨酸(Ala),精氨酸(Arg),天冬氨酸(Asp),谷氨酸(Glu),甘氨酸(Gly),组氨酸(His),脯氨酸(Pro),丝氨酸(Ser)。
1.1 蛋白质
蛋白质营养通常体现在其氨基酸的组成是否符合所投喂对象的需求[5]。微藻具有合成所有氨基酸的能力,包括人体所需要的全部必须氨基酸。研究表明,多数藻类氨基酸组成均要优于其它食物蛋白,而仅在含硫氨基酸如胱氨酸和甲硫氨酸上有所欠缺[6]。根据Webb和Chu的研究,在四爿藻(Tetraselmissuecica)和陆玆尔巴夫藻(Pavlovalutheri)中精氨酸的含量很高[5]。钝顶螺旋藻的氨基酸组成几乎和鸡蛋一致,甚至在某些特定培养条件下还优于鸡蛋[7]。几种常见微藻的氨基酸组成如表2所示。然而,也有研究显示,不同微藻的氨基酸组成较为相似,而且相对受生长阶段及光照条件的影响极小[8]。因此,仅根据蛋白质量很难评判藻类营养价值[9]。
1.2 碳水化合物
碳水化合物在藻类可消化物中占有较大的比重[10]。藻类的碳水化合物主要以淀粉、纤维素、单糖和多糖的形式存在。Renaud等人检测了澳大利亚北部12种微藻中碳水化合物的含量,发现高盐度环境中生长的绿藻门微藻所含的可溶性碳水化合物占干物质总量的11.0%~13.3%,而这些物质在硅藻门种类中的含量相对较少,只占干物质重的4.1%~6.6%。其中小球藻的可溶性碳水化合物含量最高,为12.6%~13.3%;纤维藻和衣藻中的含量最低,分别为2.7%和2.9%[11]。
水产养殖中常用的藻类如小球藻、球等鞭金藻、塔胞藻和巴夫藻中的糖类主要包括葡萄糖、甘露糖、核糖/木糖、鼠李糖和岩藻糖。其中葡萄糖占总碳水化合物的28%~86%,是最主要的糖类,而甘露糖是主要的多糖类成分[11]。微藻多糖种类丰富,不同结构的多糖生理活性各异,已有研究表明微藻多糖具有增强免疫力、抗病毒、抗恶性肿瘤及抗炎的功效[12]。与大型海藻生产用途广泛的多糖-琼脂相比,微藻多糖的产业化研究和应用还处于起步阶段。20世纪50年代开始,Lewis等利用筛选的衣藻生产胞外多糖(EPS)[13],并发现墨西哥衣藻C.mexicana可以生产出总有机产量25%的多糖。Ramus等利用绿藻、蓝绿藻和单胞红藻Porphyridiumcruemtum生产出大量的胞外多糖[14]。然而,微藻的大规模培养始终不能像大型海藻一样低成本,高产出,很大程度上限制了多糖的生产。
1.3 脂类
微藻中的脂类通常包括甘油和脂肪酸酯,其多为C12-C22之间的直链分子。甘油三脂是含量最多的脂类,占到蓝藻的总脂量的80%[15]。其它的主要脂类还包括卵磷脂、甘油磷脂和肌醇。除此之外还有一些不常见的混合物,例如甜菜碱脂和各种硫脂。Choi等分析了斜生栅藻的脂类组成,总脂含量11.7%,中性脂、糖脂和磷脂组分别是干重的7.24%、2.45%和1.48%[16]。
脂肪酸,尤其多不饱和脂肪酸(PUFA)对于水产养殖动物的生长发育至关重要。20世纪40年代,研究人员开始有关微藻脂肪酸组成的研究,迄今已鉴定了100多种,并应用于水产饲料的研发与生产[17]。Becker等发现螺旋藻可能是γ-亚麻酸重要的生物来源,约占其脂肪酸组成的20%~30%[18]。蓝藻含有25%~60%的PUFA,富含亚麻油酸(18∶2)和亚麻酸(18∶3)以及二十碳五烯酸(20∶5)和花生四烯酸(20∶4)等脂肪酸。Volkman等人报道了4种硅藻的PUFA 的含量,尤其是C.salina和Nitzschiasp.含有丰富的DHA以及EPA(44.6%)。红藻P.cruentum是花生四烯酸含量最丰富的藻种之一,大约占总脂肪酸含量的36%。微藻被认为是n-3脂肪酸的可靠来源,其是高质量鱼油的主要组成成分。研究表明,养殖动物摄入n-3脂肪酸能够明显减少应激反应和慢性疾病的风险[19]。
红琴笑靥如花,像盅惑人的林中女妖。她的身上散发出一种奇异的幽香,与林中的草木的气息混合在一起,形成一种令人沉醉的芬芳。风一吹,树上有几片黄叶飘落下来。你真的要离开我?她问。他没有回答,以往总是她逃离茶庄,去山下的小村子。她做梦也没有想到,有朝一日他也会离开茶庄,离山下的红尘世界越来越远,直至像一朵云一样飘走。她害怕了,莫非他还要再次出家,重新皈依佛门,遁入空门去白云寺当和尚?如果真是这样,这一次他一定是看破了红尘,一定会受戒的。她突然大声尖叫起来,不,你不能走!我不让你走!
1.4 其它营养成分
1.4.1 色素 微藻含有大量的天然色素,这一特性吸引了大量研究者的关注。微藻色素主要分为三大类:类胡萝卜素、叶绿素和藻胆蛋白。杜氏藻、雨生红球藻、小球藻、栅藻、螺旋藻和紫球藻属中的种类等已用于藻色素的商业化生产[1]。常见微藻所含色素如表3所示。

表3 常见微藻所含色素
类胡萝卜素的营养与治疗功效主要由于其能转化为维生素A[20]。类胡萝卜素还能够抑制活性氧,具有很强的抗氧化能力,在炎症控制方面具有一定作用。微藻类胡萝卜素平均含量占到干物质重的0.1%~2%,不同藻类在种类和含量上存在差异。杜氏盐藻中β-胡萝卜素的含量可达到干物质重的14%[21];而雨生红球藻中虾青素的含量最高,能够达到干物质重的1.5%~3%[22]。其它重要的类胡萝卜素还包括叶黄素、环氧玉米黄质、玉米黄素、紫黄素、新黄质等[23]。
微藻中的叶绿素根据吸光度的微小差异分为叶绿素a、b、c、d和f。Kumar等人对印度沿海的18种海洋微藻色素进行了研究,发现绿藻门含有最多的叶绿素a、b,其次是褐藻门和红藻门[24]。叶绿素具有不稳定性,当失去镁离子时,叶绿素会变成苍白昏黄的颜色[1]。叶绿素是开发较为成熟的天然色素,已作为保健食品、饲料、药品和化妆品等添加成分应用。
藻胆蛋白是仅存在于红藻和蓝藻中具有应用开发价值的一类色素,主要有藻红蛋白(phycoerythrin)、藻蓝蛋白(phycocyanin)和异藻蓝蛋白(allophycocyanin)三类。尽管现在更多的被用作天然染料,也有很多的证据表明其在提高健康状态方面具有一定作用[1]。
藻青蛋白常见于螺旋藻等蓝藻中,具有抗氧化、抗炎、保护神经和肝脏的作用[25],因此是最有潜在应用价值的藻色素。这种蓝绿藻内的蓝色素已用于着色饵料,以及改善食品乳化液的流变特性[26]。
1.4.2 维生素与矿物质 微藻是水生动物所需维生素的最佳来源。其中含有维生素A、维生素E、烟酸、硫氨素、核黄素、吡哆醇、维生素B12、维生素C、生物素、肌醇、叶酸和泛酸钙等多种维生素。不同微藻中维生素种类和含量差别很大,以维生素C为例,差别高达16倍[27]。Brown等人报道了澳大利亚微拟球藻(Nannochloropsis)、巴夫藻(Pavlova)、扁藻(Tetraselmis)、角毛藻(Chaetoceros)、海链藻(Thalassiosira)和等鞭金藻(Isochrysis)等微藻的维生素含量,不同种类间的维生素含量差别多在2~4倍,例如烟酸的含量为0.11~0.47 mg/g;维生素E为0.07~0.29 mg/g;硫胺素为29~109 μg/g;核黄素为2~50 μg/g;泛酸为14~38 μg/g;叶酸为17~24 μg/g;吡哆醇为3.6~17 μg/g;维生素B12为1.8~7.4 μg/g;生物素为1.1~1.9 μg/g[28-29]。由此可知,水产养殖中使用混合微藻饵料更有利于动物维生素需求的平衡。
微藻中所含的矿物质也较为丰富,其中钾、磷、钙、镁、锌和锰等元素含量相对较高。目前,已有微藻作为矿物质添加剂取代水产动物饵料中常用的无机矿物盐的研究,显示出很大的应用潜力。微藻中的天然矿物质比人工合成矿物质具有更多的生物效应,更易于生物的消化与利用[30]。富含矿物质的微藻已经应用于商品化鲑鱼饲料,而且实验证实喂食微藻饵料的鲑鱼更健康、活力明显增强,鱼肉的口感和品质更佳[31]。在水产育苗过程中,饵料不合适或者营养成分缺失会显著影响幼苗的生长和存活[32]。
2 微藻在水产生物营养强化中的应用
2.1 微藻饵料的直接应用
在可持续发展的水产养殖业领域,微藻的应用有着巨大潜力。它们在养殖水体中可以通过自养或异养作用产生蛋白质、脂类、碳水化合物等营养物质,同时这一过程消耗了水中的氮、磷等富营养化污染物,即生产了饵料又净化了水质。有关微藻在水产中的直接应用在我国已有很长的历史,淡水养殖传统技术中的“看水养鱼”、“肥水养鱼”都是应用微藻的实例。本文不对有关微藻应用的具体技术进行逐一介绍,仅就贝类、虾蟹类、鱼类育苗和养殖中一些常用的种类及其应用情况进行简述。
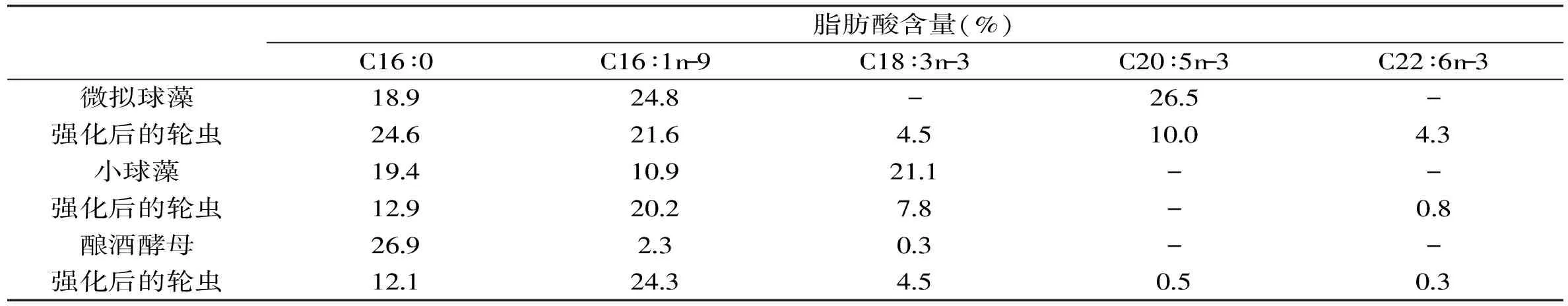
表4 微拟球藻、小球藻及以其为饵料的轮虫的脂肪酸含量[40]
注:-:未检出。
贝类自浮游期幼体开始便以微藻作为食物,实际生产中亲贝促熟和苗种培育过程均需要高质量的微藻。用于贝类苗种生产的微藻种类较多,主要包括硅藻类(角毛藻、骨条藻、三角褐指藻、海链藻)、金藻类(球等边金藻、绿色巴夫藻)、绿藻类(扁藻、杜式盐藻)、黄藻类(眼点微拟球藻)等[33]。目前,虽然已有酵母、微生态制剂或冷冻干燥的微藻加工品应用于贝类育苗的实践,但就其效果还不可能完全替代活体微藻。
微藻在虾蟹类育苗中的应用也非常普遍,实际生产中主要使用的微藻有硅藻类(骨条藻、角毛藻、海链藻)、绿藻类(扁藻、小球藻)和金藻类(等鞭金藻)。世界对虾养殖生产的进步与使用微藻有密切的关系。以养殖最多的凡纳滨对虾为例,其苗种生产从溞状幼体阶段开始大量使用微藻类饵料;后期不仅投喂藻类,还配合经过微藻强化过的浮游动物饵料,如此显著提高了对虾苗种的成活率。我国南方一些对虾苗种企业利用角毛藻、海链藻作为苗种的开口及培育期饵料,育苗全程的平均成活率超过80%[34]。而在传统的池塘养殖中,“藻相”不仅关系到对虾摄食,而且直接影响水质的稳定性,决定着养殖的成败。
与贝类甲壳动物相比,鱼类育苗所需的微藻数量更多。以幼鱼到商品鱼的成活率为30%计算,全世界范围每年用于鱼类产量的微藻需求量可达5000t(干重),这其中多数是用于动物饵料的培育与强化[35]。我国淡水养殖鱼类经典的“水花”培育模式,类似上述对虾育苗及池塘养殖,其主要内容是在池塘中以有机肥培养多样的藻类,培育轮虫等浮游生物,待鱼苗下塘后,即有丰富的饵料,进而保证了成活率,而其成本几乎降至最低。海水鱼类的育苗基本离不开轮虫培育,其中海水小球藻(拟微球藻)的使用必不可少,将在后续内容中进行介绍。
2.2 微藻对轮虫的营养强化
轮虫是水产养殖苗种培育过程中最重要的生物饵料,国内外对轮虫的营养强化研究可以追溯到20世纪70年代。日本的古川等首先利用面包酵母培养的轮虫投喂海水鱼苗,虽然获得了成功,但鱼苗成活率很低,分析原因为摄食面包酵母的轮虫体内缺乏海水鱼必需的n-3不饱和脂肪酸,尤其是DHA(22∶6n-3)和EPA(20∶5n-3)[36]。Whyte和长田比较了投喂面包酵母、小球藻、球等边金藻、四胞藻、海链藻培育轮虫的脂肪酸组成,发现以海链藻培育的轮虫富含EPA 和DHA,表明了微藻的营养组成会影响轮虫的品质[37]。研究发现,用富含EPA、DHA的海洋微藻对轮虫进行了营养强化,其体内不饱和脂肪酸的含量会有明显增加。微拟球藻(Nannochloropsis)可以迅速提高轮虫的EPA含量,等鞭金藻(Isochrysis)和红胞藻(Rhodomonas)能有效提高轮虫体内DHA的含量[38]。
轮虫能够在几个小时内将微藻脂肪酸富集于体内[39],这一生物富集与转化过程逐渐引发人们的研究兴趣。研究发现,微藻经轮虫摄食后,其中很多脂肪酸的碳链延长或缩短,脂类组成发生较明显的变化,这就改变了先前人们仅认为轮虫是“活胶囊”的概念,营养强化而非单纯的运载过程。Maria等人在微拟球藻和小球藻提高轮虫脂肪酸含量的实验中发现,轮虫的体内检测到了在微拟球藻中缺少的DHA和C18∶3n-3,尽管含量不高,却说明脂类转化过程的存在。而在投喂小球藻的轮虫体内也检测到了小球藻所缺少的C16∶1n-9[40]。
除了脂肪酸方面的营养强化研究,有关蛋白质、脂类及碳水化合物在轮虫体内的富集与转化也有报道。Martia等利用半连续培养的微拟球藻对褶皱臂尾轮虫(Brachionusplicatilis)
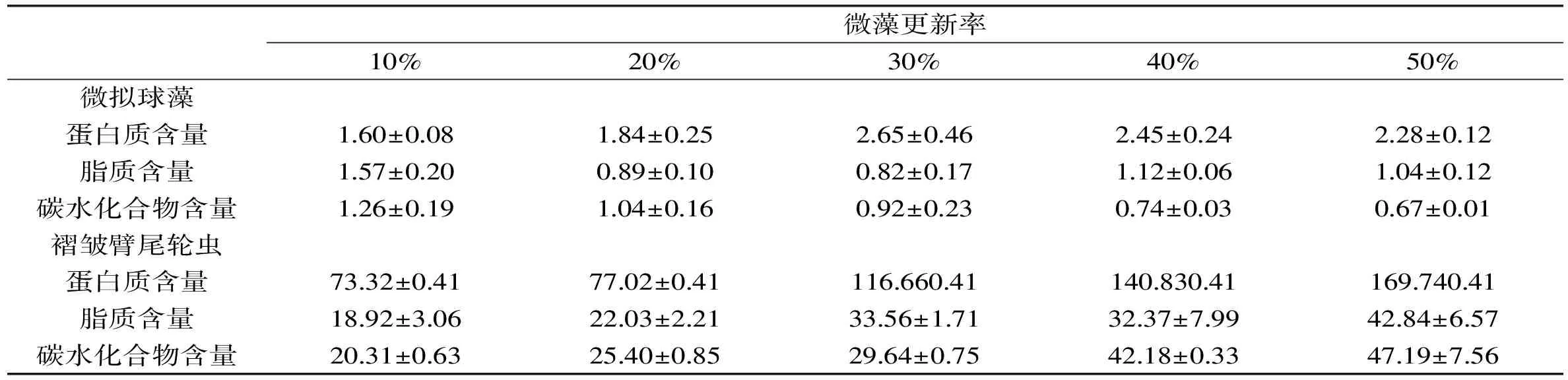
表5 微拟球藻和褶皱臂尾轮虫的主要营养成分含量
进行24 h的营养强化,测定了藻与轮虫的蛋白质、脂质及碳水化合物的含量,结果表明经过强化后的轮虫其相应营养成分均有显著的提高[41](表5)。Coutinho用球等鞭金藻强化轮虫后也得到了相似的结果[42]。
2.3 微藻对其他饵料生物的营养强化
卤虫无节幼体个体小,营养丰富,易消化,其商品化干卵孵化简单易行,是广泛使用的优质活体饵料。与轮虫相似,卤虫幼体在使用过程中也需要营养强化[43]。刚孵化的卤虫无节幼体中DHA的含量较低,故用富含DHA的微藻强化有助于提高其品质。有研究表明,用等鞭金藻比用小球藻更能有效增加卤虫幼体中DHA的含量。分析原因,除了藻种本身的营养差异外,卤虫幼体不具有咀嚼器,不能像轮虫可以有效地破坏小球藻较厚的细胞壁,从而使营养物质的消化吸收受到影响[44]。
桡足类和枝角类是小型低等甲壳动物,广泛分布于海洋和淡水中,是鱼、虾、蟹幼体的重要饵料。桡足类中哲水蚤目、剑水蚤目和猛水蚤目的一些种类,枝角类中的大型溞(Daphniamagna)、多刺裸腹溞(Moinamacrocopa)、蒙古裸腹溞(Moinamongolina)等作为生物饵料具有很大应用价值,但其培育与营养强化并没有像轮虫、卤虫一样成熟的技术模式。这些小型甲壳动物会随着发育阶段的不同,表现出对不同微藻的摄食喜好,这也为其营养强化操作指明了方向。例如,个体较小的微绿球藻和三角褐指藻等种类是桡足类初期幼体的适宜饵料,但在其幼体后期至成体期则会转为摄食亚心型扁藻和中肋骨条藻等个体较大的种类为主[45]。用中肋骨条藻和牟氏角毛藻投喂日本虎斑猛水蚤(Tigriopusjaponicus),结果表明,牟氏角毛藻是其繁殖期间的优良饵料;而较高浓度的中肋骨条藻,含碳量超过0.17/mL时对其发育和繁殖却均产生抑制[46]。
3 展望
随着水产养殖业的发展,微藻的营养研究与应用还将逐步深入。目前,利用微藻对生物饵料进行营养强化的研究主要集中在轮虫、卤虫,而桡足类和枝角类营养研究与应用潜力有待开发;就营养物质而言,蛋白质、不饱和脂肪酸方面研究较多,而对维生素、色素等方面的研究相对较少,有待深入探索。与单一微藻相比,不同藻种的组合使用,能更有效地实现生物饵料的营养强化,促进水产动物的生长。
[1]Se-Kwon Kim. Handbook of Marine Microalgae:Biotechnology Advances [M]. Academic Rress,2015:93-240.
[2]Sen Roy S,Pal R. Microalgae in Aquaculture:A Review with Special References to Nutritional Value and Fish Dietetics[J]. Proc Zool Soc,2015,68(1):1-8.
[3]Venkataraman LV,Becker EW. Biotechnology and utilization of algae:The Indian experience[M]. New Delhi,India:Dept. of Science & Technology and Central Food Technological Research Institute,Mysore,India,1985.
[4]Renaud SM,Parry DL,Thinh LV. Microalgae for use in tropical aquaculture I:Gross chemical composition and fatty acid composition of twelve species of microalgae from the Northern Territory,Australia [J]. Journal of Applied Phycology,1994,6:337-345.
[5]Webb KL,Chu FE. Phytoplankton as a food source for bivalve larvae[J]. 1983:272-291.
[6]Becker EW. Microalgae in human and animal nutrition. In Hand book of microalgal culture,ed. A. Richmond[M],Oxford:Blackwell,2004:312-351.
[7]Becker EW,Venkataraman LV. Production and utilization of the blue green alga Spirulina in India[J]. Biomass 1984,4:105.
[8]Brown MR,Dunstan GA,Jeffrey SW,et al. The influence of irradiance on the biochemical composition of the prymnesiophyte Isochrysis sp.(clone T-ISO)[J]. Phycol,1993,29:601-612.
[9]Brown MR,Garland CD,Jeffrey SW,et al. The gross and amino acid compositions of batch and semi-continuous cultures of Isochrysis sp.(clone T.ISO),Pavlova lutheri and Nannochloropsis oculata[J]. Appl Phycol,1993,5:285-296.
[10]Percival EE,Turvey JR. Polysaccharides of algae[M]. In CRC,handbook of microbiology,condensed edition,Cleveland:CRC Press Inc,1974:532.
[11]Chu,Fu-Lin E,Dupuy JL,et al. Polysaccharide composition of five algal species used as food for larvae of the American oyster,Crassostrea virginica[J]. Aquaculture,1982,29(3-4):241-252.
[12]查荣博,张辉,孙佳明. 微藻的有效成分及生物活性[J]. 吉林中医药,2015(1):64-67.
[13]Lewis R A. Extracellular polysaccharides of green algae[J]. Canadian Journal of Microbiology 1956,2:665-672.
[14]Ramus JS. The production of extracellular polysaccharides by the unicellular red alga Porphyridium eurugineum[J]. Journal of Phycology,1972,8:97-111.
[15]Tornabene TG,Holzer G,Lien S,et al. Lipid composition of the nitrogen starved green alga Neochloris oleoabundans[J]. Enzyme and Microbial Technology,1983,5(6):435-440.
[16]Choi KJ,Nakhost Z,Krukonis VJ,et al. Supercritical fluid extraction and characterization of lipids from algae Scenedesmus obliquus[J]. Food Biotechnology,1987,1(2):263-281.
[17]Borowitzka MA,Borowitzka LJ. Limits to growth and carotenogenesis in laboratory and large-scale outdoor cultures of Dunaliella Salina[M]. In:Stadler,T.,Mollion,J.,Verdus,M-C,Karamanos,Y.,Morvan,H. and Christiaen,D.,(eds.)Algal biotechnology. Elsevier Applied Science,Essex,UK,1988:371-381.
[18]Becker EW. Micro algae in human and animal nutrition[M]. In Hand book of microalgal culture,ed. A. Richmond,Oxford:Blackwell,2004:312-351.
[19]Zuo R,Ai Q,Mai K,et al. Effects of dietary n-3 highly unsaturated fatty acids on growth,nonspecific immunity,expression of some immune related genes and disease resistance of large yellow croaker( Larmichthys crocea )following natural infestation of parasites( Cryptocaryon irritans )[J]. Fish and Shellfish Immunology,2012,32(2):249-582.
[20]Guedes AC,Amaro HM,Malcata FX. Microalgae as Sources of Carotenoids[J]. Marine Drugs. 2011,9(4):625-644.
[21]Metting FB. Biodiversity and application of microalgae[J]. Journal of Industrial Microbiology,1996,17:477-489.
[22]Lorenz RT,Cysewski GR. Commercial potential for Haematococcus microalgae as a natural source of astaxanthin[J]. Trends in Biotechnology,2000,18(4):160-167.
[23]Gouveia L,Empis J. Relative stabilities of microalgal carotenoids in microalgal extracts,biomass and fish feed:Effect of storage conditions[J]. Innovative Food Science & Emerging Technologies,2003,4:227-233.
[24]Kumar V,Pillai BR,Sahoo PK,et al. Effect of dietary astaxanthin on growth and immune response of giant freshwater prawn Macrobrachium rosenbergii(De Man)[J]. Asian Fisheries Science,2009,22:61-69.
[25]Gantar M,Svircev Z. Microalgae and cyanobacteria:food for thought[J]. Phycol,2008,44:260-268.
[26]Batista AP,A Raymundo,Sousa I,et al. Rheological characterization of coloured oil-in-water food emulsions with lutein and fycocyanin added to the oil and aqueous phases[J]. Food Hydrocolloids,2006,20:44-52.
[27]Brown MR,Miller KA. The ascorbic acid content of eleven species of microalgae used in mariculture[J]. Appl Phycol,1992,4:205-215.
[28]Brown MR,Mular M,Miller I,et al. The vitamin content of microalgae used in aquaculture[J]. Journal of Applied Phycology,1999,11:247-255.
[29]Seguineau C,Laschi-Loquerie,Moal J,et al. Vitamin requirements in great scallop larvae[J]. Aquacult. Int,1996,4:315-324.
[30]Doucha J,LívanskK,Kotrbacek V,et al. Production of chlorella biomass enriched by selenium and its use in animal nutrition:a review[J]. Appl Microbiol Biotechnol,2009,83:1001-1008.
[31]Kraan S,Mair C. Seaweeds as ingredients in aquatic feeds[J]. Int Aquafeed,2010,13:10-14.
[32]史会来,楼宝,毛国民,等. 不同饵料对舟山牙鲆仔稚鱼生长发育及存活的影响[J]. 上海水产大学学报,2008,17:680-683.
[33]王志滨,许鹏,郑冬梅,等. 微藻在几种常见贝类人工育苗中的应用[J]. 现代农业科技,2014,11:299-300.
[34]姜玉声. 辽宁沿海虾蟹类与增养殖[M]. 沈阳:辽宁科学技术出版社,2015.
[35]尚国玲. 生物饵料(微藻和轮虫)的培养及其对黄颡鱼幼鱼生长的影响[D]. 南京师范大学,2015
[36]陆建学,夏连军,周凯. 轮虫营养强化研究进展[J]. 现代渔业信息,2007(2):27-29.
[37]于建华,任绍洁. 微藻在轮虫营养强化中的应用研究进展[J]. 饲料研究,2015,24:36-38.
[38]赵明日,孙世春,麦康森,等. 7株海洋微藻强化褶皱臂尾轮虫效果的研究[J]. 水产科学,2001,2(3):3-6.
[39]Calado R. Marine Ornamental Shrimp:Biology,Aquaculture and Conservation [M]. John Wiley & Sons,2009.
[40]Birkou M,Bokas D,Aggelis G. Improving fatty acid composition of lipids synthesized by brachionus plicatilis in large scale experiments[J]. Journal of the American Oil Chemists’ Society. 2012,89(11):2047-2055.
[41]Ferreira M,Coutinho P,Seixas P,et al. Enriching rotifers with “premium” microalgae. Nannochloropsis gaditana [J]. Marine biotechnology. 2009,11(5):585-595.
[42]Coutinho P. La microalga marina Rhodomonas lens:optimización de las condiciones de cultivoy potencial biotecnológico[D]. Diss. Ph.D. Thesis,Universidade de Santiago de Compostela,2008:261.
[43]苏琳,黄权. 蛋氨酸对卤虫营养强化[J]. 饲料工业,2013(13):14-17.
[44]田宝军,李英文,丁茜,等. 轮虫与卤虫在营养价值等方面的比较[J]. 河北渔业,2007,12:45-47.
[45]李捷,孙松,李超伦,等. 不同饵料对桡足类无节幼体存活、发育的影响研究[J]. 海洋科学,2006(12):13-20.
[46]许婕,王桂忠,吴荔生. 2种浮游硅藻对底栖桡足类日本虎斑猛水蚤存活、发育和繁殖的影响[J]. 厦门大学学报,2012,51(5):939-943.
Microalgae in aquaculture:a review to nutritional value and rotifers enrichment
ZHANG Ji-hong1,REN Dan-dan1,*,JIANG Yu-sheng2,REN Xian-jian1,GUP Xiao-xi1
(1.College of Food Science and Engineering,Dalian Ocean Univeristy,Dalian 116023,China;2.College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023,China)
Microalgae have abundant nutrients and capacities to purify water and produce proteins,fatty acids,enzymes and pigments which can be useful for aquaculture developments. Microalgae have been used in aquaculture as food additives,fish meal and oil replacement,colorants,and enhancers of nutritional value of zooplankton fed to fish larvae and bivalve mollusks. In this essay an attempt has been taken to review the nutritional value of microalgae in aquaculture. The application of microalgae which are fed directly to fish larvae or used indirectly as food for rotifers enrichment has been emphasized.
microalgae;nutritional value;aquatic live food;rotifers;enrichment
2016-03-24
张继红(1976-),女,硕士研究生,研究方向:微藻营养,E-mail:zhangrebecca34@gmail.com。
*通讯作者:任丹丹(1980-),女,博士,副教授,研究方向:海洋生物资源利用,E-mail:rdd80@163.com。
国家自然科学基金(31301449);辽宁省高校优秀人才项目(LJQ2014077);辽宁省农业领域青年科技创新人才项目(2015005);辽宁省海洋与渔业厅科技计划项目(201513)。
TS254.2
A
1002-0306(2016)20-0000-00
10.13386/j.issn1002-0306.2016.20.000

