甘肃鼢鼠低氧适应后心功能的变化
张静, 王倩, 钱令波, 杨静, 何建平
(陕西师范大学生命科学学院,西安710119)
甘肃鼢鼠低氧适应后心功能的变化
张静, 王倩, 钱令波, 杨静, 何建平*
(陕西师范大学生命科学学院,西安710119)
甘肃鼢鼠Eospalaxcansus是生活在我国黄土高原地区的地下鼠,是一种缺氧耐受的模型鼠,具有多种机制来适应其特殊的生活环境。为了比较慢性间歇性低氧后与地面常氧状态下甘肃鼢鼠的心脏功能,将18只甘肃鼢鼠随机分为对照组(常氧)和实验组(慢性间歇性低氧)检测其心脏功能。结果表明,低氧适应后实验组的心率较对照组显著提高(P<0.05);平均颈动脉压力、左心室收缩压较对照组极显著升高(P<0.01);左心室内压最大上升速率和左心室内压最大下降速率与对照组差异无统计学意义。表明甘肃鼢鼠存在一定低氧适应机制,在低氧刺激下其心脏代偿功能得到发挥,从而减轻缺氧对其心脏的损伤。
甘肃鼢鼠;心功能;低氧适应
鼢鼠是一类终生在地下生活的小型哺乳动物,也是一群广泛分布的独居型啮齿动物,生活在几乎完全黑暗、低氧高二氧化碳的极端环境中(Tomasco & Lessa,2011;Nevo,2013;Smorkatcheva & Lukhtanov,2014)。研究发现干旱季节鼢鼠生活的洞道中氧气浓度最高达18.9%,但在多雨季节或冬天,由于O2和CO2水平快速变化引起的低氧高二氧化碳,O2浓度最低可下降至6%,CO2浓度最高可上升至7%(Shamsetal.,2005)。洞道深度不同,洞道内O2浓度和CO2浓度变化显著:洞道越深,CO2浓度越高,O2浓度随之下降(Shamsetal.,2005;Nevo,2009)。鼢鼠对低氧的耐受是其生活史中适应进化的一大特征。其中心脏结构和功能的低氧耐受是其适应生活的一个方面。低氧能通过多种机制改善心肌收缩功能,增强心脏的容忍度,且效果因物种和年龄而不同(孙希武等,1994;Netukaetal.,2006;Ostadal & Kolar,2007)。例如,对人、羊低氧处理后,其血管平滑肌细胞的肌醇三磷酸(IP3)受体数目减少,亲和力下降,从而减轻因缺氧引起的血管收缩,增加心肌供血(Zhouetal.,1997);Wistar大鼠心肌肌浆网和心肌线粒体的Ca2+、Mg2+-ATPase活性增高,改善心肌收缩功能(孙希武等,1994);心肌线粒体呼吸链复合体酶活性增强,心肌细胞利用葡萄糖的能力增强,氧的利用率提高,为心肌提供更多的三磷酸腺苷(ATP)(Holdenetal.,1995)。在缺氧条件下,肌肉脂溶性物质(FSC)能显著提高血清一氧化氮合成酶(NOS)活性和一氧化氮(NO)含量,降低心肺血红素氧合酶(HO)活性,对缺氧损伤有保护作用,这在高原鼢鼠Myospalaxbailey的研究中有报道(刘海春,魏登邦,2003;秦桂香,魏登邦,2003)。此外,低氧信号是心肌细胞重建的重要标志,有助于心肌细胞增殖,且在富氧条件下通过DNA损伤应答可阻碍心肌细胞的增殖(Puenteetal.,2014;Kimuraetal.,2015)。与此同时,相关研究表明上述机制的作用效果因物种和年龄而不同(孙希武等,1994;Netukaetal.,2006;Ostadal & Kolar,2007)。比如,对甘肃鼢鼠Eospalaxcansus(王延正,徐文贤,1992)进行急、慢性低氧处理的实验表明,甘肃鼢鼠可在多个层次上应对低氧压力,心肌组织甚至在急性低氧(4%O2)条件下10 h后可完全恢复至正常状态,而相同条件下,SD大鼠结构已经发生不可逆的损伤(严婷婷等,2012)。
急性缺氧可显著影响心功能,大鼠经低氧适应后,心脏功能明显改善,可减轻缺氧对心脏的损伤(龙超良等,1999)。中度低氧可使乳鼠心脏成纤维细胞增殖细胞核抗原表达增加,并且出现肌成纤维细胞的表型特点(于军等,2003)。间歇性低氧诱发心率(HR)增加(Taralovaetal.,2015),交感肾上腺功能亢进、早期血流动力学改变和近端组织重建,并使外周血管敏感性下降,在反复呼吸暂停患者及慢性间歇性低氧动物模型中均表现出交感神经活性提高和血浆儿茶酚胺水平升高(Prabhakaretal.,2012)。但是,有研究表明间歇性低氧使心肌梗死更易发生,重复的氧化应激可能触发氧化应激、系统炎症和交感神经激活等,进而导致各种心血管疾病的发生和进展(Ramondetal.,2011;韩苗苗等,2014)。严重的血氧不足导致室性异位搏动,并促进心肌重构而导致房颤,重复的缺血性损害导致急性血液动力学应激,进而引起心室纤维化,促发睡眠中的室性心律失常和猝死(Monneretaetal.,2012;Rossietal.,2013;Mendesaetal.,2014)。
甘肃鼢鼠为鼹形鼠科Spalacidae动物,主要分布于黄土高原荒地、树林、丘陵,终生营地下生活(王延正,徐文贤,1992;Norrisaetal.,2004;鲁庆彬等,2013)。以往的研究表明,其心血管系统适应低氧环境,低氧处理后血红蛋白浓度升高、红细胞数量增多、压积增加、心肌收缩力增加(杨静等,2006;谢芬,2012)。甘肃鼢鼠心脏可通过提高抗氧化酶活性清除多余自由基,提高ATP酶活性,保证心电活动正常以应对低氧应激,经过4.0%氧浓度处理后,心肌超微和显微结构随时间延长由损伤逐渐恢复正常(严婷婷等,2012;唐燕红等,2013)。间歇性低氧更接近自然中O2浓度经常发生变化的情况,然而迄今对甘肃鼢鼠在间歇慢性低氧条件下心脏功能适应变化的情况尚不清楚,为此,本研究测定甘肃鼢鼠在慢性间歇性低氧适应前、后心功能变化,推测慢性间歇性缺氧会导致甘肃鼢鼠的左心室功能的提高,左、右心室质量很可能也会代偿性增加。本研究为进一步阐明甘肃鼢鼠低氧适应的机制及其应对极端环境压力的能力以及人体如何适应低氧提供参考。
1 材料与方法
1.1 实验动物
雄性甘肃鼢鼠平均体质量为290.32 g±1.20 g(280~300 g,n=18),捕自陕西省延安市(36°36′N,109°31′E)。甘肃鼢鼠于室内环境下单笼饲养,饲养笼尺寸为长475 mm×宽350 mm×高350 mm,以胡萝卜为饲料。实验室的光周期为12L∶12D,温度为22 °C ~24 °C,适应1周后将其随机分为2组:对照组(常氧组,N,n=9),实验组(慢性间歇性低氧组,CIH,n=9)。
1.2 低氧适应方式
对照组甘肃鼢鼠于实验室内不进行任何处理。实验组:将甘肃鼢鼠置于14.1%氧浓度低氧舱,每天低氧处理6 h,持续7 d,之后再置于10.5%氧浓度低氧舱,每天低氧处理6 h,持续7 d,最后用6.5%高度缺氧条件进行低氧应激,处理4 h(龙超良等,1999)。低氧舱内CO2浓度为1%左右,相对湿度为50%左右。
1.3 心脏功能的检测
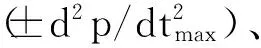
1.4 左、右心室称重
心功能指标测定完成后,迅速开胸取心,用0.9%生理盐水将心脏清洗干净,分离左、右心室,弃去室间隔,滤纸吸干后分别称重,并记录左、右心室质量。
1.5 统计处理
将测得的实验数据使用SPSS 18.0进行统计分析,结果以平均值±标准差(Mean±SD)表示,用探索分析检验数据后,符合方差分析要求的数据采用方差分析进行组间差异比较,P<0.05为差异有统计学意义,P<0.01为差异有高度统计学意义。
2 结果
2.1 低氧适应前、后心功能
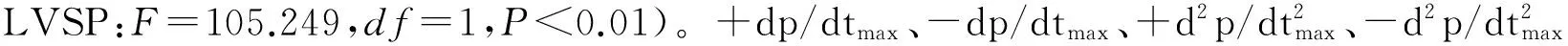
2.2 心室质量
甘肃鼢鼠左、右心室质量在常氧与慢性间歇性低氧应激状态下的变化如表2。数据表明低氧应激后,甘肃鼢鼠左、右心室质量/体质量与对照组相比明显升高(P<0.01),但是右心室与左、右心室质量比却维持在恒定水平,但与对照组差异无统计学意义(P>0.05)。
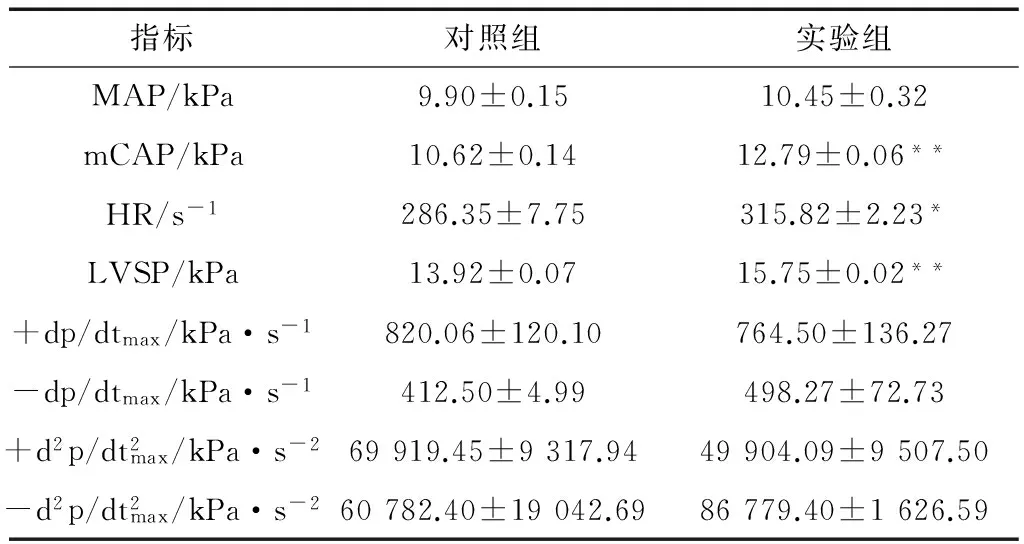
表1 对照组和实验组甘肃鼢鼠心功能各指标
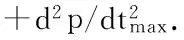
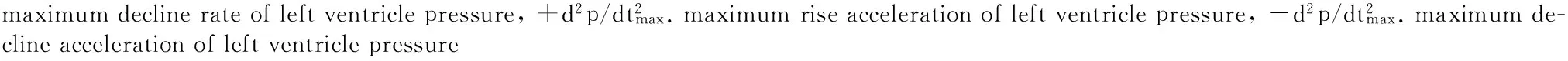
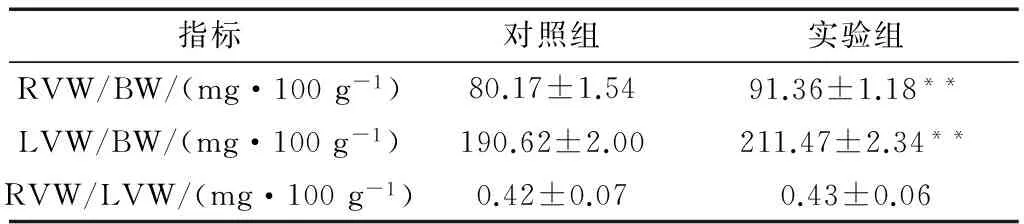
表2 对照组和实验组甘肃鼢鼠左、右心室质量
注: RVW.右心室质量, LVW.左心室质量, BW.体质量;*P<0.05,**P<0.01。
Notes: RVW.right ventricular weight, LVW.left ventricular weight, BW.body weight;*P<0.05,**P<0.01.
3 讨论
甘肃鼢鼠长期生活在低氧环境中,有研究表明4.0%氧浓度是其低氧耐受极限(唐燕红等,2013)。为充分调动甘肃鼢鼠的代偿机制,本实验采用慢性间歇性低氧的氧浓度梯度,最后6.5%高度缺氧进行低氧应激,探讨其心脏耐受低氧的机制。结果表明,间歇性低氧对甘肃鼢鼠的心脏是一种保护,在这个过程中,心脏逐步适应低氧环境,刺激了其代偿功能。
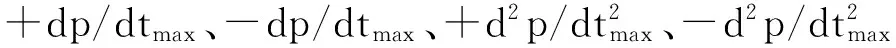
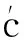
通过慢性间歇性低氧应激处理,甘肃鼢鼠能增强右心室功能以满足当前实验条件下的机体氧供应。大量研究表明,慢性间歇性低氧能充分调动各种代偿机制,以增强机体对低氧的抵抗能力,从而缓解缺氧对心肌的损害(龙超良等,1999)。甘肃鼢鼠适应低氧环境的心血管生理基础可能是其心脏代偿能力大,也可能是因为其肌肉脂溶性物质抗缺氧且红细胞表面积较大,红细胞内血红蛋白得到充分利用等因素增强了其心血管系统对低氧的适应(阮宗海等,2000;秦桂香,魏登邦,2003)。研究结果表明,甘肃鼢鼠终生居住于相对低氧的黄土高原地下洞穴,经过长期的自然选择,其心血管系统的耐低氧功能十分显著。
韩苗苗, 何庆, 施遥, 等. 2014. 睡眠呼吸暂停模式间歇低氧对心脑血管的影响[J]. 天津医药, (9): 946-949.
刘海春, 魏登邦. 2003. 高原鼢鼠肌肉脂溶性物质抗缺氧机制的探讨[J]. 黑龙江畜牧兽医, (4): 7-8.
龙超良, 周智, 尹昭云, 等. 1999. 急、慢性缺氧对大鼠心功能的影响[J]. 航天医学与医学工程, 12(4): 35-37.
鲁庆彬, 张阳, 周材权. 2013. 甘肃鼢鼠不同地理种群的形态变异分析[J]. 兽类学报, 33(2): 193-199.
秦桂香, 魏登邦. 2003. 高原鼢鼠肌肉脂溶性物质对大鼠一氧化氮合成酶和血红素氧合酶活性的影响[J]. 黑龙江畜牧兽医, (5): 51-52.
阮宗海, 陈华伟, 陈秋红, 等. 2000. 不同海拔高原鼠兔、大白鼠血红蛋白电泳及血液学对比观察[J]. 中国应用生理学杂志, 16(1): 47, 91, 95.
孙希武, 叶益新, 邓希贤. 1994. 低氧适应对缺氧性心功能损伤的保护作用及其机制探讨[J]. 中国应用生理学杂志, 10(3): 205-208.
唐燕红, 王剑, 李金钢, 等. 2013. 低氧应激下甘肃鼢鼠与SD大鼠心脏抗氧化酶和ATP酶活性的比较[J]. 兽类学报, 33(2): 178-185.
王延正, 徐文贤. 1992. 陕西啮齿动物志[M]. 西安: 陕西师范大学出版社: 113-115.
谢芬, 李涛, 何建平. 2012. 低氧对甘肃鼢鼠体内ACTH及血液生理指标的影响[J]. 动物学杂志, 47(5): 119-123.
严婷婷, 樊魏伟, 何建平. 2012. 低氧耐受对甘肃鼢鼠心肌结构的影响[J]. 陕西师范大学学报(自然科学版), 40(2): 62-66.
杨静, 李金钢, 何建平, 等. 2006. 甘肃鼢鼠血象及其与低氧适应的关系[J]. 动物学杂志, 41(2): 112-115.
于军, 朱妙章, 裴建明, 等. 2003. 低氧对心脏成纤维细胞增殖细胞核抗原表达与表型的影响[J]. 中国病理生理杂志, 19(10): 1311-1315.
袁芳, 郭赞, 徐瑛, 等. 2008. 间歇性低压低氧与连续性低压低氧对大鼠血液动力学作用的比较(英文)[J]. 生理学报, 60(6): 687-694.
张晋源, 陈彦, 肖玲, 等. 2014. 内源性大麻素系统在慢性间歇低氧大鼠心肌肥厚病理过程中的作用[J]. 中国循环杂志, 7: 545-549.
周兆年. 2003. 低氧与健康研究[J]. 中国基础科学, (5): 22-27.
Béguin PC, Joyeux-Faure M, Godin-Ribuot D,etal. 2005. Acute intermittent hypoxia improves rat myocardium tolerance to ischemia[J]. Journal of Applied Physiology, 99(3): 1064-1069.
Boer PH, Ruzicka M, Lear W,etal. 1994. Stretch-mediated activation of cardiac renin gene[J]. American Journal of Physiology-Heart and Circulatory Physiology, 267(4): H1630-H1636.
DiPasquale DM, Strangman GE, Harris NS,etal. 2015. Acute mountain sickness, hypoxia, hypobaria and exercise duration each affect heart rate[J]. International Journal of Sports Medicine, 36(8): 609-614.
Faulhaber M, Gatterer H, Haider T,etal. 2015. Heart rate and blood pressure responses during hypoxic cycles of a 3-week intermittent hypoxia breathing program in patients at risk for or with mild COPD[J]. International Journal of Chronic Obstructive Pulmonary Disease, 10: 339-345.
Holden JE, Stone CK, Clark CM,etal. 1995. Enhanced cardiac metabolism of plasma glucose in high-altitude natives: adaptation against chronic hypoxia[J]. Journal of Applied Physiology, 79(1): 222-228.
Kimura W, Xiao F, Canseco DC,etal. 2015. Hypoxia fate mapping identifies cycling cardiomyocytes in the adult heart[J]. Nature, 523(7559): 226-230.
Lavie L. 2015. Oxidative stress in obstructive sleep apnea and intermittent hypoxia-revisited-the bad ugly and good: implications to the heart and brain[J]. Sleep Medicine Reviews, 20: 27-45.
Mendesa RH, Mostardab C, Candidoc GO,etal. 2014. Hyperhomocysteinemia provokes dysfunction of cardiovascular autonomic system and liver oxidative stress in rats[J]. Autonomic Neuroscience, 180: 43-47.
Monnereta D, Tamisiera R, Ducrosb V,etal. 2012. The impact of obstructive sleep apnea on homocysteine and carotid remodeling in metabolic syndrome[J]. Respiratory Physiology & Neurobiology, 180(2): 298-304.
Netuka I, Szarszoi O, Maly J,etal. 2006. Effect of perinatal hypoxia on cardiac tolerance to acute ischaemia in adult male and female rats[J]. Clinical and Experimental Pharmacology and Physiology, 33(8): 714-719.
Nevo E. 2009. Visual system: adaptive regression and progression in subterranean mammals[M]// Squire LR. Encyclopedia of neuroscience. Oxford: Academic Press: 323-330.
Nevo E. 2013. Stress adaptation and speciation in the evolution of the blind mole rat,Spalax, in Israel[J]. Molecular Phylogenetics and Evolution, 66(2): 515-525.
Norrisa RW, Zhoub K, Zhoub C,etal. 2004. The phylogenetic position of the zokors (Myospalacinae) and comments on the families of muroids (Rodentia)[J]. Molecular Phylogenetics and Evolution, 31(3): 972-978.
Ostadal B, Kolar F. 2007. Cardiac adaptation to chronic high-altitude hypoxia: beneficial and adverse effects[J]. Respiratory Physiology & Neurobiology, 158(3): 224-236.
Prabhakar NR, Kumar GK, Peng YJ. 2012. Sympatho-adrenal activation by chronic intermittent hypoxia[J]. Journal of Applied Physiology, 113(8): 1304-1310.
Puente BN, Kimura W, Muralidhar SA,etal. 2014. The oxygen-rich postnatal environment induces cardiomyocyte cell-cycle arrest through DNA damage response[J]. Cell, 157(3): 565-579.
Ramond A, Godin-Ribuot D, Ribuot C,etal. 2011 Oxidative stress mediates cardiac infarction aggravation induced by intermittent hypoxia[J]. Fundamental & Clinical Pharmacology, 27(3): 252-261.
Rossi VA, Stradling JR, Kohler M. 2013. Effects of obstructive sleep apnoea on heart rhythm[J]. European Respiratory Journal, 41(6): 1439-1451.
Shams I, Avivi A, Nevo E. 2005. Oxygen and carbon dioxide fluctuations in burrows of subterranean blind mole rats indicate tolerance to hypoxic-hypercapnic stresses[J]. Comparative Biochemistry & Physiology Part A Molecular & Integrative Physiology, 142(3): 376-382.
Smorkatcheva AV, Lukhtanov VA. 2014. Evolutionary association between subterranean lifestyle and female sociality in rodents[J]. Mammalian Biology-Zeitschrift für Säugetierkunde, 79(2): 101-109.
Taralova Z, Terziyskia K, Dimova P,etal. 2015. Assessment of the acute impact of normobaric hypoxia as a part of an intermittent hypoxic training on heart rate variability[J]. Cor et Vasa, 57(4): e251-e256.
Tomasco IH, Lessa EP. 2011. The evolution of mitochondrial genomes in subterranean caviomorph rodents: adaptation against a background of purifying selection[J]. Molecular Phylogenetics and Evolution, 61(1): 64-70.
Zhou L, Zhao Y, Nijland R,etal. 1997. Ins(l, 4, 5)P3 receptors in cerebral arteries: changes with development and high-altitude hypoxia[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 272(6): 1954-1959.
Variety of Cardiac Functions ofEospalaxcansusafter Hypoxia Acclimatization
ZHANG Jing, WANG Qian, QIAN Lingbo, YANG Jing, HE Jianping*
(College of Life Sciences, Shaanxi Normal University, Xi’an 710119, China)
Eospalaxcansusis a unique model of hypoxic tolerance and is a blind subterranean mole rat which lives on the loess plateau of China.This species develops multiple mechanisms to adapt the special environments.In this study, to detect the effects of intermittent hypoxic acclimatization on cardiac functions, eighteenE.cansuswere randomly assigned to normoxia (N) group and chronic intermittent hypoxia (CIH) group.The results showed that, compared with the N group, CIH could significantly increase heart rate (P<0.05), and extreme significantly increase the average carotid artery pressure and the left ventricular systolic pressure (P<0.01), while no significant changes were observed in maximum rise rate of left ventricle pressure and maximum decline rate of left ventricle pressure, etc.These results indicated thatE.cansushad adapted to hypoxic habitats (underground burrow) and its cardiac compensations had been significantly developed, and these can therefore alleviate the hypoxic effects of cardiac functions.
Eospalaxcansus; cardiac functions; hypoxic acclimatization
2015-10-26 接受日期:2016-03-24 基金项目:国家自然科学基金项目(No.30670360)
张静(1990—), 女, 硕士研究生, 研究方向: 神经生物学, E-mail:6045520302@qq.com
*通信作者Corresponding author,E-mail:hejianping@snnu.edu.cn
10.11984/j.issn.1000-7083.20150335
Q954.63; Q959.8
A
1000-7083(2016)03-0421-05

