不同培养基和储存条件对家蝇幼虫分泌物中溶菌酶含量的影响
王建宇,国 果,杨蔚锦,陶如玉,陈 亚
(1.贵州医科大学2012级卓越医师班,贵州贵阳 550004;2.贵州医科大学基础医学院,贵州贵阳 550004)
不同培养基和储存条件对家蝇幼虫分泌物中溶菌酶含量的影响
王建宇1,国 果2*,杨蔚锦2,陶如玉2,陈 亚2
(1.贵州医科大学2012级卓越医师班,贵州贵阳 550004;2.贵州医科大学基础医学院,贵州贵阳 550004)
[目的] 了解不同培养基和储存条件对家蝇幼虫分泌物中溶菌酶含量的影响。 [方法] 分别以猪粪和鸡粪为培养基饲养家蝇幼虫,分别为猪粪处理组和鸡粪处理组,用麦麸饲养幼虫为正常对照组,麦麸中添加大肠杆菌菌液饲养幼虫为诱导对照组,分别提取各组2龄和3龄家蝇幼虫的分泌物,使用试剂盒检测分泌物中溶菌酶含量;分别提取正常对照组和诱导对照组中3龄幼虫的分泌物,测定在室温、4 ℃和-20 ℃下不同时间溶菌酶含量的变化。 [结果] 猪粪处理组、鸡粪处理组、正常对照组和诱导对照组中分离的3龄幼虫分泌物中溶菌酶的平均含量分别为2.462、2.782、1.019、2.117 μg/mL,均显著高于2龄幼虫(P<0.05)。猪粪处理组、鸡粪处理组和诱导对照组2龄和3龄幼虫分泌物的溶菌酶含量均高于正常对照组(P<0.05)。在室温下,正常对照组和诱导对照组中溶菌酶的活性均仅能维持14 d左右;在-20 ℃下,溶菌酶的活性均可维持70 d左右;在4 ℃下,正常对照组和诱导对照组中溶菌酶活性的维持时间介于室温和-20 ℃之间,且2组间溶菌酶含量随时间的变化规律有一定差异。 [结论] 3龄蝇蛆分泌物中溶菌酶含量高于2龄蝇蛆;鸡粪培养基和猪粪培养基能显著增强家蝇2龄和3龄幼虫分泌物中溶菌酶含量;在-20 ℃储存条件下,家蝇溶菌酶可在较长时间内保持较高的活性。
家蝇;溶菌酶;猪粪;鸡粪
家蝇幼虫又称为五谷虫,中药五谷虫即俗称的蛆[1],为丽蝇科(Calliphoridae)昆虫大头蝇(ChrysomyiamegacephalaFab.)或其他近缘昆虫的幼虫[2]。家蝇,又名大头蝇、红点蝇、红头蝇、罗仙子、水仙子等。《本草纲目》虫目第40卷指出:“凡疔疮、臁烂可用家蝇研末,香油调而外敷。鲜者更妙,取咸寒解毒,蠕动攻散也”。医学上认为,作为传统中药材的五谷虫外敷有治疗臁疮的作用。
溶菌酶(Lysozyme)又称胞壁质酶(Muramidase)或N-乙酰胞壁质聚糖水解酶(N-acetylmuramide glycanohydrlase),是一种碱性蛋白质[3]。溶菌酶分为3种类型:c 型,主要代表是鸡蛋清溶菌酶(Chicken egg-white lysozyme,cL);g 型,主要代表是鹅蛋清溶菌酶(Goose egg-white lysozyme,gL);噬菌体溶菌酶型[4]。溶菌酶在机体先天免疫中发挥重要作用,是一种非特异性免疫因子,可以通过其活性中心破坏细胞壁中N-乙酰胞壁酸和N-乙酰氨基葡糖之间的β-1,4 糖苷键,使细胞壁不溶性黏多糖分解成可溶性糖肽,导致细胞壁破裂、内容物逸出,从而使细菌溶解[5]。溶菌酶作为一种无毒副作用的天然抗菌蛋白,还可用于水产品和肉制品等食品的防腐保鲜,特别是可作为婴儿食品和配方奶粉良好的添加剂[6]。
家蝇及其幼虫主要生长在腐物、粪便和垃圾等含有大量细菌的恶劣环境中,其体表带有许多病原菌,能传播多种疾病,但其自身却不受这些病原菌的影响,更不会因为感染病原菌而引起家蝇的大批死亡,说明家蝇对病原微生物有更强大的免疫力[7]。笔者所在课题组的前期研究发现,家蝇幼虫分泌物有抗大肠埃希菌的功效,而且此抗菌物质不需任何其他的诱导便可产生[8]。从该分泌物中分离并纯化到具有广谱抗菌功能的抗菌活性蛋白,并对其进行了生物学特性研究和体内免疫活性的初步研究[9],通过肽指纹图谱鉴定发现幼虫体外分泌物中的抗菌活性物质之一是溶菌酶[10]。研究表明,家蝇溶菌酶主要属于C型溶菌酶[11],是家蝇免疫防御系统中的一员,也是一种重要的消化酶[12]。
猪粪和鸡粪富含优良的蛋白质和矿物质,是家蝇幼虫生长发育的优良培养基[13]。研究表明,对家蝇进行集约化饲养,利用其生态功能集中转化畜禽粪便等有机废物,能够将有机废物快速熟化,转化为生物有机肥,降低粪便等培养基中的有害物质含量[14]。然而,目前关于家蝇幼虫在不同培养基中生长分泌的溶菌酶活性差异的报道较少。笔者研究了经过猪粪和鸡粪培养后家蝇幼虫体外分泌物中溶菌酶含量的变化,以及不同储存条件对溶菌酶活性的影响,旨在为家蝇溶菌酶的进一步开发和利用提供试验依据。
1 材料与方法
1.1 材料
1.1.1 试验材料。家蝇(Muscadomestica)由贵州医科大学基础医学院实验室饲养传代。成虫以奶粉和白糖为饲料。饲养温度为(25±1)℃,相对湿度为50%~60%,光照时间为12 h。成虫产卵时,用饲料接卵。大肠埃希菌(Escherichiacoli) ATCC10503,购自军事医学科学院。新鲜猪粪和鸡粪均取自贵州大学饲养场。
1.1.2 仪器与试剂。Milli-Q超纯水仪(法国millipore公司)、5415R冷冻干燥离心机(德国Eppendorf公司)、冷冻干燥系统(丹麦Heto-Holten公司)、μ-Quant扫描酶标分光光度仪(美国Bio-Tek公司);溶菌酶检测试剂盒(南京建成科技有限公司)。
1.2 方法
1.2.1 培养料预处理。取新鲜的猪粪和鸡粪,使其相对湿度约为85%。在饲养粪便中加入20%(质量比)的麦麸,发酵10 h备用。
1.2.2 家蝇2龄和3龄幼虫的准备。试验组取08:00—10:00所产的家蝇卵,分别置于预处理后的猪粪和鸡粪培养基中饲养,培养48 h后得到2龄幼虫,96 h后得到3龄幼虫。常规麦麸饲养的幼虫为正常对照组,麦麸中加入大肠杆菌菌液(3.56 g/L)饲养的为细菌诱导组。
1.2.3 家蝇幼虫分泌物的提取。取2龄和3龄家蝇幼虫100 g用蒸馏水清洁体表后,浸泡于适量无菌水中,25~26 ℃条件下放置4 h,不断振荡。吸取浸液用0.22 μm的无菌滤器过滤除菌,获得分泌物粗提液。
1.2.4 不同培养基和不同龄期幼虫分泌物中溶菌酶的含量检测。分别取试验组和对照组蝇蛆分泌物,用藤黄微球菌作为底物,测定家蝇幼虫溶菌酶的含量。按照试剂盒说明书计算溶菌酶含量。
1.2.5 不同储存温度和储存时间幼虫分泌物中溶菌酶的活性检测。将猪粪饲养组的幼虫分泌物分装置于室温、4 ℃、-20 ℃条件下,每隔一定时间取出,检测其溶菌酶活性。
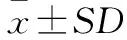
2 结果与分析
2.1 不同培养基和不同龄期幼虫分泌物中溶菌酶含量的比较 由表1可知,各组3龄幼虫分泌物中溶菌酶含量均显著高于2龄幼虫(P<0.05)。猪粪培养基、鸡粪培养基和细菌诱导培养基中培养的2龄和3龄幼虫,其分泌物中溶菌酶含量均显著高于正常对照组(P<0.05)。
表1 不同培养基和不同龄期幼虫分泌物中溶菌酶含量的比较
Table 1 The comparison of lysozyme content in the secretions of different instars of larvae cultivated with various kinds of culture media μg/mL

注:不同小写字母表示差异显著(P<0.05)。
Note:Different lowercases stand for significant differences(P<0.05).
2.2 不同储存温度和储存时间对幼虫分泌物中溶菌酶含量的影响 从图1可以看出,幼虫分泌物在室温下溶菌酶含量可以维持7 d,8~14 d溶菌酶活性基本消失;在4 ℃条件下放置7 d溶菌酶含量无明显变化,但8~21 d溶菌酶含量逐渐下降,22~63 d溶菌酶含量维持在最初测定值的一半左右,64~70 d溶菌酶活性逐渐消失;放置于-20 ℃下幼虫分泌物的溶菌酶含量一直比较稳定,64~70 d溶菌酶含量无明显变化。
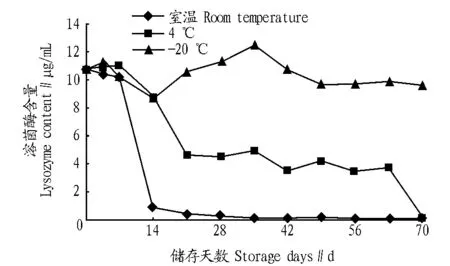
图1 不同储存温度和储存时间对溶菌酶含量的影响Fig.1 Effects of different storage temperatures and storage time on the lysozyme content
3 讨论与结论
溶菌酶作为一种非特异性免疫因子,广泛分布于生物体的体液和组织液中[15]。除了天然的抗菌活性外,人溶菌酶与机体的防御体系密切相关,其具有抗炎、抗肿瘤、提高机体免疫力等功能,同时作为内源性蛋白质,不会对人体产生不良反应和副作用[16]。大量研究表明,除植物溶菌酶存在差异外,人和动物的溶菌酶在功能和作用机制上相同或相似。家蝇溶菌酶作为重要的非特异性防御功能因子,与人溶菌酶均属于C型溶菌酶[17],具有广阔的开发和利用前景。
已有研究表明,鱼类消化道所分泌的消化酶对溶菌酶制品活力的影响因鱼的种类和消化道部位的不同而不同[18]。为了进一步了解家蝇幼虫的龄期及生存环境对其分泌的溶菌酶活性的影响,笔者检测了不同培养基中饲养的2龄、3龄家蝇幼虫分泌物的溶菌酶含量,根据在一定浓度的混浊菌液中,由于溶菌酶能水解细菌细胞壁上肽聚糖,使细胞裂解,导致细菌浓度降低,透光度增强,根据透光度来推算溶菌酶的含量[19]。该试验结果表明,各组3龄幼虫分泌物中溶菌酶的含量均高于2龄幼虫。据推测,可能是因为家蝇幼虫要经历1龄、2龄、3龄3个时期,一般情况下1龄和2龄均为家蝇幼虫的主要生长期,其体内主要以合成自身结构蛋白为主,分泌性蛋白的合成较少[20]。3龄幼虫属于生长的过渡时期,其体内积累了大量的分泌蛋白,就会产生更多的分泌性溶菌酶。3龄幼虫的体液免疫和细胞免疫功能逐渐趋于完善,能更好地抵御外界侵害,为进入蛹期做好充分的准备。溶菌酶作为家蝇幼虫分泌的广谱的抗菌效应分子,其分泌量在3龄会有所提高。因此,3龄家蝇幼虫是最佳的溶菌酶获取时期。大肠杆菌诱导组中溶菌酶含量显著高于正常对照组,鸡粪处理组和猪粪处理组中溶菌酶含量亦高于正常对照组,因为鸡粪与猪粪中含有大量的细菌、真菌和放线菌等病原菌,可推测经外界病原菌等不利因素诱导后蝇蛆可分泌更多的溶菌酶,并且猪粪和鸡粪等天然培养基的诱导效果较单纯大肠杆菌菌液好。
溶菌酶作为一种碱性蛋白,不同的环境条件(如温度、pH、储存时间)均会对其活性产生影响[20]。该研究结果表明,无论是否经大肠杆菌菌液诱导,家蝇溶菌酶含量的下降幅度随着储存温度的降低而均逐渐减缓,在-20 ℃储存温度下家蝇溶菌酶在70 d内仍可保持较高的含量。这说明低温有利于家蝇溶菌酶的储存。在4 ℃条件下,诱导对照组溶菌酶含量高于正常对照组,亦可推测出大肠杆菌菌液的诱导可提高家蝇溶菌酶含量。该试验结果可进一步揭示家蝇溶菌酶活性变化的规律,为其进一步开发和利用提供试验支持。
[1] 张振,王寿宇,刁云鹏,等.从中药五谷虫的应用看中药西用的策略[J].吉林医药学院学报,2010,31(2):90-91.
[2] 孙晓亚,刘虹霞,张国刚.蟾饲五谷虫及五谷虫的研究进展[J].沈阳药科大学学报,2011,28(7):581-584.
[3] GUO T K,ZHAO X,XIE X D,et al.The anti-proliferative effects of recombinant human lysozyme on human gastric cancer cells[J].J Int Med Res,2007,35(3):353-360.
[4] SHIMADA J,MOON S K,LEE H Y,et al.Lysozyme M deficiency leads to an increased susceptibility toStreptococcuspneumoniae-induced otitis media[J].BMC Infect Dis,2008,8(1):134.
[5] MASSCHALCK B,MICHIELS C W.Antimicrobial properties of lysozyme in relation to foodborne vegetative bacteria[J].Crit Rev Microbiol,2003,29(3):191-214.
[6] RAMANATHAN M,LUCKARIFT H R,SARSENOVA A,et al.Lysozyme-mediated formation of protein-silica nano-composites for biosensing applications[J].Colloids Surf Biointerfaces,2009,73(1):58-64.
[7] AI H,WANG F,ZHANG N,et al.Antiviral,immunomodulatory,and free radical scavenging activities of a protein-enriched fraction from the larvae of the housefly,Muscadomestica[J].J Insect Sci,2013,13(112):1-6.
[8] 赵瑞君,刘成芳,董建臻,等.家蝇抗菌肽的诱导提取及筛选[J].热带医学杂志,2005,5(2):193-194.
[9] 国果,吴建伟,付萍,等.家蝇幼虫分泌物抗菌肽的生化特性初步研究[J].昆虫学报,2006,49(6):918-923.
[10] 国果,吴建伟,付萍,等.家蝇幼虫分泌物抗菌肽的分离及其部分特性[J].中国寄生虫学与寄生虫病杂志,2007,25(2):87-92.
[11] 国果,吴建伟,付萍,等.家蝇幼虫分泌型抗菌肽分子鉴定[J].中国公共卫生,2010,26(10):1288-1289.
[12] CALLEWAERT L,MICHIELS C W.Lysozymes in the animal kingdom[J].Journal of bioscience,2010,35(1):127-160.
[13] 彭传林,魏川川,吴建伟,等.家蝇溶菌酶MDLZM 基因克隆、表达和序列分析[J].中国公共卫生,2015,31(6):764-766.
[14] LEMOS F J A,RIBEIRO A F,FERRA W R.A bacteria-digesting midgut-lysozyme fromMuscadometica(Diptera)Larvae.Purification,properties and secretary mechanism[J].Insect Biochem Mol Biol,1993,23(4):533-541.
[15] ZHUA F X,YAOA Y L,WANGB S J,et al.Housefly maggot-treated composting as sustainable option for pig manure management[J].Waste management.2015,35:62-67.
[16] ZHAO J M,QIU L H,NING X X,et al.Cloning and characterization of an invertebrate type lysozyme from Venerupis philippinarum[J].Comparative biochemistry and physiology Part B:Biochemistry and molecular biology,2010,156(1):56-60.
[17] 国果,吴建伟,付萍,等.家蝇幼虫分泌型抗菌肽对小鼠免疫功能影响[J].中国公共卫生,2012,28(5):570-573.
[18] BUONOCORE F,RANDELLI E,TRISOLINO P,et al.Molecular characterization,gene structure and antibacterial activity of a g-type lysozyme from the European sea bass(DicentrarchuslabraxL.)[J].Mol Immunol,2014,62(1):10-18.
[19] LIANG Y,WANG J X,ZHAO X F,et al.Molecular cloning and characterization of cecropin from the housefly(Muscadomestica),and its expression inEscherichiacoli[J].Dev Comp Immunol,2006,30(3):249-257.
[20] 邢思华,华雪铭,朱站英,等.渔用溶菌酶制品的稳定性研究[J].饲料工业,2014,35(22):20-23.
Effects of Different Culture Media and Storage Conditions on the Lysozyme Content in the Secretions of Housefly Larvae
WANG Jian-yu1, GUO Guo2*,YANG Wei-jin2et al
(1. Excellent Doctors Class in Grade 2012 in Guizhou Medical University, Guiyang, Guizhou 550004; 2. School of Basic Medical Sciences, Guizhou Medical University, Guiyang, Guizhou 550004)
[Objective] To study the effects of different culture media and storage conditions on lysozyme content in the secretions of housefly larvae. [Method] Swine manure and chicken manure were used as the culture media to feed housefly larvae. The housefly larvae in control group were fed with wheat bran and that in induced group were fed with wheat bran with addingEscherichiacoli. The secretions of 2-instar and 3-instar housefly larvae in each group were extracted to determine lysozyme content in the secretions by using reagent kits. The secretions in 3-instar larvae in control group and induced group were extracted to analyze the changes of lysozyme content at room temperature, 4 ℃ and -20 ℃ respectively. [Result] The average lysozyme content in the secretions of 3-instar larvae in swine manure group,chicken manure group,control group and induced group were 2.462,2.782,1.019 and 2.117 μg/mL respectively, significantly higher than that in 2-instar larvae(P<0.05). The lysozyme content in the secretions of 2-instar larvae and 3-instar larvae in swine manure group,chicken manure group and induced group were higher than that in control group(P<0.05).At room temperature, lysozyme activity in control group and induced group could be maintained for about 14 days. At -20 ℃, lysozyme activity could be maintained for about 70 days. At 4 ℃,the maintenance time of lysozyme activity in control group and induced group were in between room temperature and -20 ℃, and lysozyme content in these two groups had some differences at different time. [Conclusion] The lysozyme content in the in the secretions of 3-instar larvae is higher than that in 2-instar larvae. Swine manure culture medium and chicken manure culture medium can significantly increase the lysozyme content in the secretions of 2-instar larvae and 3-instar larvae. And higher lysozyme activity in housefly larvae can be maintained at -20 ℃.
Housefly; Lysozyme; Swine manure; Chicken manure
国家自然科学基金项目(81160204);高校博士点学科专项科研基金项目(20105215120001);国家级大学生创新训练项目(201310660016)。
王建宇(1993- ),男,山东德州人,本科生,专业:临床医学。*通讯作者,副教授,博士,从事医学昆虫方面的研究。
2016-09-12
S 476.3
A
0517-6611(2016)31-0005-03

