蛋鸡感染新城疫病毒后输卵管组织中病毒分布与炎症相关细胞因子mRNA的表达
耿海婷,王晶钰,唐超超,黎瑞巧
(西北农林科技大学动物医学院,陕西杨凌 712100)
蛋鸡感染新城疫病毒后输卵管组织中病毒分布与炎症相关细胞因子mRNA的表达
耿海婷,王晶钰*,唐超超,黎瑞巧
(西北农林科技大学动物医学院,陕西杨凌 712100)
通过间接免疫荧光(IFC)和实时荧光定量PCR(real-time PCR)方法研究了蛋鸡感染新城疫病毒(NDV)后输卵管组织中病毒分布及炎症相关细胞因子mRNA的表达变化。结果表明,NDV可在输卵管组织中复制,证明感染成功,NDV感染引起蛋鸡输卵管膨大部和子宫部IL-2、IL-6、IL-1β、IFN-β、CXCLi1、CXCLi2及CCR5 mRNA mRNA表达上调;在感染120 h后,膨大部IL-2、IFN-β和IL-1β mRNA表达达到峰值,分别为健康对照组的137倍、95.1倍和15.9倍;子宫部在感染第9天达到峰值,分别为36.2倍、59.9倍和10.3倍。在感染前3 d,IFN-α mRNA在膨大部的表达为下调的趋势,而从感染第5天开始上调;而子宫部IFN-α的mRNA表达均上调。NDV感染后趋化因子CXCLi1、CXCLi2及 CCR5 mRNA的在膨大部和子宫部表达均上调,其中膨大部CXCLi1、CXCLi2和CCR5 mRNA上调的最高值分别为20.5倍、78.3倍和22.1倍;其在子宫部分别上调5.5倍、64.3倍、25.5倍。总的来说, NDV能感染蛋鸡输卵管组织并引起IL-2、IL-6、IL-1β、IFN-β、CXCLi1、CXCLi2及CCR5mRNA表达上调,这些细胞因子mRNA表达的上调可能与输卵管炎症的发生有关。
新城疫病毒;输卵管;细胞因子;趋化因子;炎症
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的一种急性、高度接触传染性疾病,给我国养禽业造成了巨大损失[1]。新城疫病毒感染蛋鸡不仅可引起呼吸道出现急性症状,也可引起蛋鸡输卵管充血、出血,出现炎症病理变化,导致输卵管机能障碍,产蛋率下降40%~60%,产软壳蛋、沙壳蛋的的几率增加[2]。1950年疫苗免疫已经被用于对新城疫的防控,但是该疾病仍然在国内一些地区流行。Ⅶ型NDV是目前在亚洲流行的主要基因型,对家禽业造成了巨大的威胁[3]。关于Ⅶ型NDV病原学特点的研究很多,但是Ⅶ型NDV感染蛋鸡后输卵管各部位细胞因子及趋化因子基因的表达研究很少。因此,本研究用Ⅶ型NDV感染非免疫产蛋母鸡,研究了NDV在蛋鸡输卵管组织中的分布规律,检测与炎症相关的白细胞介素-2(IL-2)、IL-6、IL-1β,干扰素-α(IFN-α)、IFN-β和趋化因子CXCLi1、CXCLi2,趋化因子受体 CCR5 mRNA在输卵管膨大部和子宫部的表达,为揭示基因Ⅶ型NDV感染蛋鸡后导致输卵管功能障碍提供理论依据。
1 材料与方法
1.1 材料
1.1.1 病毒株 基因Ⅶ型NDV(NDV/Chicken/TC/1/2011)毒株,由西北农林科技大学动物医学院预防兽医系鉴定保存。
1.1.2 试验用鸡 40周龄非免疫产蛋高峰期罗曼白壳蛋鸡(新城疫HI抗体≤2 log2),购自杨凌绿方生物工程有限公司。
1.1.3 SPF鸡胚 10日龄SPF鸡胚购自杨凌绿方生物工程有限公司。
1.1.4 主要试剂 抗荧光淬灭封片剂为碧云天生物技术研究所产品;Hoechst 33342 染液为北京索莱宝科技有限公司产品;鼠抗NDV HN蛋白单克隆抗体和FITC标记的羊抗鼠IgG荧光二抗为美国Santa Cruz公司产品; RNA提取和cDNA合成试剂盒、SYBR green荧光定量mix为北京全式金公司产品。
1.2 方法
1.2.1 基因Ⅶ型NDV增殖及EID50测定 复苏在-80 ℃保存的新城疫病毒,进行1 000倍稀释。接种0.1 mL稀释的病毒液于10日龄SPF鸡胚尿囊腔中,37℃温箱孵育,72 h后无菌收集尿囊液。血凝试验(HA)测定尿囊液血凝价为27~8,置-80 ℃保存备用。
10倍梯度稀释NDV尿囊液,取10-5~10-10稀释度,将每个稀释度的尿囊液接种5枚10日龄SPF鸡胚,每枚鸡胚接种0.1 mL,37 ℃温箱中孵育72 h 后,收集尿囊液,HA试验检测其血凝性,若出现血凝现象则按照Reed-Muench计算NDV的EID50。
1.2.2 攻毒试验 将40只40周龄非免疫产蛋高峰期罗曼白壳蛋鸡随机分为8组,每组5只。第1组为健康对照组,第2组至第8组分别经点眼和滴鼻接种NDV,0.5 mL/只,为攻毒试验组。于感染前处死第1组,其余7组分别在感染后第1、3、5、7、9、11、15天颈部放血处死,分离并采集输卵管并立即将输卵管不同部位,一部分保存于40 mL/L多聚甲醛溶液中固定,用于免疫荧光试验,另一部分立即放入液氮保存,用于荧光定量PCR检测。
1.2.3 间接免疫荧光(IFC)检测NDV在输卵管组织中的分布
1.2.3.1 石蜡切片制作 参照陈占莉等[4]的方法将健康蛋鸡及感染蛋鸡输卵管5个部位组织进行石蜡包埋及切片。
1.2.3.2 新城疫病毒HN蛋白间接免疫荧光检测 将组织切片于55℃烘箱中烘片30 min,二甲苯Ⅰ脱蜡5 min,二甲苯Ⅱ脱蜡5 min,二甲苯、乙醇混合液(1∶1)5 min。之后在无水乙醇Ⅰ、无水乙醇Ⅱ; 950、90、80、70 mL/L乙醇依次复水2 min;自来水冲洗5次,蒸馏水2 min。随后用1×PBS轻轻润洗切片3次,每次5 min,每个样本上滴加100 μL 5 mL/L胎牛血清封闭液,37 ℃反应30 min。弃去封闭液,切片润洗15 min,之后每个样本上滴加100 μL鼠抗HN蛋白单克隆抗体(PBS 1∶400稀释),4℃孵育1 h。一抗孵育过夜后,用1×PBS 润洗切片3次,每次5 min。之后,每个样本滴加100 μL羊抗鼠FITC IgG二抗,37℃避光孵育1 h。反应后的样本片浸入1×PBS 避光润洗15 min;用Hoechst 33342染色液复染细胞核,室温避光反应5 min;封片后激光共聚焦显微镜检测,使用NIS-Elements高清晰度彩色图文分析系统照相,记录观察结果。判断标准:细胞核为蓝色,HN蛋白阳性染色为绿色。
1.2.4 Real-time PCR检测NDV感染蛋鸡后输卵管主要细胞因子mRNA的表达
1.2.4.1 引物的设计与合成 根据GenBank中公布的鸡IL-2、IL-8、IL-1β、IFN-α、IFN-β、CXCLi1、CXCLi2、CCR5、β-actin基因序列,用Primer premiere 5.0 软件设计引物,采用Primer blast工具进行检索来验证其特异性,引物序列见表1。
1.2.4.2 RNA的提取和cDNA的合成 RNA的提取和cDNA的合成根据北京全式金生物技术有限公司Trizol总RNA提取试剂盒说明说书和cDNA合成试剂盒说明书。
1.2.4.3 Real-time PCR 用核酸测定仪测定cDNA浓度。将膨大部和子宫部cDNA稀释成相同的浓度,作为real-time PCR检测的模板。最佳反应体系为20 μL:cDNA 2 μL,SYBR Green Reaction Mix 10 μL,dd H2O 7 μL,上、下游引物(10 pmol/L)各0.5 μL;real-time PCR程序:95℃ 5 min;94℃ 15 s,55℃ 20 s,72℃ 20 s,40个循环,设定收集荧光。
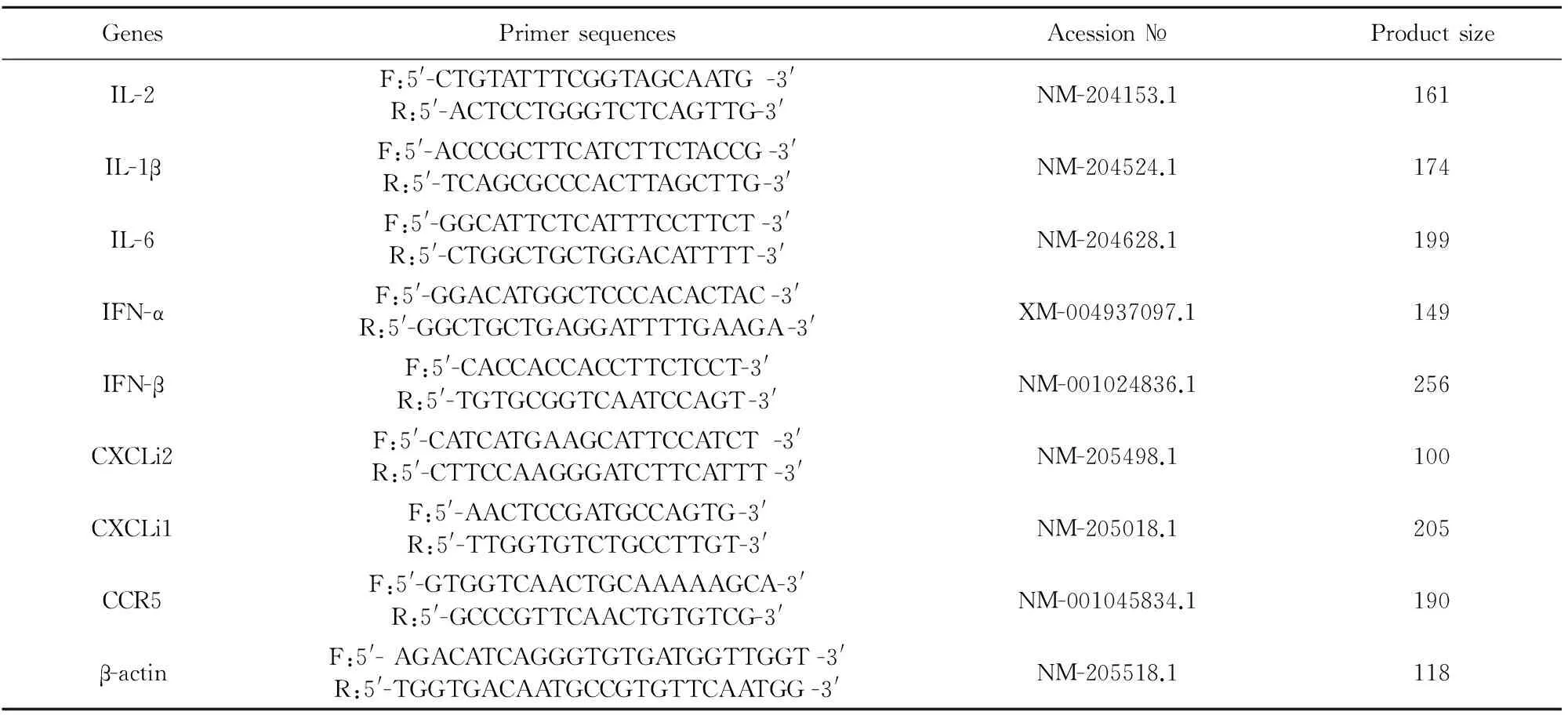
表1 Real-time引物表
2 结果
2.1 蛋鸡感染NDV临床症状观察
在人工感染后第2天可见蛋鸡出现轻微的临床症状,嗜睡、羽毛蓬松、精神沉郁。感染第3天,感染蛋鸡表现出典型的新城疫临床症状,如呼吸困难,嗜睡,采食和饮水减少;拉黄绿色稀粪,产软壳蛋。在感染第5~第10天,多数鸡死亡。在感染第15天,有的蛋鸡恢复了健康。剖检发现感染蛋鸡腺胃出血,气管出血,大脑水肿,卵泡溶解,输卵管水肿。健康对照组未出现临床症状和病理变化。
2.2 新城疫病毒在输卵管的分布情况
采用间接免疫荧光染色观察新城疫病毒感染蛋鸡后第5天病毒在输卵管不同部位的分布结果见图1。图1A为健康组织中未观察到绿色荧光,健康对照成立。图1B为感染鸡的输卵管组织,可观察到病毒主要存在于伞部、膨大部、峡部黏膜固有层腺上皮细胞,零散分布在黏膜下层细胞;在子宫部,病毒主要存在于黏膜下层细胞,而零散的分布于固有层细胞;而病毒主要存在于阴道部黏膜上皮细胞。
2.3 炎症相关细胞因子mRNA的表达变化
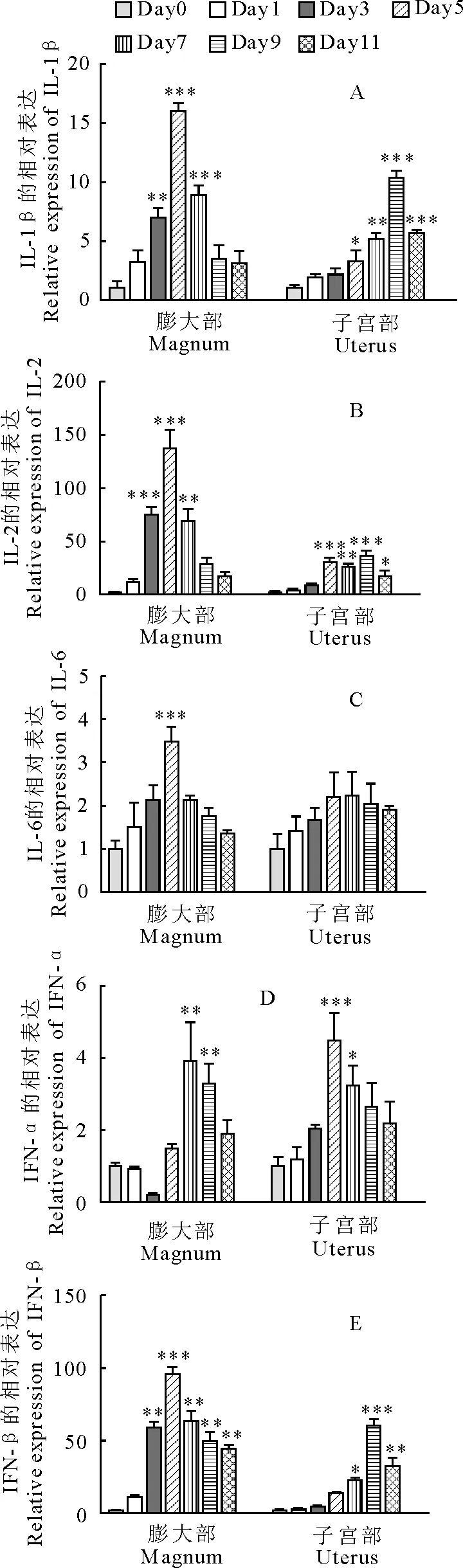
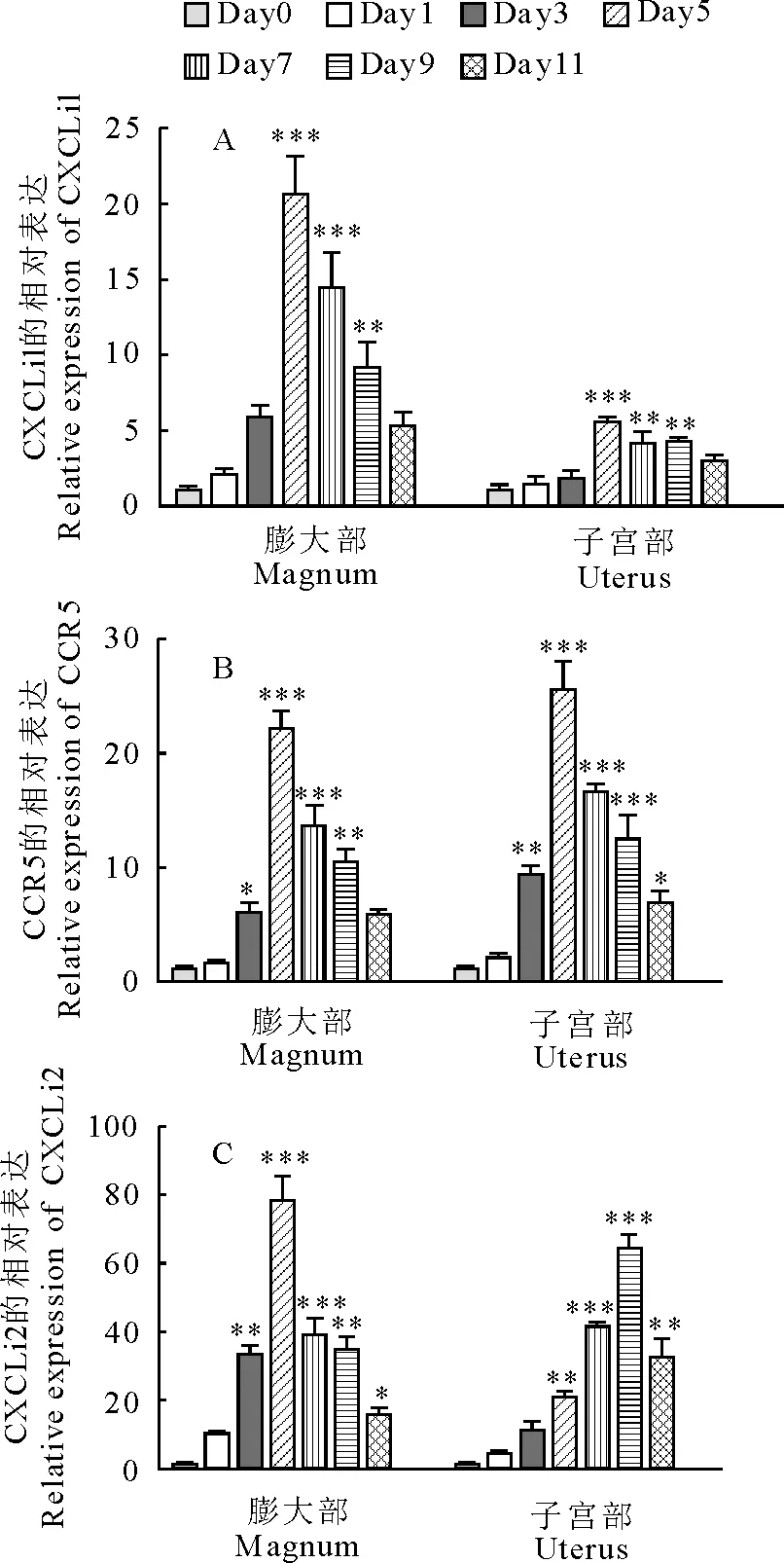
NDV感染蛋鸡后输卵管膨大部和子宫部细胞因子mRNA的表达呈现不同的趋势。膨大部IL-2、IL-6、IL-1β、IFN-β在感染过程中都呈现出不同程度的上调,且在感染第5天达到峰值,分别为137倍、3.5倍、15.9倍和95.1倍(图2),子宫部IL-2、IL-1β、IFN-β在感染第9天达到峰值,分别为36.3倍、10.3倍和59.9倍(图2)。引人注意的是,膨大部IFN-α mRNA在感染初期下调随后上调,而子宫部IFN-α mRNA表达均为上调。趋化因子CXCLi1、CXCLi2和趋化因子受体CCR5 mRNA的表达在整个感染过程中均上调。感染第5天,CXCLi1在膨大部和子宫部都达到峰值,分别为20.5倍和5.5倍; 膨大部CXCLi2和CCR5在感染第5天达到最大值,分别为78.3倍和22.1倍,子宫部CXCLi2和CCR5分别在第9天和第5天达到了最高值,分别为64.3倍和25.5倍(图3)。
3 讨论
本试验用间接免疫荧光方法对输卵管5个部位进行病毒染色。结果病毒在伞部、膨大部、峡部主要存在于固有层腺上皮细胞,零星的分布于黏膜下层细胞;在子宫部,病毒主要存在于黏膜下层细胞,零星分布于固有层细胞;在阴道部病毒主要分布于黏膜上皮细胞。研究表明NDV HN蛋白是病毒进入宿主细胞的关键蛋白,它能识别并结合细胞表面表达的唾液酸受体[5-7],病毒在5个部位的分布差异可能反应出不同部位的黏膜上皮或固有层腺上皮细胞表达唾液酸受体的量存在差异。病毒感染可能导致输卵管不同部位产生不同的病理变化,从而降低输卵管腺体细胞的分泌功能,继而影响产蛋质量和蛋品质下降。

A.健康对照鸡的输卵管5个部位染色;B.病毒感染后输卵管5个部位染色;蓝色荧光为细胞核,绿色荧光为阳性的HN蛋白染色
"*"P<0.05,"**"P<0.01,"***"P<0.001
图2 NDV感染后IL-1β、IL-2、IL-6、IFN-α和IFN-β mRNA在膨大部和子宫部不同时间的表达变化
Fig.2 IL-1β,IL-2,IL-6,IFN-α,IFN-β mRNA expressions in oviducts of hens infected with NDV at different time
"*"P<0.05,"**"P<0.01,"***"P<0.001.
图3 NDV感染后CXCLi1、CXCLi2和CCR5 mRNA在膨大部和子宫部不同时间的表达变化
Fig.3 CXCLi1,CXCLi2,CCR5 mRNA expressions in oviducts of hens infected with NDV at different time
由于膨大部和子宫部为鸡蛋形成的重要部位,本试验特地检测了NDV感染诱导蛋鸡的膨大部和子宫部细胞因子IL-2、IL-6、IL-1β、IFN-α、IFN-β和趋化因子CXCLi1、CXCLi2、CCR5 mRNA的表达变化。膨大部和子宫部细胞因子及趋化因子基因表达的增加可能与临床症状和输卵管局部炎症有关[8-9]。除IFN-α外,输卵管膨大部细胞因子及趋化因子mRNA的上调倍数几乎都高于子宫部,且膨大部基因表达几乎都在第5天达到最高值,而子宫部多在第九天达到峰值。膨大部和子宫部相关细胞因子和趋化因子基因表达变化的差异反应出膨大部对NDV感染的免疫应答更为敏感。病毒对膨大部固有层腺上皮细胞的感染可能促进了局部细胞因子和趋化因子的表达及分泌,从而加速对局部淋巴细胞的招募以及病毒的清除。
值得注意的是膨大部IFN-α在感染早期呈现明显的下调趋势,抑制IFN-α的基因表达可能是病毒促进自身快速复制的机制,也是病毒与宿主细胞相互作用的结果[10]。鸡的趋化因子CXCLi1 和 CXCLi2主要趋化单核细胞[11]。本研究中,趋化因子CXCLi1、CXCLi2和趋化因子受体都呈现出上调的趋势,可能是感染基因Ⅶ型NDV后,蛋鸡输卵管黏膜上皮或是腺上皮细胞产生的趋化因子基因表达上调,趋化因子的分泌增多,继而使带有CCR5受体的淋巴细胞从血液当中移行到感染部位,参与炎症反应。
[1] 杨亮珍.浅谈非典型鸡新城疫的危害及防治[J].中国畜牧兽医文摘,2014,30(10):151-157.
[2] 王 雷,寇兵涛,牛松普.一例蛋鸡新城疫的症状与诊治[J].现代畜牧科技,2015,2(2):41.
[3] 孟良玉,王志亮,魏 荣.一株基因 Ⅶ 型新城疫病毒的分离与鉴定[J].动物医学进展,2003,24(2):97-99.
[4] 陈占莉,曹晓蕾,唐 超.蛋鸡感染H9N2 AIV后输卵管不同部位病毒的分布及病理组织学观察[J].动物医学进展,2014,35(11):56-61.
[5] Shunlin H,Huailiang M,Yantao W,et al.A vaccine candidate of attenuated genotype Ⅶ Newcastle disease virus generated by reverse genetics[J].Vaccine,2009,27(6):904-910.
[6] Sun C,Wen H,Chen Y,et al.Roles of the highly conserved amino acids in the globular head and stalk region of the Newcastle disease virus HN protein in the membrane fusion process[J].Biosci Trends,2015,9(1):56-64.
[7] Tan W S,Lau C H,Ng B K,et al.Nucleotide sequence of the haemagglutinin-neuraminidase(HN) gene of a Malaysian heat resistant viscerotropic-velogenic Newcastle disease virus (NDV) strain AF2240[J].DNA Seq,1995,6(1):47-50.
[8] Sergel T,McGinnes L W,Morrison T G.The fusion promotion activity of the NDV HN protein does not correlate with neuraminidase activity[J].Virology,1993,196(2):831-834.
[9] Annamalai T,Selvaraj R K.Chicken chemokine receptors in T cells isolated from lymphoid organs and in splenocytes cultured with concanavalin A[J].Poult Sci,2010,89(11):2419-25.
[10] Hughes S,Poh T Y,Bumstead N.Re-evaluation of the chicken MIP family of chemokines and their receptors suggests that CCL5 is the prototypic MIP family chemokine,and that different species have developed different repertoires of both the CC chemokines and their receptors[J].Dev Comp Immunol,2007,31(1):72-86.
[11] Wang Z,Ning Z,Sun M,et al.Interferon regulatory factor 7- (IRF7-) mediated immune response affects Newcastle disease virus replication in chicken embryo fibroblasts[J].Acta Vet Hung,2014,62(4):500-11.
[12] Li S,Zhang M Z,Yan L,et al.Induction of CXC chemokine messenger-RNA expression in chicken oviduct epithelial cells by Salmonella enterica serovar enteritidis via the type three secretion system-1[J].Avian Dis,2009,53(3):396-404.
Virus Distributions and Related Cytokine mRNA Expressions in Oviducts of Layers Infected with Newcastle Disease Virus
GENG Hai-ting,WANG Jing-yu,TANG Chao-chao,LI Rui-qiao
(CollegeofVeterinatyMedicine,NorthwestA&FUniversity,Yangling,Shaanxi,712100,China)
To investigate the main cytokine mRNA expression changes in oviducts of layers infected with NDV,real-time PCR was used to detect the mRNA expression changes of IL-2,IL-6,IL-1β,IFN-β,CXCLi1,CXCLi2 and CCR5 in magnum and uterus.The results showed that the cytokine and chemokine mRNA expressions of IL-2,IL-6,IL-1β,IFN-β,CXCLi1,CXCLi2 and CCR5 mRNA were up-regulated in magnum and uterus after NDV infection.At the fifth day post infection(dpi),the mRNA expressions of IL-2,IFN-β,IL-1β reached peak,the changes were 137-fold,15.9-fold and 95.1-fold respectively compared with healthy controls; while the mRNA expression changes of IL-2,IFN-β,IL-1β peaked at 9 dpi in uterus,respectively 36.2-fold,59.9-fold and 10.3-fold.IFN-αmRNA expressions in magnum were down-regulated during the three days post infection,while at 5dpi,it began to up regulate.In uterus,IFN-α mRNA expression was always up-regulated during infection process.CXCLi1,CXCLi2 and CCR5 mRNA were up-regulated in magnum and uterus after NDV infection,CXCLi1, CXCLi2,CCR5 mRNA were up-regulated in magnum,the peak values were 20.5-fold,78.3-fold and 22.1-fold,respectively.In general,oviuctal tissues can be infected with NDV,and IL-2,IL-6,IL-1β,IFN-β,CXCLi1,CXCLi2 and CCR5 mRNA expressions were induced by NDV infection.The induction of mRNA expressions of the cytokines and chemokines may be associated with the inflammation occurred in oviduct tissues after NDV infection.
Newcastle disease virus;oviduct;cytokine;chemokine; inflammation
2016-04-06
耿海婷(1989年—),女,陕西咸阳人,兽医硕士,主要从事兽用生物制品的研发。*通讯作者
S852.659.5
A
1007-5038(2016)11-0043-05

