四川红原县牦牛隐孢子虫感染情况分子流行病学调查
郝力力,李 锐,段 玲,贺 亮
(1.西南民族大学 生命科学与技术学院,四川 成都 610041; 2.浙江省农业科学院 农产品质量标准研究所,浙江 杭州310021; 3.国家上海新药安全评价研究中心,上海201203)
四川红原县牦牛隐孢子虫感染情况分子流行病学调查
郝力力1,李 锐2,段 玲1,贺 亮3,*
(1.西南民族大学 生命科学与技术学院,四川 成都 610041; 2.浙江省农业科学院 农产品质量标准研究所,浙江 杭州310021; 3.国家上海新药安全评价研究中心,上海201203)
为调查红原地区牦牛隐孢子虫感染情况,采用巢式PCR对采自红原县的216头份牦牛粪便进行了检测(其中包括腹泻粪便样本18份)。该地区牦牛隐孢子虫总感染率为14.8%,其中Cryptosporidiumbovis感染率为3.7%,C.ryanae感染率为5.1%,C.andersoni感染率为6.0%,而腹泻样本并未检出隐孢子虫。以上结果表明,牦牛是隐孢子虫的天然宿主,但该实验中未见隐孢子虫和牦牛腹泻间存在明显相关性,隐孢子虫和牦牛腹泻之间的关系需要后续研究来进一步阐明。
牦牛;隐孢子虫;腹泻
隐孢子虫是一种能引起人和动物腹泻的重要机会性原虫,由其引起的隐孢子虫病是一种人兽共患病。它具有广泛的宿主类型,可以寄生于哺乳类、鸟类、爬行类及两栖类等240多种动物(包括人),并且可通过水源、食物、空气等多种途径传播[1]。隐孢子虫主要感染幼儿、幼畜以及免疫缺陷的人畜,免疫系统发育正常的人和动物也能感染,隐孢子虫病已被列为人类最常见的6种腹泻疾病之一[2],具有重要的公共卫生意义。
我国是世界拥有牦牛数量最多的国家,约有1400多万头,占世界牦牛总数的95%以上。四川省是牦牛大省,近年来发现红原地区牦牛春夏之际经常发生季节性腹泻,并常伴有血便,不仅大大降低了牦牛的生产性能,严重时还会导致病畜死亡,给牧民造成较大的经济损失。因此,本课题拟对红原地区牦牛进行隐孢子虫分子流行病学调查,以确定该地区流行的隐孢子虫种类,为红原地区牦牛隐孢子虫病的防控和畜牧业的健康发展奠定前期基础。
1 材料与方法
1.1 材料
1.1.1 主要仪器设备和试剂
粪便DNA提取试剂盒(QIAamp DNA Stool Kit),台式高速离心机(eppendorf 5402型),Bio-Rad伯乐梯度PCR仪(PTC240型),水平电泳仪(BG-subMIDI型,北京百晶公司),2×EasyTaqPCR SuperMix(北京全式金公司)和2.5%重铬酸钾溶液(自制)。
1.1.2 粪便样本的采集
采集新鲜牦牛粪便30~40g,立即放于80mL离心管中,加体积1.5倍的无菌蒸馏水配制的2.5%重铬酸钾溶液4℃保存。样本总量为216头份,其中腹泻粪便样本18份。
1.2 方法
1.2.1 改良抗酸染色
将粪样混合均匀,从中取5~10g置小烧杯中,加少量无菌蒸馏水浸泡30min,然后捣碎粪便成泥状,再加适量水充分搅匀,铜筛过滤。滤液置离心管中以1006g离心10min,弃去上清液。取浓集粪样涂片,按照Lindsay等[1]报道的方法进行染色,于1000倍镜下观察拍照。
1.2.2 饱和蔗糖溶液漂浮法富集隐孢子虫卵囊
取粪样10g加20倍量的无菌蒸馏水搅拌均匀,先后用80目和130目金属筛过滤,滤液置于离心管中以1006g离心10min,弃上清,再加入50mL饱和蔗糖溶液,用玻璃棒搅拌均匀,再以1006g离心10min,用自制的铁丝网吊环蘸取表层液,然后在装有约100mL自来水的烧杯中涮洗,将表层富集的卵囊全部收至烧杯中制成卵囊混悬液,再将卵囊混悬液倒入离心管中以1006g离心10min,弃上清,沉淀用于DNA的提取。
1.2.3 粪便总DNA和富集后卵囊DNA的提取
取混匀后的粪便2g,采用QIAamp DNA Stool Kit大样本量提取方法提取粪便总DNA;富集后的卵囊按照 QIAamp DNA Stool Mini Kit 说明书进行操作,取200mg沉淀进行提取,提取后电泳检测提取质量。
1.2.4 PCR检测
先采用彭昊等[2]建立的牛隐孢子虫的快速检测方法,以2g粪便中提取的总DNA为模板进行PCR鉴定,靶基因为ITS-1,片段大小为263bp。PCR阳性的样本采用饱和蔗糖溶液漂浮法富集卵囊后进行抗酸染色,观察是否有卵囊,染色阳性则提取富集后含有卵囊的沉淀物总DNA,采用Xiao等[3]方法,根据隐孢子虫18S rRNA序列合成2对引物进行巢式PCR,目的片段长度大小为570bp左右。PCR反应结束后取2μL反应液进行电泳,出现目的条带的样本TA克隆后双向测序。
1.2.5 进化树分析
核苷酸序列应用Clustal X 1.81进行比对,分子进化树用MEGA 7构建。
2 结果与分析
2.1 ITS-1PCR检测结果
采用彭昊等[2]建立的PCR方法进行检测,216头粪便样本共检出32头阳性,如图1所示,在250~500bp间出现目的条带,目的条带为263bp。总感染率为14.8%,18份腹泻样本均未检出。
2.2 改良抗酸染色结果
经过饱和蔗糖溶液漂浮的卵囊直接在显微镜下观察均呈现淡玫瑰红色(图2-A,B),卵囊外围环绕有淡绿色的光圈,卵囊形状为卵圆形。改良抗酸染色后的隐孢子虫卵囊为卵圆形,卵囊呈深玫瑰红色(图2-C,D),残体背景为鲜艳蓝绿色,卵囊对比分明,32头ITS-1PCR阳性样本染色后观测均为阳性。
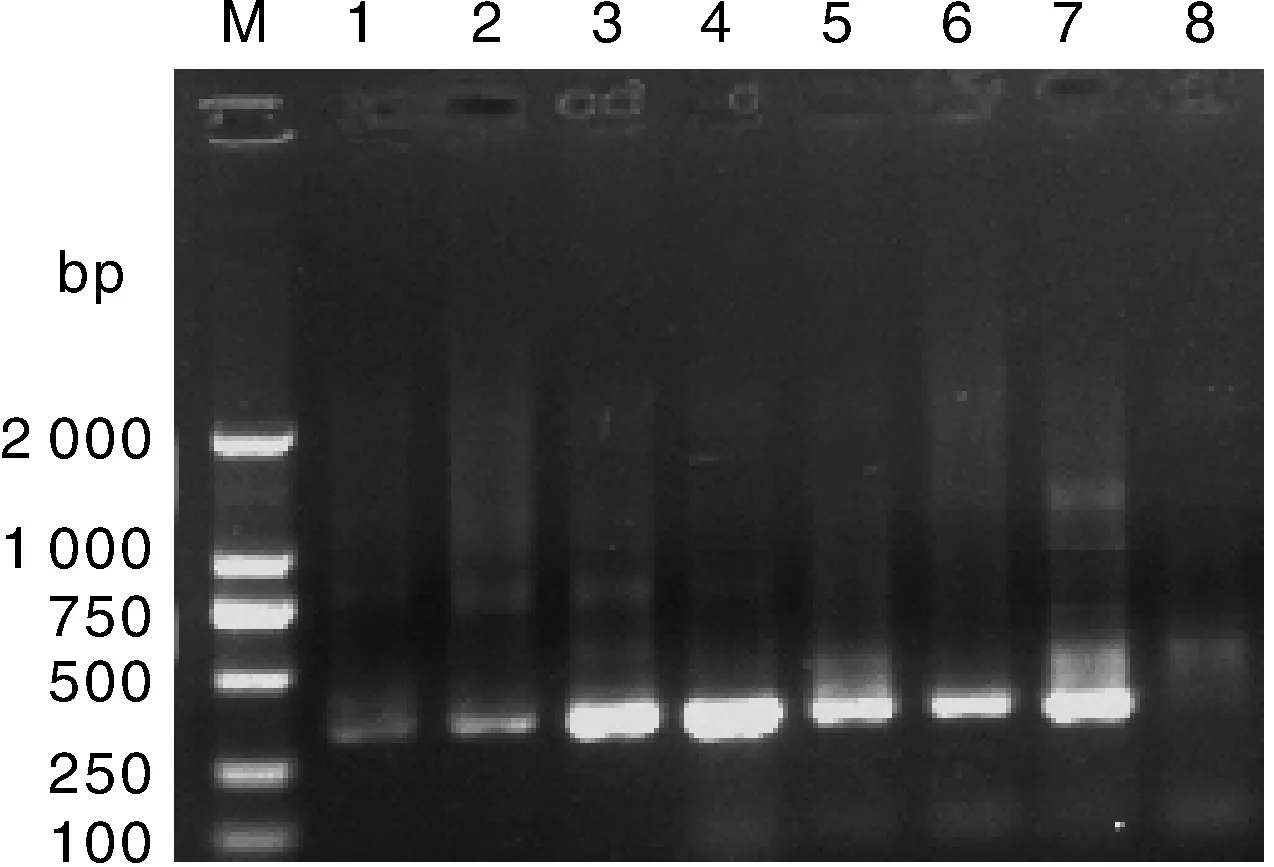
M,DL 2000marker;1—6,粪便样本;7,阳性对照;8,阴性对照M,DL 2000marker; 1-6,Fecal sample; 7,Positive control; 8,Negative control

图2 饱和蔗糖法分离出的卵囊和改良抗酸法染色后的卵囊Fig.2 Cryptosporidium oocyst under the Shether’s sugar flotation technique and the modified acid-fast stain method
2.3 18s rRNA PCR检测结果
采用Xiao等[3]建立的方法对染色阳性样本进行检测,均扩增出目的条带,目的条带为570bp左右,如图3所示,最右侧为阴性对照。条带回收后进行TA克隆,对应的每个回收产物挑选3个菌落双向测序。
2.4 进化树分析
将32个18s rRNA PCR阳性样本测序后,最终得到3个克隆,采用NCBI blast在线比对后,分别和牛隐孢子虫(C.bovis)、瑞氏隐孢子虫(C.ryanae)和安氏隐孢子虫(C.andersoni)的同源性较高,均为100%。32个阳性样本中分别对应牛隐孢子虫阳性样本8个,瑞氏隐孢子虫阳性样本11个,安氏隐孢子虫阳性样本13个,对应216份粪便样本的感染率分别为3.7%、5.1%和6.0%。将3个分离株(C.ryanaeHongyuan;C.bovisHongyuan ;C.andersoniHongyuan) 的测定序列和 GenBank 参考序列(C.parvumAJ493076;C.ryanaeJN40088;C.andersoniJN400881;C.bovisKM873713;C.ubiquitumKT027447;C.suisKJ790244)进行种系发育关系分析,构建进化树,如图4所示,3个分离株均和对应的隐孢子虫种位于同一分支。实验中也尝试了对PCR产物进行直接测序,出现双峰现象,如图5-A所示。
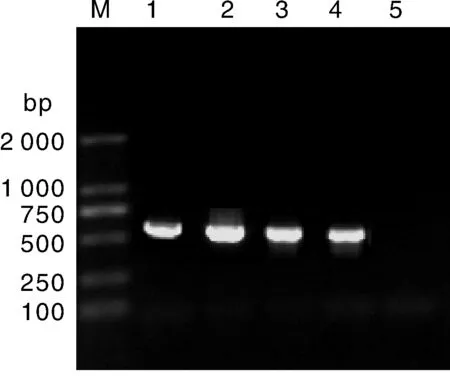
M,DL 2000marker;1—3,粪便样本;4,阳性对照;5,阴性对照M,DL 2000marker; 1-3,Fecal sample; 4,Positive control; 5,Negative control

图4 三个分离株在基于18S rRNA 基因构建的隐孢子虫进化树上的分布Fig.4 Distribution of 3Cryptosporidium spp.isolates in the phylogenetic tree of Cryptosporidium based on 18S rRNA gene
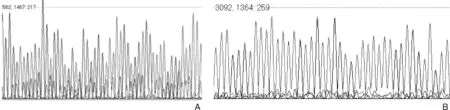
图5 PCR产物直接测序时出现的双峰现象(A)及正常的单峰(B)Fig.5 Sequencing results of PCR products with two peaks(A) and single peak(B)
3 讨论
隐孢子虫的检测多以18s rRNA基因为目的基因,通过巢氏PCR扩增目的片段[4-5]。和常规PCR相比,巢式PCR敏感性是常规PCR方法的40倍以上[6],在本实验中,以ITS-1为靶基因,先对粪便样本进行初步检测,由于产物序列较短,只有263bp,PCR扩增效率较高,适合对粪便样本进行隐孢子虫的快速初筛。初筛后采取饱和蔗糖漂浮法富集虫体,提取DNA,再对18s rRNA 进行PCR鉴定,条带较亮(图3)。曾尝试直接提取粪便总DNA后进行18s rRNA PCR扩增,有些目的条带十分微弱。这一现象说明采用饱和蔗糖法富集虫卵后,一方面提取的沉淀总DNA中虫卵DNA含量较多,另一方面除去了大部分杂质,提取的总DNA中PCR反应抑制物相对减少,这样无疑提高了PCR反应效率,也同时提高了检出率。除此之外,本实验中部分样本PCR产物直接测序时结果为杂合双峰(图5),无法读出序列,但是PCR产物电泳条带特异,无杂带,这一现象提示可能存在混合感染,也就是说,PCR产物可能是至少2个种的隐孢子虫18s rRNA基因扩增产物的混合物。针对此现象,曾尝试多次TA克隆后进行测序,但只能得到同一个克隆。
隐孢子虫已被列为人类最常见的6种腹泻疾病病原之一,红原地区春夏之际牦牛经常腹泻,严重时甚至产生血便。何美琳等[7]采用酶联免疫吸附试验(ELISA)对来源于川西北阿坝州8县的1070份牦牛血清中牛病毒性腹泻病毒(bovineviraldiarrheavirus,BVDV)、牛冠状病毒(bovinecoronavirus,BCV)和牛轮状病毒(bovinerotavirus,BRV)进行抗体检测。结果显示,BVDV、BCV和BRV抗体平均阳性率分别为44.3%、84.1%和94.4%,表明牦牛普遍感染导致腹泻的病毒。通过检索PubMed发现,报道牦牛感染隐孢子虫的文章只有5篇[8-12],这5篇报道中隐孢子虫感染率分别为24.2%、30.0%、5.26%、4.0%和28.5%,总共检出了C.andersoni,C.ryanaecattletype,C.ryanaebuffalotype,C.suis-like,C.ubiquitum,C.xiaoi和一个新基因型,并且存在混合感染的情况,但检测的粪便样本中都没有腹泻样本。
而在本研究中,隐孢子虫总感染率为14.6%,216头粪便样本中有18份为腹泻样本,但是均未检出隐孢子虫,原因可能是由于在高原地区采集样本的时间限制,无法在短时期内收集到较多的腹泻样本,而较少的样本量则无法说明腹泻牦牛隐孢子虫的实际感染状况。
综上所述,本研究一方面初步明确了红原地区牦牛是隐孢子虫的天然宿主,检出了瑞氏隐孢子虫、牛隐孢子虫和安氏隐孢子虫3个虫种;另一方面由于采集到的腹泻粪便样本数量较少并且未检出隐孢子虫,因此并不能说明隐孢子虫和牦牛腹泻间存在明显相关性,留待收集较多的腹泻样本后再做进一步研究。
[1] LINDSAY D S,UPTON S J,OWENS D S,et al.Cryptosporidiumandersoni,n.sp.(Apicomplexa: Cryptosporiidae) from cattle,Bostaurus[J].JournalofEukaryoticMicrobiology,2000,47(1): 91-95.
[2] 彭昊,李军,陶立,等.安氏隐孢子虫ITS-1基因PCR检测方法的建立[J].南方农业学报,2012,43(5):701-704.
PENG H,LI J,TAO L,et al.Establishment of PCR assay for detection of ITS-1gene inCryptosporidiumandersoni[J].JournalofSouthernAgriculture,2012,43(5):701-704.(in Chinese with English abstract)
[3] XIAO L H,FAYER R,RYAN U,et al.Cryptosporidium taxonomy: recent advances and implications for public health[J].ClinicalMicrobiologyReviews,2004,17(1):72-97.
[4] 张龙现,蒋金书.隐孢子虫和隐孢子虫病研究进展[J].寄生虫与医学昆虫学报,2001,8(3):184-191.
ZHANG L X,JIANG J S.Research progression ofCryptosporidiumand cryptosporidiosis[J].ActaParasitologicaetMedicaEntomologicaSinica,2001,8(3):184-191.(in Chinese with English abstract)
[5] AZAMI M ,MOGHADDAM D D,SALEHI R,et al.The identification ofCryptosporidiumspecies (protozoa) in Ifsahan,Iran by PCR-RFLP analysis of the 18S rRNA gene[J].MolekuliarnaiaBiologiia,2007,41(5):934-939.
[6] 曾铁兵,吴移谋,黄澍杰,等.巢式PCR扩增梅毒螺旋体polA及其临床应用的研究[J].中国皮肤性病学杂志,2004,18(2):74-76.
ZENG T B,WU Y M,HUANG S J,et al.Amplification of the DNA polymerase Ⅰ gene ofTreponemapallidumand its clinical application[J].TheChineseJournalofDermatovenereology,2004,18(2):74-76.(in Chinese with English abstract)
[7] 何美琳,张焕容,王永,等.川西北牦牛3种病毒性腹泻病血清学调查[J].中国畜牧兽医,2014,41(3):248-251.
HE M L,ZHANG H R,WANG Y, et al.Serological survey on three viral diarrhea diseases of yaks in northwest Sichuan province[J].ChinaAnimalHusbandry&VeterinaryMedicine,2014,41(3):248-251.(in Chinese)
[8] LI P,CAI J Z,CAI M,et al.Distribution ofCryptosporidiumspecies in Tibetan sheep and yaks in Qinghai,China[J].VeterinaryParasitology,2016,215:58-62.
[9] MA J B,CAI J Z,MA J W,et al.Occurrence and molecular characterization ofCryptosporidiumspp.in yaks (Bos grunniens) in China[J].VeterinaryParasitology,2014,202(3/4):113-118.
[10] MI R S,WANG X J,LI C H,et al.Prevalence and genetic characterization ofCryptosporidiumin yaks in Qinghai province of China[J].PLoSOne,2013,8(9):e74985.
[11] QI M,CAI J Z,WANG R J,et al.Molecular characterization ofCryptosporidiumspp.andGiardiaduodenalisfrom yaks in the central western region of China[J].BMCMicrobiology,2015,15(1):1-7.
[12] QIN S Y,ZHANG X X,ZHAO G H,et al.First report ofCryptosporidiumspp.in white yaks in China[J].Parasites&Vectors,2014,7(1):1-3.
(责任编辑 卢福庄)
Prevalence and molecular identification of Cryptosporidium spp.in yaks in Hongyuan County of Sichuan Province
HAO Li-li1,LI Rui2,DUAN Ling1,HE Liang3,*
(1.CollegeofLifeScience&Technology,SouthwestUniversityforNationalities,Chengdu610041,China; 2.InstituteofQualityandStandardforAgro-products,ZhejiangAcademyofAgriculturalSciences,Hangzhou310021,China; 3.NationalShanghaiCenterforNewDrugSafetyEvaluationandResearch,Shanghai201203,China)
In order to investigate prevalence ofCryptosporidiumspp.in yaks in Hongyuan County,in this study,Cryptosporidiumisolates from 216fecal samples were identified by nest-PCR method (including 18diarrhea fecal samples).Total infection rate ofCryptosporidiumwas 14.8%.It showed that prevalence ofCryptosporidiumbovis,C.ryanaeandC.andersoniwas 3.7%,5.1% and 6.0%,respectively.However,noCryptosporidiumspp.was detected in 18diarrhea fecal samples.Above results showed that yaks were natural hosts ofCryptosporidiumspp..But in this study,no obvious correlation existed betweenCryptosporidiumspp.and diarrhea,and the relationship betweenCryptosporidiumspp.and diarrhea in yaks should be further explored.
yaks;Cryptosporidiumspp.; diarrhea
10.3969/j.issn.1004-1524.2016.11.06
2016-03-04
西南民族大学中央高校基本科研业务费青年教师基金项目(2016NZYQN34);国家科技支撑项目(2014BAD13B03)
郝力力(1980—),男,山西长治人,博士,副研究员,研究方向为分子寄生虫学。E-mail: leelee_hao@126.com
*通信作者,贺亮,E-mail: microvet@163.com
S855.9+9
A
1004-1524(2016)11-1842-05
浙江农业学报ActaAgriculturaeZhejiangensis,2016,28(11): 1842-1846
http://www.zjnyxb.cn
郝力力,李锐,段玲,等.四川红原县牦牛隐孢子虫感染情况分子流行病学调查[J].浙江农业学报,2016,28(11): 1842-1846.

