巴西龟对福寿螺的直接捕食及间接干扰效应
郭 靖, 张春霞, 章家恩, 项 瑶, 江 雪
(1 华南农业大学 资源环境学院, 广东 广州 510642; 2 农业部华南热带农业环境重点实验室/广东省现代生态农业与循环农业工程技术研究中心/广东省高等学校农业生态与农村环境重点实验室, 广东 广州 510642)
巴西龟对福寿螺的直接捕食及间接干扰效应
郭 靖1†, 张春霞1†, 章家恩1,2, 项 瑶1, 江 雪1
(1 华南农业大学 资源环境学院, 广东 广州 510642; 2 农业部华南热带农业环境重点实验室/广东省现代生态农业与循环农业工程技术研究中心/广东省高等学校农业生态与农村环境重点实验室, 广东 广州 510642)
【目的】研究巴西龟Trachemysscriptaelegans对福寿螺Pomaceacanaliculata的直接捕食效应,为福寿螺的资源化利用提供参考,并探究巴西龟的间接干扰对福寿螺的影响。【方法】福寿螺与巴西龟共存养殖,定期调查福寿螺的存活和受损情况,确定巴西龟对不同大小福寿螺的控制效果;同时研究在不会被捕杀的情况下,福寿螺感知到同类在被捕食过程中释放的警戒信号后的摄食、生长、存活等方面的变化。【结果】福寿螺在巴西龟的直接捕食作用下,14 d后仅1/3的个体存活,其中,小螺(壳高5~15 mm)和中螺(壳高15~25 mm)的存活率分别降至0和40%,2/3的大螺(壳高25~35 mm)存活,但受损率达到存活个体的45%。而在间接干扰作用下,福寿螺摄食量明显下降,相应的个体生长受到抑制,但存活率不受影响。【结论】巴西龟对福寿螺有良好的捕食效果,且会抑制周边感知到捕食风险的其他福寿螺的摄食和生长,本研究可以为福寿螺入侵地和巴西龟原产地(美国)控制福寿螺提供新的思路,并对福寿螺的入侵机制和种群变化研究有一定的参考价值。
福寿螺; 巴西龟; 生物防治; 捕食效应; 干扰效应
福寿螺Pomaceacanaliculata作为中国已公布的3批外来入侵物种名单中唯一的淡水螺类,原产于南美洲亚马逊河流域。因蛋白质含量丰富、营养价值高等特点,在未进行生态风险评估的情况下,福寿螺于1981年引入我国广东省中山市,于1984年开始逐渐出现危害农作物的情况,现已成为南方十多个省区的严重农业威胁[1-2]。而且福寿螺体内可寄生引起人体嗜酸性脑膜炎的广州管圆线虫Angiostrongyluscantonensis和引起犬类心肺感染并致死的脉居管圆线虫Angiostrongylusvasorum[3- 4]。2000年,福寿螺被世界自然保护联盟外来入侵物种专家委员会列入世界100种恶性外来入侵物种名单[5]。
目前,防治福寿螺主要有物理、化学和生物方法。化学防治往往见效快、控螺效果较好,但其对水生生态系统破坏性大,有很大的局限性[6]。物理防治耗费人力且控效不尽人意,常作为辅助手段[7]。通常情况下,刚刚入侵的有害生物在局部为害时,使用见效快的化学或物理防治方法更为奏效,而当入侵生物已经建立种群并广为传播时,生物防治因可持续性及潜在的生态效益成为最佳策略[8]。已有研究发现控制福寿螺的生物资源多种多样,但能推广应用的并不多,是否具有经济效益往往成为该生物防治措施能否成功推广的关键因素[7]。广西桂林市自2005年开始利用福寿螺饲养中华鳖Pelodiscussinensis,因每养殖667 m2水面鳖每年需消耗1万kg左右的福寿螺,福寿螺收购范围延伸到桂林周边省市,取得了明显的经济效益[9]。浙江省余姚市利用茭白田、莲藕田套养中华鳖控螺[6, 10],高蛋白的福寿螺也成为山瑞鳖Paleasteindachneri、黄喉拟水龟Mauremysmutica、草龟Chinemysreevesiis、鳄龟Macrochelystemminckii等的优质饵料[11-14]。同属龟鳖类的巴西龟Trachemysscriptaelegans原产于美国中南部,于20世纪80年代引入广东,继而作为水族馆宠物迅速流向全国,我国已经成为世界上巴西龟最多的国家[15]。巴西龟食性杂,福寿螺亦是其食源之一,目前国内巴西龟养殖产业巨大,全国年上市成龟3 000多万只[16]。在不提倡巴西龟养殖的前提下,若能捞取福寿螺作为巴西龟养殖的饵料,不失为一种控害手段;同时,巴西龟的大量引入和繁育可能也会导致当地各种螺类种群的变化,但目前研究少有涉及,且在巴西龟的原产地美国南部同样有福寿螺入侵[17],故调查巴西龟对不同大小福寿螺的捕食效果,可为多地福寿螺的控制及种群变化研究提供新的思路。除了被巴西龟直接捕食外,福寿螺还能感知同类在被捕食过程中释放的警戒信号,并通过紧闭厣甲、钻土自埋、爬出水面等行为快速逃逸[11, 18-19]。在巴西龟的间接干扰下,除了行为响应,福寿螺摄食、生长、生存是否会受到影响还知之甚少。本研究探索巴西龟对福寿螺的直接捕食效应,调查福寿螺在巴西龟的间接干扰效应下的摄食、生长、存活等情况,以期为福寿螺的入侵机制研究提供理论依据。
1 材料与方法
1.1 材料
供试福寿螺于2015年5月中旬采集于华南农业大学校内农场(23°09′ N, 113°01′ E)水渠,每天投喂福寿螺足量新鲜生菜LactucasativaL.和浮萍LemnaminorL.,驯养2周后,挑选表观正常、活力较强的个体用于试验。试验所用巴西龟(216.33±7.79) g购自广州市花鸟虫鱼市场,均为表观正常、活力较强的个体。
长方筛(50 cm×40 cm×14 cm,47.5 cm×37.5 cm×14 cm,长宽以开口端计);多参数水质分析仪(上海海争电子科技有限公司)。
1.2 方法
试验前,在所选用塑料箱(72.0 cm×56.0 cm×38.5 cm)的底部放置厚度约为10 cm已风干并搅拌均匀的水稻土后加入自来水,水深同样约10 cm。在塑料箱中部放入长方筛(50 cm×40 cm × 14 cm),长方筛上有数百个供福寿螺和巴西龟呼吸换气的长方形小孔(10 mm×3 mm)。长方筛底部与土表接触,静置1 d后用于试验。
1.2.1 巴西龟对福寿螺的直接捕食效应 每个长方筛中放入30只福寿螺,其中壳高为5~15(小螺)、15~25(中螺)、25~35(大螺)mm等3种规格的各10只。试验共需6个塑料箱,分别设为对照组和处理组,每组3个重复。与对照组不同的是,处理组每个长方筛内除投放30只福寿螺外,另投入2只巴西龟,之后处理组和对照组均倒扣一个长方筛(47.5 cm×37.5 cm×14 cm),防止巴西龟和福寿螺逃逸,试验装置如图1所示。试验为期14 d,分别于试验的3、7、10、14 d后观察并统计长方筛内不同壳高福寿螺的死亡及受损情况。由于巴西龟属于杂食性动物,为避免食物投喂影响巴西龟的选择,试验期间长方筛内未投放任何食物。
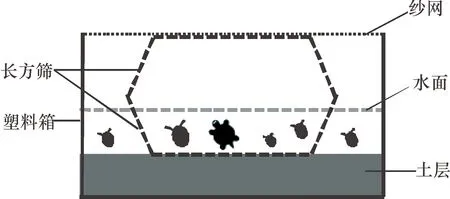
图1 试验装置示意图
1.2.2 巴西龟对福寿螺的间接干扰效应 挑选60只壳高在15~25 mm的福寿螺(中螺),随机均等分成6组,测量其壳高(游标卡尺测定,精确度0.02 mm)和体质量,分别投入“1.2.1”中所述对照组和处理组的塑料箱内(长方筛外),通过长方筛与“1.2.1”中的巴西龟和福寿螺相隔,研究长方筛内巴西龟在对福寿螺的捕食过程中,长方筛外福寿螺的摄食和生长情况,由此分析巴西龟的捕食行为及干扰信号对福寿螺的非目标干扰效应。此试验与“1.2.1”试验同时进行,为期14 d。在试验的前4 d,每天投放定量生菜至长方筛外,次日同时捞取剩余生菜并称质量,以此来确定长方筛外福寿螺每日摄食量。之后每天投放足量生菜、大薸Pistiastratiotes等作为长方筛外福寿螺的食物。分别于试验的7和14 d后统计长方筛外福寿螺的存活状况,并测量其壳高和体质量。于试验3、7、10、14 d后扰动水体前,取长方筛外100 mL水样,使用多参数水质分析仪测定水体浑浊度。
1.3 数据分析
采用SPSS 20.0、Excel 2007软件对试验数据进行整理和统计学分析,差异显著性分析采用t检验,对福寿螺在巴西龟直接捕食作用下的存活率进行重复测量方差分析,对水体浑浊度进行双因素方差分析。整理绘图采用Origin 8.0进行。
2 结果与分析
2.1 巴西龟对福寿螺的直接捕食效应
由图2A可见,对照组福寿螺适宜在试验所设模拟稻田生境中生存,处理3 d后,福寿螺存活率为97.78%;而处理组在引入巴西龟的3 d内,近1/3的福寿螺被捕杀,与对照组存活率差异显著(P<0.05),且有2.22%的福寿螺出现受损情况。试验7 d后,53.33%的福寿螺在巴西龟的捕食下存活,与对照组的存活率差异达到极显著水平(P<0.01),对照组存活率仍大于90%。随试验时间的延长,对照组和处理组的差异进一步拉大,且一直存在极显著差异(P<0.01),处理组存活率在不断下降的同时,受损率持续增加,14 d后受损率已达到13.33%。重复测量方差分析结果显示,福寿螺存活率存在极显著的时间差异(F=23.367;P<0.001)和有龟与否状态差异(F=77.955;P<0.05),且两者交互作用明显(F=4.152;P<0.05)。
巴西龟对不同大小福寿螺的捕食作用见图2B,小螺在试验结束时已被巴西龟全部捕食,中螺的存活率降至40%,明显低于对照组中螺(86.7%);处理组2/3的大螺仍存活,略低于对照组大螺(P>0.05)。整个试验过程中,小螺被巴西龟完全取食。随着试验的推进,中螺和大螺受损的情况逐渐严重,福寿螺受损情况多为其厣甲边缘被啃食。试验结束时,处理组中螺和大螺的受损个体分别占存活个体的25.0%和45.0%,对照组无受损情况。
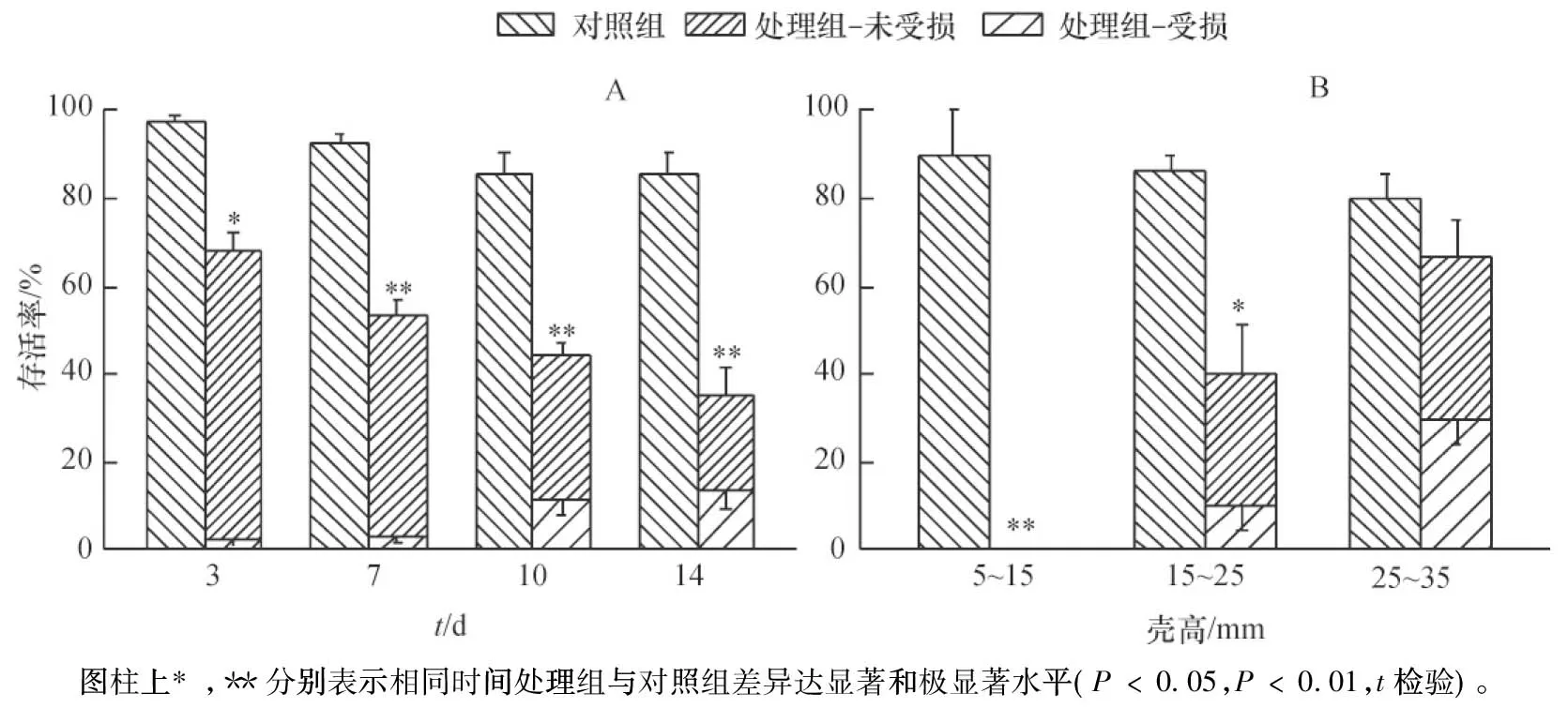
图2 巴西龟对福寿螺的捕食作用
2.2 巴西龟对福寿螺的间接干扰效应
2.2.1 巴西龟对福寿螺摄食、生长和存活的影响 巴西龟对福寿螺摄食的影响见图3,在巴西龟的捕食风险下,福寿螺摄食量明显减小,处理组和对照组处理1 d后的摄食量分别为8.00和14.45 g,两者差异显著(P﹤0.05)。就试验前4 d而言,处理组和对照组的摄食量均表现为随着时间推进递增,且处理组摄食量显著低于对照组(P﹤0.05),占其45.7%~55.4%不等。
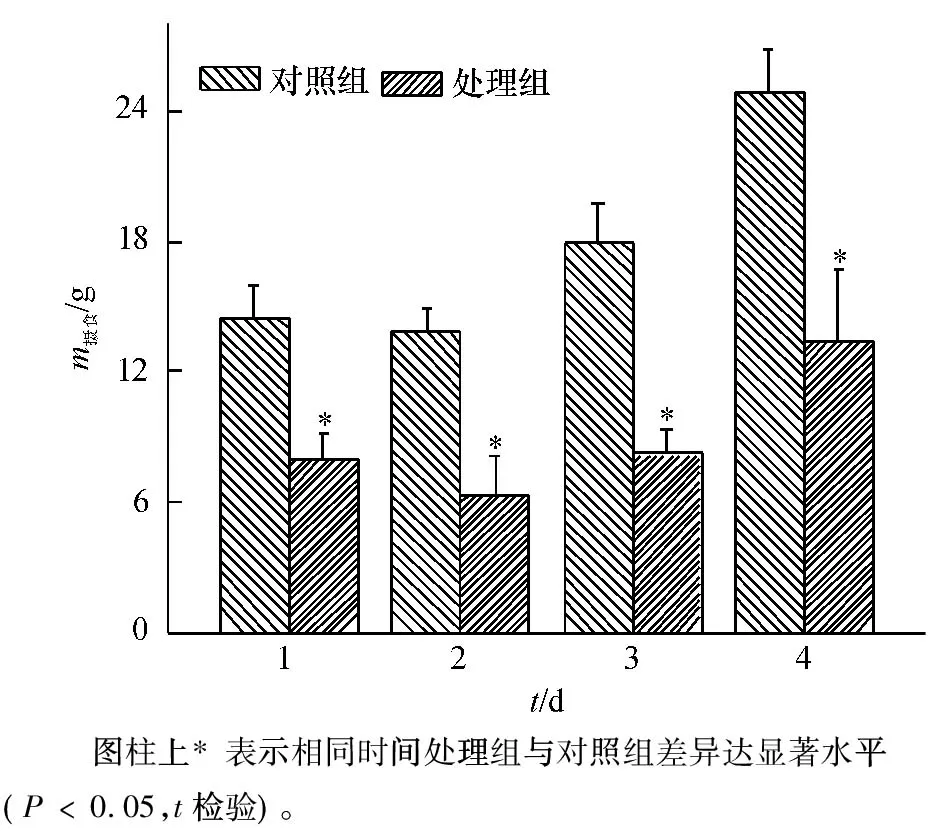
图3 巴西龟对福寿螺摄食的干扰
巴西龟对福寿螺生长的影响见图4,试验前,对照组和处理组福寿螺的壳高及体质量无明显差别(P>0.05);引入巴西龟7 d后,两者壳高分别为23.09和20.26 mm,体质量分别为2.78和1.95 g,差异均达到了显著水平(P﹤0.05);处理14 d后,两者差异进一步加大,处理组福寿螺壳高和体质量分别占对照组的82.1%和56.5%。
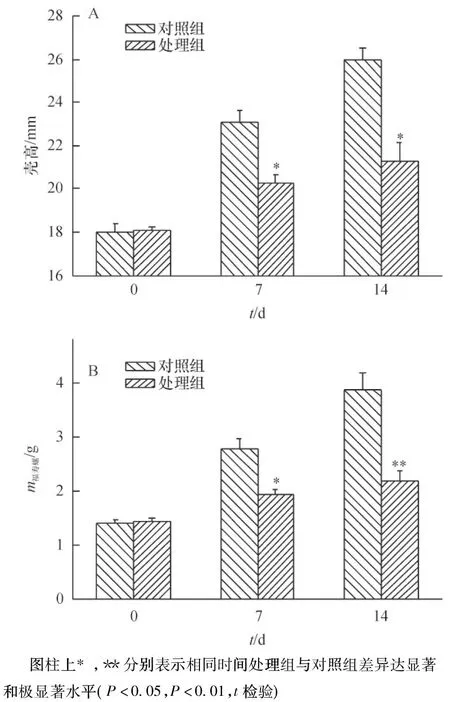
图4 巴西龟对福寿螺生长的干扰
巴西龟对福寿螺存活率的影响见图5,试验7 d后,对照组和处理组的存活率均为96.67%;到14 d时,处理组存活率无变化,对照组存活率降至93.33%,两者未表现出显著性差异(P>0.05)。表明巴西龟在捕食福寿螺的过程中,形成的干扰信号对福寿螺不能产生明显的致死效应。
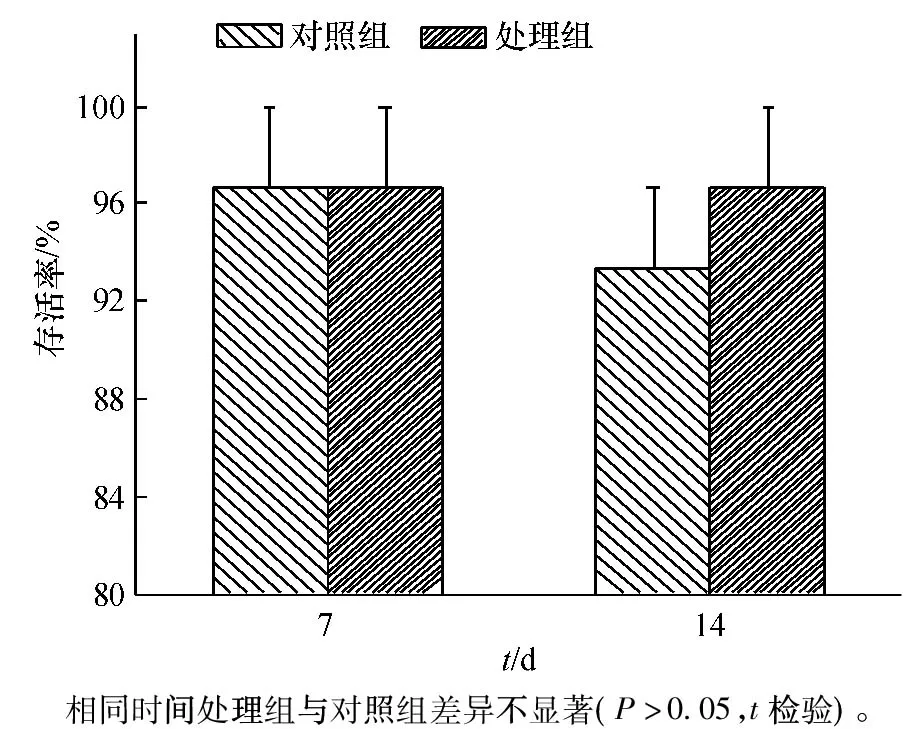
图5 巴西龟干扰对福寿螺存活的影响
2.2.2 巴西龟干扰对福寿螺生存环境的影响 图6结果显示,处理组水体的浑浊度高于对照组,试验3、7、10、14 d后水体浑浊度分别是对照组的3.31、5.18、8.95和90.79倍,这主要是由于巴西龟在水生生境中会不断搅浑水体;但某些时间点处理组和对照组差异均未达到显著水平,这主要是由巴西龟的个体日常活动行为差异造成的。而在对照组,水体浑浊度越来越低,原因是水体没有受到外来干扰,随着时间的延长,其中的悬浮物不断下沉,水体得以澄清。双因素方差分析发现,有龟与否对水体浑浊度产生了明显的影响(F1,16=30.94,P<0.001),而处理时长带来的影响并不明显(F3,16=0.75,P=0.54)。
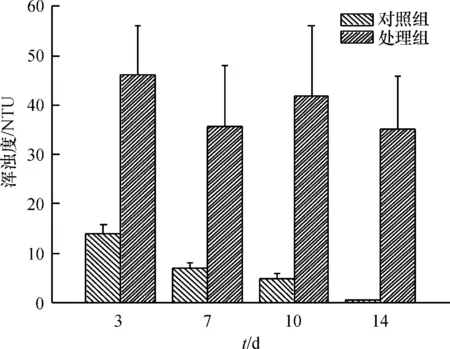
图6 巴西龟对水体浑浊度的干扰
3 讨论与结论
福寿螺作为一种世界性入侵生物,其天敌种类较为多样化,据不完全统计,福寿螺的天敌涵盖了腹足纲、环带纲、昆虫纲、软甲纲、辐鳍鱼纲、爬行纲、鸟纲、哺乳纲等[7],其中爬行纲的几种动物均表现出对福寿螺良好的控制效果,如中华鳖、草龟、彩龟Trachemysscripta等[6, 12]。本研究报道了巴西龟对福寿螺的捕食能力,并表现出良好的控制效果:近2/3的福寿螺被巴西龟捕杀,其对壳高为5~15 mm的福寿螺防治效果达到100%,并将壳高在15~25 mm的螺数量控制在50%以下。与其他龟鳖类动物一样,巴西龟通过其嘴咬合破坏螺壳,后将壳吐出,并取食螺肉。尽管被取食螺的个体大小与龟嘴大小呈显著正相关关系[11-12],但当螺伸展出头足部,与中华鳖一样[6],巴西龟可迅速袭击其软体部分,这也是试验结束后有45%的壳高在25~35 mm的福寿螺出现厣甲边缘被啃食的原因。
邢树文等[20]研究发现包括薇甘菊Mikaniamicrantha、南美蟛蜞菊Wedeliatrilobata在内的4种入侵植物水浸提液对非洲大蜗牛Achatinafulica成体、幼体和卵均具有较好的触杀与抑制效果;也有研究发现包括薇甘菊、南美蟛蜞菊等多种入侵植物的水浸提液或乙醇提取物对福寿螺产生了明显的毒杀作用[21]。而在入侵动物方面,克氏原螯虾Procambarusclarkii作为我国一种重要水产资源,对壳高小于20 mm的福寿螺和靠近水面8 cm以内的福寿螺卵块均有一定的控制作用[12, 22]。由于巴西龟具有生命力强、色彩艳丽、成本低廉等特点,我国多达18个省市有巴西龟养殖场的分布,其相关贸易则见于全国所有省份,几乎所有龟类贸易的水产品市场和大部分花鸟虫鱼市场均有巴西龟销售[15, 23-24]。若捞取福寿螺作为巴西龟饵料,对于福寿螺种群的控制是非常有利的。
福寿螺在感知到同类遭受巴西龟捕食释放的警戒信号后,其摄食量明显下降,可能原因如下:一是福寿螺会通过各种逃逸行为来躲避巴西龟,本试验发现处理组的长方筛外有福寿螺钻入土中,或泥土表面有福寿螺钻进去后又爬出来而留下的空洞,这种情形必然会减少福寿螺的摄食时间,导致摄食量下降;二是巴西龟在运动过程中会搅动水体,使水体浑浊度大大增加,已有研究发现鸭子搅动浑水会影响福寿螺的呼吸效率,增加其摄食难度[25];三是福寿螺在巴西龟存在的胁迫压力下产生应激反应,单位时间内食物摄取量也会有所下降,这种现象在部分昆虫中已有发现[26]。福寿螺摄食量的下降,必然会导致其生长速度减缓,在巴西龟的间接干扰效应下,福寿螺的壳高和体质量均显著低于对照组,但消化效率和代谢率是否表现出负效应,需要进一步研究。
本研究选用的福寿螺壳高为15~25mm,福寿螺在巴西龟间接干扰作用下存活率未受到明显影响,Nyström等[27]发现2种螯虾Pacifastacusleniusculus和Astacusastacus在天敌胁迫下存活率未受影响;也有研究发现天敌突然出现会吓死蜻蜓Leucorrhiniaintacta幼虫,即使它们没有被吃掉的危险,且暴露在天敌面前的蜻蜓幼虫蜕变成成虫的过渡期死亡率远高于其在自由环境中发生蜕变时的死亡率[28]。巴西龟对被捕食者的间接干扰是否存在致死效应也可能与被捕食者的大小有关,对此尚需要进一步分析比较并验证。
[1] 俞晓平, 和田节, 李中方, 等. 稻田福寿螺的发生和治理[J]. 浙江农业科学, 2001, 13(5): 247-252.
[2] HALWART M. The golden apple snailPomaceacanaliculatain Asian rice farming systems: Present impact and future threat[J]. Int J Pest Manage, 1994, 40(2): 199-206.
[3] LÜ S, ZHANG Y, LIU H X, et al. Invasive snails and an emerging infectious disease: Results from the first national survey onAngiostrongyluscantonensisin China[J]. Plos Neglect Trop D, 2009, 3(2): 368.
[4] MOZZER L R, COAGLIO A L, DRACZ R M, et al. The development ofAngiostrongylusvasorum(Baillet, 1866) in the freshwater snailPomaceacanaliculata(Lamarck, 1822)[J]. J Helminthol, 2014, 89(6): 1-5.
[5] LOWE S, BROWNE M, BOUDJELAS S, et al. 100 of the world’s worst invasive alien species: A selection from the global invasive species database[M]. Auckland, New Zealand: Invasive Species Specialist Group, 2000: 6-7.
[6] DONG S, ZHENG G, YU X, et al. Biological control of golden apple snail,Pomaceacanaliculataby Chinese soft-shelled turtle,Pelodiscussinensisin the wild rice,Zizanialatifoliafield[J]. Sci Agr, 2012, 69(2): 142-146.
[7] 郭靖, 章家恩. 福寿螺的生物防治现状、问题与对策[J]. 生态学杂志, 2015, 34(10): 2943-2950.
[8] 万方浩, 李保平, 郭建英, 等. 生物入侵: 生物防治篇[M]. 北京: 科学出版社, 2008: 4- 8.
[9] 王艳阳. 阳朔: 巧用福寿螺养甲鱼[J]. 农家之友, 2015(6): 23.
[10]夏岳章, 翁丽青, 符长焕. 藕鳖共育控制福寿螺及套养技术[J]. 浙江农业科学, 2013(10): 1363-1365.
[11]YOSHIE H, YUSA Y. Effects of predation on the exotic freshwater snailPomaceacanaliculata(Caenogastropoda: Ampullariidae) by the indigenous turtleChinemysreevesii(Testudines: Geoemydidae)[J]. Appl Entomol Zool, 2008, 43(4): 475- 482.
[12]YUSA Y, SUGIURA N, WADA T. Predatory potential of freshwater animals on an invasive agricultural pest, the apple snailPomaceacanaliculata(Gastropoda: Ampullariidae), in southern Japan[J]. Biol Invasions, 2006, 8(2): 137-147.
[13]赵忠添, 黄立斌, 张益峰, 等. 山瑞鳖人工繁殖试验研究[J]. 现代农业科技, 2015(11): 271-272.
[14]周维官, 覃国森. 不同饵料养殖黄喉拟水龟效果的研究[J]. 四川动物, 2008, 27(2): 283-286.
[15]环境保护部, 中国科学院. 关于发布中国外来入侵物种名单(第三批)的公告[EB/OL].(2014-08-15)[2015-12-15]. http://www.mep.gov.cn/gkml/hbb/bgg/201408/t20140828_288367.htm.
[16]史海涛, 龚世平, 梁伟, 等. 控制外来物种红耳龟在中国野生环境蔓延的态势[J]. 生物学通报, 2009, 44(4): 1- 4.
[17]RAWLINGS T A, HAYES K A, COWIE R H, et al. The identity, distribution, and impacts of non-native apple snails in the continental United States[J]. BMC Evol Biol, 2007, 7(1): 97.
[18]CARLSSON N, KESTRUPÅ, MÅRTENSSON M, et al. Lethal and non-lethal effects of multiple indigenous predators on the invasive golden apple snail (Pomaceacanaliculata)[J]. Freshwater Biol, 2004, 49(10): 1269-1279.
[19]UESHIMA E, YUSA Y. Antipredator behaviour in response to single or combined predator cues in the apple snailPomaceacanaliculata[J]. J Mollus Stud, 2015, 81(1): 51-57.
[20]邢树文, 朱慧, 查广才, 等. 四种入侵植物提取液对褐云玛瑙蜗牛的防控效果[J]. 生态学报, 2015, 35(9): 3067-3075.
[21]ZHAO B L, FANG L, ZHANG J E, et al. Effects of five exotic invasive plants extracts on the survival of the invasive snailPomaceacanaliculata(Lamarck)[J]. Allelopathy J, 2015, 36(1): 123-132.
[22]杨爱娟, 谭济才, 袁哲明, 等. 福寿螺产卵高度与克氏原螯虾捕食卵块的研究[J]. 中国农学通报, 2012, 28(8): 90-93.
[23]刘丹, 史海涛, 刘宇翔, 等. 红耳龟在我国分布现状的调查[J]. 生物学通报, 2011, 46(6): 18-21.
[24]SHI H T, PARHAM J F, FAN Z, et al. Evidence for the massive scale of turtle farming in China[J]. Oryx, 2008, 42(1): 147-150.
[25]方丽. 南方稻田福寿螺种群发生动态及其生态控制研究[D]. 广州: 华南农业大学, 2008: 76-77.
[26]MCPEEK M A, GRACE M, RICHARDSON J M L. Physiological and behavioral responses to predators shape the growth/predation risk trade-off in damselflies[J]. Ecology, 2001, 82(6): 1535-1545.
[27]NYSTRÖM P. Non-lethal predator effects on the performance of a native and an exotic crayfish species[J]. Freshwater Biol, 2005, 50(12): 1938-1949.
[28]MCCAULEY S J, ROWE L, FORTIN M J. The deadly effects of “nonlethal” predators[J]. Ecology, 2011, 92(11): 2043-2048.
【责任编辑 霍 欢】
Predation and indirect interference effects of Trachemys scripta elegans on Pomacea canaliculata
GUO Jing1†, ZHANG Chunxia1†, ZHANG Jia’en1,2, XIANG Yao1, JIANG Xue1
(1 College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642, China; 2 Key Laboratory of Agro-environment in the Tropics, Ministry of Agriculture/Guangdong Engineering Research Center for Modern Eco-agriculture and Circular Agriculture/Key Laboratory of Agro-ecology and Rural Environment of Guangzhou Regular Higher Education Institutions, Guangzhou 510642, China)
【Objective】 To investigate the predatory effect of red-eared slider turtle,Trachemysscriptaeleganson golden apple snail,Pomaceacanaliculataso as to provide an effective way for resource utilization ofP.canaliculata, and to explore its indirect interference effect onP.canaliculata.【Method】T.scriptaelegansandP.canaliculatawere put in a set of specially-designed plastic aquarium together, control effects of the turtles on various sizes of snails were determined through regular surveys of the survival and damage ofP.canaliculata. Meanwhile, the change of feeding, growth and survival of another group snails outside the cage net under indirect interference effect ofT.scriptaeleganswere investigated, which means that the snails were exposed to the caged predators which had no opportunities to attack them but can respond to alarm signals from conspecific snails predated by turtles.【Result】The snails under the predation ofT.scriptaelegansfor 14 days, only one third of individuals were still alive, among which, the survival rate of small snails (5-15 mm shell height) and medium snails (15-25 mm shell height) decreased to 0 and 40 percent respectively. Two thirds of large snails (25-35 mm shell height) survived but the injured individuals accounted for 45 percent of the survival. The food intake of the other snails (medium) significantly decreased and growth was restricted under the indirect interference of the turtles, although this treatment exhibited less impact on its survival.【Conclusion】T.scriptaeleganshas strong predatory effect on the invasiveP.canaliculata, that also depresses the feeding and growth of surrounding conspecific snails which can perceive the predation risk. These findings would provide new ideas for control ofP.canaliculatain its invaded habitat and origin area of turtle (United States), and provide reference values for invasion mechanism and population dynamics research ofP.canaliculata.
Pomaceacanaliculata;Trachemysscriptaelegans; biological control; predation effect; interference effect
2016- 02- 01 优先出版时间:2016-10-24
郭 靖(1989—),男,博士研究生,E-mail: jingaj@163.com;张春霞(1990—),女,硕士研究生,E-mail: zhangcx@stu.scau.edu.cn;†对本文贡献相同;通信作者:章家恩(1968—),男,教授,博士,E-mail: jeanzh@scau.edu.cn
国家自然科学基金(U1131006,30770403,30900187); 广东省科技计划项目(2007B020709007,2011B020309009,2012B020310005,2015B090903077); 广东省高等学校高层次人才项目(粤教师函2010[79号]); 广东省引进国(境)外高层次人才智力项目(粤外专[2010]51号); 广东省青年创新人才类项目(2014WQNCX020)
S476
A
1001- 411X(2016)06- 0059- 06
优先出版网址:http://www.cnki.net/kcms/detail/44.1110.s.20161024.1041.022.html
郭 靖, 张春霞, 章家恩, 等.巴西龟对福寿螺的直接捕食及间接干扰效应[J].华南农业大学学报,2016,37(6):59- 64.

