卵巢功能衰退患者血清抗苗勒管激素的水平变化及意义
李强,张建海,田向文,余江
(胜利油田中心医院,山东东营257200)
卵巢功能衰退患者血清抗苗勒管激素的水平变化及意义
李强,张建海,田向文,余江
(胜利油田中心医院,山东东营257200)
目的 观察卵巢功能衰退患者血清抗苗勒管激素(AMH)的水平变化,探讨其临床意义。方法 选取卵巢功能衰退患者60例,根据卵泡刺激素(FSH)水平分为卵巢早衰28例(POF组)、过渡期卵巢功能衰竭32例(TOF组),同期选取月经正常查体健康女性20例作为对照组。检测各组血清AMH、FSH、黄体生成素(LH)及雌二醇(E2)水平。卵巢功能衰退患者给予克龄蒙口服,1片/d,21 d为1个周期,治疗6个周期后再次复查上述激素水平。结果 与对照组比较,治疗前POF组、TOF组AMH、E2水平下降,FSH、LH水平上升(P均<0.05),TOF组以上指标变化更明显(P均>0.05)。与治疗前比较,治疗6个周期TOF组、POF组AMH水平无明显变化(P均>0.05),FSH、LH水平下降,E2水平上升(P均<0.05)。结论 卵巢功能衰退时,血清AMH水平下降,克龄蒙治疗前后变化不大;检测血清AMH水平,可早期预测卵巢功能衰退。
卵巢功能衰退;抗苗勒管激素;卵泡刺激素;雌二醇;黄体生成素
近年来卵巢功能下降患者呈现年轻化趋势,然而在临床工作中发现根据卵泡刺激素(FSH)、黄体生成激素(LH)、雌二醇(E2)等这些传统指标作出诊断时,患者可能已经发生闭经,进入更年期,卵巢功能已不可逆转。抗苗勒管激素(AMH)在性腺中产生,仅在初级卵泡及小窦卵泡中表达,调控卵泡的生长发育,反映卵巢池中始基卵泡及窦前卵泡的数量和质量,因而其能够更早地反映卵巢的功能。本文对卵巢功能衰退患者进行分组,检测其卵巢各项激素水平,以期找到更早预测卵巢功能衰退的敏感指标。
1 资料与方法
1.1临床资料 选择2013年1月~2014年1月本院诊治的卵巢功能衰退患者60例,诊断标准:年龄<40岁且FSH>10 IU/L。根据FSH水平将患者分为卵巢早衰28例(POF组)、过渡期卵巢功能衰竭32例(TOF组)。TOF组年龄30~36(32.21± 1.23)岁,月经稀发、量少,10 IU/L<FSH≤40 IU/L;POF组年龄32~38(34.43±2.41)岁,40岁前闭经或闭经超过自身月经周期3个周期以上或半年以上,FSH>40 IU/L。同期选取本院月经正常查体健康女性20例作为对照组,年龄30~36(33.15± 1.35)岁。各组年龄比较差异无统计学意义(P>0.05)。入选对象近3个月内均未使用激素,泌乳素、甲状腺功能、肾上腺功能检查均正常,无糖尿病、肥胖、吸烟及酗酒史,无血栓病史。POF组、TOF组于月经第3天给予克龄蒙口服,1片/d,服用21 d为1个周期,连续治疗6个周期。
1.2血清激素水平检测 POF组、TOF组于治疗前、治疗6个周期,对照组于体检时,三组均于月经周期第3天(闭经者采血时间不限)晨8:00空腹抽取肘静脉血5 mL,室温静置30 min,4 000 r/min离心,分离血清,-40℃保存待检。采用全自动荧光免疫分析仪检测FSH、LH及E2水平。酶联免疫吸附法检测AMH,测定范围为0.079 1~4.6 ng/mL,批内及批间差异分别为4.00%及1.96%。均严格按照试剂盒及仪器说明书进行操作。
1.3统计学方法 采用SPSS18.0统计软件。计量资料用±s表示,多组比较采用方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
各组血清激素水平比较见表1。与对照组比较,治疗前POF组、TOF组AMH、E2水平下降,FSH、LH水平上升(P均<0.05),POF组以上指标变化更明显(P均<0.05)。治疗前后TOF组、POF组AMH水平比较无统计学差异(P均>0.05),治疗后两组FSH、LH水平下降,E2水平上升(P均<0.05)。
表1 各组血清激素水平比较(±s)
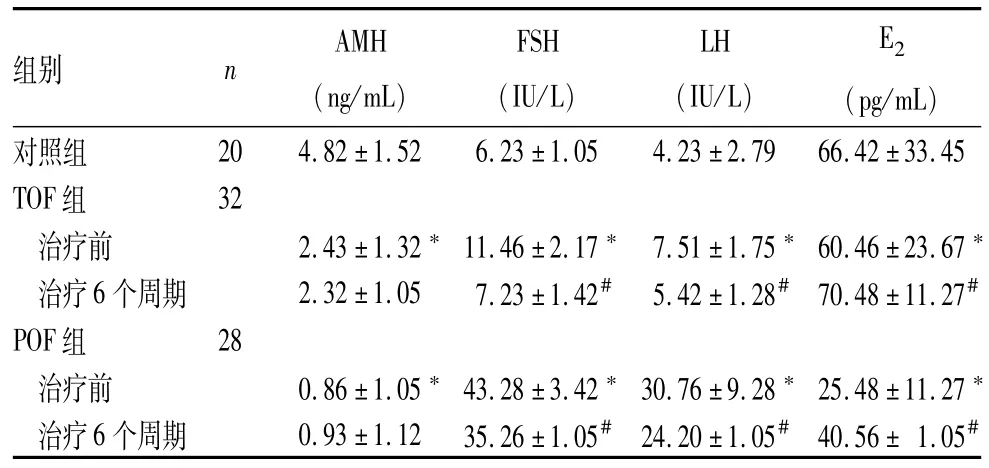
表1 各组血清激素水平比较(±s)
注:与对照组比较,*P<0.05;与同组治疗前比较,#P<0.05。
组别nAMH(ng/mL)FSH(IU/L)LH(IU/L)E2(pg/mL)对照组204.82±1.526.23±1.054.23±2.7966.42±33.45 TOF组32治疗前2.43±1.32*11.46±2.17*7.51±1.75*60.46±23.67*治疗6个周期2.32±1.057.23±1.42#5.42±1.28#70.48±11.27#POF组28治疗前0.86±1.05*43.28±3.42*30.76±9.28*25.48±11.27*治疗6个周期0.93±1.1235.26±1.05#24.20±1.05#40.56±1.05#
3 讨论
AMH又称苗勒管抑制物质[1],最早于1947年由Jost在男性胚胎的睾丸细胞中发现,在男性胎儿的睾丸支持细胞所分泌的AMH拥有抑制苗勒管分化为女性生殖系统的作用,如果缺乏睾丸及AMH雌性胚胎的苗勒管则进步分化成为输卵管、子宫及阴道组织[2]。女性胚胎36周以后卵巢颗粒细胞才分泌AMH[3]。原始卵泡不表达AMH[4],初级卵泡的颗粒细胞才是AMH主要分泌部位[5],绝大部分AMH由5~8 mm卵泡分泌[6],随着卵泡的增大,AMH分泌反而减少,当卵泡直径>8 mm时,AMH分泌几乎消失[7],闭锁卵泡则未发现AMH表达[8]。因此有研究认为AMH是卵泡募集的调节因子[9]。
女婴出生时外周血几乎检测不到AMH,随着第二性征发育在性成熟后达到最高水平,在整个生育年龄维持较高水平,随着年龄的增长呈现下降趋势[10],绝经期消失,且在整个月经周期中波动极小[11],对于其他卵巢激素而言处于相对稳定的水平。有研究表明,AMH在卵泡期、排卵期、黄体期水平差异不大,基本稳定,Eman等[12]测定早卵泡日、取卵日、黄体期的AMH水平,发现在这三个时期AMH无明显变化,只是在取卵日AMH略高,但差异无统计学意义。对月经周期正常及正常排卵女性给予FSH刺激卵巢后,比较基础AMH及刺激后AMH水平发现AMH变化不明显,但E2升高明显,说明AMH是不受性腺激素影响[13],下丘脑-垂体-卵巢轴对其分泌没有影响。研究还发现,即使在妊娠期间、口服避孕药情况下血清AMH水平并无明显变化[14]。本研究发现,与对照组比较,POF组、TOF组AMH、E2水平下降,FSH、LH水平上升。提示TOF组FSH、LH、E2并未达到诊断卵巢早衰的标准,但AMH水平已提示卵巢功能衰退,说明AMH可以更早预测卵巢功能衰退。对于卵巢功能衰退患者给予激素替代治疗后,AMH水平较治疗前无统计学意义,但FSH、LH水平降低,E2水平升高。说明AMH不受外源性激素影响,其水平具有稳定性,这较其他卵巢激素具有明显优势,能够稳定反映卵巢功能[15]。
[1]Jeppesen JV,Anderson RA,Kelesy TW,et al.Which follicles make the most anti-Mullerian hormone in humans?Evidence for an abrupt decline in AMH production at the time of follicle selection[J].Mol Hum Reprod,2013,19(8):519-527.
[2]Hansen HK,Hodnett GM,Knowlton N,et al.Correlation of ovarian reserve tesets with histologically determined primordial follicle number[J].Fertil Steril,2011,95(1):170-175.
[3]Clarke TR,Hoshiya Y,Yi SE,et al.Müllerian inhibiting substance signaling uses a bone morphogenetic protein(BMP)-like pathway mediated byALK2 and induces smad6 expression[J].Mol Endoerinol,2001,15(6):946-959.
[4]Steiner AZ,Herring AH,Kesner JS,et al.Antimullerian hormone as a predictor of natural fecundability in women aged 30-42 years[J].Obstet Gynecol,2011,117(4):798-804.
[5]Kelsey TW,Wright P,Nelson SM,et al.A validated model of serum anti-mullerian hormone from conception to menopause[J].PLoS One,2011,6(7):e22024.
[6]Hagen CP,Vestergaard S,Juul A,et al.Low concentration of circulating antimüllerian hormone is not predictive of reduced fecundability in young healthy women:a prospective cohort study[J].Fertil Steril,2012,98(6):1602-1608.
[7]邵静宜,马艳萍,李云秀.抗苗勒氏管激素与生殖[J].中国优生与遗传杂志,2012(5):13-15.
[8]任妞,刘彦.生育期女性血清抗苗勒管激素水平的研究[J].中国妇产科临床杂志,2011,12(4):281-283.
[9]Practice Committee of the American Society for Reproductive Medicine.Testing and interpreting measures of ovarian reserve:a committee opinion[J].Feril Steril,2012,98(6):1407-1415.
[10]陈秀英,李斌.抗苗勒管激素在女性生殖系统的研究进展[J].国际妇产科学杂志,2013,41(2):123-125.
[11]钱警语,陈秀娟.抗苗勒管激素与女性生育功能关系研究进展[J].生殖与避孕,2013,33(7):473-478.
[12]Eman AE,Dahilia OE,Azza ES,et al.Anti-mullerian hormone:correlation of early fpllicular,ovulatory and midluteal levels with ovarian response and cycle outcome in intracytoplasmic sperm injection patients[J].Fetili Steril,2008,89(6):1670-1676.
[13]Eilertsen TB,Vanky E,Carlsen SM.Anti-mullerian hormone in the diagnosis of polycystic ovary syndrome:can morphologic description be replaced[J].Hum Reprod,2012,27(8):2494-2523.
[14]Piltonen T,Morin PL,Koviunen R,et al.Seru anti-mullerrian hormone level remain hogh until late reproductive age decrease during therapy in women with polycystic ovary syndrome[J].Hum Reprod,2005,20(7):1820-1826.
[15]纪晓宁,丰有吉.抗苗勒管激素与妇科肿瘤相关性的研究进展[J].上海交通大学学报(医学版),2014.34(1):109-112.
10.3969/j.issn.1002-266X.2016.21.025
R711.75
B
1002-266X(2016)21-0063-02
余江(E-mail:slyj1966@163.com)
(2016-01-01)

