膝骨关节炎患者软骨组织与血浆中miRNA表达变化及意义
荆琳,单鹏程,张洪美,王秀均
(中国中医科学院望京医院,北京100102)
膝骨关节炎患者软骨组织与血浆中miRNA表达变化及意义
荆琳,单鹏程,张洪美,王秀均
(中国中医科学院望京医院,北京100102)
目的 观察膝骨关节炎患者软骨组织及血浆中miRNA的表达变化,并探讨其临床意义。方法 取2例因外伤导致膝关节软骨剥脱无法回植的正常关节股骨髁非负重区软骨组织、2例行人工关节置换术的原发膝骨关节炎股骨髁非负重区软骨组织以及15例正常志愿者及15例骨关节炎患者的血浆标本。用RT-PCR技术及HiSeq高通量测序技术检测软骨组织miRNA表达,根据fold change>1且P<0.01,筛选骨关节炎致病基因;采用RT-PCR技术检测血浆中miRNA表达。结果 软骨组织中检测的miRNA长度主要分布在22 nt,共筛选出5种基因:hsa-miR-378c、hsa-miR-1268a、hsa-miR-483-5p、hsa-miR-375、hsa-miR-1275,筛选出的miRNA在正常软骨中低表达,在骨关节炎软骨组织中高表达。筛选出的miRNA在原发膝骨关节炎患者及健康志愿者血浆中表达差异无统计学意义(P均>0.05)。结论 hsa-miR-378c、hsa-miR-1268a、hsa-miR-483-5p、hsa-miR-375和hsa-miR-1275在骨关节炎软骨组织中高表达,在血浆中表达无规律;以上5种miRNA可能为膝骨关节炎发病的潜在致病基因。
膝骨关节炎;微小RNA;软骨
microRNA(miRNA)是一类内源性的非编码RNA,参与细胞生长、发育、基因转录和翻译等诸多生命活动的调控过程,在细胞增殖、分化和凋亡及机体发育、疾病发生过程中发挥着重要的调控作用。据估计,人类至少有1/3的基因受miRNA调控[1]。有研究表明,miRNA在组织细胞中具有特征性的表达谱,并且身体发育过程和疾病发生会导致其表达谱发生明显变化[2,3]。然而,国内外有关miRNA与骨关节炎关系的报道较少。2015年1月~2016年3月,本研究通过比较正常膝关节与原发膝骨关节炎关节软骨组织中miRNA的表达差异,以探索miRNA在膝骨关节炎病理过程中的作用。
1 资料与方法
1.1 临床资料 选行人工关节置换术的原发膝骨关节炎男性患者2例,年龄分别为45、56岁,取股骨髁非负重区软骨组织作标本(OA1、OA2);选本院因外伤导致膝关节软骨剥脱、无法回植的男性志愿者2例,年龄分别为42、55岁,取股骨髁非负重区软骨组织作标本(CK1、CK2)。选择原发膝骨关节炎患者15例(观察组),男6例、女9例,年龄36~62(42±4.7)岁;体检健康志愿者15例(健康对照组),男7例、女8例,年龄24~60(40±6.2)岁;均早晨空腹抽取外周静脉血5 mL,离心,分离血浆,于-70 ℃下保存待检;二者性别、年龄比较差异无统计学意义,具有可比性。
1.2 软骨组织中miRNA表达检测 将关节软骨组织及血浆标本送于深圳华大基因科技服务有限公司进行基因测序。取软骨组织100 mg置1.5 mL离心管中,加TRIzol 1 mL,充分匀浆,室温静置5 min,加入氯仿0.2 mL振荡、离心,取上清液加入异丙醇0.5 mL离心,弃上清液,加入75%乙醇1 mL沉淀、晾干,获取纯化RNA。采用RT-PCR技术、HiSeq高通量测序技术的miRNA数字化分析,边合成边测序,构建样品之间的小分子RNA差异表达谱。将原始数据进行去除接头、去污染序列及去低质量序列处理,得到可信的目标分析序列,再对其进行RNA序列长度分布统计和样本间公共序列统计。Ct值为待检基因实时荧光强度明显大于背景循环数,采用2-ΔΔCt法计算目的基因相对表达量。建立数据库,分别使用Scatter plot图、fold change及t检验比较两标本中共同基因的差异表达,fold change=log2(OA/CK)(OA、CK为两组基因相对表达量)。筛选条件:fold change>1且P<0.01,认为是差异基因。
1.3 血浆miRNA表达检测 取血浆标本按照TRIzol试剂说明提取总RNA,根据筛选出的目标基因,用Pola(A)加尾法及实时RT-PCR技术进行检测。使用One Step PrimeScript miRNA cDNA Synthesis Kit(TaKaRa)进行Poly(A)多聚尾和合成cDNA,用SYBR Premix Ex TaqTM Ⅱ(TaKaRa) 进行加样,每个样本均重复检测3次,取平均值。采用2-ΔΔCt法计算目的基因相对表达量。
2 结果
2.1 膝骨关节炎及正常软骨组织中miRNA表达比较 CK1、CK2、OA1、OA2中测得的miRNA长度主要集中于22 nt,其次为23 nt。长度为22 nt的miRNA占31.4%~51.73%,而22 nt加23 nt的miRNA占58.17%~75.88%。在fold change>1且P<0.01的条件下,共筛选出5种miRNA:hsa-miR-378c、hsa-miR-1268a、hsa-miR-483-5p、hsa-miR-375、hsa-miR-1275,以上均在OA1、OA2中低表达而在CK1、CK2中高表达。见表1、2。
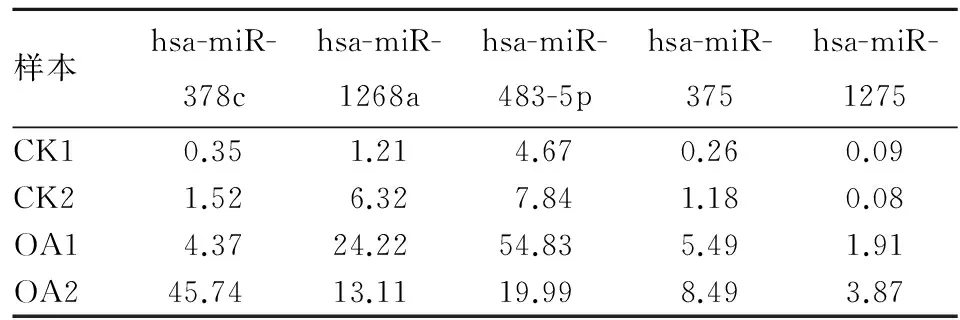
表1 CK1、CK2及OA1、OA2中miRNA的相对表达量
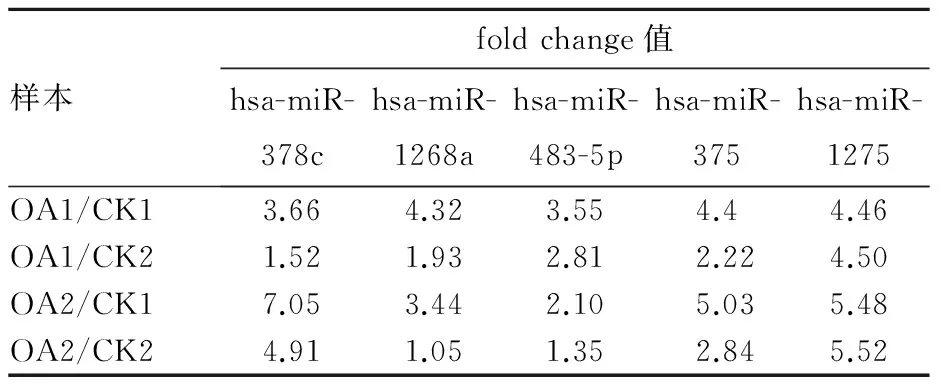
表2 膝骨关节炎及正常软骨组织和miRNA的fold change值
2.2 膝骨关节炎患者及健康志愿者血浆中miRNA表达比较 膝骨关节炎患者及健康志愿者血浆中hsa-miR-1268a、hsa-miR-375、hsa-miR-1275相比表达量比较差异无统计学意义(P均>0.05);两组血浆中均无hsa-miR-483-5p、hsa-miR-378c表达。

表3 膝骨关节炎患者及健康志愿者血浆miRNA相对表达量比较±s)
3 讨论
miRNA能通过与靶mRNA特异性的结合而导致靶mRNA降解或抑制其翻译,从而对基因进行转录后调控。组织细胞内的microRNA可通过某种方式分泌至外周血中,成为循环microRNA,后者作为一种全新的疾病诊断标记物已经得到了重视。目前,miRNA的生物学作用在许多疾病发生发展的过程中被逐渐认识,然而miRNA在骨关节炎发病机制中的作用国内外研究非常有限。所以我们针对原发膝骨关节炎患者及正常志愿者的膝关节软骨及血浆进行研究,筛选出具有差异表达的miRNA,以期对其进一步深入研究[4~6]。
通常所说的miRNA是指长度18~24 nt的单链非编码小分子RNA,其通过结合目标信使RNA(mRNA)的3′端非翻译区降解目标基因,或抑制目标基因翻译来调节基因表达[7~9]。miRNA长度分布的峰值能够帮助判断小RNA的种类,多数情况下植物样本和动物样本序列长度分布上有着明显的差异,其表现是植物样本长度分布的峰值一般出现在21 nt或24 nt,而动物样本峰值则出现在22 nt。根据这些条件对于样品情况和测序情况可以做初步判断。我们检测的4例人软骨标本中miRNA长度主要集中在22 nt,其次为23 nt。这与理论上动物标本miRNA峰值一致。
本研究由Scatter plot图不难发现,每组miRNA表达差异比较中,都有miRNA在骨关节炎软骨组织中高表达,而在正常软骨组织中低表达。而这些存在差异表达的miRNA可能在骨关节炎发病机制中发挥重要作用,有待进一步深入研究。Iliopoulos等[10]通过比较正常人与骨关节炎患者关节软骨组织中已知的365种miRNA的表达情况,从中鉴别出的16种miRNA存在差异,通过以上16种miRNA能够区别正常软骨和骨关节炎软骨。在miRNA基因库中,目前人类已知的miRNA就有800余种。本研究中,针对所有检测的已知miRNA,比较其在正常软骨及骨关节炎软骨组织中的表达,在fold change>1且P<0.01的条件下,筛选出hsa-miR-378c、hsa-miR-1268a、hsa-miR-483-5p、hsa-miR-375及hsa-miR-1275这5种miRNA,均在骨关节炎软骨组织中高表达,而在正常软骨组织中低表达。推断这5种miRNA可能在骨关节炎的发病机制中发挥重要作用。
Diaz-Prado等[11]曾比较4例正常志愿者关节软骨及6例骨关节炎患者关节软骨中已知的729种miRNA,在fold change值>1.5及P<0.01的条件下,只有hsa-miR-483-5p在骨关节炎软骨中表达明显升高。而在Iliopoulos等[10]鉴别出的在正常软骨及骨关节炎软骨组织中表达具有显著差异的16种miRNA中,hsa-miR-483-5p在骨关节炎软骨中的表达,不论是通过miRNA的微阵列分析还是定量PCR分析都显著升高。此外,Zuntini等[12]也通过实验证明,hsa-miR-483-5p在骨关节炎软骨中表达明显升高。本研究中,hsa-miR-483-5p在骨关节炎软骨中的表达明显升高,其fold change值均>1,这说明hsa-miR-483-5p的高表达可能与骨关节炎的发病密切相关。除hsa-miR-483-5p外,hsa-miR-378c、hsa-miR-375及hsa-miR-1275的fold change值分别为1.52、2.22及4.46,这3种miRNA的表达在数据分析中比hsa-miR-483-5p更理想,所以以上几种miRNA可能为膝骨关节炎发病的潜在基因。目前,已经有研究证明,miR-27a和miR-27b在骨关节炎患者软骨中能够调节基质金属蛋白酶13的表达,从而在骨关节炎的发病过程中起调节作用[13,14]。此外还有研究报道,miR-34a可以抑制骨关节炎大鼠软骨细胞凋亡[15]。因此,如果能够找出调控骨关节炎发病的miRNA,可为骨关节炎的早期诊断及靶向治疗提供强有力的理论依据。本研究已经鉴别出的5种miRNA在骨关节炎软骨中高表达,以上均可能是骨关节炎发病的潜在致病基因。因此,我们将继续针对这5种miRNA在骨关节炎发病机制中的作用进行深入研究。
本研究所筛选的目标基因在血浆中部分无表达,部分表达组间比较差异无统计学意义。推论可能是因为5种miRNA在关节软骨组织及血浆中出现的机制不同,在血浆中出现的机制较为复杂,有待进一步研究及积累更多临床数据。
由于正常软骨标本获取困难,miRNA筛选、测序复杂,且价格昂贵,本研究只在小样本中对骨关节炎潜在的致病基因做初步筛选。但是以上miRNA在血浆中表达不稳定,无规律可循。我们计划下一步扩大软骨和血浆样本量,再次进行循环验证,并探索这些潜在致病基因在骨关节炎发病过程中的调控机制,以期通过干预发现防治骨关节炎的新方法。
[1] Lu J, Getz G, Miska EA, et al. MicroRNA expression profiles classify human cancers[J]. Nature, 2005,435(7043):834-838.
[2] Marcucci G, Radmacher MD, Maharry K, et al. MicroRNA expression in cytogenetically normal acute myeloid leukemia[J]. N Engl J Med, 2008,358(18):1919-1928.
[3] Pfeffer S, Zavolan M, Grasser FA, et al. Identification of virus-encoded microRNAs[J]. Science, 2004,304(5671):734-736.
[4] Denli AM, Tops BB, Plasterk RH, et al. Processing of primary microRNAs by the microprocessor complex[J]. Nature, 2004,432(7014):231-235.
[5] Gregory RI, Yan KP, Amuthan G,et al. The microprocessor complex mediates the genesis of microRNAs[J]. Nature, 2004,432(7014):235-240.
[6] Lee Y, Ahn C, Han J, et al. The nuclear RNase Ⅲ Drosha initiates microRNA processing[J]. Nature, 2003,425(6956):415-419.
[7] Chendrimada TP, Gregory RI, Kumaraswamy E, et al. TRBP recruits the Dicer complex to Ago2 for microRNA processing and gene silencing[J]. Nature, 2005,436(7051):740-744.
[8] Sun BK, Tsao H. Small RNAs in development and disease[J]. J Am Acad Dermatol, 2008,59(5):725-737.
[9] Farh KK, Grimson A, Jan C, et al. The widespread impact of mammalian MicroRNAs on mRNA repression and evolution[J]. Science, 2005,310(5755):1817-1821.
[10] Iliopoulos D, Malizos KN, Oikonomou P, et al. Integrative microRNA and proteomic approaches identify novel osteoarthritis genes and their collaborative metabolic and inflammatory networks[J]. PLoS One, 2008,3(11):e3740.
[11] Diaz-Prado S, Cicione C, Muinos-Lopez E, et al. Characterization of microRNA expression profiles in normal and osteoarthritic human chondrocytes[J]. BMC Musculoskeletal Disorders, 2012(13):144.
[12] Zuntini M, Salvatore M, Pedrini E, et al. MicroRNA profiling of multiple osteochondromas: identification of disease-specific and normal cartilage signatures[J]. Clin Genet, 2010,78(6):507-516.
[13] Tardif G, Hum D, Pelletier JP, et al. Regulation of the IGFBP-5 and MMP-13 genes by the microRNAs miR-140 and miR-27a in human osteoarthritic chondrocytes[J]. BMC Musculoskelet Disord, 2009(10):148.
[14] Akhtar N, Rasheed Z, Ramamurthy S, et al. MicroRNA-27b regulates the expression of matrix metalloproteinase 13 in human osteoarthritis chondrocytes[J]. Arthritis Rheum, 2010,62(5):1361-1371.
[15] Abouheif MM, Nakasa T, Shibuya H, et al. Silencing microRNA-34a inhibits chondrocyte apoptosis in a rat osteoarthritis model in vitro[J]. Rheumatology(Oxford), 2010,49(11):2054-2060.
北京市自然科学基金资助项目(7102166)。
10.3969/j.issn.1002-266X.2016.37.020
R684.3
B
1002-266X(2016)37-0061-03
2016-07-21)

