缺氧缺血性脑病新生儿血清8-羟基脱氧鸟苷水平变化及其临床意义
李晓梅,刘建红,朱法荣,刘向红,康丽丽,李晓莺
(济南市儿童医院,济南 252000)
缺氧缺血性脑病新生儿血清8-羟基脱氧鸟苷水平变化及其临床意义
李晓梅,刘建红,朱法荣,刘向红,康丽丽,李晓莺
(济南市儿童医院,济南 252000)
目的 探讨8-羟基脱氧鸟苷(8-OHDG)在新生儿缺氧缺血性脑病(HIE)发生、发展中的作用。方法 选择60例HIE患儿作为观察组,其中HIE为轻度、中度、重度各20例;同期非HIE,有发热表现但排除颅内感染的足月新生儿20例作为对照组。采用高效液相色谱法检测两组出生后1、3、7天血清8-OHDG。结果 出生后1、3、7天血清8-OHDG(pg/mL)水平:观察组分别为43.8±2.1、69.9±3.2、34.9±2.8,其中轻度者分别为29.6±4.5、46.2±3.1、20.6±4.5,中度者分别为42.3±3.1、62.6±7.0、37.5±3.1,重度者分别为54.2±2.9、90.2±6.2、47.1±4.1;对照组分别为25.7±3.1、36.6±4.6、33.1±1.8;观察组出生后第3天血清8-OHDG水平明显高于出生后1、7天,相同时间点观察组血清8-OHDG水平明显高于对照组,P均<0.05;观察组轻度、中度、重度者相同时间点两两比较差异均有统计学意义(P均<0.05)。结论 8-OHDG可能参与了HIE的病理生理过程,血清8-OHDG水平可作为判断HIE病情的指标。
缺氧缺血性脑病;新生儿;8-羟基脱氧鸟苷
围生期各种病理因素导致胎儿机体的供氧供血减少,可引起机体组织器官缺氧缺血性损害,其中新生儿窒息是影响神经系统发育的重要因素,脑细胞对此最为敏感,脑细胞凋亡在神经元变性的病理过程中起至关重要的作用[1],由此即可导致新生儿缺氧缺血性脑病(HIE),HIE轻度者几乎不留神经系统后遗症,中重度者病死率高,存活者多遗留智力低下、语言、运动、认知功能障碍等后遗症。8-羟基脱氧鸟苷(8-OHDG)可评估体内氧化损伤和修复及氧化应激与DNA损伤程度,是目前国际上公认的评价DNA氧化损伤和氧化应激状态的敏感指标和生物标志物[2~5]。本课题探讨HIE患儿血清8-OHDG的水平变化及临床意义。
1 资料与方法
1.1 临床资料 观察组为2010年2月~2013年2月在我院住院的足月HIE患儿(排除早产因素对脑发育的影响)60例,其中男31例、女29例,剖宫产28例、顺产32例,胎(周)龄(38.3±1.2)周,体质量(3.78±0.42)kg,母亲年龄(29.5±1.1)岁。根据2005年第4届全国新生儿学术会议修订的新生儿HIE的诊断依据和临床分度标准[6],HIE为轻度、中度、重度者各20例。对照组为同期住院治疗的非HIE,有发热表现但经完善脑脊液检查最终排除颅内感染的足月新生儿20例,其中新生儿肺炎8例、新生儿败血症6例、新生儿脓疱疮6例,男11例、女9例;剖宫产12例、顺产8例,胎(周)龄(39.2±0.9)周,体质量(3.70±0.54)kg,母亲年龄(27.2±1.6)岁。两组性别、产式、胎龄、体质量、母亲年龄具有可比性。
1.2 血清8-OHDG检测 两组分别于出生1、3、7天采集静脉血1.5 mL,3 000 r/min离心10 min分离血清。采用高效液相色谱法[7]检测8-OHDG。操作过程中避免任何细胞刺激, 质谱条件:选用的电离源为ESI(+),采用多反应模式进行检测(MRM);色谱条件:流动相:A=甲醇,B=10 mmol/L醋酸铵含0.1%甲酸的水溶液;A∶B=80∶20 (v/v),流速:0.6 mL/min;进样量:20 μL。

2 结果
两组不同时间点血清8-OHDG水平比较见表1,观察组不同病情者血清8-OHDG水平比较见表2。由表1可见,相同时间点观察组血清8-OHDG水平明显高于对照组,P均<0.05; 观察组出生3天血清8-OHDG水平明显高于出生后1、7天。由表2可见,观察组轻度、中度、重度者相同时间点血清8-OHDG水平均明显高于对照组(P均<0.05)。
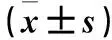
表1 两组不同时间点血清8-OHDG水平比较
注:与同组出生1天及出生7天比较,*P<0.05;与对照组同时间点比较,△P<0.01。

表2 观察组不同病情者血清8-OHDG水平比较±s)
3 讨论
各种围产期异常的母体、胎盘、脐带、羊水及胎儿因素等均可引起新生儿窒息,导致机体多脏器缺氧缺血性损害,脑细胞对缺氧最为敏感。新生儿脑组织的生理结构、功能、细胞间连接、信号传导通路等方面均与成人脑组织不同,极易受各种不良因素影响,缺氧后的反应也不一样。缺氧缺血性损伤后机体可产生大量活性氧自由基(ROS)如羟自由基、单线态氧等攻击DNA分子中的鸟嘌呤碱基第8位碳原子而产生的一种氧化性加合物,其可攻击DNA中的鸟嘌呤使脱氧鸟苷氧化成8-OHDG[8]。自由基一直被认为是引起DNA损伤的主要因素之一,可对生物体产生多种损害作用,其作用机制主要涉及DNA的损伤。羟自由基和超氧阴离子能直接与DNA分子反应,导致DNA链断裂、碱基修饰和DNA蛋白交联等氧化性DNA损伤,慢性的神经元凋亡在神经细胞的变性中起重要作用,并由此导致脑细胞凋亡或坏死。Kato等[9]在心血管领域研究证实8-OHDG是缺氧后DNA分子发生损伤的生物标志。Kang等[10]通过研究孕母及其新生儿也发现8-OHDG是氧化应激损伤的标志物。有研究表明,海马区蛋白质对氧化应激损伤非常敏感,机体的氧化损伤广泛存在,主要表现为生物大分子(如DNA、蛋白质、脂类等)结构和功能的损伤,氧化性DNA损伤在生物体细胞老化、死亡的发生过程中起重要作用[11,12]。
本研究结果表明,观察组在病程同一阶段存在缺氧缺血性损害后体内细胞出现DNA损伤,血清中8-OHDG生成明显增多;对照组血清中8-OHDG虽有一定表达,但在急性期(住院治疗3日内)及恢复期(病情好转)差异无显著性。本研究观察组出生1、3、7天8-OHDG水平均明显高于对照组,证实8-OHDG水平随缺氧缺血性DNA损伤加重而升高,8-OHDG可能参与了HIE的病理生理过程。本研究观察组病情轻、中、重者血清8-OHDG水平逐渐升高,提示其脑细胞缺氧重者细胞DNA损伤相应加重,8-OHDG与病情轻重程度密切相关,动态监测血清8-OHDG水平可指导临床治疗及评估预后[13,14]。有动物实验表明,脑缺氧缺血损伤发生脑梗死再灌注后的12 h 8-OHDG明显升高,DNA断链可被检测出,24 h达高峰,虽然时间峰值与临床结果稍有出入,但提示8-OHDG可作为DNA的损伤标志物在一定程度上反映急性脑损伤程度[15]。本研究发现,8-OHDG在HIE的不同阶段变化趋势不同。出生后第1天时随着分娩过程及机体环境的改变,脑细胞缺氧得到一定程度改善,但细胞DNA损伤并未停止,血清中8-OHDG水平开始升高;出生后第3天为新生儿HIE的急性期,8-OHDG水平较出生第1天及恢复期第7天明显升高,与疾病的自然病程一致。提示临床HIE急性期血清8-OHDG升高的患儿脑细胞损伤较重,尽快改善脑细胞代谢、防止脑水肿加重可缩小脑损伤面积。
综上所述,血清8-OHDG水平可作为判断窒息新生儿是否会发生HIE的指标,为可用于判断神经节苷酯的治疗效果及对DNA损伤的修复作用。
[1] Suganuma H, Arai Y, Kitamura Y, Maternal docosahexaenoic acid-enriched diet prevents neonatal brain injury[J]. Neuropathology, 2010,30(6):597-605.
[2] Fukuda M, Yamauchi H, Yamamoto H, et al. The evaluation of oxidative DNA damage in children with brain damage using 8-hydroxydeoxyguanosine levels[J]. Brain Dev, 2008,30(2):131-136.
[3] 刘海霞.8-羟基脱氧鸟苷在早产儿脑损伤中的临床意义[J].宁夏医学杂志,2015,10(37):895-896.
[4] Honda M, Yamada Y, Tomonaga M, et al. Correlation of urinary 8-hydroxy-2′-deoxyguanosine (8-OHdG), a biomarker of oxidative DNA damage, and clinical features of hematological disorders: a pilot study[J]. Leuk Res, 2000,24(6):461-468.
[5] 邓娟,周华东,陈曼,等.局灶性脑缺血再灌注大鼠神经元DNA氧化损伤的研究[J].中国危重病急救医学,2001,13(8):478-480.
[6] 中华医学会儿科学会新生儿学组.新生儿缺氧缺血性脑病诊断标准[J].中华儿科杂志,2005,43(8):584.
[7] 刘仲,于志刚.人尿液8-羟基脱氧鸟苷的超高效液相色谱-串联质谱联用检测方法[J].中华预防医学杂志,2016,50(4):357-361.
[8] 汪莉君,邵华.8-OHDG检测方法研究进展[J].中国卫生检验杂志,2007,17(10):5191-5195.
[9] Kato S, Yoshimura K, Kimata T, et al. urinary 8-hydroxy-2′-deoxyguanosine: a biomarker for radiation-induced oxidative DNA damage in pediatric cardiac catheterization[J]. J Pediatr, 2015,167(6):1369-1374.
[10] Kang S, Kim S, Park J, et al. Urinary paraben concentrations among pregnant women and their matching newborn infants of Korea, and the association with oxidative stress biomarkers[J]. Sci Total Environ, 2013,9(1):461-462.
[11] Furukawa A, Kawamoto Y, Chiba Y, et al. Proteomic identification of hippocampal proteins vulnerable to oxidative stress in excitotoxin-induced acute neuronal injury[J]. Neurobiol Dis, 2011,43(3):706-714.
[12] Takizawa Y, MiYazawa T, Nonoyama S, et al. Edaravone inhibits DNA peroxidation and neuronal cell death in neonatal hypoxic-ischemic encephalopathy Model Rat[J]. Pediatr Res, 2009,65(6):636-641.
[13] Matsubasa T, Uchino T, Karashima S, et al. Oxidative stress in very low birth weight infants as measured by urinary 8-OHdG[J]. Free Radic Res, 2002,36(2):189-193.
[14] 孙咏梅,戴树栓,袭著平.DNA加合物8-OHDG特性研究[J].上海环境科学,2001,20(9):409-413.
[15] Liu H, Uno M, Kitazato KT, et al. Peripheral oxidative biomarkers constitute a valuable indicator of the severity of oxidative brain damage in acute cerebral infarction[J]. Brain Res, 2004,1025(1-2):43-50.
山东省医药卫生科技发展计划(HD004)。
李晓莺(E-mail: lxy_jn@sina.com)
10.3969/j.issn.1002-266X.2016.36.017
R722.1
B
1002-266X(2016)36-0054-03
2015-12-28)

