10例甲状腺岛状癌患者临床病理特征及预后分析
蒋春樊,杨眉
(襄阳市中心医院,湖北襄阳441021)
10例甲状腺岛状癌患者临床病理特征及预后分析
蒋春樊,杨眉
(襄阳市中心医院,湖北襄阳441021)
目的 为进一步提高甲状腺岛状癌(ITC)的诊治水平提供依据。方法 回顾性分析10例ITC患者的临床资料,分析其临床病理特征、治疗及预后情况。结果 10例ITC患者年龄16~69岁、中位年龄45岁,病程1~48个月;临床分期:Ⅰ期2例,Ⅱ期1例,Ⅲ期3例,Ⅳ期4例;因颈部肿块发现就诊8例,因声音嘶哑就诊、因吞咽不适就诊各1例。影像学表现:质硬、界限不清肿块或多灶性病变,多伴有神经、气管、血管等侵犯症状及远处转移;病理学特征:肿瘤由低分化小细胞构成,大小一致,有丝核分裂像与核仁不易见到,可成巢状排列,即小岛状结构,局部呈大片坏死,而存活的瘤细胞放射状排列,中心围绕小血管,呈“血管外皮瘤样”;10例患者中生长结构呈岛状者5例,有核坏死者6例,有核扭曲者8例,有血管浸润者7例。所有患者均行手术治疗,术后辅以131I治疗者5例,辅以外放射治疗者1例。术后1年生存9例,术后3年生存6例,术后5年生存5例,中位生存时间为55个月。结论 ITC恶性程度较高,易发生转移,肿瘤细胞呈现岛状、梁状或实性生长结构,病理特征介于高分化与未分化甲状腺癌之间;临床治疗以甲状腺切除+颈淋巴结清除为主,术后辅以131I放射治疗,患者预后较差。
甲状腺岛状癌;临床病理特征;预后
甲状腺岛状癌(ITC)是一种临床罕见的甲状腺肿瘤,主要来源于甲状腺乳头状癌或滤泡癌,部分来源不确定,其病理特征介于高分化型与未分化型甲状腺癌之间。因其发病罕见,临床医师对其认识不足,且其诊断标准存在一定争议,故首次诊断时易被误诊为甲状腺乳头状癌或滤泡癌,常因多次复发或转移才被确诊,患者预后较差[1,2]。近年来我国甲状腺癌的发病率不断升高,ITC病例亦逐渐增多。本研究分析10例ITC患者的临床特点,旨在为提高ITC的诊治水平提供依据。
1 临床资料
1.1 基本资料 1996年4月~2011年11月我院收治甲状腺恶性肿瘤患者4 711例,经术后组织病理检查确诊ITC 10例(0.21%)。诊断以都灵会议确定的ITC诊断共识为依据[3]:①具有甲状腺滤泡源性恶性肿瘤的基础特征,且存在岛状、梁状或实性结构;②不具有毛玻璃样核等乳头状癌细胞核特征;③具有核扭曲、核坏死或核分裂象3/10 HPF及以上形态学特征。排除标准:①分化型及非分化型甲状腺癌者;②合并其他恶性肿瘤者;③罹患精神异常、肝肾功能严重障碍、凝血系统障碍等者;④临床资料不全者。其中,男3例、女7例,年龄16~69岁、中位年龄45岁,病程1~48个月;临床分期:Ⅰ期2例,Ⅱ期1例,Ⅲ期3例,Ⅳ期4例;因颈部肿块发现就诊8例,因声音嘶哑就诊、因吞咽不适就诊各1例。
1.2 影像学特征 10例患者均接受B超、CT常规及增强扫描。B超检查结果显示:甲状腺弥漫性增大,可见不规则肿块影,呈低回声且内部回声粗糙不均匀,后方回声减弱或消失,边界欠清楚,边缘不整齐;4例无明显包膜回声,可见小的强回声灶或弥漫性钙化斑,CDFI示肿块内部血流紊乱,伴有动脉血流及阻力指数增高。CT检查结果显示:7例表现为软组织高密度结节影,不规则弥漫浸润性肿块;3例未发现弥漫浸润性肿块;6例发现内部液化坏死,与周围组织分界欠清,侵及多个邻近组织,增强扫描显示肿瘤不规则强化,岛状肿瘤结构,表面不光滑,边界模糊。
1.3 临床病理特征 组织病理形态:肿瘤呈弥漫状或结节状,质硬,剖面呈灰白色或灰红色,肿瘤直径>4 cm者6例;光镜下可见肿瘤组织由大小一致的低分化小细胞构成,有丝核分裂象与核仁不易见到,成巢状排列,薄层纤维组织围绕在周边,即小岛状结构,局部大片坏死,而存活的瘤细胞呈放射状排列,中心围绕小血管,呈“血管外皮瘤样”。细胞学特征:胶质缺乏,无砂砾体,细胞核重叠较广、细胞核质比增大;滤泡组织和小的形态一致的肿瘤细胞构成肿瘤细胞丛,可见明显的血管侵犯,见插页Ⅱ图4。10例患者肿瘤突破甲状腺包膜7例,侵及气管5例,侵及食管4例,侵及喉返神经5例,侵及血管5例。伴有颈淋巴结转移7例,伴远处转移5例。组织病理证实,TNM分期与临床分期基本一致。10例患者临床病理特征见表1。
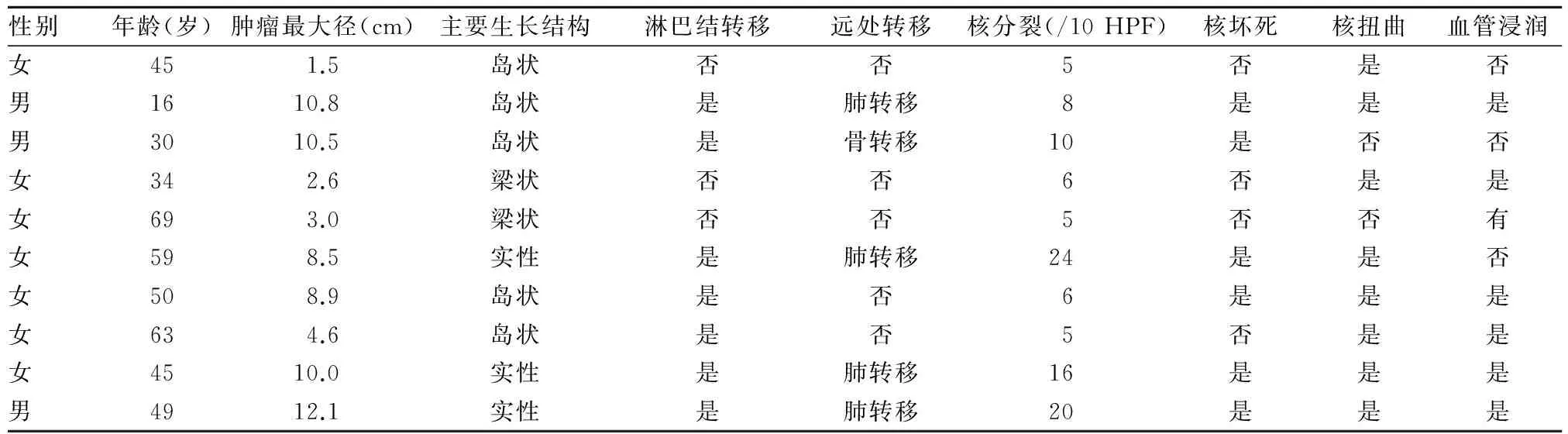
表1 10例ITC患者临床病理特征
1.4 治疗及预后 10例患者经影像学检查确诊后接受手术治疗。4例单侧腺叶单发病灶患者中,1例由于术前考虑为甲状腺腺瘤行甲状腺肿物切除术,术后病理证实为ITC,再次手术行患侧腺叶切除+扩大中央区淋巴结清除术,术后给予左甲状腺素治疗;3例患者切除肿瘤后,快速冰冻病理证实为ITC,施行患侧腺叶切除+中央区或扩大中央区淋巴结清除术,术后给予左甲状腺素治疗。6例弥漫性ICT患者中,5例患者手术次数至少2次,其中4例反复手术史有3次以上(包括处理原发灶复发及颈部淋巴结转移),最终均行全甲状腺切除+双侧Ⅱ~Ⅵ区全颈淋巴结清除术;1例胸骨后侵犯者行胸骨劈开后肿物切除术,1例因双侧喉返神经受累行神经移植及气管切开术,术后1个月拔除气管套管;5例患者在全甲状腺切除术后均给予放射性131I治疗肺或骨转移灶,术后给予左甲状腺素及替代治疗。另1例弥漫性ICT患者病情进展较快,出现间变表现,行双侧甲状腺次全切除+气管切开术,术后给予外放射治疗。术后随访时间6~168(55.0±44.5)个月,无一例失访,术后1年生存9例、术后3年生存6例、术后5年生存5例,中位生存期55个月。
2 讨论
ITC在欧洲和南美洲比较常见,尤其是意大利[4],而在我国并不常见。本研究ITC在甲状腺恶性肿瘤中仅占0.21%,明显低于文献报道的3%~7%[5]。其原因可能与不同地区经济、环境条件等因素不同有关,也可能与我国ITC报道少、对ITC认识不足有关。ITC好发于中老年人,女性发病率明显高于男性,本研究患者中位年龄为45岁,男女比为1:2.33,进一步证实了上述观点。本研究患者呈多发病灶者6例,多伴淋巴结转移;此外,ITC多具有侵袭性,常侵及甲状腺包膜、气管或血管等[6,7]。本研究患者颈淋巴结转移占70%,与Agha等[5]报道一致;伴远处转移者5例,如肺、骨等部位[8],其次是脑、肝等。Carcangiu等[9]研究了25例特殊甲状腺癌患者,发现其癌细胞在镜下呈岛屿状排列,故定名为甲状腺低分化癌(岛状癌),并发现“Langhans wuehemde struma”的镜下形态与ITC一致。本组10例ITC患者组织病理学显示肿瘤组织由大小不一低分化小细胞构成,呈现小岛状结构,局部大片坏死,存活瘤细胞呈现放射状排列特点。且根据研究结果,结合相关文献报道认为,ITC临床病理特征主要表现为梁状、岛状或实性结构,伴核分裂象多、核扭曲或核坏死细胞特点。
ITC在影像学上表现呈进行性生长、不规则实质性肿块或弥漫性增大等特点,易与甲状腺腺瘤或桥本甲状腺炎混淆,往往需要通过细针穿刺活检、术中冰冻病理或术后病理结果作出诊断,而影像学检查对术前诊断有所帮助。B超检查可通过肿物的边界、包膜情况、内部回声、钙化以及后方回声等特点与良性肿瘤相鉴别[10],ITC肿物CDFI显示肿物内部血流紊乱;CT对肿物侵犯的范围及与周围血管的关系有重要的定位作用,尤其部分患者出现胸骨后侵犯,更需要特别关注[11]。经济条件允许的患者可行PET/CT检查,可全面了解全身肿瘤状况,尤其对判断分期。
ITC明确诊断后应尽早行手术治疗[12],术中尽可能切净肿瘤组织,尤其是胸骨后,必要时行胸骨劈开术。由于ITC具有较强的侵袭性,术后若侵犯气管则需行气管切开术。目前对术后放射性131I及外放射治疗可延长患者的生存率存在争议[13],我们认为全甲状腺切除术后具有较高吸碘率的患者术后放射性131I治疗用以治疗转移灶是必须的。对临床表现为甲状腺弥漫性病变或影像诊断不除外恶性的甲状腺肿瘤(如发展迅速、气管、血管、神经受侵表现、颈淋巴可见转移或远处转移等)者术前应通过针吸活检或术中冰冻病理活检进一步明确诊断,进而采用适当术式治疗,从而避免多次手术。ICT易复发、转移,患者预后差,常将其分为中间分化型甲状腺癌(比普通的分化型甲状腺癌侵袭性高,比未分化型甲状腺癌侵袭性低),其5年及10年生存率较低[14],改善患者预后是近年来ICT研究的热点。在治疗上应采取个体化、功能性和多学科的积极治疗措施[15]。本研究10例患者中术后1年生存9例,术后3年生存6例,术后5年生存5例,中位生存期为55个月。表明ITC患者预后较差,其原因可能与ITC恶性程度高、腺外侵犯等有关。近年来人们对ITC进行了RAS、p53、p21、bcl-2等相关基因研究,但至今仍未发现有价值的肿瘤分子标志物;对手术难以切除且放射性131I治疗不敏感的ITC患者行分子靶向治疗可能是其治疗的发展方向之一。
[1] 杨雅洁,温文,关弘,等.甲状腺低分化癌三例报道并文献复习[J].中华临床医师杂志(电子版),2011,5(4):1145-1148.
[2] 孙健,杨堤,崔全才.低分化甲状腺癌临床病理学进展[J].中华病理学杂志,2011,40(12):850-853.
[3] Volante M, Collini P, Nikiforov YE, et al. Poorly differentiated thyroid carcinoma: the Turin proposal for the use of uniform diagnostic criteria and an algorithmic diagnostic approach[J]. Am J Surg Pathol, 2007,31(8):1256-1264.
[4] Asioli S, Erickson LA, Righi A, et al. Poorly differentiated carcinoma of the thyroid: validation of the Turin proposal and analysis of IMP3 expression[J]. Mod Pathol, 2010,23(9):1269-1278.
[5] Agha A, Glockzin G, Woenckhaus M, et al. Insular carcinomas of the thyroid exhibit poor prognosis and long-term survival in comparison to follicular and papillary T4 carcinomas[J]. Langenbecks Arch Surg, 2007,392(6):671-677.
[6] Chao TC, Lin JD, Chen MF. Insular carcinoma: infrequent subtype of thyroid cancer with aggressive clinical course[J]. World J Surg, 2004,28(4):393-396.
[7] Mvouni S, Tombu S, Meurisse M, et al. Management of an insular thyroid carcinoma invading the larynx and trachea[J]. B-ENT, 2006,2(1):17-20.
[8] Donnellan KA, Carron JD, Bigler SA, et al. Metastatic insular thyroid carcinoma in the pediatric patient[J]. Am J Otolaryngol, 2009,30(7):61-64.
[9] Carcangiu ML, Zampi G, Rosai J. Poorly differentiated ("insular") thyroid carcinoma. A reinterpretation of Langhans "wuchernde Struma"[J]. Am J Surg Pathol, 1984,8(9):655-668.
[10] 赵敬柱,高明,张晟,等.B超介导甲状腺微小乳头状癌定性及定位诊断价值研究[J].中国实用外科杂志,2013,33(5):393-396.
[11] 张镇滔,郑晓林,张旭升,等.甲状腺常见病变CT诊断及与ECT对照分析[J].中国CT和MRI杂志,2014,12(4):54-56.
[12] 高明.甲状腺癌的诊疗进展及策略[J].中华耳鼻咽喉头颈外科杂志,2010,45(11):887-890.
[13] Lai HW, Lee CH, Chen JY, et al. Insular thyroid carcinoma: collective analysis of clinicohistologic prognostic factors and treatment effect with radioiodine or radiation therapy[J]. J Am Coll Surg, 2006,203(5):715-722.
[14] Asioli S, Erickson LA, Righi A, et al. Poorly differentiated carcinoma of the thyroid: validation of the Turin proposal and analysis of IMP3 expression[J]. Mod Pathol, 2010,23(9):1269-1278.
[15] 方铣华,葛明华,罗娟.甲状腺低分化癌(岛状癌)的病理诊断[J].肿瘤学杂志,2011,17(8):625-629.
10.3969/j.issn.1002-266X.2016.36.016
R737.1
B
1002-266X(2016)36-0051-03
2015-11-03)

