体外冲击波疗法联合仙桃草口服用于兔桡骨骨不连临床效果观察
赵子星,李宏宇,席立成,郁少林,刘搏宇
(广西壮族自治区人民医院,南宁530021)
体外冲击波疗法联合仙桃草口服用于兔桡骨骨不连临床效果观察
赵子星,李宏宇,席立成,郁少林,刘搏宇
(广西壮族自治区人民医院,南宁530021)
目的 探讨体外冲击波疗法(ESW)联合中草药仙桃草口服对桡骨骨不连的治疗效果。方法 将120只桡骨骨不连兔按随机数字表法分为联合组、仙桃草组、ESW组和对照组,各30只。各组均予标准饲喂养1周。ESW组进行ESW治疗1次;仙桃草组将1 g仙桃草磨成粉剂加入到60 g精饲料中,制成仙桃草混合饲料100 g,2次/d,共12周。联合组行ESW联合仙桃草混合饲料喂养,对照组不予特殊处理。各组于分组处理后48 h(T0)、1周(T1)、2周(T2)、4周(T3)、6周(T4)、12周(T5),分别取5只大白兔行X线检查,观察其骨折愈合情况;处死动物,取骨痂组织,采用免疫组化法检测骨形态发生蛋白2(BMP-2)、血管内皮生长因子(VEGF)。结果 随时间延长,联合组和ESW组骨痂逐渐增多,骨痂密度升高,骨不连处逐渐愈合,联合组T2~T5时间点骨折愈合情况均优于ESW组;仙桃草组和对照组骨折间隙仍存在,骨折端仍为硬化骨,各时间点骨折愈合情况无明显变化。与T0时间点比较,各组T1~T5时间点骨痂组织BMP-2、VEGF表达均升高(P均<0.05)。联合组T1~T5时间点骨痂组织BMP-2、VEGF表达均高于其余各组,ESW组均高于仙桃草组、对照组(P均<0.05)。仙桃草组T1~T5时间点骨痂组织VEGF表达均高于对照组(P均<0.05),BMP-2表达比较差异无统计学意义(P均>0.05)。结论 ESW联合仙桃草口服对兔桡骨骨不连的愈合具有促进作用,其机制可能与上调骨痂组织BMP-2、VEGF表达有关。
骨不连,兔;体外冲击波;仙桃草;骨形态发生蛋白2;血管内皮生长因子
骨组织具有强大的自身修复能力,但部分患者骨折后8个月仍不能愈合,而3个月无愈合倾向即称为骨不连。目前临床对骨不连多采用手术治疗,但具有损伤大、费用高和需多次手术等缺点[1]。研究发现,体外冲击波疗法(ESW)能够活跃成骨细胞,促进骨痂生成,特别是对于长骨骨不连的治疗效果较好;中药仙桃草亦具有一定的成骨作用[2]。2012年12月~2015年5月,本研究对大白兔桡骨骨不连模型采用ESW联合仙桃草治疗,取得较好效果。现报告如下。
1 材料与方法
1.1 材料 雄性新西兰大白兔120只,兔龄5~6个月,体质量3.0~3.5 kg,由广西医科大学动物实验中心提供。试剂与仪器:SABC试剂盒、DAB显色试剂盒(武汉博士物生物工程有限公司);体外冲击波碎石机(德国多尼尔医疗技术公司),小型台式离心机(I-13,美国Sigma公司),数码成像X线机(德国西门子公司),光学显微镜(BX40,日本Olympus公司),脱水机、石蜡切片机、包埋机、摊片机(德国Leica公司)。
1.2 模型制备与分组处理 120只大白兔标准饲料饲养1周后,制作兔桡骨骨不连模型:10%水合氯醛耳缘静脉麻醉,截除右侧桡骨中段1 cm,冲洗后填塞明胶海绵,逐层缝合。3个月后X线片检查显示骨折端硬化,骨折间隙清晰可见,表明骨不连模型制备成功。将120只桡骨骨折兔按随机数字表法分为ESW组、仙桃草组、联合组和对照组,各30只。分组后第1天ESW组行1次ESW治疗:耳缘静脉麻醉后,采用体外冲击波碎石机分别于体外骨折远、近端边缘处行冲击治疗。设置参数:焦点能量0.5 mJ/mm2、频率70~80次/min、冲击量800次、焦点聚焦范围1.5 cm2。仙桃草组行仙桃草混合饲料喂养:将1 g仙桃草磨成粉剂加入到60 g精饲料中,制成仙桃草混合饲料100 g,2次/d,共12周。联合组参照上法给予ESW治疗联合仙桃草混合饲料喂养。对照组给予精饲料喂养,不予特殊处理。
1.3 相关指标观察
1.3.1 骨折愈合情况 各组处理48 h(T0)、1周(T1)、2周(T2)、4周(T3)、6周(T4)、12周(T5)分别取5只大白兔行X线检查,观察骨折愈合情况。
1.3.2 骨痂组织骨形态发生蛋白2(BMP-2)、血管内皮生长因子(VEGF)检测 采用免疫组化法。各组观察骨折愈合情况后以空气栓塞法处死。取骨不连处长1.5~2.0 cm的骨痂组织,4%多聚甲醛溶液固定,10% EDTA脱钙液脱钙;乙醇梯度脱水,二甲苯透明,石蜡包埋,HE染色处理,4 μm连续切片。石蜡切片脱蜡水化,3% H2O2抗原修复,正常羊血清封闭,滴加BMP-2或VEGF单克隆抗体一抗和生物素标记的二抗;加入SABC液,DAB显色,苏木素复染,梯度乙醇脱水干燥,二甲苯透明,中性树胶封固。Olympus光学显微镜下采用盲法观察免疫组化切片,应用Imagepro Plus6.0图像软件对阳性反应细胞的平均光密度值(MOD)进行分析。
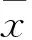
2 结果
2.1 各组骨折愈合情况比较 各组T0、T1时间点骨折愈合未见明显变化。联合组T2时间点骨折端有模糊骨痂影出现;T3时间点可见骨折间隙缩小,骨痂密度增高,呈云雾状;T4时间点骨痂逐渐增多,骨痂密度较高,但骨纹理较乱;T5时间点骨痂较致密,外形趋于正常,骨纹理有规律的纵向排列,髓腔已通。ESW组T3时间点可见骨痂影,骨不连区间隙缩小;T4时间点骨痂明显增多,骨痂密度高,骨痂影呈梭形,可见骨小梁;T5时间点骨痂密度进一步增高,骨小梁增多,排列较规律。联合组各时间点骨折愈合情况均优于ESW组,而仙桃草组和对照组骨折间隙仍存在,骨折端仍为硬化骨,各时间点骨折愈合情况无明显变化。
2.2 各组骨痂组织BMP-2、VEGF表达比较 与T0时间点比较,各组T1~T5时间点骨痂组织BMP-2、VEGF表达均升高(P均<0.05)。联合组BMP-2、VEGF表达均高于其余各组,ESW组均高于仙桃草组、对照组(P均<0.05)。仙桃草组T1~T5时间点骨痂组织VEGF表达均高于对照组(P均<0.05),骨痂组织BMP-2表达比较差异无统计学意义(P均>0.05)。见表1。
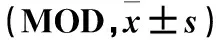
表1 各组骨痂组织BMP-2、VEGF表达比较
注:与同组T0时间点比较,*P<0.05;与联合组同时间点比较,△P<0.05;与桃仙草组同时间点比较,#P<0.05;与ESW组同时间点比较,▲P<0.05。
3 讨论
研究证实,ESW可以诱导血管生成,上调成骨相关生长因子,从而促进细胞的增殖和分化,有助于组织再生[3~5]。仙桃草具有化瘀止血、清热消肿、止痛等功效,主治跌打损伤[6~7]。现代药理研究表明,仙桃草的主要化学成分为β-谷甾醇、胡萝卜苷、绿原酸等[8]。绿原酸是仙桃草的成骨活性成分之一,能够促进成骨细胞增殖分化[9]。本研究结果表明,随时间延长,联合组和ESW组骨痂逐渐增多,骨痂密度升高,骨不连处逐渐愈合;联合组T2~T5时间点骨折愈合情况均优于ESW组;仙桃草组和对照组骨折间隙仍存在,骨折端仍为硬化骨,各时间点骨折愈合情况无明显变化。说明ESW联合仙桃草可促进兔桡骨骨不连的愈合。
骨组织的愈合受多种细胞生长因子的调控。BMP-2和VEGF的成骨作用比较突出[10,11]。BMP-2是促进骨愈合的重要生物因子[12],其表达上调能增强组织细胞向成骨细胞分化的潜能,促进成骨;其表达下降则可导致间质细胞向成纤维细胞转化,抑制成骨。Shibasaki等[13]研究认为,BMP-2主要是通过阻断c-Met通路实现其成骨作用。VEGF为一种有效的血管生成因子,能够促进骨痂内毛细血管生成,新生毛细血管长入后可带来大量骨生长所需的细胞因子和生长因子,从而促进骨不连的愈合[14]。本研究各组T0时间点骨痂组织BMP-2、VEGF表达比较差异无统计学意义,可能与观察时间短有关;仙桃草组T1~T5时间点骨痂组织VEGF表达均高于对照组,而两组骨痂组织BMP-2表达比较差异无统计学意义,说明仙桃草的主要作用在于上调VEGF表达,加速骨不连断端毛细血管生成,为骨痂生长带来必须的营养成分,间接促进骨不连愈合[15~17]。联合组T1~T5时间点骨痂组织BMP-2、VEGF表达均高于其余各组,ESW组均高于仙桃草组、对照组,说明ESW联合仙桃草口服促进兔桡骨骨不连愈合的作用机制可能与其上调骨痂组织BMP-2、VEGF表达有关。分析原因,可能是冲击波产生的微震动使本来硬化的骨端产生微小新鲜骨折,随之发生无菌性炎症,炎性反应导致机体释放大量炎性物质,从而刺激局部BMP-2和VEGF表达上调[6,7]。BMP-2上调能够促进骨痂生长,逐渐缩小骨断端间隙,促进骨不连愈合; VEGF表达上调能激发骨断端发生血管反应,使得大量新生毛细血管长入,带来大量的营养物质及生长因子;二者相互协作,最终达到促进骨折愈合的目的。
综上所述,ESW联合仙桃草口服对兔桡骨骨不连的愈合具有促进作用,其机制可能与上调骨痂组织BMP-2、VEGF表达有关。但其具体作用机制及作用靶点尚不明了,且BMP-2和VEGF的表达是否存在相互作用也需要进一步探讨。
[1] 赵子星,李宏宇.骨不连治疗方法的研究进展[J].中国临床新医学,2015,8(8):789-792.
[2] 李宏宇,梁斌,金先跃.体外冲击波治疗四肢骨折内固定术后骨不连[J].中国矫形外科,2011,19(2):175-176.
[3] Vulpiani MC, Vetrano M, Conforti F, et al. Effects of extracorporeal shock wave therapy on fracture nonunions[J]. Am J Orthop(Belle Mead NJ), 2012,41(9):122-127.
[4] Frairia R, Berta L. Biological effects of extracorporeal shock waves on fibroblasts. A review[J]. Muscles Ligaments Tendons J, 2012,1(4):138-147.
[5] Wang CJ, Huang KE, Sun YC, et al. VEGF modulates angiogenesis and osteogenesis in shockwave-promoted fracture healing in rabbits[J]. J Surg Res, 2011,171(1):114.
[6] Wang FS, Yang KD, Kuo YR, et al. Temporal and spatial expression of bone morphogenetic proteins in extracorporeal shock wave-promoted healing of segmental defect[J]. Bone, 2003,32(4):387-396.
[7] Ma HZ, Zeng BF, Li XL. Upregulation of VEGF in subchondral bone of necrotic femoral heads in rabbits with use of?extracorporeal?shockwaves[J]. Calcif Tissue Int, 2007,81(2):124-131.
[8] 李胜华,李爱民,伍贤进.接骨草化学成分研究[J].中草药,2011,42(8):1502-1504.
[9] 王朝元,易继凌,宋超,等.绿原酸对体外培养成骨细胞活性的影响[J].中南民族大学学报(自然科学版),2013,32(2):46-50.
[10] Wang L, Liu T, Zhang X, et al. Expression of bone morphogenetic protein 2 in Human nonunion tissue and the clinical significance[J]. Zhong Nan Da Xue Xue Bao Yi Xue Ban, 2014,39(10):1023-1028.
[11] Ogilvie CM, Lu C, Marcucio R, et al. Vascular endothelial growth factor improves bone repair in a murine nonunion model[J]. Iowa Orthop J, 2012,32(1):90-94.
[12] 陆联松,徐佳,康庆林,等.肥大型骨不连断端组织成骨潜能的实验研究[J].中国临床解剖学杂志,2013,31(4):441-446.
[13] Shibasaki S, Kitano S, Karasaki M, et al. Blocking c-Met signaling enhances bone morphogenetic protein-2 induced osteoblast differentiation[J]. FEBS Open Bio, 2015,20(5):341-347.
[14] 鲍小明,张民.VEGF在骨质疏松性骨折愈合中的作用[J].中国矫形外科杂志,2012,20(22):2054-2056.
[15] 方芳,王平珍,邱芸.仙桃草促进骨折愈合机制探讨[J].中国民族民间医药,2014,21(1):15.
[16] 李治,马骥,张洋,等.无头加压空心螺钉用于桡骨远端骨折内固定术效果观察[J].山东医药,2012,52(35):65-66.
[17] 张传开,史跃,刘英,等.经皮自体骨髓间充质干细胞移植术治疗四肢骨折骨不连41例[J].山东医药,2012,52(2):95-96.
广西医疗卫生重点科研课题(桂卫重2011120);广西中医药管理局中医药科技专项面上课题(GZPT1242);广西适宜卫生技术研发推广人才小高地项目(006011)。
李宏宇(E-mail: lihongyu36@sohu.com)
10.3969/j.issn.1002-266X.2016.36.009
R683
A
1002-266X(2016)36-0031-03
2015-12-10)

