糖尿病肾病大鼠肾组织MMP-9表达及意义
凌厉,陈立波,劳国娟,张长宁
(1广东医学院附属深圳南山医院,广东深圳518052;2中山大学孙逸仙纪念医院)
·基础研究·
糖尿病肾病大鼠肾组织MMP-9表达及意义
凌厉1,陈立波1,劳国娟2,张长宁1
(1广东医学院附属深圳南山医院,广东深圳518052;2中山大学孙逸仙纪念医院)
目的 探讨基质金属蛋白酶9(MMP-9)在糖尿病肾病发生、发展中的作用。方法 将60只Wistar大鼠随机分为两组,对照组24只、模型组36只,模型组一次性腹腔注射链脲佐菌素(150 mg/kg)制备糖尿病模型,成模24只;对照组注射等量的柠檬酸缓冲液。给药1、2、4、8周时,两组分别随机选择6只大鼠,取其肾组织观察病理学变化,标本行HE染色,采用免疫组化法检测肾组织MMP-9表达,计数每个肾小球内MMP-9染色阳性的足细胞(MMP-9阳性足细胞)数量。采用RT-PCR法检测肾组织TET1蛋白、活化因子蛋白1(AP-1 )mRNA相对表达量。结果 模型组给药1、2、4、8周时可见肾小球体积逐渐增大,基底膜逐渐增厚,毛细血管袢逐渐扩张,伴随肾小管扩张或萎缩,可见轻度纤维化。对照组给药1周时 MMP-9阳性足细胞数量为(0.47±0.31)个;模型组给药1、2、4、8周时MMP-9染色阳性足细胞数量分别为(2.75±1.29)、(4.59±1.63)、(7.95±2.36)、(15.61±2.77)个,呈逐渐增高趋势,且均高于对照组,组间及组内比较P均<0.05。模型组给药后1、2、4、8周时肾组织AP-1、TET1相对表达量呈逐渐增高趋势,且均高于同时间点对照组,组间及组内比较P均<0.05。结论 MMP-9高表达参与了糖尿病肾病的发生、发展,激活AP-1、TET1基因可能是其作用机制。
糖尿病肾病;基质金属蛋白酶9;活化因子蛋白1;TET1蛋白
糖尿病及其慢性并发症是目前严重的社会问题。炎症反应及代谢异常是糖尿病慢性并发症的主要发病机制[1,2]。糖尿病肾病是一种常见的糖尿病微血管并发症,是导致糖尿病患者死亡的原因之一,但其发生机制仍不明确。持续微量蛋白尿是糖尿病肾病早期主要临床表现。Vestra等[3]发现,糖尿病肾病早期阶段肾足突状细胞的密度和数量与尿白蛋白排泄率呈正相关。正常生理条件下,肾脏内基质金属蛋白酶9(MMP-9)主要来源于足细胞,对维持基底膜正常结构的动态平衡具有重要作用,但其与糖尿病肾病发生、发展的关系尚不明确。2015年3~11月,我们观察了糖尿病肾病大鼠肾组织MMP-9表达,探讨其对糖尿病肾病的影响及作用机制。
1 材料与方法
1.1 材料 60只体质量为220~250 g的健康雄性Wistar大鼠,购自广东省医学实验动物中心[动物许可证编号:SYXK(粤)20130002]。链脲佐菌素(STZ)购自Sigma公司。鼠抗MMP-9单克隆抗体购自北京博奥森生物技术有限公司。活化因子蛋白1(AP-1)、ET1蛋白 PCR引物及试剂盒购自Invitrogen公司。
1.2 模型制作与处理 将60只大鼠随机分为两组,对照组24只、模型组36只。模型组一次性腹腔注射STZ(150 mg/kg)制备糖尿病模型,对照组注射相同剂量的柠檬酸缓冲液。给药72 h时模型组尾静脉采血检测血糖,血糖≥16.7 mmol/L判定为造模成功。取造模成功的24只大鼠。在给药1、2、4、8周时两组分别随机选择6只大鼠,结扎肾动脉后取肾组织,-80 ℃冰箱保存。
1.3 肾组织病理学观察 取两组各时间点肾组织标本,4%多聚甲醛固定,脱水,透明,石蜡包埋,切片,HE染色,观察肾组织病理变化。
1.4 肾组织MMP-9表达 采用免疫组化法。取两组各时间点肾组织切片,常规处理后加入鼠抗MMP-9单克隆抗体(1∶500),4 ℃过夜;PBS缓冲液清洗,逐滴加入适量稀释的辣根过氧化物标记的二抗,37 ℃或室温下孵育10~15 min;PBS冲洗,显色剂显色,显微镜下观察MMP-9表达。以PBS替代一抗作为阴性对照。每张切片随机选择30个不重叠视野,计数每个肾小球内MMP-9染色阳性(棕黄色)足细胞数量。
1.5 肾组织TET1、AP-1 mRNA表达 采用RT-PCR法。取两组各时间点肾组织标本,TRIzol法提取总蛋白。参照PrimeScript RT试剂盒方法进行cDNA合成及反转录实验。TET1 引物:上游5′-TGCCTGAATCGCTACCTCTACC-3′,下游5′-CTTGCGCCGAAGGTAGTCTTAT-3′;AP-1引物:上游5′-AGGCGGACATTCTGGAAATG-3′,下游5′-TCGTTCATGCACTCGCTGA-3′;GAPDH引物:上游5′-TGCTGATGTACCAGTTGCCG-3′,下游5′-GCACGGACACTCACAATGTTC-3′。计算TET1、AP-1基因相对表达量。每个实验均重复3次,取平均值。

2 结果
2.1 肾组织病理学变化 对照组各时间点肾小球、肾小管及肾间质结构均清楚,未见明显病理学改变。模型组给药1周时肾小球体积略有增大,基底膜未见明显增厚;2周时可见毛细血管袢扩张,肾小球肥大;4周时可见肾小球显著增生,基底膜增厚、增宽,系膜基质显著增多,伴随肾小管扩张或萎缩,肾小管区可见炎症细胞浸润;8周时可见肾小球及肾小管病变进一步加重,肾小管区开始出现轻度纤维化。见插页Ⅰ图1。
2.2 肾组织MMP-9表达 对照组各时间点肾小球均仅有极少量MMP-9阳性表达细胞,因此仅选取对照组给药1周时进行肾小球内MMP-9染色阳性足细胞数量计数。对照组给药1周时MMP-9阳性足细胞数量为(0.47±0.31)个;模型组给药1、2、4、8周时MMP-9阳性足细胞数量分别为(2.75±1.29)、(4.59±1.63)、(7.95±2.36)、(15.61±2.77)个,呈逐渐增高趋势,且均高于对照组,组间及组内比较P均<0.05。见插页Ⅰ图2。
2.3 肾组织TET1、AP-1 mRNA表达 模型组给药后1、2、4、8周时肾组织AP-1、TET1相对表达量呈逐渐增高趋势,且均高于同时间点对照组,组间及组内比较P均<0.05。见表1。
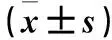
表1 肾组织TET1、AP-1 mRNA相对表达量
注:与对照组同时间点比较,*P<0.05;与同组给药1周时比较,△P<0.05;与同组给药2周时比较,#P<0.05;与同组给药4周时比较,▲P<0.05。
3 讨论
糖尿病肾病患者一旦发生临床蛋白尿,肾脏病变难以逆转,现有治疗手段有限,疗效不理想,最终发展为慢性肾功能衰竭。糖尿病肾病的发生、发展涉及多因素、多环节,糖脂代谢异常、肾脏血流动力学改变以及多种炎症物质和细胞因子的产生一直被认为是导致糖尿病肾病的基本机制。建立稳定、有效的糖尿病肾病动物模型对于研究糖尿病肾病的机制具有重大意义。目前,研究糖尿病肾病动物模型均由糖尿病大鼠模型获得[4],国际上常采用STZ诱导糖尿病建立糖尿病肾病模型。本研究模型组给药1~8周时观察到肾小球体积逐渐增大,基底膜逐渐增厚,毛细血管袢逐渐扩张,伴随肾小管扩张或萎缩,可见轻度纤维化;以上病理改变印证糖尿病肾病动物造模成功。
MMP-9又称明胶酶B,通过调节Ⅳ型胶原和层黏连蛋白的降解。在糖尿病患者及糖尿病动物模型的肾脏病理切片中发现,MMP-9可能在浸润的巨噬细胞、小管上皮细胞、足突状细胞、小球系膜细胞等处高表达[5]。高糖环境可诱导体外培养的足细胞高表达MMP-9[5]。本研究发现,MMP-9在糖尿病大鼠模型肾组织中表达明显高于对照组,且随着给药时间的延长,MMP-9表达呈逐渐增高趋势,提示MMP-9表达升高可能参与了糖尿病肾病的发生、发展。
AP-1通过赖氨酸拉链结构与DNA结合,这一结构属于DNA结合蛋白中的碱性赖氨酸拉链结构[6]。AP-1和一些生长因子、细胞因子的基因转录有关,其活化可能参与一系列生物学改变,如细胞癌变、增殖与凋亡等,进而引起相应的生理和病理改变[7,8]。对胃癌细胞的研究发现,抑制AP-1激活可导致MMP-9表达增高,参与肿瘤的侵袭和转移[9,10]。心肌梗死患者心肌组织AP-1激活可影响MMP-9表达[11]。Desnet等[12]研究发现,肾小管损伤程度及蛋白尿程度均与AP-1活性紧密相关。在急性或慢性炎症损伤肾组织中,AP-1表达升高[13]。TET蛋白家族是一类在DNA主动去甲基化过程中发挥重要作用的酶蛋白家族,可催化甲基化胞嘧啶羟基化转化为5-羟甲基胞嘧啶,进而脱甲基[14],是近年来表观遗传调控研究的热点。TET蛋白家族有3个成员,TET1主要表达于胎儿组织及干细胞,TET2在造血系统中含量较高,TET3主要表达于结肠和肌肉等组织[15]。已有研究表明,在缺血再灌注损伤的小鼠肾脏中检测到TET1基因表达异常,且与目的蛋白的DNA去甲基化调控相关[16]。在一项针对MCF-7乳腺癌细胞株的研究发现,敲除TET1基因可导致MMP-9表达异常及细胞侵袭性增强[17]。另一项针对人骨关节炎软骨细胞的研究证实,炎症因子通过改变TET1表达而影响MMP-1/MMP-3转录活性[18]。本研究结果显示,糖尿病肾病大鼠肾组织AP-1、TET1相对表达量均高于对照组,且随着肾损伤加重,二者的表达量均逐渐增加,提示二者的高表达可能参与了MMP-9启动子的脱甲基化,促进MMP-9过度表达,进而参与糖尿病肾病的发生、发展。
综上所述, MMP-9高表达参与了糖尿病肾病的发生、发展,激活AP-1、TET1基因可能是其作用机制。
[1] Du P, Fan B, Han H, et al. NOD2 promotes renal injury by exacerbating inflammation and podocyte insulin resistance in diabetic nephropathy[J]. Kidney International, 2013,84(2):265-276.
[2] Villeneuve L, Natarajan R. The role of epigenetics in the pathology of diabetic complications [J]. Am J Physiol Renal Physiol, 2010,299(1):14-25.
[3] Vestra M, Masiero A, Roiter A, et al. Is podocyte injury relevant in diabetic nephropathy? studies in patients with type 2 diabetes[J]. Diabetes, 2003,52(4):1031-1035.
[4] 李佑生,王文建. 啮齿类糖尿病肾病动物模型研究进展[J].中国中医基础医学杂志,2006,12(7):530-532
[5]Okada R, Kawai S, Naito M, et al. Matrix metalloproteinase-9 gene polymorphisms and chronic kidney disease[J]. Am J Nephrol, 2012,36(5):444-450.
[6] Shaulian E, Karin M. AP-1 as a regulator of cell life and death[J]. Nat CellBiol, 2002,4(5):E131-E136.
[7] Vesely PW, Staber PB, Hoefler G, et al. Translational regulation mechanisms of AP-1 proteins [J]. Mutat Res, 2009,682(1):7-12.
[8] Shin S, Asano T, Yao Y, et al. Activator protein-l has an essential role in pancreatic cancer cells and is regulated by a novel Akt-mediated mechanism[J]. Mol cancer Res, 2009,7(5):745-754,
[9] Osna N, Elliott K, Chaika O, et al. Histamine utilizes JAK-STAT pathway in regulating cytokine preduction[J]. Int Immunophartnacol, 2001(1):759-762.
[10] Wagner EF. AP-1 Introductory remarks[J]. Oncogene, 2001,20(19):2333-2497.
[11] Nakamura Y, Hoshino U. TH2 cytokines and associated transcription factors as therapeutic targets in asthma[J]. Curr Drug Targets Inflamm A1lergy, 2005,4(2):267-270.
[12] Desmet C, Gosset P,Henry E,et al.Treatment of experimental asthma by decoy-mediated local inhibition of activator protein-1[J]. Am J Respir Crit Care Med, 2005,172(6):671-678.
[13] Lee MJ, Rao YK, Chen K, et al. Andrographolide and 14-deoxy-11,12-didehydroandrographolide from andrographis paniculata attenuate high glucose-induced fibrosis and apoptosis in murine renal mesangeal cell lines[J]. J Ethnopharmacol, 2010,132(2):497-505.
[14] Bhutani N, Burns DM, Blau HM. DNA Demethylation Dynamics[J]. Cell, 2011,146(6):866-872.
[15] Ito S, D′alessio AC, Taranova OV, et al. Role of TET1 proteins in 5mC to 5hmC conversion, ES-cell self-renewal and inner cell mass specification[J]. Nature, 2010,466(7310):1129-1133.
[16] Huang N, Tan L, Xue Z, et al. Reduction of DNA hydroxymethylation in the mouse kidney insulted by ischemia reperfusion[J]. Biochem Biophys Res Commun, 2012,422(4):697-702.
[17] Lu HG, Zhan W, Yan L, et al. TET1 partially mediates HDAC inhibitor-induced suppression of breast cancer invasion[J]. Mol Med Rep, 2014,10(5):2595-600.
[18] Taylor SE, Smeriglio P, Dhulipala L, et al. A global increase in 5-hydroxymethylcytosine levels marks osteoarthritic chondrocytes[J]. Arthritis Rheumatol, 2014,66(1):90-100.
Expression and mechanism of MMP-9 in kidney tissues of rats with diabetic nephropathy
LINGLi1,CHENLibo,LAOGuojuan,ZHANGChangning
(1ShenzhenNanshanHospitalAffiliatedtoGuangdongMedicalCollege,Shenzhen518052,China)
Objective To investigate the effect of matrix metalloproteinase 9 (MMP-9) expression in the occurrence and development of diabetic nephropathy of rats.Methods Sixty Wistar rats were randomly divided into two groups: the control group (n=24) and the model group (n=36). Rats in the model group received intraperitoneal injection of STZ (150 mg/kg) to establish the diabetes models while rats in the control group received equal dose of citrate buffer. At 1, 2, 4, and 8 weeks after treatment, 6 rats were randomly selected from each group and their renal tissues were collected and analyzed by HE staining, immunohistochemistry for MMP-9 expression. And we counted the sertoli cells with MMP-9 positive staining in glomeruli (MMP-9 positive sertoli cells). RT-PCR was used to detect the TET1 and AP-1 mRNA expression. Results At 1, 2, 4, and 8 weeks after drug administration, rats of the model group showed gradually enlarged renal glomeruli, thickened basement membrane, and expanded capillary loops, with visible tubular dilatation or atrophy and mild fibrosis. MMP-9-positive cells in each renal glomerulus of the control group was 0.47±0.31 at 1 week after drug administration; while this number of the model group was 2.75±1.29, 4.59±1.63, 7.95±2.36 and 15.61±2.77 respectively at 1, 2, 4, and 8 weeks after drug administration, which showed an increasing tendency and was significantly higher than that of the control group (allP<0.05). The relative mRNA levels of AP-1 and TET1 of the model group showed an increasing tendency, which were also significantly higher than those of the control group at the same time (allP<0.05). Conclusion The high expression of MMP-9 may play a significant role in the development and progression of diabetic nephropathy, possibly through the activation of AP-1 and TET1.
diabetic nephropathy; matrix metalloproteinase 9; activation factor protein 1; TET1 protein
国家自然科学基金青年科学基金资助项目(81400818);深圳市卫生计生系统科研项目(201402128)。
陈立波(E-mail: Chenlibo_1979@126.com)
10.3969/j.issn.1002-266X.2016.36.008
R587.1
A
1002-266X(2016)36-0028-04
2016-01-02)

